氧化对银鲳肌原纤维蛋白功能性质的影响
2017-06-29陈霞霞杨文鸽楼乔明胡小超
陈霞霞,杨文鸽,*,楼乔明,胡小超,郑 璐
(1.宁波大学海洋学院,浙江省动物蛋白食品精深加工重点实验室,浙江 宁波 315211;2.宁波城市职业技术学院国际学院,浙江 宁波 315100)
氧化对银鲳肌原纤维蛋白功能性质的影响
陈霞霞1,杨文鸽1,*,楼乔明1,胡小超1,郑 璐2
(1.宁波大学海洋学院,浙江省动物蛋白食品精深加工重点实验室,浙江 宁波 315211;2.宁波城市职业技术学院国际学院,浙江 宁波 315100)
蛋白氧化所引起的功能特性改变会进一步影响食品品质,为确定氧化对银鲳肌肉蛋白功能特性及其凝胶品质的影响,本研究模拟羟自由基氧化,研究银鲳肌原纤维蛋白氧化后溶解性及乳化特性,凝胶保水性、质构、色差及其微观结构的变化。结果表明,银鲳肌原纤维蛋白的溶解度、乳化活性及其乳化稳定性与氧化体系中的氧化剂(H2O2)浓度有关,3 个指标在低浓度H2O2组中氧化1 h时均达到最高值,而在高浓度H2O2组中随着氧化时间的延长均呈下降趋势。在氧化过程中,肌原纤维蛋白凝胶保水性、硬度及弹性呈先上升后下降趋势,色差L*值呈下降趋势,而b*值呈上升趋势。凝胶微观结构表明,在低浓度H2O2组中氧化3 h后,肌原纤维蛋白形成的凝胶结构紧密、交联度较高;在高浓度H2O2组中,氧化初期肌原纤维蛋白颗粒聚集成致密的网络结构,5 h后凝胶网状结构则完全被破坏。羟自由基对银鲳肌原纤维蛋白的适度氧化可以改善其蛋白功能及凝胶品质,但过度的氧化会导致蛋白变性凝聚,降低肌肉品质。
银鲳;蛋白氧化;功能性质;凝胶品质;微观结构
6630-201711022. http://www.spkx.net.cn
银鲳(Pampus argenteus)是我国重要的海洋经济鱼类,年捕获量达33万 t[1]。银鲳含肉率高,肉质细嫩、味道鲜美,是消费者喜食的较为名贵鱼类之一。但由于银鲳肉组织富含易被氧化的脂类、亚铁血红素、过渡态的金属离子、各种氧化酶及其他各种促氧化因子[2],肌肉蛋白很容易受活性自由基的攻击而发生氧化,而氧化所导致的蛋白功能性质的改变是影响银鲳肉品质的主要因素之一。
蛋白氧化也是自由基的一种链式反应,主要由羟自由基、肌红蛋白自由基或脂类次级氧化产物等引起[3-4],氧化后的蛋白结构发生改变,表现为蛋白侧链的修饰、蛋白之间及内部产生交联以及蛋白分子的断裂[5-6]。Lund等[7]认为氧化使蛋白质的三、四级结构发生改变,内部构象发生转化,蛋白质表面疏水性升高,直接导致蛋白聚集和交联。在肌肉组织中,由于蛋白氧化引起其功能特性改变,并进一步影响肉制品的持水性、质构及其嫩度等的研究有较多报道,如Decker等[8]将火鸡胸肉的肌原纤维蛋白氧化,发现氧化后的肌原纤维蛋白凝胶性和持水性都有所下降;Morzel等[9]发现氧化会降低肌原纤维蛋白的消化率,使其营养价值下降,但姜晴晴等[10]发现肌原纤维蛋白的适度氧化能提高其消化率,Srinivasan等[11]则解释了消化率的变化取决于氧化蛋白所形成的产物是可溶性还是不溶性聚集物;Pacheco-Aguila等[12]认为微弱的氧化可以改善鱼肉蛋白的功能性质,如使用KBrO3或低浓度的FeCl3-H2O2-抗坏血酸体系氧化鱼糜或鱼糜蛋白后,蛋白的乳化能力及其所形成凝胶的硬度和弹性均有提高;胡忠良等[13]发现经不同程度氧化的鸡胸肉肌原纤维蛋白其理化特性及热凝胶特性会发生改变,用低于0.1 mmol/L H2O2进行氧化能改善肌原纤维蛋白的热凝胶特性。
目前在氧化胁迫条件下,蛋白氧化对鱼肉品质的影响还没有统一的定论,蛋白质理化性质的改变与肌肉品质之间的关系,还需要进一步的研究。在鱼类中,肌原纤维蛋白是一类有重要生物学功能的蛋白质群,约占肌肉总蛋白含量的2/3,它不仅与肌肉收缩相关,对鱼肉品质及其加工特性也起关键作用。实验模拟羟自由基氧化,分析氧化后的肌原纤维蛋白溶解性及乳化特性,凝胶保水性、质构、色差及其微观结构的变化,研究氧化对银鲳肌原纤维蛋白功能特性及凝胶品质的影响,旨在为银鲳贮藏及其加工品的质量控制提供参考。
1 材料与方法
1.1 材料与试剂
新鲜银鲳购于宁波路林水产市场,体质量(250±15) g,加冰30 min内运至浙江省动物蛋白食品精深加工重点实验室,清洗后去头尾及内脏,快速取鱼肉进行肌原纤维蛋白提取。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、叔丁醇、戊二醇 美国Sigma公司;过氧化氢、三氯化铁、抗坏血酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、三氯乙酸、乙醇(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Biofuge Stratos高速冷冻离心机 美国Thermo公司;XHF-D高速分散器 宁波新芝生物科技公司;SpectraMax i3多功能酶标仪 美国Molecular Devices公司;色差仪CR-400色差仪 日本柯尼卡美能达公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;JEM-1230扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
参照Chin等[14]的方法,并略作修改。取绞碎鱼肉约3 g,加4 倍体积磷酸盐缓冲液A(20 mmol/L、pH 7.5),匀浆后离心,取沉淀,重复2 次;沉淀加4 倍体积0.1 mol/L NaCl溶液,匀浆后离心;沉淀加8 倍体积磷酸盐缓冲液B(20 mmol/L、pH 7.5,含0.1 mol/L NaCl)匀浆、4 层纱布过滤,滤液离心后所得到的膏样沉淀即为肌原纤维蛋白。整个过程均在4 ℃条件下进行,离心转速7 500 r/min,时间15 min。双缩脲法测定肌原纤维蛋白含量。
1.3.2 肌原纤维蛋白的氧化
参照文献[11]构建羟自由基模拟氧化体系,反应过程为:抗坏血酸+Fe3+→Fe2+,Fe2++H2O2→☒OH。体系中FeCl3浓度为0.1 mmol/L,抗坏血酸浓度为0.1 mmol/L,H2O2浓度0.0、0.1 mmol/L和1.0 mmol/L分别对应对照组、低浓度组和高浓度组。将提取的肌原纤维蛋白分散于上述氧化体系中(最终质量浓度为20 mg/mL),25 ℃条件下分别氧化1、2、3、4、5 h,加入EDTA(最终浓度为1 mmol/L)终止氧化反应,冷冻离心(4 ℃、10 000 r/min,20 min),沉淀即为氧化后的肌原纤维蛋白,用于肌原纤维蛋白溶解性、乳化性的测定及凝胶制备。
1.3.3 肌原纤维蛋白溶解性的测定
参照Benjakul等[15]的方法,略作修改。用磷酸盐缓冲液C溶解氧化后的肌原纤维蛋白,匀浆30 s,室温条件下搅拌4 h,取5 mL蛋白液用0.5 mol/L氢氧化钠溶解。剩余蛋白液进行冷冻离心(7 500 r/min,30 min),取5 mL上清液加入50%三氯乙酸,之后溶解于0.5 mol/L氢氧化钠。溶解性用上清液中蛋白质含量占原液中蛋白质含量的百分比表示,蛋白含量用双缩脲法测定。
1.3.4 肌原纤维蛋白乳化性的测定
参照Agyare等[16]的方法。取氧化后的肌原纤维蛋白,用磷酸盐缓冲液C(50 mmol/L、pH 6.5,含0.6 mol/L NaCl)配制成1 mg/mL的蛋白溶液。将2.0 mL大豆油和8 mL肌原纤维蛋白液混合,匀浆1 min,立即从底部取出50 μL,加5 mL 0.1% SDS,混匀后,测定500 nm波长处的吸光度(A0)。静置10 min后,从底部再取50 μL,加5 mL 0.1% SDS,混匀后测定500 nm波长处的吸光度(A),0.1% SDS溶液作空白。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别按(1)、(2)计算。

式(1)中:ρ为乳化之前的肌原纤维蛋白质量浓度/(mg/mL);φ为乳化液中大豆油所占总体积的比例/%。1.3.5 肌原纤维蛋白凝胶的制备
取氧化后的肌原纤维蛋白,用磷酸盐缓冲液C配制成40 mg/mL的蛋白溶液。将蛋白液置于小烧杯中,保鲜膜封口,在20 ℃水浴锅中恒温15 min,随后以1 ℃/min的速率升温至70 ℃,保温20 min形成蛋白凝胶,4 ℃冰箱内放置8~12 h,进行凝胶保水性、质构及扫描电子显微镜分析。
1.3.6 肌原纤维蛋白凝胶保水性的测定
参照Badii等[17]的方法,略作修改。取2 g蛋白凝胶放入离心管底部,冷冻离心(3 000 r/min,10 min)后去除管内液体,记录离心前后的离心管与蛋白凝胶的总质量及离心管的质量。凝胶保水性(water holding capacity,WHC)计算公式如式(3)。

式中:m0为离心管的质量/g;m1为离心前离心管与蛋白凝胶总质量/g;m2为离心后离心管与蛋白凝胶的总质量/g。
1.3.7 肌原纤维蛋白凝胶质构特性的测定
用纸吸去凝胶表面水分,利用质构剖面分析(texture profile analysis,TPA)法测定质构特性,各实验组进行4 个重复。参数:触发力5.0 kg;触发类型Auto;探头型号P50。测定模式:压缩比40%,测前速率为0.5 mm/s,测试速率2 mm/s,测后速率2 mm/s;数据采集速率:200 pps。用仪器自带软件TPA.MAC处理结果,凝胶的硬度及弹性单位为g。
1.3.8 肌原纤维蛋白凝胶色差的测定
将凝胶表面切割平整,同一样品用色差计测定3 次,用亮度值L*、红度值a*及黄度值b*记录结果。测前用标准白板校正色差计。
1.3.9 肌原纤维蛋白凝胶微观结构观察
2.5 %戊二醛固定凝胶,24 h后用磷酸盐缓冲液(0.1 mol/L、pH 7.2)漂洗3 次,依次用30%、40%、50%、70%、80%、90%及无水乙醇梯度洗脱,随后按V(无水乙醇)∶V(叔丁醇)分别为3∶1、1∶1、1∶3的比例及纯叔丁醇依次洗脱,最后用少量叔丁醇覆盖样品,冷冻干燥,贴样、镀金后用于扫描电子显微镜观察,加速电压为15 kV。
1.4 数据处理
除质构分析及扫描电子显微镜观察外,所有实验均重复3 次。显著性分析采用SPSS statistics 19软件单因素方差分析(one-way ANOVA)中的Duncan检验,数据绘图使用Origin 8.0软件。
2 结果与分析
2.1 氧化后银鲳肌原纤维蛋白溶解性的变化

浓度和氧化时间对银鲳肌原纤维蛋白溶解性的影响Fig. 1 Effect of H2O2concentration and oxidation time on the solubility of MP from P. argenteus图1 H2O2
蛋白溶解性是蛋白质之间及蛋白质与溶剂之间相互作用的结果[18],可用于表示蛋白质交联及聚集的程度。因此,蛋白溶解性在一定程度上可以作为肌肉蛋白氧化程度。由图1可知,氧化1 h后,低浓度H2O2组中肌原纤维蛋白溶解性略有上升,但与对照组无显著差异(P>0.05),随后蛋白溶解性一直呈下降趋势,氧化3 h后溶解性显著下降(P<0.05);高浓度H2O2组在整个氧化过程中,肌原纤维蛋白的溶解性始终呈显著下降趋势(P<0.05)。
蛋白质溶解性的下降主要是由于蛋白氧化引起氨基酸残基发生修饰,分子内部的疏水基团暴露、表面疏水性增强[19],导致蛋白发生凝聚,溶解性降低,这与Srinivasan等[20]在研究鳕鱼蛋白氧化的结果相同。本实验也表明肌原纤维蛋白溶解性的变化与氧化剂的浓度有关,氧化剂浓度越高,溶解性下降越多。
2.2 氧化后银鲳肌原纤维蛋白乳化性的变化
肌原纤维蛋白属于两性分子,兼具亲水性和亲油性,是一种能将水和油结合在一起的乳化剂[21]。通常使用EAI和ESI作为蛋白乳化性的重要指标,EAI主要反映在体系中蛋白质固定脂肪的能力,ESI反映乳化剂保持乳状液稳定、阻止相分离的能力。
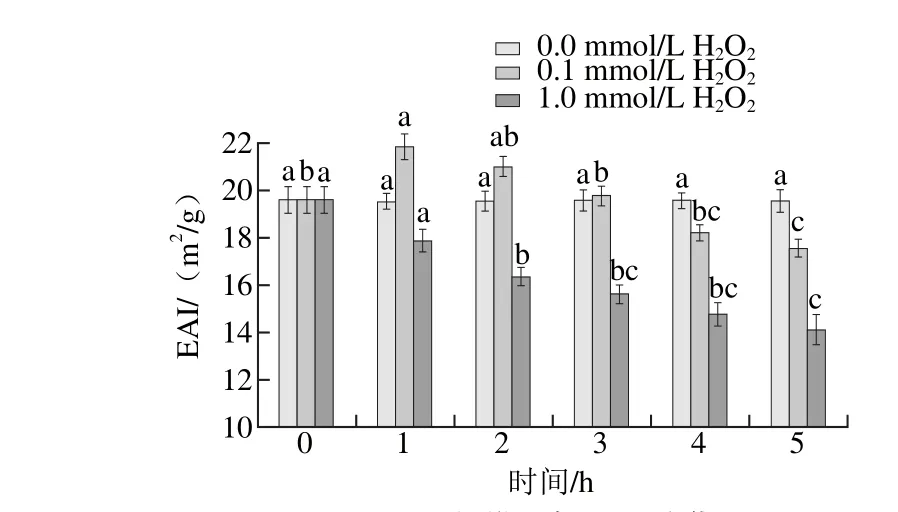
图2 肌原纤维蛋白EAI的变化Fig. 2 Change in EAI of myofibrillar protein
由图2可知,低浓度H2O2组肌原纤维蛋白EAI在氧化1 h时有所上升,随后一直下降,而高浓度H2O2组在氧化过程中蛋白EAI始终呈下降趋势,尤其在前3 h内下降速率较快,3 h后变化不显著(P>0.05)。在相同的氧化时间内,氧化剂浓度越高,肌原纤维蛋白的EAI下降越多。氧化会降低银鲳肌原纤维蛋白的EAI,这与田童童等[22]研究乳清蛋白氧化后的结果相似。
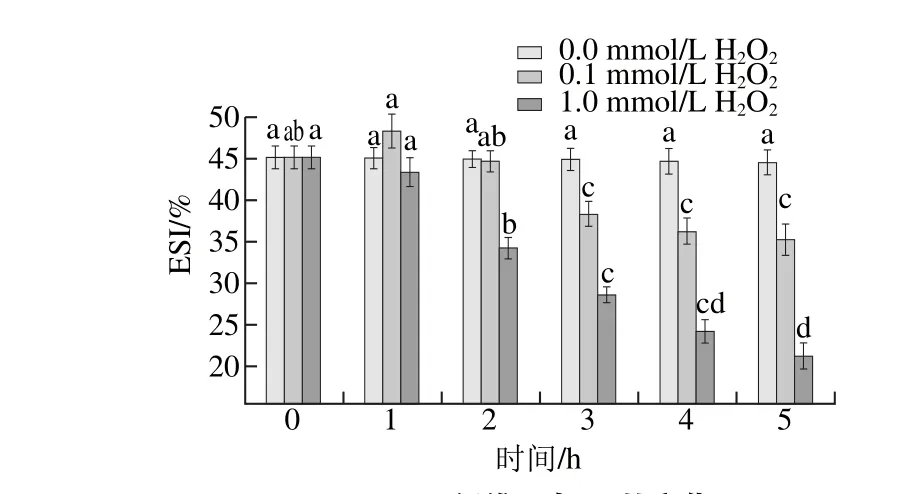
图3 肌原纤维蛋白ESI的变化Fig. 3 Change in ESI of myofibrillar protein
由图3可知,肌原纤维蛋白的ESI与EAI的变化相似,除低浓度H2O2组在氧化1 h时ESI略有上升(P>0.05)外,其余均呈下降趋势。乳化能力与溶解性和表面疏水性有关,且与溶解性呈极显著相关,本实验低浓度H2O2组在氧化1 h时肌原纤维蛋白EAI和ESI的上升,可能与蛋白溶解性的变化有关。Xiong Youling L.等[23]研究也发现肌原纤维蛋白经较低的羟自由基浓度微弱氧化后(如0.05 mmol/L H2O2),其乳化性能有所提高。
2.3 氧化后银鲳肌原纤维蛋白凝胶质构的变化
肌原纤维蛋白通过热诱导作用可以形成三维网状结构的凝胶体系,其凝胶特性与其加工品的品质,包括口感、保水性等有关。凝胶化过程涉及蛋白的加热变性、相互凝集及相互交联[24],任何影响这3 个过程的因素都可能会对形成的凝胶特性产生影响。

图4 肌原纤维蛋白凝胶硬度的变化Fig. 4 Change in hardness of myofibrillar protein gel

图5 肌原纤维蛋白凝胶弹性的变化Fig. 5 The change in springiness of myofibrillar protein gel
由图4可知,随氧化时间的增加,银鲳肌原纤维蛋白凝胶的硬度发生了显著改变。高浓度H2O2组凝胶硬度的最高值出现在氧化2 h,而低浓度H2O2组在氧化3 h时达到最高,随后缓慢下降,低浓度H2O2组的凝胶硬度从氧化3 h后高于高浓度H2O2组。氧化后银鲳肌原纤维蛋白凝胶弹性变化与其硬度变化有所差异。由图5可知,高浓度H2O2组氧化1 h时蛋白凝胶弹性上升,1 h后呈下降趋势;低浓度H2O2组则在氧化2 h达到最高值,氧化1 h后凝胶弹性下降不显著(P>0.05),但始终高于初始值。
可以认为,肌原纤维蛋白适度的氧化可以改善其凝胶特性,提高凝胶强度。这主要是由于适度氧化可以提高蛋白的溶解性,蛋白分子所发生的构象变化有利于交联形成可溶性的低聚体,增强凝胶网络结构的强度。但进一步的氧化或者高浓度的氧化剂会使蛋白溶解性迅速下降,形成不溶性低聚体,同时蛋白分子构象的改变导致疏水基团的大量暴露,分子间的疏水作用显著增强,不利于凝胶体系的形成。Xiong Youling L.等[18]在研究氧化诱导蛋白形成肌原纤维蛋白凝胶机制时发现微弱氧化可以增加肌球蛋白的尾尾结合,使肌原纤维蛋白在加热时倾向于生成黏弹性更好的凝胶网络。
2.4 氧化后银鲳肌原纤维蛋白凝胶保水性的变化
保水性是蛋白凝胶的重要特性,凝胶依靠毛细作用、蛋白水合作用以及蛋白表面电荷相互作用束缚水分,凝胶结构越均匀致密,其保水性越好[25]。由图6可知,随着氧化的进行,低浓度H2O2组和高浓度H2O2组凝胶的保水性均呈先上升后下降的趋势。
低浓度H2O2组在氧化3 h时,保水性达到最高值,氧化5 h内蛋白凝胶的保水性均高于对照组。高浓度H2O2组则在氧化1~2 h时达到最高值,随后开始下降,4 h后保水性已低于初始值及对照组。可以看出,蛋白经过较低浓度的氧化剂或较短时间的适度氧化,可以提高其凝胶的保水性,但过度的蛋白氧化则会破坏凝胶网络结构的形成,降低凝胶网络束缚水分的能力。胡忠良等[26]在研究鸡胸肉肌原纤维蛋白凝胶性质时也发现小于0.5 mmol/L H2O2时,其凝胶保水性随H2O2浓度升高而逐渐增大;当H2O2浓度继续增大时其保水性显著降低。
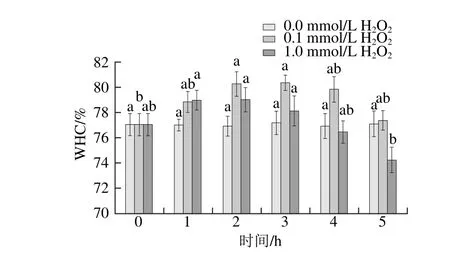
浓度和氧化时间对肌原纤维蛋白凝胶保水性的影响Fig. 6 Effect of H2O2concentration and oxidation time on water-holding capacity of MP gel图6 H2O2
2.5 氧化后银鲳肌原纤维蛋白凝胶色差的变化
由图7A、B可知,氧化会引起银鲳肌原纤维蛋白颜色的变化。氧化5 h内,两实验组的L*值均呈下降趋势,肌原纤维蛋白颜色变暗。氧化3 h内,L*值的变化不显著(P>0.05),4 h后高浓度H2O2组L*值下降速率加快。随着氧化的进行,b*值则呈上升的趋势。在相同的氧化时间内,高浓度H2O2组L*和b*值的变化要比低浓度H2O2组更为明显。由图7C可知,在氧化过程中,低浓度H2O2组和高浓度H2O2组的a*值均无显著变化。Hwang等[27]认为鱼糜氧化后凝胶白度的变化可能与蛋白变性程度相关,Benjakul等[28]在研究鱼糜凝胶形成中发现颜色的变化可能是在提取肌原纤维蛋白时,由于不能完全除去色素蛋白,在氧化体系中色素蛋白与肌原纤维蛋白会发生相互作用所引起。
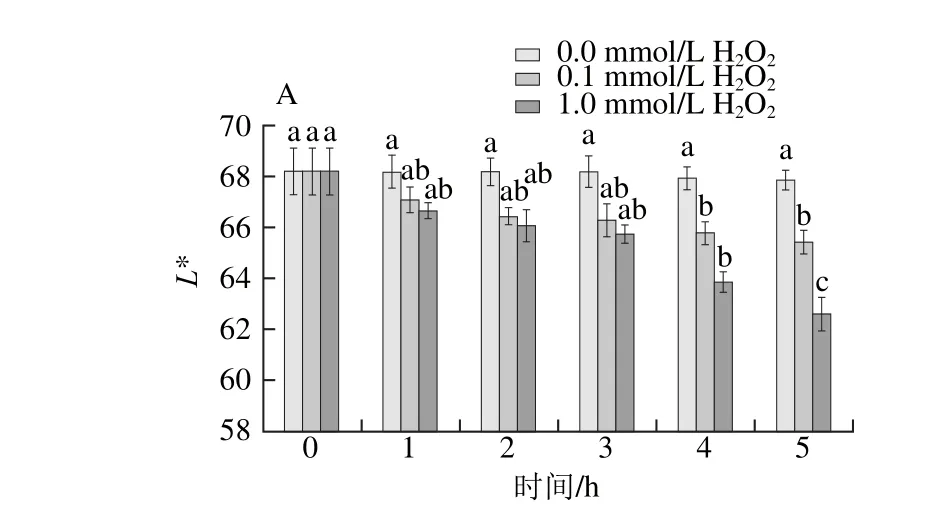
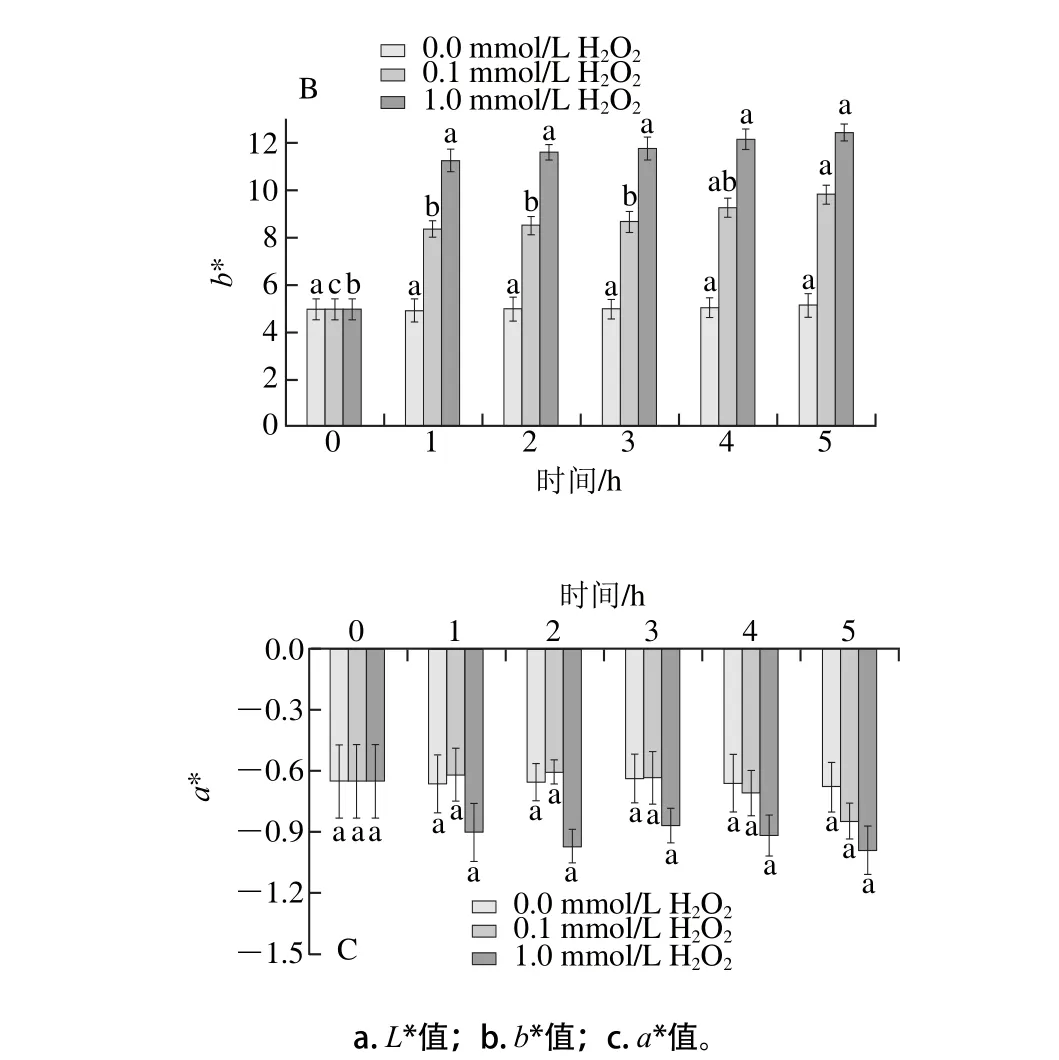
图7 肌原纤维蛋白凝胶色差值的变化Fig. 7 Changes in color parameters of MP gel
2.6 氧化后银鲳肌原纤维蛋白凝胶微观结构的变化
银鲳肌原纤维蛋白凝胶质构及其保水性与其微观结构密切相关。通过扫描电子显微镜观察(图8),不同H2O2浓度及不同氧化时间氧化后得到的蛋白凝胶微观结构有所差异。

2 000)Fig. 8 Change in microstructure of MP gel (× 2 000)图8 肌原纤维蛋白凝胶微观结构的变化(×
未氧化的肌原纤维蛋白凝胶网络结构(图8A)均匀,呈现良好的三维网状结构,肉眼观察凝胶表面光滑平整,但交联程度不高,这与其硬度及保水性较低的结果相同。低浓度H2O2组氧化3 h时凝胶网络结构(图8B2)较为紧密,交联程度高,氧化5 h后凝胶网络(图8B3)结构变得较为疏松,交联度有所下降。高浓度H2O2组氧化1 h时就形成较为致密的网络结构(图8C1),这是由于氧化后的蛋白颗粒由于其疏水、静电及氢键的相互作用改变,导致其发生聚集和交联;氧化5 h后蛋白凝胶网络结构(图8C3)基本被破坏,微观结构杂乱无章,凝胶表面质地较差。这与Liu等[29]对大豆分离蛋白凝胶性质的研究结果相类似,说明适度的氧化可以促进肌原纤维蛋白间的交联,提高其凝胶强度,但过度的氧化则会使蛋白发生凝聚,刚性变差,无法形成良好的凝胶网络。
3 结 论
鱼肉蛋白在贮藏及加工过程中易发生氧化变性,导致鱼肉品质下降。本研究通过模拟氧化体系对银鲳肌原纤维蛋白进行氧化,发现氧化对银鲳蛋白的影响较为复杂。低浓度H2O2组短时间氧化银鲳肌原纤维蛋白,可以适度改善其溶解性、乳化特性及凝胶品质。但过度的氧化会导致肌原纤维蛋白溶解性显著降低,EAI及ESI下降,蛋白凝胶的硬度、弹性降低,色泽变暗变黄。由此可见,微弱的氧化有利于蛋白溶解及相互之间的交联,使得银鲳肌原纤维蛋白发挥其良好的功能特性;但氧化程度过高,导致蛋白间趋向形成不溶性聚集体,从而不利于蛋白质展现其良好的功能特性。在银鲳贮藏及加工过程中,应注意合理应用及控制鱼肉蛋白的氧化。
[1] 农业部渔业渔政管理局. 2015中国渔业统计年鉴[G]. 北京: 中国农业出版社, 2015: 44-45.
[2] 鲁珺, 余海霞, 杨水兵, 等. 液氮速冻对银鲳鱼品质及微观结构的影响[J]. 现代食品科技, 2015, 33(4): 210-216. DOI:10.13982/ j.mfst.1673-9078.2015.4.034.
[3] PARK D, XIONG Youling L., ALDERTON A L, et al. Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J]. Journal of Agricultural and Food Chemistry, 2006, 54(12): 4445-4451. DOI:10.1021/jf0531813.
[4] KIM Y H, HUFF-LONERGAN E, SEBRANEK J G, et al. Highoxygen modified atmosphere packaging system induces lipid and myoglobin oxidation and protein polymerization[J]. Meat Science, 2010, 85(4): 759-767. DOI:10.1016/j.meatsci.2010.04.001.
[5] FREDERIKSEN A M, LUND M N, ANDERSEN M L, et al. Oxidation of porcine myosin by hypervalent myoglobin: the role of thiol groups[J]. Journal of Agricultural and Food Chemistry, 2008, 56(9): 3297-3304. DOI:10.1021/jf072852p.
[6] EST☒VEZ M, OLLILAINEN V, HEINONEN M. Analysis of protein oxidation markers α-aminoadipic and γ-glutamic semialdehydes in food proteins using liquid chromatography (LC)-electrospray ionization (ESI)-multistage tandem mass spectrometry (MS)[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3901-3910. DOI:10.1021/jf804017p.
[7] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research, 2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[8] DECKER E A, XIONG Youling L., CALVERT J T, et al. Chemical, physical, and functional properties of oxidized turkey white muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1993, 41(2): 186-189. DOI:10.1021/jf00026a007.
[9] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-543. DOI:10.1016/ j.meatsci.2006.02.005.
[10] 姜晴晴, 鲁珺, 胡玥, 等. 羟自由基氧化体系对带鱼蛋白理化性质的影响[J]. 现代食品科技, 2015, 33(5): 116-123. DOI:10.13982/ j.mfst.1673-9078.2015.5.019.
[11] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radicalgenerating system[J]. Journal of Agricultural and Food Chemistry, 1997, 45(2): 310-320. DOI:10.1021/jf960367g.
[12] PACHECO-AGUILAR R, CRAWFORD D L. Potassium bromate effects on gel-forming ability of Pacific whiting surimi[J]. Journal of Food Science, 1994, 59(4): 786-791. DOI:10.1111/j.1365-2621.1994. tb08128.x.
[13] 胡忠良, 邹玉峰, 林玉海, 等. 氧化程度对肌原纤维蛋白热诱导凝胶及理化特性的影响[J]. 食品科学, 2013, 34(17): 19-22. DOI:10.7506/ spkx1002-6630-201317005.
[14] CHIN K B, GO M Y, XIONG Youling L.. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel: effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572. DOI:10.1016/j.meatsci.2008.10.012.
[15] BENJAKUL S, BAUER F. Physicochemical and enzymatic changes of cod muscle proteins subjected to different freeze-thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150. DOI:10.1002/1097-0010(200006)80:8<1143::AIDJSFA610>3.0.CO;2-C.
[16] AGYARE K K, ADDO K, XIONG Youling L.. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81. DOI:10.1016/ j.foodhyd.2007.11.012.
[17] BADII F, HOWELL N K. Effect of antioxidants, citrate, and cryoprotectants on protein denaturation and texture of frozen cod (Gadus morhua)[J]. Journal of Agricultural and Food Chemistry, 2002, 50(7): 2053-2061. DOI:10.1021/jf010824f.
[18] XIONG Youling L., BLANCHARD S P, OOIZUMI T, et al. Hydroxyl radical gel network formation of myofibrillar protein[J]. Journal and Ferryl-Generating Systems of Food Science, 2010, 75(2): 215-221. DOI:10.1111/j.1750-3841.2009.01511.x.
[19] LI C Q, XIONG Youling L., CHEN J. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2012, 60(32): 8020-8027. DOI:10.1021/jf302150h.
[20] SRINIVASAN S, XIONG Youling L., BLANCHARD S P, et al. Physicochemical changes in prawns (Machrobrachium rosenbergii) subjected to multiple freeze-thaw cycles[J]. Journal of Food Science, 1997, 62(1): 123-127. DOI:10.1111/j.1365-2621.1997.tb04381.x.
[21] 刘士江. 乳化剂在肉制品加工中的应用[J]. 肉类研究, 2003, 17(4): 36-45. DOI:10.3969/j.issn.1001-8123.2003.04.013.
[22] 田童童, 巩子路, 朱新荣, 等. 蛋白质氧化对乳清分离蛋白功能性质的影响[J]. 现代食品科技, 2014, 30(7): 110-116. DOI:10.13982/ j.mfst.1673-9078.2014.07.029.
[23] XIONG Youling L., PARK D, OOIZUMI T. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 153-159. DOI:10.1021/jf8024453.
[24] SHAND P J, YA H, PIETRASIK Z, et al. Transglutaminase treatment of pea proteins: effect on physicochemical and rheological properties of heat-induced protein gels[J]. Food Chemistry, 2008, 107(2): 692-699. DOI:10.1016/j.foodchem.2007.08.095.
[25] WHITING R. Influence of various salts and water soluble compounds on the water and fat exudation and gel strength of meat batters[J]. Journal of Food Science, 1987, 52(5): 1130-1132. DOI:10.1111/ j.1365-2621.1987.tb14025.x.
[26] 胡忠良, 邹玉峰, 林玉海, 等. 氧化对鸡胸肉肌原纤维蛋白热诱导凝胶保水性及水分子T2弛豫特性的影响[J]. 南京农业大学学报, 2013(4): 121-126. DOI:10.7685/j.issn.1000-2030.2013.04.020.
[27] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J]. Food Chemistry, 2007, 104(2): 746-753. DOI:10.1016/j.foodchem.2006.11.075.
[28] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al. Effect of frozen storage on chemical and gel-forming properties of fish commonly used for surimi production in Thailand[J]. Food Hydrocolloids, 2005, 19(2): 197-207. DOI:10.1016/ j.foodhyd.2004.05.004.
[29] LIU G, XIONG Youling L., BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey- and soyprotein isolates[J]. Journal of Food Science, 2000, 65(5): 811-818. DOI:10.1111/j.1365-2621.2000.tb13592.x.
Effect of Oxidation on Functional Properties of Myofibrillar Protein from Pampus argenteus
CHEN Xiaxia1, YANG Wenge1,*, LOU Qiaoming1, HU Xiaochao1, ZHENG Lu2
(1. Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province, School of Marine Science, Ningbo University, Ningbo 315211, China; 2. International School, Ningbo City College of Vocational Technology, Ningbo 315100, China)
Protein oxidation will induce changes in functional properties of food proteins and further influence the quality of food. In order to determine the influence of oxidation on functional and heat-induced gel properties of Pampus argenteus muscle protein, we examined the changes in the solubility and emulsifying properties of fish myofibrillar protein (MP) and the water-holding capacity, color and microstructure of heat-induced gels of MP. The results showed that the solubility, emulsifying activity and emulsion stability of MP from P. argenteus were related to the concentration of H2O2in the model oxidation system. At low concentration of H2O2, all three indicators reached the highest value at 1 h of oxidation, while there was a declining trend with oxidation time at high concentration of H2O2. Water-holding capacity, hardness and springiness of MP gels increased firstly and decreased afterwards, the color parameter L* value rose, and b* value decreased during the oxidation process. At 3 h of oxidation, the microscopic structure of MP gels became more dense and cross-linked at low concentration of H2O2. On the other hand, at high concentration of H2O2, MP particles were gathered into a compact network structure during initial stages of oxidation, which was then completely destroyed at 5 h. Therefore, moderate hydroxyl free radical-induced oxidation of MP from P. argenteus muscle can improve its functional and heat-induced gel properties, but excessive oxidation will cause protein denaturation and aggregation and lower the quality of fish muscle.
Pampus argenteus; protein oxidation; functional properties; gel quality; microstructure
10.7506/spkx1002-6630-201711022
TS254.4
A
1002-6630(2017)11-0135-07
陈霞霞, 杨文鸽, 楼乔明, 等. 氧化对银鲳肌原纤维蛋白功能性质的影响[J]. 食品科学, 2017, 38(11): 135-141.
DOI:10.7506/spkx1002-6630-201711022. http://www.spkx.net.cn
CHEN Xiaxia, YANG Wenge, LOU Qiaoming, et al. Effect of oxidation on functional properties of myofibrillar protein from Pampus argenteus[J]. Food Science, 2017, 38(11): 135-141. (in Chinese with English abstract) DOI:10.7506/spkx1002-
2016-05-25
海洋公益性行业科研专项(201305013);浙江省动物蛋白食品精深加工重点实验室开放基金项目
陈霞霞(1991—),女,硕士研究生,研究方向为水产品贮藏与质量控制。E-mail:cxxchenxiaxia@163.com
*通信作者:杨文鸽(1966—),女,教授,博士,研究方向为水产品保鲜加工与高值化利用。E-mail:yangwenge@nbu.edu.cn
