腺苷A1受体对杏仁核点燃癫痫大鼠海马神经元损伤作用机制
2017-06-29吴艳芝邓文静徐国卫李海静滕军放通讯作者
吴艳芝 邓文静 乔 芳 徐国卫 李海静 滕军放(通讯作者)
1)郑州大学附属郑州中心医院 郑州 450042 2)郑州大学第一附属医院 郑州 450052
腺苷A1受体对杏仁核点燃癫痫大鼠海马神经元损伤作用机制
吴艳芝1)邓文静2)乔 芳1)徐国卫1)李海静1)滕军放2)(通讯作者)
1)郑州大学附属郑州中心医院 郑州 450042 2)郑州大学第一附属医院 郑州 450052
目的 探讨腺苷A1受体活性对点燃癫痫大鼠海马神经元损伤的作用。方法 选择84只SPF级雄性Wistar大鼠,根据随机数字表法将动物分为正常组、致痫组、致痫+腺苷A1R拮抗剂(8-环戊-1,3-二丙基黄嘌呤,DPCPX)组、致痫+腺苷A1R激动剂(2-氯化腺苷,2-CADO)组,每组21只。致痫组、致痫+DPCPX组、致痫+2-CADO组采用电刺激点燃癫痫模型。正常组未进行手术和电刺激致痫等处理;致痫组癫痫模型建立成功前后未注射任何药物;致痫+DPCPX组大鼠癫痫模型建立成功前1 h和成功后1 h尾部静脉注射0.3 mg/kg DPCPX;致痫+2-CADO组大鼠癫痫模型成功前1 h和成功后1 h尾部静脉注射0.6 mg/kg 2-CADO。采用苏木精-伊红染色法和TUNEL神经元凋亡测定法观察各组在癫痫模型建立成功后1 d、15 d、30 d时的海马CA3区组织学病理变化及神经元凋亡指数(AI)变化情况。结果 致痫组、致痫+DPCPX组、致痫+2-CADO组动物在点燃癫痫后1 d、15 d、30 d均出现不同程度的神经元细胞排列松散无规则,轮廓模糊,边缘欠清晰,胞核萎缩,胞浆空泡等神经元结构损害;相同时间点,致痫+DPCPX组的神经元结构损害程度较致痫组加重,致痫+2-CADO组较致痫组减轻。正常组在不同时间点的AI变化不明显(P>0.05),致痫组、致痫+DPCPX组、致痫+2-CADO组的AI随着癫痫发作时间的延长,AI逐渐增加(P<0.05);在相同时间点,致痫组、致痫+DPCPX组、致痫+2-CADO组的AI均明显高于正常组(P<0.05),致痫+DPCPX组的AI均明显高于致痫组(P<0.05);致痫+2-CADO组的AI明显低于致痫组和致痫+DPCPX组(P<0.05)。结论 癫痫发作会引起神经元损伤和凋亡,其可能与腺苷A1R活性降低,兴奋性氨基酸谷氨酸浓度增加有关,谷氨酸兴奋性增加可诱导神经元凋亡,这可能是癫痫发作后神经元损伤的机制之一。
腺苷A1受体;癫痫;海马神经元
细胞凋亡是指有核细胞在某些生理性或病理性因子刺激后,其表面分子结构作出应答反应,并将信号传入胞内,激活胞内分子机制,诱发细胞死亡的过程。有研究报道,癫痫发作会影响脑内神经递质的释放和细胞跨膜信息的传递,致使神经元受损甚至凋亡,最终导致胶质细胞增生、突触重建等脑结构和功能的可塑性改变,这种改变会使癫痫反复性发作[1]。故癫痫继发性脑损伤的机制和保护措施是近年来难治性癫痫研究的热点。
腺苷系统对中枢神经系统具有抑制性保护作用,其机制主要是结合腺苷A1受体(A1R)发挥作用。大量的研究表明,腺苷A1R对各种中枢性神经系统疾病所致的神经元损伤有保护作用[2],但其对杏仁核点燃癫痫大鼠各个时间段海马神经元的病理组织学和凋亡的影响鲜见报道。本实验通过探讨腺苷A1R与模型海马神经元损伤的关系,了解其对脑神经的保护作用,从而能更深刻地理解腺苷A1R与癫痫的关系,为癫痫的治疗提供参考。
1 材料与方法
1.1 实验动物及分组 SPF级雄性Wistar大鼠(200~250 g)84只,均购自河南省实验动物饲养中心,动物饲养条件:昼夜交替12 h光照,避噪声,单笼饲养,温度18~25 ℃,相对湿度45%~70%。根据随机数字表法将动物分为正常组、致痫组、致痫+腺苷A1R拮抗剂(8-环戊-1,3-二丙基黄嘌呤,DPCPX)组、致痫+腺苷A1R激动剂(2-氯化腺苷,2-CADO)组,每组21只。选取点燃癫痫模型成功后的1 d、15 d、30 d作为观察时间点,各时间点选7只大鼠。
1.2 点燃癲痫模型的建立
1.2.1 五芯电极的制作:材料:尖头钳、镊子、剪刀、刀片、电烙铁、捍锡、松香、打火机、直径0.19 mm镍铬丝、传感接头、微型螺丝(均为市场购买);登士柏牙托水、仿生型牙托粉(均购自郑州凯斯特医疗器械有限公司)、6%水合氯醛(水合氯酸粉剂配制成溶液,并用过滤器过滤无菌)。制作方法:①取镍铬丝,剪取长5 cm 3根,长3.5 cm 2根;②用打火机将5根剪裁好的镍铬丝两头烧红变黑,用刀片将外面的镀层去掉;③拔出传感接头上的塑料接头,并在凹槽处依次标记1~5;④将去掉镀层的镍铬丝固定在塑料接头上,标记1、4、5位置固定5 cm的镍铬丝,标记2、3位置固定3.5 cm镍铬丝,并用电烙铁及焊锡加固;⑤将2根3.5 cm镍铬丝相互扭转成一直线,并垂直于塑料接头,尾端位置分叉,但间隙<1 mm;⑥将3根5 cm镍络丝末端拧上螺丝,避免松动;⑦调整牙托粉和牙托水比例,确保电极及塑料接头固定良好。
1.2.2 手术及电极植入:动物麻醉:取6%水合氯醛麻醉,对致痫组、致痫+DPCPX组、致痫+2-CADO组大鼠采用腹腔注射方式,每100 g注射量为0.5 mL。用手术钳夹大鼠尾巴,其无反应即可判断麻醉成功,若麻醉不成功,可增加0.3 mL,增加次数须≤2次。电极植入:①剪去大鼠颅顶部手术区被毛,并固定于离体定位仪上,保持头正中位,其门牙置于定位仪牙槽孔内;常规消毒模型颅顶部手术区皮肤,行一1.5~2 cm的切口,充分显露术野。②将已消毒的电极固定在夹持器上,将3、4位置两根互相拧成直线的镍络丝做成的扎入电极与地面垂直;③调整三维坐标轴,调整扎入电极尖端定位于前囟点,记录三维坐标刻度值(X/Y/Z);④参照大鼠脑立体定位图谱,用牙科钻在已定位的右侧杏仁外侧核处(BLA)钻孔,尽可能不伤及脑膜;⑤植入扎入电极约8.5 mm,用牙托粉和牙托水固定电极在入颅处;⑥在1、 2位置的两个螺丝固定在前囟点左右作记录电极,5位置螺丝固定在人字缝后方为参考电极;调整塑料电极头使其凹槽处于前方,将电极、微型螺丝、塑料接头均固定在颅骨表面;⑦将大鼠从立体定位仪上取下,放回笼中。术后观察:术后7 d内,每天抓取测量其体质量,自由进食水和食物。
1.2.3 模型点燃:①术后第8天开始,所有大鼠接受电刺激,采用BL-420F生物功能实验系统,通道1和通道2设置为脑电信号,采用细电流连续串刺激模式,电流强度500 mA,延时100 ms,波宽1 ms,频率50 Hz,串长100,每天刺激1次。刺激前后记录杏仁核后放电及大鼠行为学变化。②根据国际通用的癫痫发作Racine分级:0级:无行为学改变;1级:湿狗样震颤;2级:点头及阻嚼动作;3级:前肢单肢阵挛,未直立;4级:双前肢阵挛伴身体直立;5级:强直阵挛发作伴随直立并背部倒地。大鼠连续10 d达到5级发作视为模型成功。
1.3 各组的处理方法 正常组未进行手术和电刺激致痫等处理;致痫组大鼠癫痫模型建立成功后未注射任何药物;致痫+DPCPX组大鼠癫痫模型建立成功前1 h和成功后1 h尾部静脉注射0.3 mg/kg DPCPX;致痫+2-CADO组大鼠癫痫模型成功前1 h和成功后1 h尾部静脉注射0.6 mg/kg 2-CADO。其中2-CADO购自美国Sigma公司、DPCPX购自美国Sigma公司。
1.4 石蜡切片制作、HE染色及TUNEL神经元凋亡测定
1.4.1 标本采集及石蜡切片制作:取6%水合氯醛对大鼠进行麻醉,并将其仰卧固定于解剖板上,从剑突处开胸,显露心脏,用穿刺针掺入心尖部并固定在左心室位置,再在动物心脏右心耳剪一小口放血,进行主动脉灌流,迅速注入生理盐水100 mL,再灌注200 mL含4%多聚甲醛的缓冲液,切断动物头部,取出脑组织,4%多聚甲醛固定。常规脱水、透明、浸蜡、包埋。将模具放在冰上10 min后,将蜡块取出,置于4 ℃冰箱保存。
1.4.2 HE染色:按照苏木精-伊红染色法的步骤操作,其中苏木素购自上海士锋生物科技有限公司,无水乙醇购自石家庄瑞兴化工有限公司,二甲苯购自石家庄瑞兴化工有限公司,中性树胶购自北京百奥莱博科技有限公司,依次二甲苯脱蜡、酒精浸泡、苏木素染色、脱水、返蓝、冲洗、伊红染色、透明、封片。每个标本进行海马组织切片,随机取5个400倍光镜视野,计算总细胞数和神经元凋亡细胞数,取平均值作为最后结果进行计算。
1.4.3 TUNEL神经元凋亡测定:采用TUNEL法对神经元细胞凋亡细胞数目进行测定,TUNEL细胞凋亡检测试剂盒购自北京世联搏研科技有限公司,首先对切片脱蜡,滴加蛋白酸K工作液,20~37 ℃作用20~30 min,灭活内源性过氧化物酶,加50 μL TdT 酶反应液,37 ℃避光培育 1 h,加50 mL Strep-tavidin-HRP工作液37 ℃避光培育30 min,以上5个程序过后均用PBS洗涤3~5次,5 min/次,然后进行显色、返蓝、脱水、透明、封片,在显微镜观察获得图像。神经元凋亡细胞经TUNEL染色后细胞核呈棕色或棕褐色。神经元细胞凋亡指数(AI)是指每个视野神经元细胞凋亡细胞总数除以每个视野的细胞总数。

2 结果
2.1 杏仁核点燃大鼠癫痫模型的行为学及脑电特征观察 致痫组、致痫+DPCPX组、致痫+2-CADO组大鼠随着电刺激次数的增加,杏仁核后放电逐渐升高,电刺激第10天时达到稳定5级发作(图1)。致痫组、致痫+DPCPX组、致痫+2-CADO组大鼠脑电波在点燃前(未到达5级发作时)未见痫样放电(图2),点燃后模型癫痫发作时可见大量高幅棘波发放,脑电基本频率正常(图3)。
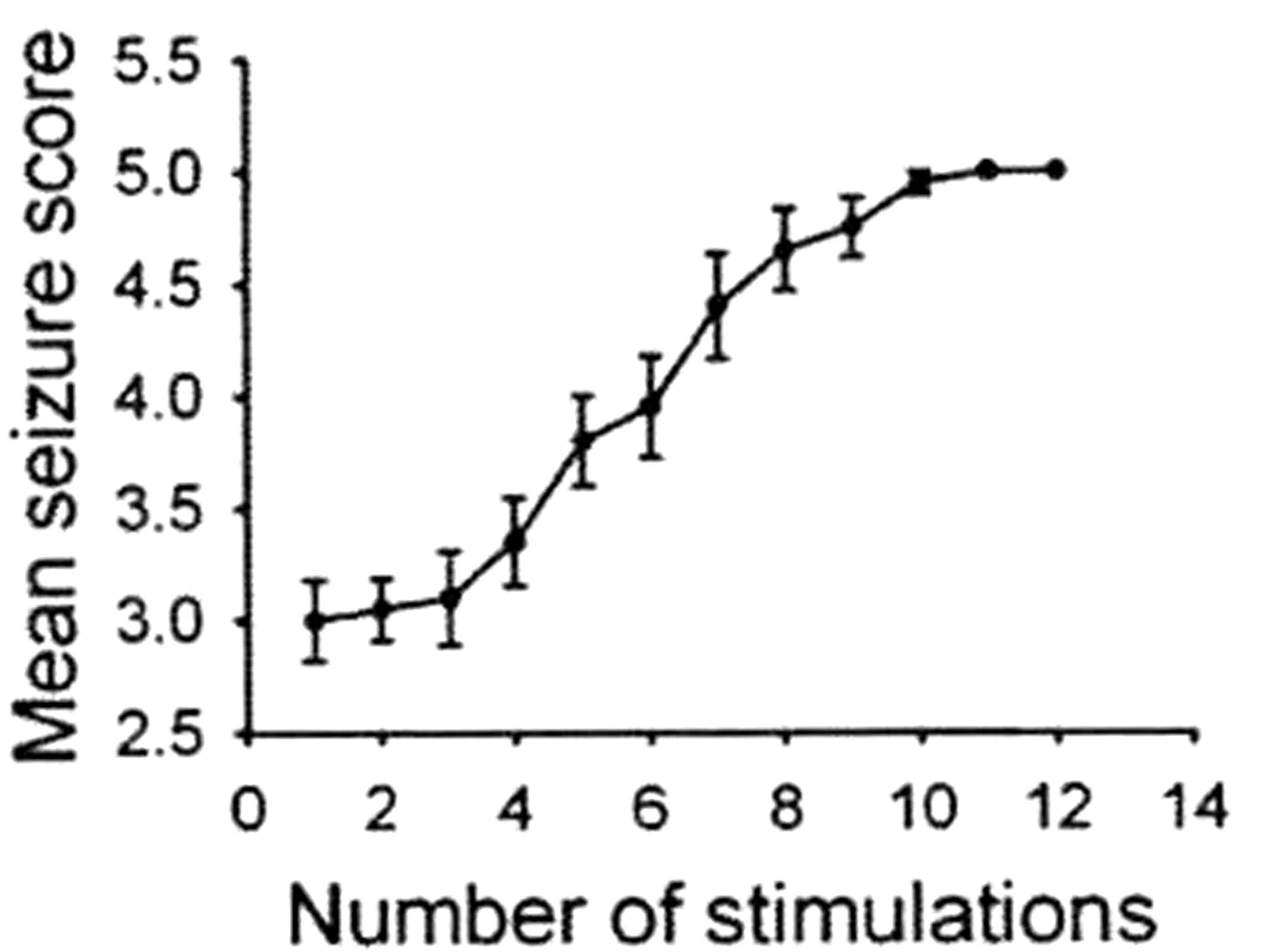
图1 刺激时间与ADD的关系
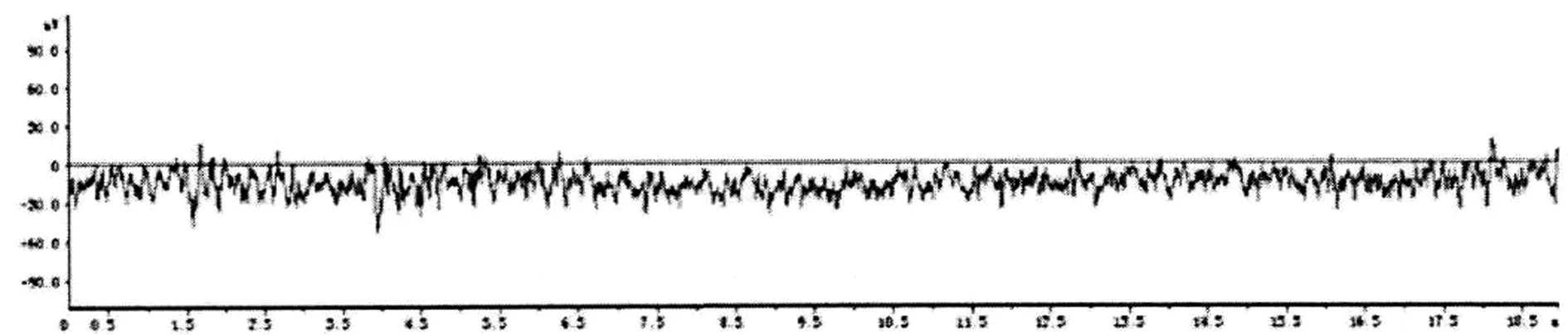
图2 点燃前脑电图表现
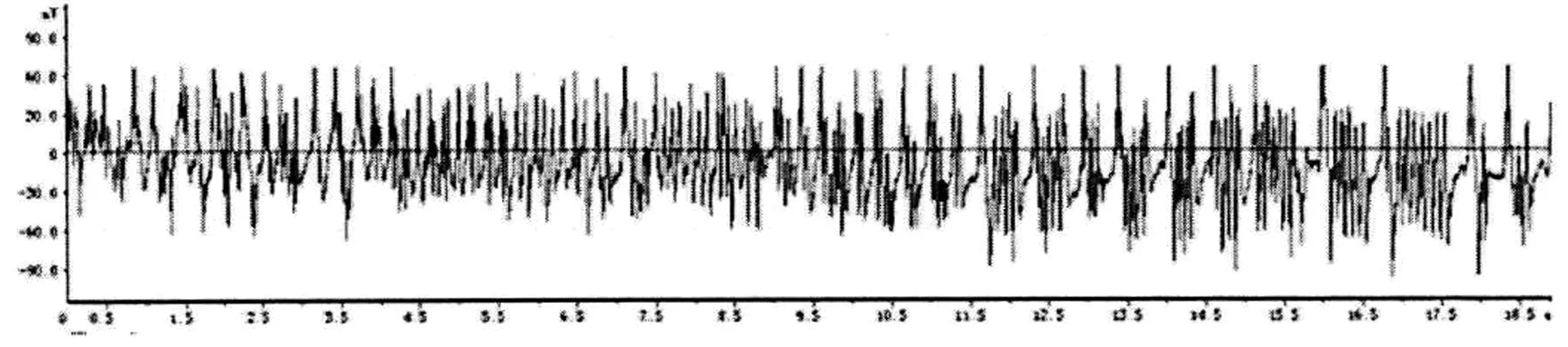
图3 点燃后脑电图表现
2.2 腺苷A1R对点燃癫痫大鼠海马神经元损伤的神经保护作用 4组海马CA3区神经元损伤病理组织学变化情况对比:(1)正常组1 d、15 d及30 d时动物模型海马CA3区HE染色情况见图4,神经元细胞排列紧密,轮廓清晰,胞核呈圆形或椭圆形,胞浆透明,结构完整。(2)致痫组点燃癫痫后1 d、15 d及30 d时动物模型海马CA3区HE染色情况见图5,点燃癫痫后1 d神经元细胞结构基本正常,排列欠整齐,少量神经细胞肿胀、形态不完整;15 d、30 d时神经元细胞排列松散无规则,轮廓模糊,边缘欠清晰,胞核萎缩,胞浆空泡,出现明显神经元变性,死亡等不同程度的结构损害。(3)致痫+DPCPX组点燃癫痫后1 d、15 d及30 d时动物模型海马CA3区HE染色情况见图6,与致痫组相比,相同时间点致痫+DPCPX组大鼠海马CA3区神经元细胞排列更加紊乱,细胞水肿、胞浆空泡、神经元变性坏死等结构损害程度加重。(4)致痫+2-CADO组点燃癫痫后1 d、15 d及30 d时动物模型海马CA3区HE染色情况见图7,与致痫组相比,相同时间点致痫+2-CADO组大鼠海马CA3区神经元细胞排列基本规整有序,细胞水肿、胞浆空泡、神经元变性坏死等结构损害程度减轻。
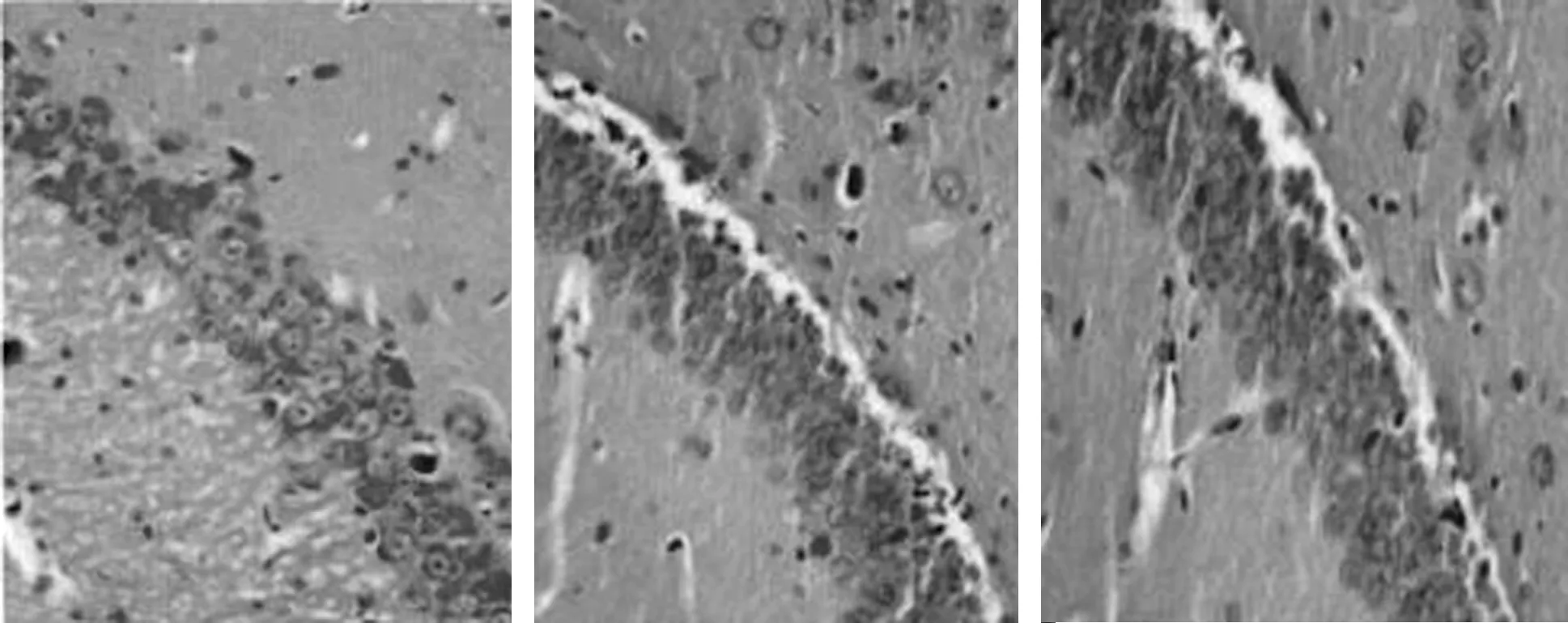
1 d 15 d 30 d图4 正常组大鼠海马CA3区1 d、15 d及30 d时神经元HE染色
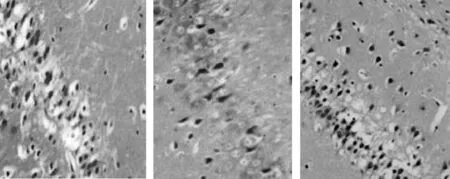
1 d 15 d 30 d图5 致痫组点燃癫痫后大鼠海马CA3区1 d、15 d及30 d时神经元HE染色
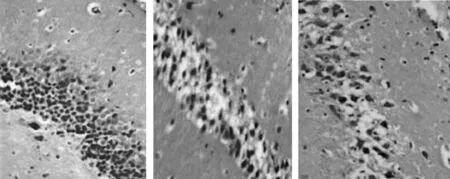
1 d 15 d 30 d图6 致痫+DPCPX组点燃癫痫后大鼠海马CA3区1 d、15 d及30 d时神经元HE染色
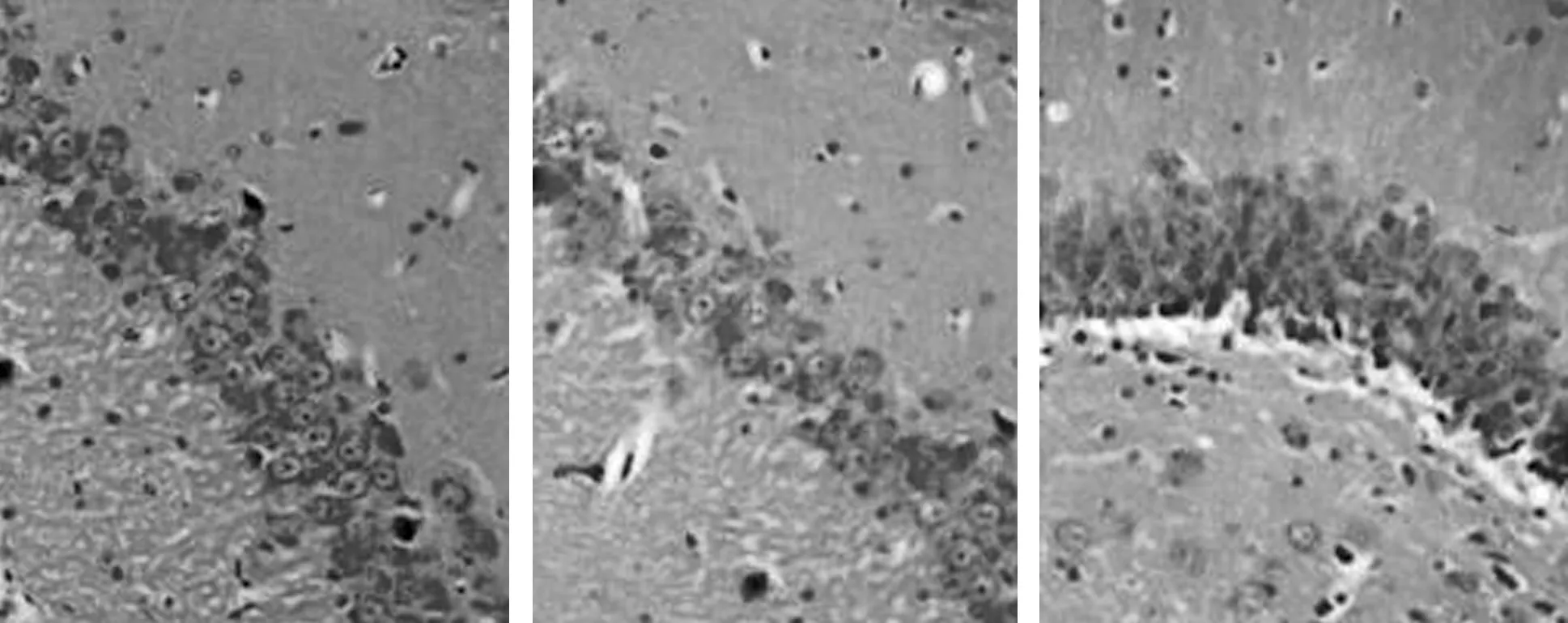
1 d 15 d 30 d图7 致痫+2-CADO组点燃癫痫后大鼠海马CA3区1 d、15 d及30 d时神经元HE染色
2.3 4组点燃癫痫后1 d、15 d、30 d海马CA3区神经元凋亡指数(AI)比较情况 正常组在不同时间点的AI变化不明显(P>0.05),致痫组、致痫+DPCPX组、致痫+2-CADO组的AI随着癫痫发作时间的延长,凋亡指数逐渐增加(P<0.05);在相同时间点,致痫组、致痫+DPCPX组、致痫+2-CADO组的AI均明显高于正常组(P<0.05),致痫+DPCPX组的AI均明显高于致痫组(P<0.05);致痫+2-CADO组的AI明显低于致痫组和致痫+DPCPX组(P<0.05)。见表1。
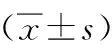
表1 4组点燃癫痫后1 d、15 d、30 d海马CA3区神经元 凋亡指数(AI)比较情况
注:与正常组比较,aP<0.05;与致痫组比较,bP<0.05;与致痫+DPCPX组比较,cP<0.05
3 讨论
癫痫的发生与多种因素相关,为了阐明其发病机制,癫痫模型的建立起着重要作用。目前,癫痫模型有化学试剂诱导癫痫模型和电剌激癫痫模型等[3]。电刺激癫痫模型最早由Goddard于1967年提出,这种模型具有以下优势[4]:(1)动物癫痫发作与脑电图痫样放电同步;(2)每天采用低强度电刺激对脑组织的损伤作用较弱;(3)模型点燃成功后,其自发性癫痫发作持续时间可达12个月以上。研究表明,电刺激癫痫模型,在点燃癫痫过程中并未出现神经元缺失和脑组织结构损害[5]。Pak等[6]采用定量体视学技术对电刺激癫痫模型进行神经元损伤进行观察,发现当大鼠出现5级发作3次后其海马神经元出现部分缺失,随着5级发作次数的增多,神经元缺失逐渐加重。
研究报道,点燃癫痫发作可损害海马,引起海马神经元损伤和凋亡[7-8]。本实验中,致痫组、致痫+DPCPX组、致痫+2-CADO组大鼠经过10次5级发作后HE染色可见,与正常组相比,其海马CA3区均出现明显的神经元缺失;正常组动物海马神经元细胞排列紧密,轮廓清晰,胞核呈圆形或椭圆形,胞浆透明,结构完整;致痫组动物在癫痫发作第1天时海马神经元细胞结构基本正常,排列欠规则,部分细胞肿胀,癫痫发作15 d、30 d时神经元细胞松散无序,边缘模糊,胞核萎缩,胞浆空泡,细胞间距增大,出现明显神经元变性、坏死,这一结果提示癫痫发作会引起海马神经元损伤;在同一时间点,致痫+DPCPX组海马神经元细胞排列更加松散无序,细胞水肿、胞浆空泡更加严重,神经元变性坏死等结构损害程度较致痫组加重;而与致痫组相比,致痫+2-CADO组海马神经元细胞排列较规整,细胞水肿、胞浆空泡、神经元变性坏死等结构损害均减轻;这提示腺苷A1R活性增强会减轻海马神经损伤,故提高腺苷A1R活性对癫痫发作引起的海马损伤具有保护作用。
本实验采用TUNEL神经元凋亡测定不同腺苷A1R活性状态下癫痫大鼠模型的海马神经元凋亡指数,发现在相同时间点,致痫组、致痫+DPCPX组、致痫+2-CADO组大鼠海马神经元凋亡指数均明显高于正常组,说明癫痫发作可诱发神经元死亡;致痫+DPCPX组动物的神经元凋亡指数较致痫组显著增高,提示腺苷A1R活性的降低会加剧海马神经元的凋亡;致痫+2-CADO组的神经元凋亡指数较致痫组降低,提示腺苷A1R活性的增加会阻止海马神经元的凋亡,这与上述HE染色发现的海马组织学病理变化相一致,从而证实了腺苷A1R参与了癫痫发作后海马神经元损伤过程中对神经的保护作用,且可抵抗神经元调亡。
综上所述,癫痫发作会引起神经元损伤和凋亡,其可能与腺苷A1R活性降低、兴奋性氨基酸谷氨酸浓度增加有关,谷氨酸兴奋性增加可诱导神经元凋亡,这可能是癫痫发作后神经元损伤的机制之一。因此,通过增加腺苷A1R活性可保护神经元,降低其损伤,可能是终止癫痫发作的一个治疗方向。
[1] 张丹参,任雷鸣,张力,等.腺苷A1受体阻断剂对大鼠海马BDNF蛋白表达及内质网的影响[J].中国药理学通报,2006,75(2):69-70.
[2] Brambilla D,Chapman D,Greene R.Adenosine Mediati-on of Presynaptic Feedback Inhibition of Glutamate Release[J].Neuron,2005,46(2):52-53.
[3] 游明瑶,伍国锋,蒋乃昌.低频电刺激双侧丘脑底核对癫痫模型大鼠脑内谷氨酸表达及海马细胞单位放电的影响[J].贵阳医学院学报,2014,39(2):928-929.
[4] 刘真苓,刘怀普,郭惠明,等.腺苷处理后犬脊髓缺血再灌注损伤中神经元凋亡及相关蛋白表达的变化[J].中华胸心血管外科杂志,2014,74(2):82-83.
[5] 桂莉.腺苷A2A受体与神经元缺血性损伤[J].重庆医学,2010,67(2):62-63.
[6] Pak DT,Yang S,Rudolph-Correia S,et al.Regulation of dendritic spine morphology by SPAR,a PSD-95-associated RapGAP[J].Neuron,2001,2(2):53-54.
[7] 于军,钟一声.腺苷及其衍生物在眼科应用的研究进展[J].中华实验眼科杂志,2011,206(3):70-71.
[8] Hill EL,Hosie S,Mulligan RS,et al.Temperature elevation increases GABA(A)-mediated cortical inhibition in a mouse model of genetic epilepsy[J].Epilepsia,2011,52(1):179-184.
(收稿2016-11-10)
R-332
A
1673-5110(2017)05-0040-05
