miR-182在胆囊癌中的表达及其对胆囊癌细胞增殖、侵袭能力的影响
2017-06-28张智勇常虎林杜立学
张智勇,郑 伟,常虎林,杜立学,刘 阳
1.陕西省人民医院肝胆外科(西安710068),2.西安交通大学第二附属医院普外科(西安710004)
miR-182在胆囊癌中的表达及其对胆囊癌细胞增殖、侵袭能力的影响
张智勇1,郑 伟1,常虎林1,杜立学1,刘 阳2△
1.陕西省人民医院肝胆外科(西安710068),2.西安交通大学第二附属医院普外科(西安710004)
目的:检测miR-182在胆囊癌中的表达,探讨其影响胆囊癌细胞增殖、侵袭的可能机制。方法:实时荧光定量 PCR检测miR-182、p38在10例胆囊癌组织、癌旁组织中的表达情况;应用miR-182 mimics转染胆囊癌细胞GBC-SD,应用p38 MAPK信号通路特异性阻滞剂SB203580处理转染miR-182 mimics的GBC-SD细胞,通过MTT实验、细胞周期检测、Transwell小室检测miR-182对GBC-SD细胞增殖、侵袭能力的影响。结果:胆囊癌组织中miR-182、p38的表达高于癌旁组织;miR-182 mimics转染GBC-SD细胞后,p38的表达水平随之升高(P<0.05),细胞增殖能力增强,细胞迁移数增多(75±8),S期细胞比例增多[(68.81±7.57)%];应用SB203580处理转染miR-182的GBC-SD细胞,细胞增殖能力降低,细胞迁移数减少(23±5),S期细胞比例减少[(34.49±7.05)%]。结论:miR-182 在胆囊癌组织中高表达,通过上调p38 MAPK信号通路增强胆囊癌细胞的增殖、侵袭能力,参与了胆囊癌的发生发展过程。
胆囊癌是胆道系统常见的恶性肿瘤,发病隐匿,是侵袭性和致死性较高的恶性肿瘤之一,由于肿瘤早期极易侵犯肝脏或通过淋巴结发生转移,因此手术切除率较低,文献报道外科手术切除后5年存活率约为5%[1],因此,研究胆囊癌的发生发展机制对改善患者预后有着重要的意义。microRNA(miRNA)是一类约18~25个碱基组成的非编码单链RNA,转录后参与肿瘤的发生发展[2]。miR-182定位于人7号染色体(7q32.2),大量研究报道miR-182与胃癌、结直肠癌、胰腺癌等多种肿瘤的发生发展有关[3]。本研究旨在探讨miR-182在胆囊癌组织与癌旁组织中的表达差异,并通过细胞实验探讨miR-182影响胆囊癌细胞GBC-SD增殖、侵袭的可能机制。
材料与方法
1 材 料 选取2013年1月至2014年6月陕西省人民医院肝胆外科收治的10例胆囊癌患者,癌组织标本均为手术切除并经过病理证实,切除距癌灶边缘2~5 cm的组织作为癌旁组织;胆囊癌细胞GBC-SD,购自中国科学院上海细胞生物学研究所。主要试剂:p38 MAPK信号通路特异性阻滞剂SB203580,购自美国Selleck公司;miR-182、p38、β-actin引物由上海生物工程技术服务有限公司合成;miR-182 mimics、miRNA阴性对照,购自广州锐博生物科技有限公司;胎牛血清、Trizol试剂,购自美国Amresco公司;LipofectamineTM2000、Opti-MEM,购自美国Invitrogen公司;逆转录试剂盒、SYBR Premix Ex Taq实时定量PCR试剂盒,购自北京中山生物工程公司;Transwell小室,购自美国Corning公司。
2 实验方法 ①实时荧光定量PCR检测胆囊癌组织、癌旁组织中miR-182、p38 mRNA的表达:按照Trizol试剂说明书提取胆囊癌组织、癌旁组织的总RNA,取1μl RNA 溶液,用无RNA酶的水10倍稀释,取2 μl稀释后的RNA溶液,在波长260 nm和280 nm处测定光密度(OD)值,估计RNA 纯度,A260/A280 比值在1.8~2.0之间则满足实时荧光定量PCR实验要求。配制逆转录反应体系:总RNA 500 ng,特异性逆转录引物0.5 μl,10 mmol/L的dNTP mix 0.5 μl,5×ExScriptTMBuffer 2 μl,RNase inhibitor 0.25 μl,ExScriptTMRtase 0.25 μl,加无RNA酶水至10 μl,反应体系的配制在冰上进行。将反应体系混匀后进行逆转录反应,反应条件:42 ℃,15 min;95 ℃,2 min。将所得的cDNA模板2 μl与上游引物1μl、下游引物1μl、SYBR Green PCR Master Mix 12.5 μl、ddH2O 8.5 μl混匀,用ABI Prism 7000型荧光定量PCR仪进行扩增,反应条件:95 ℃预变性2 min后;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸40 s,总计40个循环。根据公式 Folds=2-△△Ct来计算目的基因的相对表达量。②miR-182转染胆囊癌细胞GBC-SD:选取对数生长期的GBC-SD细胞胰酶消化后接种到6孔板(1×105/孔),24 h后细胞融合率达到30%~50%后弃去培养液,使用LipofectamineTM2000进行转染,转染试剂配制:将1 μl 的LipofectamineTM2000与50 μl轻轻混匀,室温孵育5 min;将miR-182 mimics(20 pmol)、miRNA阴性对照分别溶于Opti-MEM使其终浓度为20 μmol/L,室温孵育5 min;将miR-182 mimics、miRNA阴性对照分别与LipofectamineTM2000混匀,室温放置20 min,加入到含有GBC-SD细胞的6孔板中,并置于培养箱孵育24 h,实时荧光定量 PCR检测转染前后GBC-SD细胞中miR-182、p38 mRNA的表达。③MTT实验:将转染miR-182、miRNA阴性对照的GBC-SD细胞以1×105/孔的浓度接种于96孔板,分为转染组、阴性对照组,另设空白对照组,每组设3个复孔。分别于转染0、24、48、72、96 h后弃去培养液,加入20 μl的MTT试剂,置于37 ℃、5% CO2培养箱中孵育4 h后,每孔加入150 μl的 DMSO溶解,小心振荡10 min,在酶联免疫检测仪490 nm波长处测定每孔OD值;另取一组转染miR-182的GBC-SD细胞,加入SB203580,使其终浓度为75 μmol/L,设为SB203580组,实验过程同转染组。计算各组的细胞抑制率,细胞抑制率(%)=(1-实验组OD值/空白对照组OD值)×100%。④细胞周期检测:将GBC-SD细胞以1×105个/孔接种于6孔板中,将miR-182、miRNA阴性对照转染GBC-SD细胞,胰酶消化后,800 r/min离心5 min后弃去上清液,加入10 μl的Annexin Ⅳ-FITC和5 μl的PI,避光室温反应10~15 min,加入300 μl结合缓冲液后上流式细胞仪检测。另设空白对照组、SB203580组(75 μmol/L),细胞周期检测过程同转染组。实验重复3次。⑤侵袭实验:GBC-SD细胞转染24 h后,胰酶消化,DMEM培养基重悬细胞,调整细胞浓度为1×106/ml,上室加细胞悬液100 μl,下室加含1%胎牛血清的DMEM培养基400 μl,置于37 ℃、5% CO2培养箱中孵育24 h,弃培养液,95%乙醇固定20 min,0.1%结晶紫浸染30 min,显微镜下计数迁移至Transwell小室下层的细胞个数,另设空白对照组、阴性对照组、SB203580组(75 μmol/L),实验过程同转染组,每组实验重复3次。
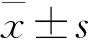
结 果
1 胆囊癌组织、癌旁组织中miR-182、p38 mRNA的表达情况 见图1。实时荧光定量PCR结果显示,胆囊癌组织中miR-182mRNA的表达高于癌旁组织(P<0.05),p38 mRNA在胆囊癌组织中的表达亦高于癌旁组织(P<0.05)。
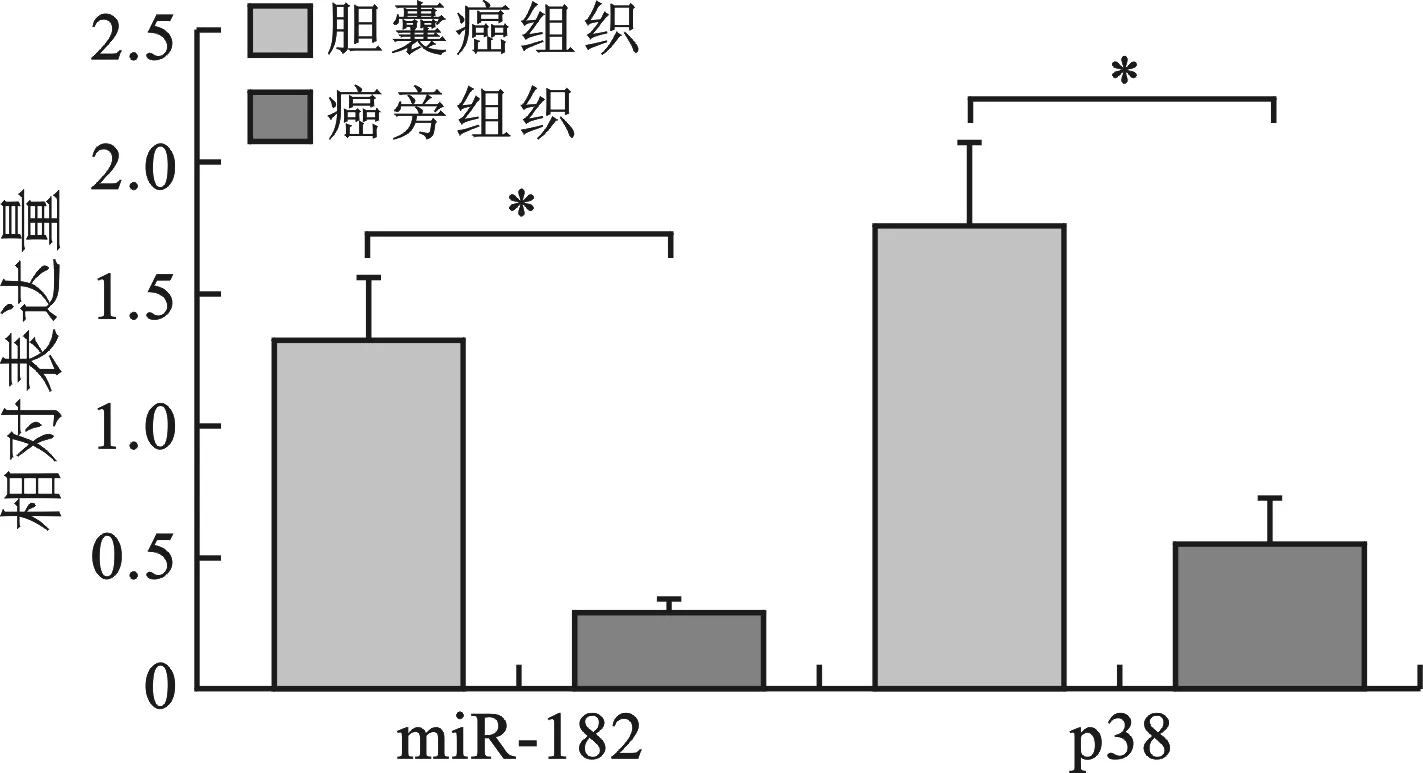
* P<0.05
2 miR-182对胆囊癌细胞GBC-SD侵袭能力的影响 miR-182转染胆囊癌细胞GBC-SD后,miR-182(5.31±0.62)、p38(3.48±0.44)的表达较阴性对照组、空白对照组表达升高(P<0.05)(图2),表明miR-182已成功转染至GBC-SD细胞中,miR-182上调了p38的表达。转染组GBC-SD细胞迁移数(75±8)高于阴性对照组(25±5)和空白对照组(30±6)(P<0.05);SB203580组GBC-SD细胞的迁移数(23±5),与转染组细胞迁移数的差异有统计学意义(P<0.05)(图3)。
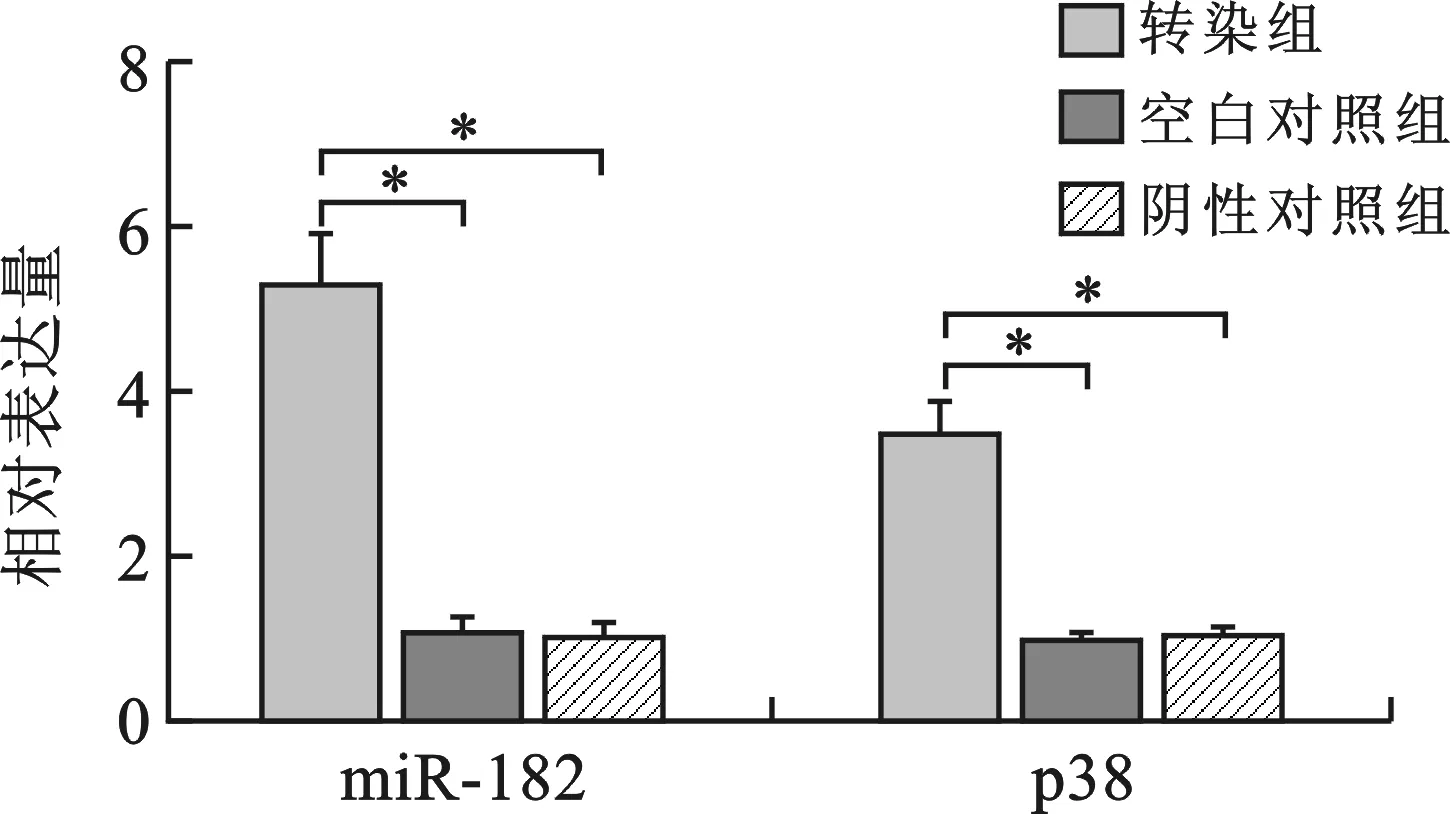
* P<0.05

* P<0.05
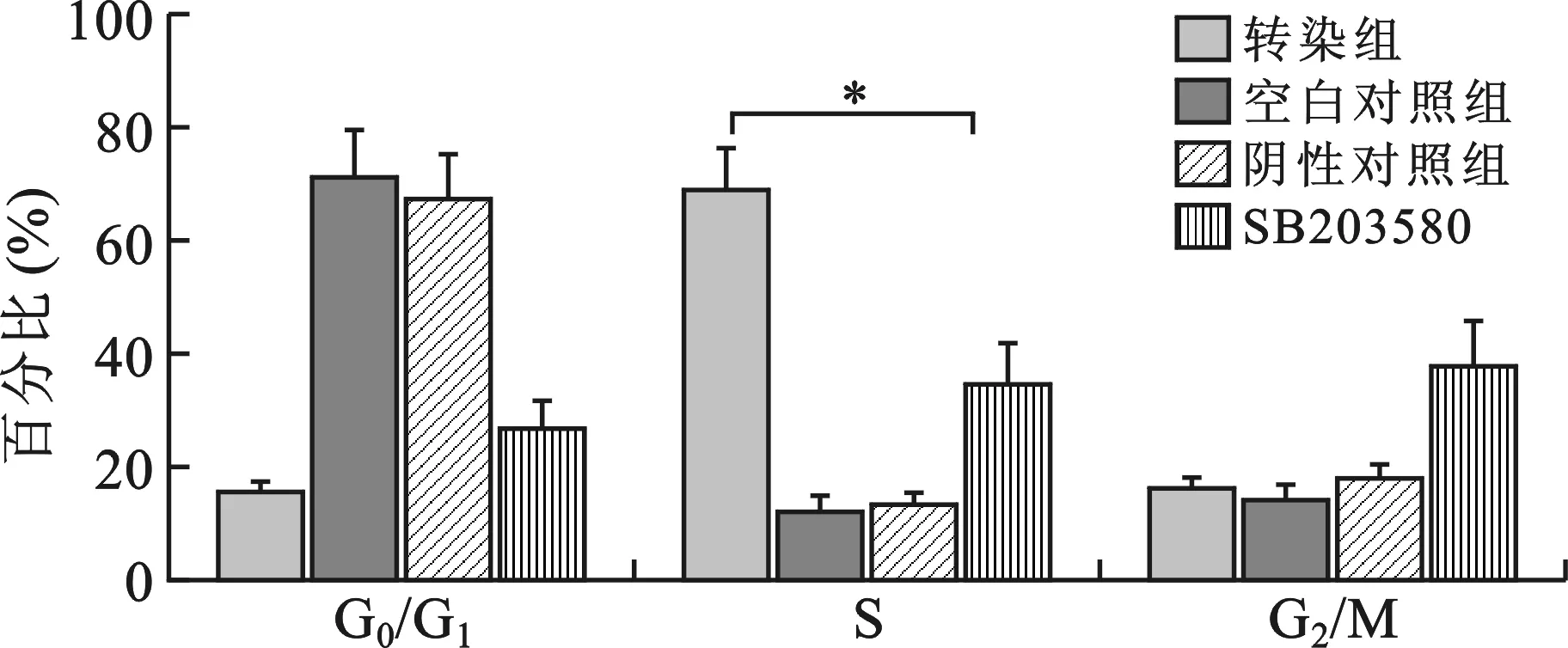
3 miR-182对胆囊癌细胞GBC-SD增殖的影响 miR-182转染后促进GBC-SD细胞的增殖,与阴性对照组和空白对照组比较差异有统计学意义(P<0.05),SB203580抑制miR-182对GBC-SD细胞的促增殖作用(图4)。细胞周期检测结果显示miR-182增加GBC-SD细胞S期百分比[(68.81±7.57)%],与阴性对照组[(14.55%±3.06)%]、空白对照组[(20.03%±2.81)%]、SB203580组[(34.49%±7.05)%]比较差异有统计学意义(P<0.05)(图5)。
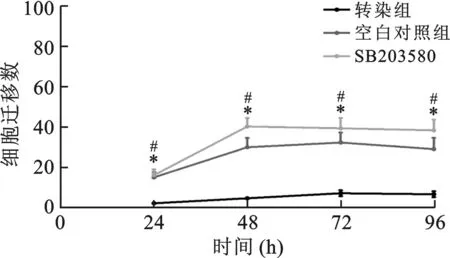
转染组与阴性对照组比较,*P<0.05;转染组与SB203580组比较, #P<0.05
*P<0.05
讨 论
胆囊癌患者就诊时已存在不同程度的毗邻脏器浸润或转移,由于肿瘤的高度侵袭性,仅凭手术难以改善患者的远期疗效[4],寻找特异性的诊断和治疗靶点是胆囊癌的研究热点。多数肿瘤中均可检测到miRNA的异常表达,通过转录后水平调控基因的表达,起“癌基因”或“抑癌基因”样作用调控肿瘤的发生发展[5]。Lagos-Quintana等[6]首次在小鼠的眼中发现了miR-182,随后有大量的研究发现miR-182在胰腺癌、胆管癌、结直肠癌、肝癌中发挥着类似癌基因的作用[3]。袁源[7]发现miR-182在胆囊癌组织中表达上调,但其在胆囊癌发生发展中的具体机制不详,我们的研究也发现了miR-182在胆囊癌组织、癌旁组织中的差异表达,miR-182在胆囊癌组织中的高表达参与了胆囊癌发生发展的调控过程。
p38 MAPK信号通路是MAPKs超家族4条平行通路之一,作用于细胞周期的各个检验点,参与调控细胞增殖过程[8]。文献报道p38 MAPK在多种肿瘤组织中持续高表达[9],我们的研究也发现了p38在胆囊癌组织中高表达,通过miR-182转染胆囊癌细胞GBC-SD后,p38呈高表达水平,细胞的增殖、侵袭能力也增强,S期细胞所占比例增多,使用p38 MAPK信号通路特异性阻滞剂SB203580后,细胞的增殖、侵袭能力也随之降低,表明了miR-182可能通过上调p38 MAPK信号通路参与胆囊癌发生发展的调控。
miR-182类似癌基因样作用多见于乳腺癌、结直肠癌、胰腺癌,Chen等[10]检测109例胰腺癌患者血清中循环型miR-182的表达,发现肿瘤患者循环型miR-182的表达高于胰腺炎、正常对照患者,诊断的敏感性和特异性均高于CA19-9,Kaplan-Meier生存曲线分析亦提示miR-182与患者预后明显相关。本实验仅检测了胆囊癌组织中miR-182的表达,未检测循环型miR-182的表达,临床样本量只有10例,因此未分析患者预后与miR-182表达水平的相关性。刘慧等[11]检测了86例直肠癌组织中miR-182的表达,发现miR-182的表达水平与肿瘤浸润、转移和分期显著相关,结果提示miR-182与肿瘤转移有关。我们的研究也发现,利用脂质体转染miR-182后GBC-SD细胞的侵袭能力增强,而这种增殖、侵袭能力的增强与p38 MAPK信号通路有关。然而,miR-182的表达与胆囊癌临床病理特征、预后是否相关有待于进一步的研究发现,也有文献报道miR-182通过抑制肿瘤转移抑制基因1的表达,促进肿瘤转移[12]。现有对miR-182靶基因的研究大多建立在miR-182与靶基因3'UTR互补配对,最新的关于miRNA探索领域是ceRNA调控网络假说[13],而miR-182及其基因簇在ceRNA调控网络中的确切机制仍有待进一步加以探索。
本研究发现miR-182在胆囊癌组织中高表达,miR-182转染胆囊癌细胞GBC-SD 后细胞的增殖、侵袭能力增强,其分子机制可能是通过上调p38 MAPK信号通路实现的,miR-182调控胆囊癌发生发展的具体机制仍有待进一步研究。
[1] 慎浩鑫,宋虎伟,王 林,等.西北五省17家医院2379例胆囊癌临床分析[J].中华外科杂志,2015,53(10):747-751.
[2] Bartel DP. MicroRNAs: target recognition and regulatory functions [J].Cell, 2009, 136(2): 215-233.
[3] 蒋金艳,谢海龙.MiR-182研究进展[J].中南医学科学杂志,2015,33(5):584-588.
[4] 俞文隆,张永杰. 胆囊癌根治性切除术的关键问题[J].外科理论与实践,2013,15(2):104-107.
[5] Brennecke J,Hipfner DR,Stark A,etal.Bantam encodes a developmentally regulated miRNA that controls cell proliferation and regulates the proapoptotic gene hid in drosophila[J].Cell,2003,113(1):25-36.
[6] Lagos-Quintana M, Rauhut R, Meyer J,etal. New microRNAs from mouse and human [J].RNA,2003,9(2):175-179.
[7] 袁 源. miRNA-145在胆囊癌发病过程中的调控作用及机制研究[D].中南大学,2014.
[8] 黄 川.JNK、p38MAPK信号通路与肿瘤细胞凋亡[J].实验与检验医学,2012,30(5):447-452.
[9] 邱建武,郭 薇,申丽娟. p38MAPK在肝细胞癌中的研究进展[J]. 世界华人消化杂志,2008,21(5):503-509.
[10] Chen QL, Yang LJ, Xiao YL,etal. Circulating microRNA-182 in plasma and its potential diagnostic and prognostic value for pancreatic cancer[J]. Medical Oncology,2014,31(11):225.
[11] 刘 慧,杜鲁涛,杨咏梅,等.MiR-182在结直肠癌中的表达及其对结直肠癌细胞迁移能力的影响[J].山东大学学报:医学版,2013,51(12):70-74.
[12] Ng EK,Chong WW,Jin H,etal. Differential expression of microRNAs in plasma of patients with colorectal cancer: a potential marker for colorectal cancer screening[J].Gut,2009,58(10):1375-1381.
[13] Salmena L,Poliseno L,Tay Y,etal.A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language[J].Cell,2011,146(3):353-358.
(收稿:2016-12-01)
The expression of miR-182 in gallbladder carcinoma and its effect on cell proliferation and migration of GBC-SD cells
Zhang Zhiyong,Zheng Wei,Chang Hulin,et al.
Department of Hepatobiliary Surgery, Shaanxi Provincial People’s Hospital (Xi’an 710068)
Objective: To detect the expression of miR-182 in gallbladder carcinoma, and explore its effect on cell proliferation and migration of GBC-SD cells in vitro. Methods: The expressions of miR-182, p38 in 10 pairs of gallbladder carcinoma and pericarcinomatous tissues were detected by Real-time PCR; the cell proliferation and migration of GBC-SD cells, which were transiently transfected with miR-182 mimics, and treated by p38 MAPK signaling pathway blocker SB203580, were tested by MTT, cell cycle analysis and Transwell chamber. Results: The expressions of miR-182, p38 were significantly higher in gallbladder carcinoma tissues compared with pericarcinomatous tissues; the expressions of p38(P<0.05), proliferation ability, cell migration(75±8) and S-phase fraction[(68.81±7.57)%]increased after GBC-SD cells were transfected with miR-182 mimics; proliferation ability, cell migration(23±5)and S-phase fraction [(34.49±7.05)%]decreased after the transfected GBC-SD cells were treated by SB203580. Conclusion: miR-182 is over expressed in gallbladder carcinoma, and up-regulates p38 MAPK signaling pathway to enhance the capacity of cell proliferation and migration in vitro, suggesting miR-182 may play an important role in the tumorigenesis and development of gallbladder carcinoma.
Gallbladder neoplasm/pathology MicroRNAs Cell proliferation Neoplasm metastasis
*陕西省自然科学基础研究计划项目(2015JM8389)
胆囊肿瘤/病理学 微RNAs 细胞增殖 肿瘤转移
R735.8
A
10.3969/j.issn.1000-7377.2017.06.003
△通讯作者
