纤维素乙醇产业化的突破口
——集成就地产酶工艺的多联产生物精炼
2017-06-28曲音波毕衍金李雪芝赵淑晶韩小龙闫俊卿杜健李宏伟
曲音波,毕衍金,李雪芝,赵淑晶,韩小龙,闫俊卿,杜健,李宏伟
1.山东大学微生物技术国家重点实验室,国家糖工程技术研究中心,济南 250100
2.山东泉林纸业有限责任公司科研所,聊城 252800
纤维素乙醇产业化的突破口
——集成就地产酶工艺的多联产生物精炼
曲音波1,毕衍金2,李雪芝1,赵淑晶2,韩小龙1,闫俊卿2,杜健1,李宏伟2
1.山东大学微生物技术国家重点实验室,国家糖工程技术研究中心,济南 250100
2.山东泉林纸业有限责任公司科研所,聊城 252800

曲音波,教授,博士生导师。曾任中国微生物学会副理事长,亚洲生物技术联合会咨询委员。现为亚洲生物技术联合会生物能源与生物炼制分会理事,《微生物学报》副主编。长期从事纤维素酶研究和可再生资源微生物转化技术开发,先后担任过“973”项目首席科学家和国家自然科学基金重点项目负责人,主持或参加了20余项国家或省部级以上科研项目。发表研究论文360余篇。主持或参与编写著作10余部。筛选到的青霉纤维素酶抗降解物阻遏高产突变株已被用于工业酶制剂生产。先后获得国家科技进步二等奖1项,国家技术发明二等奖和四等奖各1项,省部级二等以上科技奖励8项,国家发明专利13项,并获得中国发明专利优秀奖1项。E-mail:quyinbo@sdu.edu.cn
纤维素乙醇产业化在可再生资源利用、环境污染控制、农业产业链延伸、农村经济发展、农民就业等方面均可发挥重大作用。但由于生产成本仍然偏高,至今未能实现大规模的产业化。把集成了就地产酶过程的多联产生物精炼技术选择为实现纤维素乙醇大规模产业化的突破口,可以大幅度降低酶解产糖的用酶成本。同时,引进精炼概念,提高了纤维素乙醇生产与同类粮食和石油产品的经济竞争力。玉米芯生物精炼联产木糖产品-乙醇-木质素工艺技术,成功实现了纤维素乙醇工业化生产,最近正在合作开发秸秆生物精炼联产纸浆-乙醇-黄腐酸肥新技术,有望实现更大规模的工业生产。
纤维素乙醇;集成生物精炼;就地产酶;纤维素酶;戊糖/己糖共发酵
1 纤维素乙醇研究的意义和开发进展
通过纤维素乙醇的规模化生产,可以大规模开发未被充分利用的秸秆等可再生性的农林废弃物资源,防止秸秆就地焚烧造成的空气污染。同时,通过推广含10%~20%乙醇的汽油醇用作车用燃料,可以提高汽油的辛烷值,减少汽车尾气中的氮氧化物、硫氧化物及微细颗粒物。这些都可以协助减少雾霾的形成。来源于太阳光合作用吸收二氧化碳生产的纤维素乙醇属于碳中性的清洁燃料,燃烧过程不会造成二氧化碳的净排放,大规模应用可以减少化石能源利用和减缓气候变暖,保护生态环境。另外,发展纤维素乙醇产业还可以在不影响粮食安全供应的基础上,延长农业生产的产业链、安排农民就业和增收、促进农村经济发展,为解决我国的三农问题提供帮助。从人类历史发展的长远角度来看,纤维素乙醇生产技术的成熟还可以推动可再生的木质纤维素资源转化生产液体燃料和生物基化学品巨型产业的形成和发展,为人类应对石油与煤炭等一次性化石资源的逐渐耗竭,实现以可再生资源利用为基础的绿色循环生物经济的永续发展打下基础。因而,其对人类社会可持续发展的重要意义是不言而喻的,受到了世界各国的广泛重视,并对其研发过程给与了大力的支持。
然而,经过了30多年坚持不懈的艰苦努力,纤维素乙醇至今却仍未能实现大规模的产业化。以致纤维素乙醇被某些人戏称为“梦幻燃料”,不少人已不再相信“狼来了”的呼唤,放弃了继续的努力或对进一步研发的支持。目前,纤维素乙醇生产的研发过程已经取得了巨大进展,并已经开始进入了产业化阶段。稀酸、汽爆、水热、氨法等多种预处理技术都能使纤维素和半纤维素的水解转化率达到80%以上;诺维信等公司开发的第二代、第三代(Cellic CTec2、Cellic CTec3)等复合纤维降解酶制剂的吨乙醇用酶成本已经达到了经济上可以接受的水平;经过代谢网络工程反复改造的酵母工程菌株已经可以实现木糖-葡萄糖的共发酵。在此基础上,意大利M&G集团与诺维信合作建立的贝塔可再生公司(Beta Renewables)早在2012年底就在意大利克雷什迪诺(Crescentino)建成了年产4万~6万吨级工业规模的纤维素乙醇工厂,并于2013年10月宣布投产。2014年9月POET-DSM先进生物燃料有限公司,也在美国爱荷华州(Emmetsburg,Iowa)为美国第一家商业规模的纤维素乙醇工厂举办了开工典礼。此后,美国、巴西等国又有多家企业宣称他们的工业规模生产装置已经投入试产[1]。然而,多方面因素造成石油价格在2014年出现暴跌,造成燃料乙醇价格快速跌落,沉重打击了纤维素乙醇的产业化进程,加上新技术在放大过程中必然会出现的一些工程上的问题,使这些商业化装置在投入试产后多半未能实现长时间连续生产或达到预期的产能。
总体来说,多家工业规模纤维素乙醇生产装置的成功建成,说明了由纤维素资源生产液体燃料和化学品技术的产业化已迈出了实质性的关键一步,已经处于大规模产业化应用的起步阶段。进一步改进和完善纤维素乙醇生产技术,提高其在经济上的竞争力成为纤维素乙醇产业化成败的关键。在分析和比较已有研究成果的基础上,笔者研究团队把集成就地产酶过程的多产物联产生物精炼技术选择为实现纤维素乙醇大规模产业化的突破口,开展了积极探索。
2 就地产酶技术与纤维素乙醇生产的集成
由于天然木质纤维素材料的复杂结构是植物通过亿万年进化后用来保护自身不被微生物及其酶系统攻击的防护措施,纤维素被严密地包裹在木质素和半纤维素等组成的保护层中,加上纤维素本身能形成紧密的结晶结构,使纤维素酶解的比活力非常低。尽管经过适当的预处理后使其可降解性有明显改善,但是纤维素酶解过程需要的用酶量仍然远远大于粮食乙醇的用酶量。通常情况下,1吨玉米淀粉原料水解时只需要约0.2~0.3kg淀粉酶蛋白,而每吨纤维素原料水解时往往需要10~50kg酶蛋白,用酶量高出了数十乃至上百倍。这在提高了纤维素乙醇生产成本的同时,也给大规模纤维素乙醇企业的酶制剂稳定供应制造了难题。把发酵生产出来的粗酶液加工成可储存运输的商品酶制剂需要复杂的后加工工艺过程(除菌、浓缩、防腐等),在增加生产费用的同时还造成一定的损耗,加上包装、运输等费用,显著增加了用酶的成本。把产酶过程集成进纤维素生物炼制系统内,可以去除酶制剂生产的后处理过程和保质、储运的成本及损耗,并可通过就地利用纤维素加工中产生的废弃物或副产物配制廉价的培养基,通过企业内部的热电平衡来进一步降低产酶的成本,从而大幅度地降低酶解产糖的用酶成本。德国克莱恩(Clariant)公司在巴伐利亚州建立了年产1000吨纤维素乙醇的示范工厂,在其多年实验运行中对集成现场产酶的优势进行了详细的比较分析[2],发现可以使纤维素酶在乙醇总生产成本中的比例从外购商品酶时的35%,或异地产酶时的28%,降低到集成现场产酶时的10%,而且可以做到成本和风险可控,使纤维素乙醇具备了市场竞争性。
3 理性构建纤维素酶高产菌株和高效降解酶系
采用现场就地产酶技术需要乙醇生产企业具有高效纤维素酶系的高产菌株和生产技术。山东大学长期从事真菌纤维素酶的相关基础和生产技术研究,通过筛选诱变获得了一批纤维素酶高产菌株[3]。其中一些青霉菌株已被用于纤维素酶制剂的生产,在食品、饲料等工业领域得到了应用。近年来,在国家“973”项目支持下,笔者研究团队对3株青霉菌株进行了基因组学、分泌蛋白组学和转录组学的系统分析[4]。研究发现,所谓纤维素酶是由降解纤维素酶、半纤维素酶、果胶酶等数十种木质纤维素酶组分组成的复杂酶系统,各种酶系组分通过协同作用来共同完成对植物纤维素类底物的高效降解。与出发菌株相比,纤维素酶高产突变株不仅胞外蛋白质的产量有所提高,而且纤维素、半纤维素降解酶系主要组分的比例均同步明显提高,而淀粉酶和蛋白酶等其他酶系组分的比例则同时明显下降,使纤维素降解酶系的比活力得到大幅度提高。因此笔者研究团队推测,不同酶系中各基因的表达是在转录水平上协同调控的[5]。通过对出发菌株与高产突变菌株中可能相关的转录调控因子基因碱基序列的比较,发现因碳降解物阻遏因子CreA的结构基因上缺失了一个碱基而造成了移码突变,使其部分丧失了介导降解物阻遏效应的功能,是突变体纤维素酶产量提高的主要因素。而在淀粉酶激活因子ArmR和蛋白酶激活因子PrtT的基因启动子部位发现的碱基突变,则可以影响两种转录激活因子的表达量,进而导致淀粉酶和蛋白酶产量的下降,间接提高了纤维素酶系的比活力。为了阐明是否还有转录调控因子会影响纤维素酶系的合成,笔者研究团队利用生物信息学分析了青霉的基因组,共预测到529个可能的转录因子基因,进而使用已建立的高效基因敲除平台[6],对全部转录因子进行了单基因敲除,建立起了含470个突变体的转录因子突变体文库。通过对文库的筛选鉴定,发现了20种与纤维素酶合成调控相关的转录因子[7]。其中,ClrB在纤维素酶合成中发挥关键的表达激活作用;新发现的ClrB-2也发挥一定的协同激活作用;XlnR主要促进半纤维素酶的基因表达,同时在纤维素酶基因表达中与ClrB有协同作用;而AmyR本身的表达受ClrB的阻遏,同时参与了CreA对纤维素酶合成的抑制。多种转录调控因子之间有直接的相互作用,共同完成了对碳源利用相关基因表达的精确反馈调控。
各转录因子自身的表达则受到不同碳源的诱导或阻遏。葡萄糖等易代谢碳源的存在会阻遏复杂多糖降解酶类的合成。而组成型合成的少量纤维素酶降解胞外的纤维素所产生的纤维二糖等纤维寡糖,通过纤维寡糖转运蛋白运输到细胞内后,则会通过相关转录因子,诱导纤维素降解相关酶基因的表达合成(图1)。对纤维寡糖转运蛋白的过表达,特别是对胞内β-葡萄糖苷酶基因的敲除,可以显著提高纤维素酶的产量[8-9]。
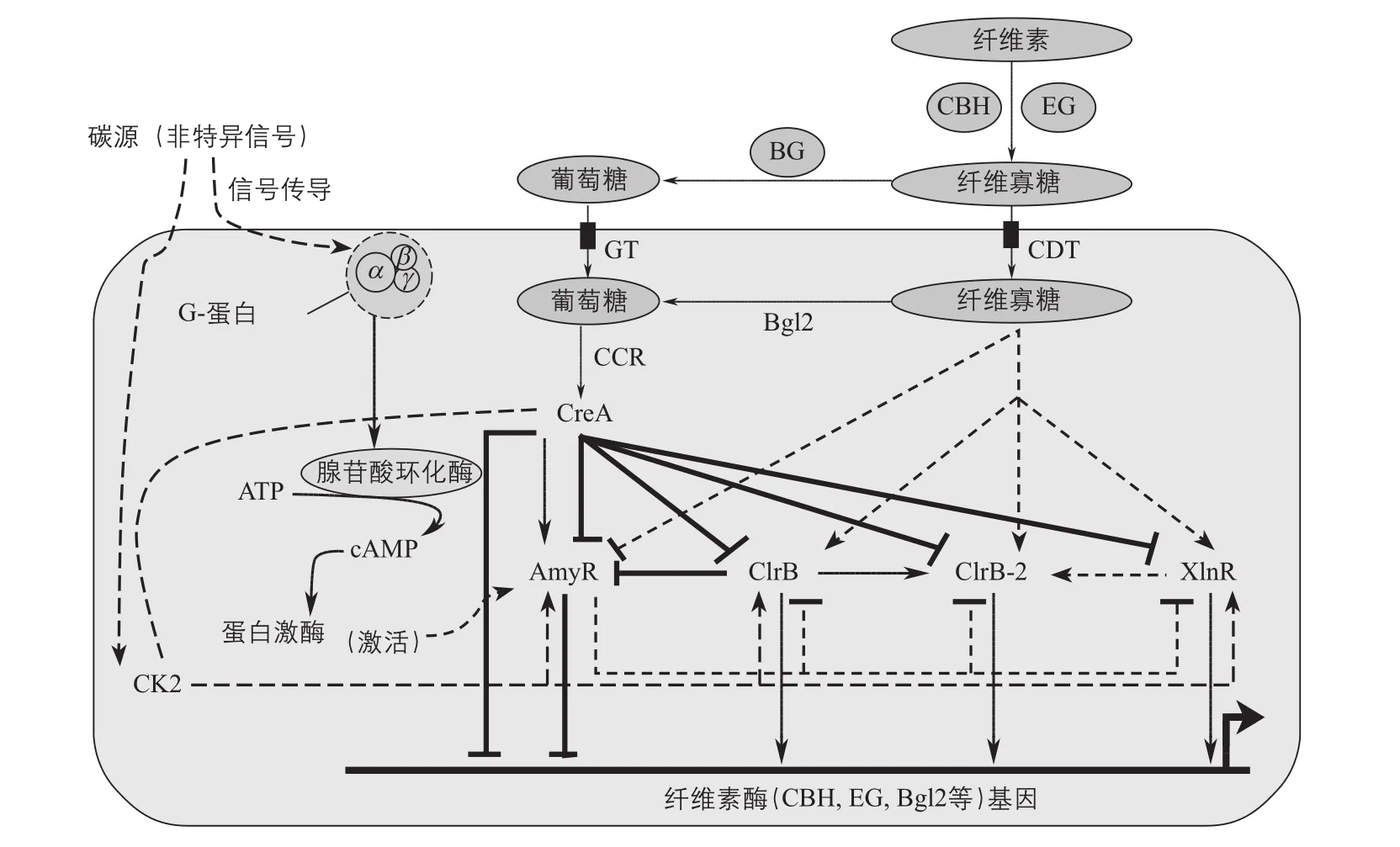
图1 纤维素酶基因合成调控机制CBH—外切纤维素酶;EG—内切纤维素酶;BG—β-葡萄糖苷酶;Bgl2—胞内β-葡萄糖苷酶2;GT—葡萄糖转运蛋白;CDT—纤维寡糖转运蛋白;CCR—碳降解物阻遏;CreA—碳降解物阻遏因子;AmyR—淀粉酶激活因子;ClrB—纤维素酶激活因子;XlnR—半纤维素酶激活因子;CK2—酪蛋白激酶2;ATP—腺三磷;cAMP—环腺一磷
在较深入地了解纤维素酶合成调控机制的基础上,笔者研究团队通过对基因的多步遗传操作(如过表达ClrB和XlnR,敲除CreA和Bgl2)[7,10],重构了青霉菌的纤维素酶合成调控网络,大幅度提高了纤维素酶的生产效率。同时,通过在高产菌株中过表达特定的酶系组分(如β-葡萄糖苷酶),明显改进了酶系的纤维素酶解效率[11],为就地产酶提供了优良产酶菌株。
4 木质纤维素多产品联产的生物精炼技术
石化产业获得成功的根本经验之一是利用催化裂化等技术将原油精炼成为多种石化产品,满足了多样的市场需求,实现了产品价值的最大化。秸秆等植物生物质的组成成分其实比原油更加复杂,只利用其中的部分组分转化生产廉价的液体燃料,而不将其他组分也转化成相对高值的产品,经济上很难具备竞争力。为此,笔者研究团队于2005年在国际上率先提出了玉米芯生物精炼的集成创新技术:先从玉米芯中提取半纤维素,生产低聚木糖、木糖醇等高附加值产品,再用木糖渣就地生产纤维素酶和燃料乙醇,残渣中的木质素也提取出来用于生产化工产品,从而实现原料组分全利用、产物多样化、价值最大化。技术经济分析显示,其乙醇生产成本接近或低于粮食乙醇成本。新技术于2012年在山东龙力生物科技公司正式实现了工业化,成为国内首家、也是目前唯一一家获得国家发展和改革委员会批准的纤维素乙醇生产企业,取得了良好的经济和社会效益。然而,由于玉米芯生物精炼的主要盈利产品低聚木糖和木糖醇的市场规模不够大,激烈的竞争造成了分散的小规模经营,木质素产品的推广应用也需要时间,所以新技术一直未能得到广泛推广。进一步完善相关生产技术,努力扩大纤维原料种类和联产产品种类,成为纤维素乙醇产业发展的新方向。例如,河南天冠集团提出了利用秸秆联产燃料乙醇-沼气/车用燃气-热/电-渣肥四类产品的新技术路线,建设了万吨级示范工厂,进行了试生产。只是由于后几类产品均不够高值,仍在努力改进新技术和提高经济竞争力。
最近,山东泉林纸业集团开发出了秸秆清洁制浆及其废液肥料资源化利用新技术(获国家技术发明二等奖),并成功在工业规模上获得了推广应用,取得了良好的经济和社会效益。山东大学研究团队也在高效纤维素酶高产菌株构建、戊糖/己糖共发酵酿酒酵母代谢工程改造[12]等方面获得突破性进展。在此基础上,目前山东大学研究团队正在与泉林纸业合作,开发新的利用秸秆联产本色纸浆-燃料乙醇-黄腐酸肥料的生物精炼技术(图2)。
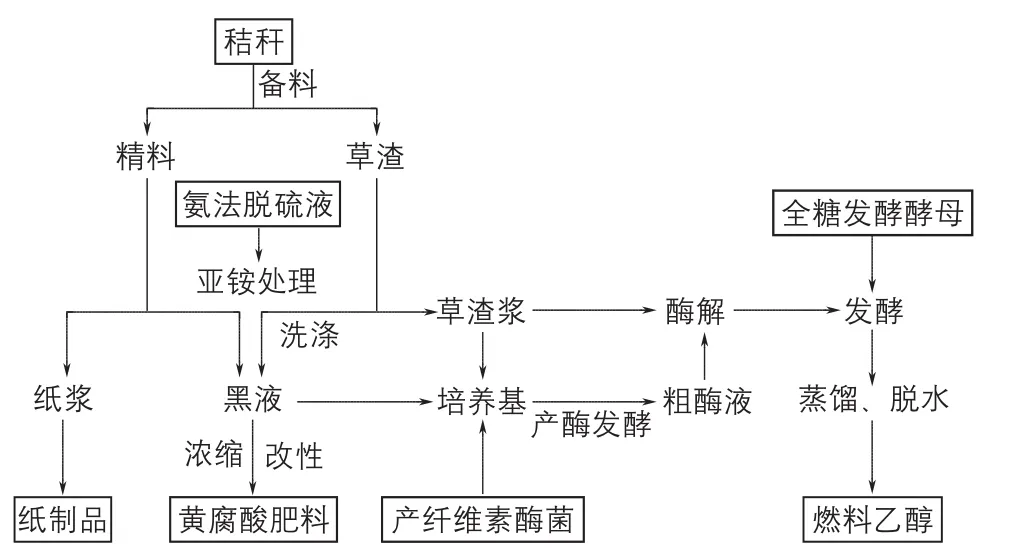
图2 本色纸浆-燃料乙醇-黄腐酸肥料联产的生物精炼技术路线
由于纤维素酶生产可以就地取材,利用自产的少量预处理浆和亚铵制浆黑液(含有大量能诱导产酶的纤维素和半纤维素来源的寡糖及残铵等营养物)配制廉价的培养基,结合采用流加补料培养等新型发酵技术,可使纤维素乙醇的酶解用酶成本降到很低。同时,通过戊糖和己糖同步糖化共发酵,可以大幅度提高原料的乙醇得率和发酵液的乙醇浓度。实验室实验结果的初步分析显示,新技术的经济可行性明显提高。目前,企业正在积极筹备开展中试放大研究。新技术非常契合国家“十三五”发展规划中实现秸秆综合利用85%以上、大力发展纤维素乙醇等目标要求,且具有技术已经比较成熟、3种产品(纸浆、乙醇和肥料)均有巨大市场的明显优势,具有良好的发展前景。
[1] 曲音波,王禄山,刘国栋,等.非粮生 物质炼制技术——木质纤维素生物降解机理及其酶系合成调控[M]. 北京:化学工业出版社,2017:6-7.
[2] RARBACH M. Process integrated enzyme production:the costefficiert way to commercially viable 2G cellulosic ethanol[EB/ OL].(2017-01-23)[2017-05-19]. http://www.biofuelsdigest.com/ bdigest/2017/01/23/process-integrated-enzyme-production-the-costeff cient-way-to-commercially-viable-2g-cellulosic-ethanol/.
[3] WANG M Y,LI Z H,FANG X,et al. Cellulolytic enzyme production and enzymatic hydrolysis for second-generation bioethanolproduction[J]. Adv Biochem Engin/Biotechnol,2012,128:1-24.
[4] LIU G,ZHANG L,WEI X,et al. Genomic and secretomic analyses reveal unique features of the lignocellulolytic enzyme system of Penicillium decumbens[J]. PLoS One,2013,8(2):e55185.
[5] LIU G D,ZHANG L,QIN Y Q,et al. Long-term strain improvements accumulate mutations in regulatory elements responsible for hyperproduction of cellulolytic enzymes[J]. Scientific Reports,2013,3:1569.
[6] LI Z H,DU C M,ZHONG Y H,et al. Development of a highly eff cient gene targeting system allowing rapid genetic manipulations in Penicillium decumbens[J]. Appl Microbiol Biotechnol,2010,87:1065-1076.
[7] LI Z H,YAO G S,WU R M,et al. Synergistic and dose-controlled regulation of cellulase gene expression in Penicillium oxalicum[J]. PLoS Genet,2015,11(9):e1005509.
[8] LI J,LIU G,CHEN M,et al. Cellodextrin transporters play important roles in cellulase induction in the cellulolytic fungus Penicillium oxalicum[J]. Appl Microbiol Biotechnol,2013,97(24):10479-10488.
[9] CHEN M,QIN Y,CAO Q,et al. Promotion of extracellular lignocellulolytic enzymes production by restraining the intracellular β-glucosidase in Penicillium decumbens[J]. Bioresource Technology,2013,137:33-40.
[10] YAO G S,LI Z H,GAO L W,et al. Redesigning the regulatory pathway to enhance cellulase production in Penicillium oxalicum[J]. Bio technol Biofuels,2015,8:71.
[11] YAO G S,WU R M,KAN Q B,et al. Production of a high-eff ciency cellulase complex via β-glucosidase engineering in Penicillium oxalicum[J]. Bio technol Biofuels,2016,9:78.
[12] LI H X,SHEN Y,WU M L,et al. Engineering a wild-type diploid Saccharomyces cerevisiae strain for second-generation bioethanol production[J]. Bioresour Bioprocess,2016,3:51.
Breakthrough point for commercialization of cellulosic ethanol:Integrated biorefinery with on-site cellulase production
QU Yinbo1, BI Yanjin2, LI Xuezhi1,ZHAO Shujing2, HAN Xiaolong1,YAN Junqing2,DU Jian1,LI Hongwei2
1. State Key Laboratory of Microbial Technology, National Glycoengineering Research Center, Shandong University, Jinan 250100, China
2. Institute of Science and Technology, Shandong Tranlin Group, Liaocheng 252800, China
Cellulose ethanol industry can play a signif cant role in the use of renewable resources, environmental pollution control, agricultural industry chain extension, the development of rural economy, and farmers’ employment. However, its production cost is still high and so far hasn’ t achieved large-scale industrialization. We have developed integrated multiproducts bioref nery with on-site enzyme production technology to achieve a breakthrough in large-scale industrialization of cellulosic ethanol. At the same time, the concept of refining to maximize the interests and improving the economic competitiveness of comprehensive processing with that of grain and oil products is introduced. Based on the development of corncob bioref nery to produce xylose products-ethanol-lignin, cellulosic ethanol production was industrialized successfully. Recently, a straw bioref nery process to produce pulp-ethanol-fulvic acid fertilizer together is being explored, with expect to establish a larger-scale lignocellulosic bioref nery industry.
cellulosic ethanol; integrated biorefinery; on-site enzyme production; cellulases; pentose/hexose cofermentation
10.3969/j.issn.1674-0319.2017.03.005
