甘蓝型油菜GPDH基因克隆及其生物信息学分析
2017-06-28刘少锋汪慧慧邬克彬熊兴华
刘少锋,汪慧慧,邬克彬,熊兴华
(湖南农业大学 作物基因工程湖南省重点实验室,湖南 长沙 410128)
甘蓝型油菜GPDH基因克隆及其生物信息学分析
刘少锋,汪慧慧,邬克彬,熊兴华
(湖南农业大学 作物基因工程湖南省重点实验室,湖南 长沙 410128)
为了进一步研究甘蓝型油菜GPDH基因,通过从拟南芥GPDH基因与甘蓝型油菜的共线性分析发现:拟南芥GPDH基因(At2g41540)在甘蓝型油菜A基因组和C基因组中有4个拷贝,分别为:GSBRNA2T00132785001、GSBRNA2T00024258001、GSBRNA2T00058395001、GSBRNA2T00019118001。从GenBank分别下载了它们的DNA序列和cDNA序列,cDNA序列依次命名为GPDH1、GPDH2、GPDH3、GPDH4。根据序列信息设计了4对不同的引物,从甘蓝型油菜湘油15号cDNA全长序列中扩增出了4条片段,分别命名为BnGPDH1、BnGPDH2、BnGPDH3、BnGPDH4。利用生物信息学软件和在线系统进行核苷酸序列分析和蛋白进化分析。结果显示:4条片段大小依次为1 395,1 395,1 389,1 536 bp。其中,BnGPDH4翻译成氨基酸时序列中间出现终止密码子,不能合成有效蛋白。3个BnGPDH蛋白的氨基酸数目为464,464和462个,理论分子量为 51.584 4~51.829 7 kDa,二级结构α螺旋和无规则卷曲所占比例在42%左右,其次是延伸链所占比例约为15%。三者的跨膜结构总体来说是相同的。3个蛋白都由保守结构GpsA、NADB_Rossmann superfamily和NAD_Gly3P_dh_C superfamily组成,属于GPDH超基因家族。同源建模分析表明3个蛋白均能适用甘油3磷酸脱氢酶(Glycerol-3-phosphate dehydrogenase,GPDH)模型。对其进行亚细胞定位预测在细胞质膜的概率为79.0%。从序列分析、核苷酸聚类、理化性质预测、二级、三级结构预测、亚细胞定位预测、氨基酸聚类分析得出结论,它们具有GPDH基因家族的特征,为甘蓝型油菜GPDH基因家族中的成员。
GPDH;甘蓝型油菜;生物信息学分析
油菜是我国重要的油料作物,种植面积超过一亿亩,提供了我国人民60%的食用油。通过改造和优化油脂形成中关键酶的作用来提高油菜含油量,不但可以满足人民对食用油日益增加的需求,而且可以运用到润滑油、化妆品、化工原料、医药等领域。同时,菜籽油所含脂肪酸的碳链长度与柴油酸相近,也是生产生物柴油的理想原料。由此产生的经济效益是不可估计的,对我国社会和经济的发展具有重要意义。因此,高油油菜和油脂调控机理研究成为油菜研究的重要目标[1]。甘油三磷酸脱氢酶(Glycerol-3-phosphate dehydrogenase,GPDH)是糖酵解的中间产物磷酸二羟丙酮(DHAP)还原成3-磷酸甘油(G3P)和NAD+的酶[2],3-磷酸甘油是油脂合成中的底物之一,其含量是油脂生成量的一个关键因素。也说明了GPDH是糖代谢连接脂代谢的关键酶,但对在油菜内源GPDH基因的表达与种子含油量的关系不详。因此,利用基因工程手段来克隆油菜GPDH基因,进一步研究该基因的生物学功能,验证其对油菜种子含油量的影响具有重要意义。
伴随着分子生物学的发展,对调控油脂合成过程中的关键酶的研究越来越深入,调控油脂合成过程的关键酶有很多,这些基因决定着油脂合成阶段中间产物3-磷酸甘油、溶血磷脂酸、磷脂酸、二酰甘油、三酰甘油等的表达量,已经有部分报道了这些酶对油脂的调控,如Yao等[3]将三角褐藻的GPDH基因在细胞内超表达,细胞中甘油的浓度增加6.8倍,中性脂含量增加1.9倍,细胞干质量增加39.7%。这说明GPDH基因在TAG合成中的重要作用。在工业上,通过缺失GUT2、NDE1、NDE2和FPSL切断甘油降解途径,大幅度促进了甘油的生产,获得高产甘油酵母菌株[4]。
对gpd1Δgpd2Δ双缺陷型菌株,不能产生甘油,高度渗透压敏感并不能在缺氧条件下生长,伴随着NADH的积累。超表达GPD1或GPD2基因,都会使该双缺陷型在缺氧或高盐条件下生长。而且,GPD1和GPD2编码的酶在一定培养条件可以相互代替[5]。另外还有报道植物细胞中3-磷酸甘油(G3P)是合成所有细胞甘油酯的重要组成,它是通过胞质3-甘油磷酸脱氢酶或甘油激酶催化产生。提高G3P水平能提高植物抗病性抗病相关基因的表达[6-7],还有研究表明,供给甘油或超表达NAD-GPDH能增加油菜G3P水平而促进发育胚中TAG的合成[8]。乙酰辅酶A羧化酶(ACCase)是脂肪酸合成的关键酶,表达胞质中单基因编码的ACCase并加上质体定位序列,可使种子含油量增加5%[9]。在拟南芥和油菜中超表达酵母溶血磷脂酸酰基转移酶(LAPT)含油量增加高达48%,田间试验也证明了有明显提高[10]。二酰甘油酰基转移酶(DGAT)催化TAG合成途径即Kennedy途径的最后一步,在野生型拟南芥中超表达拟南芥的二酰甘油转移酶(DGAT),其含油量得到增加[11]。过量表达拟南芥LEC1基因可影响其他转录因子,如ABI3、FUS3和WRI1等,提高脂肪酸合成相关基因表达的整体水平,引起脂肪酸和油脂含量的提高[12-13]。
综合上述原因,进一步研究GPDH的性质和功能。通过拟南芥GPDH基因与油菜基因的共线性分析,找到油菜A、C基因组中位于胞质的4个GPDH基因家族成员。查找GPDH基因的序列信息,设计引物,从性状优良的甘蓝型油菜双低品种湘油15 cDNA中克隆出来4个不同的基因片段,并进行测序。对获得的序列进行生物信息学分析讨论。
1 材料和方法
1.1 试验时间和地点
本试验于2015-2016年在湖南农业大学生命科学楼作物基因工程湖南省重点实验室完成。
1.2 试验材料
油菜种质:甘蓝型油菜湘油15。由湖南农业大学邬贤梦教授提供。
试剂及菌种:PGEM-TEasy Vector购自Promega公司。植物总RNA提取试剂盒TransZol UP、TransScriptTMFirst-Strand cDNASynthesis SuperMix试剂盒、DNA高保真聚合酶、T4DNA连接酶、DNA Marker、大肠杆菌菌种DH5α、DNA凝胶回收试剂盒、微量质粒提取试剂盒,购自北京全式金生物技术有限公司,引物由北京鼎国昌盛生物技术有限公司合成。测序工作由上海生工生物科技有限公司完成。
1.3 试验方法
1.3.1GPDH基因引物设计 登录拟南芥数据库,对拟南芥和甘蓝型油菜共线性分析发现甘蓝型油菜GPDH基因有A基因组和C基因组,分别有2个不同的拷贝,分别为:GSBRNA2T00132785001、GSBRNA2T00024258001、GSBRNA2T00058395001、GSBRNA2T00019118001。依次简化名称为GPDH1、GPDH2、GPDH3、GPDH4。用Primer5设计了4对不同的引物,如表1所示。引物交由北京鼎国昌盛生物科技有限公司合成。

表1 GPDH基因cDNA序列扩增所需引物序列
1.3.2 湘油15号总RNA 的提取以及cDNA的合成 取处于开花期的湘油15号油菜花瓣50~100 mg,放置在预冷的研钵中,加入适量的液氮,充分而迅速研磨。按照TransZol UP试剂盒上的方法提取油菜花瓣总RNA,并通过凝胶电泳进行检测以及检测总RNA浓度。以总RNA为模板进行反转录合成cDNA。第一链cDNA合成反应体系:Total RNA 5 μL,Anchored Oligo(dT)18 Primer 1 μL,2×TS Reaction Mix 15 μL,TransScript RT/RI Enzyme Mix 1 μL,gDNA Remover 1 μL,RNase-free Water 7 μL,总反应体系30 μL。
1.3.3 目的基因克隆及测序 以合成的第一链cDNA为模板,合成的4对引物分别进行扩增。PCR反应体系总体积20 μL,包括cDNA模板1 μL,2.5 mmol/L dNTP 2 μL,10×Buffer 2 μL,5 U/μL HiFi高保真DNA聚合酶0.5 μL,ddH2O 12.5 μL。PCR扩增程序:94 ℃预变性3 min;94 ℃变性45 s,59 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃延伸10 min。反应获得的PCR产物进行凝胶电泳检测目的条带。用胶回收试剂盒回收目的基因,-20 ℃保存备用。将回收产物连接到PGEM-TEasy Vector。DNA连接反应体系:Insert DNA 4 μL,PGEM-TEasy Vector 0.5 μL,T4DNA Ligase 0.5 μL,2×Buffer 5 μL,总反应体积10 μL。将连接产物用热激法转化至DH5α大肠杆菌感受态细胞,进行Amp抗性筛选和X-gal/IPTG蓝白斑筛选,12~16 h后可以观察到蓝色和白色的菌落。挑取白色的单菌落进行菌落PCR,在检测为阳性的菌落中挑取单菌落摇菌过夜,保存2管菌液,其中一管送上海生工生物科技有限公司测序,3次重复。剩余的菌液用于提取质粒,再用凝胶电泳检测提取的质粒条带,并保存至-20 ℃。
1.3.4 序列分析 基因序列同源性分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。作测序结果的初步鉴定,分析它们碱基序列差异。运用MEGA 6.06进行聚类系谱分析。
1.3.5 蛋白结构预测分析 Primer Premier 5.0将核苷酸序列翻译成氨基酸序列,经BlastP进一步鉴定。运用ExPASY Protparam tool预测氨基酸的组成以及理化信息,疏水性分析,利用在线软件GOR IV Secondary structure prediction method进行蛋白二级结构预测分析,利用在线软件DAS预测可能的蛋白跨膜结构区域,在NCBI上对编码蛋白的保守结构域分析,经Swiss Model进行同源建模分析,利用在线软件PSORT Predition进行编码蛋白亚细胞定位预测。
1.3.6 多种植物氨基酸序列聚类分析 将BnGPDH1氨基酸序列作为参考序列,用NCBI数据库BlastP在线查找同源物种氨基酸序列,利用Mega 6.06把该基因氨基酸序列和多种植物氨基酸序列进行聚类分析其亲缘关系。
2 结果与分析
2.1 基因的克隆与分析
2.1.1GPDH基因在胞质内4个拷贝的获得 设计4对不同的引物,从处于开花期的湘油15号油菜花瓣中提取总RNA,如图1所示。反转录合成cDNA ,从cDNA中扩增出4条大小不同的片段,片段大小1 400 bp左右,如图2所示。将片段回收后克隆至PGEM-TEasy Vector,挑选阳性菌落PCR进行检测,获得阳性重组子,测序对比得到4个不同的序列,片段大小分别为1 395,1 395,1 389,1 536 bp。分别命名为BnGPDH1、BnGPDH2、BnGPDH3、BnGPDH4。

图1 湘油15号总RNA电泳图谱
2.1.2GPDH基因鉴定 克隆得到的4个基因序列在网站(https://blast.ncbi.nlm.mih.gov/Blast.cgi)进行分析,BnGPDH1与甘蓝型油菜GPDH1全长CDS相似度为92%,序列覆盖度为100%,BnGPDH2与甘蓝型油菜GPDH2全长CDS相似度为92%,序列覆盖度为100%,BnGPDH3与甘蓝型油菜GPDH3全长CDS相似度为99%,序列覆盖度为99%,BnGPDH4与甘蓝型油菜GPDH4全长CDS相似度为99%,序列覆盖度为93%。利用Lasergene7.0分别对GPDH1和BnGPDH1、GPDH2和BnGPDH2、GPDH3和BnGPDH3、GMPDH4和BnGPDH4进行相似性评估,如表2所示。综合表明:BnGPDH1与GPDH1相似度达99.6%,BnGPDH2与GPDH2相似度99.9%,BnGPDH3与GPDH3相似度99.1%,BnGPDH4与GPDH4相似度99.9%。Mega 6.06对上述基因比对分析结果,如图3所示。上述结果初步表明,根据NCBI下载的cDNA序列设计的引物,以湘油15号油菜cDNA为模板扩增所得的4条CDS序列初步鉴定为油菜胞质内GPDH基因A基因组和C基因组的4个不同拷贝。

M.DGL2000 DNA Marker。

表2 基因间相似性分布表
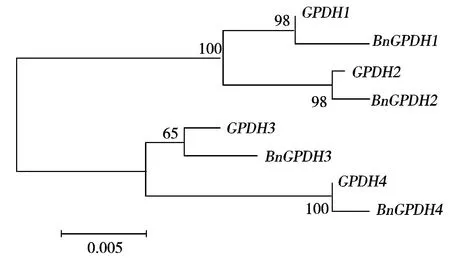
由Mega 6.06软件绘制,图中数值表示自展值。This analysis was generated by using Mega 6.06 program,the number means Bootstrap value.
2.2 四个甘蓝型油菜GPDH基因编码蛋白质结构预测与分析
2.2.1 四个甘蓝型油菜GPDH基因编码蛋白质一级结构预测与分析 用Primer premier 5.0软件将GPDH基因4个拷贝的序列分别翻译为氨基酸序列,使用在线软件ExPASY Protparam tool(http://web.expasy.org/protparam/)预测GPDH家族基因理化性质,如表3所示。从表3中可以得知,3个BnGPDH蛋白的氨基酸数目分别为464,464和462个,理论分子量为 51.584 4~51.829 7 kDa,所编码的氨基酸偏向于中性蛋白,且编码的是稳定蛋白,均具有较高的脂肪族特性,同时属于亲水性蛋白。BnGPDH4在翻译成氨基酸序列时,中间存在终止密码子,不能形成有效蛋白,故之后不做具体结构分析。
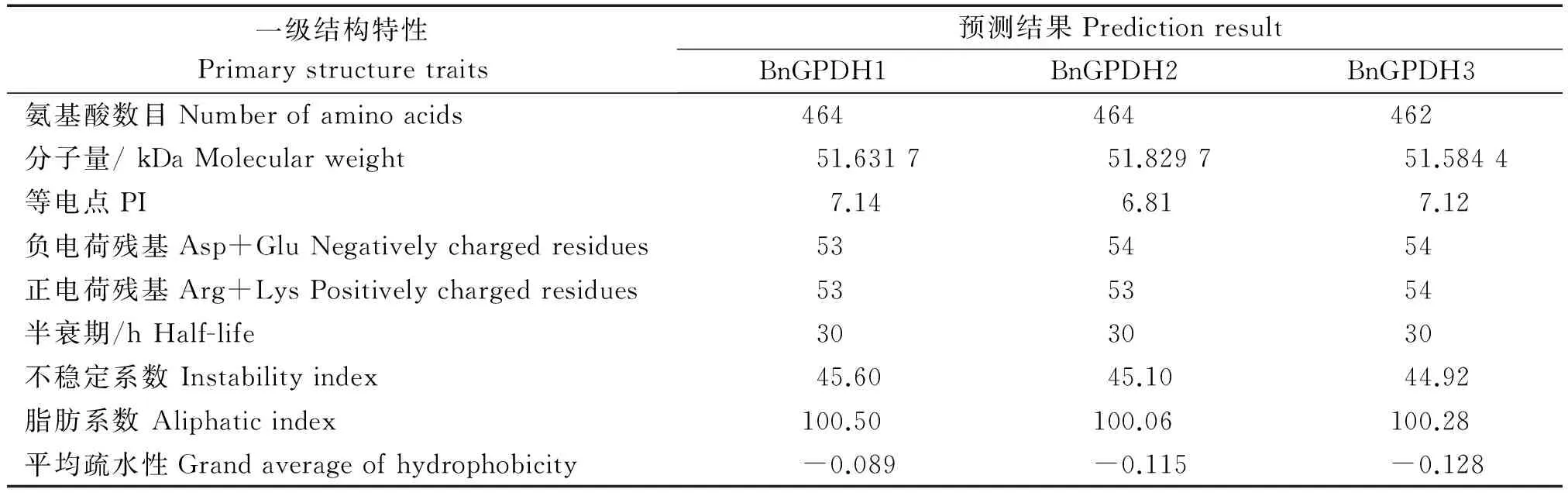
表3 甘蓝型油菜GPDH家族基因编码蛋白的一级结构预测结果
2.2.2 三个甘蓝型油菜GPDH基因编码蛋白质二级结构预测与分析 利用在线软件GOR IV Secondary structure prediction method(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_gor4.html)蛋白质二级结构分析工具,分别对3个基因所编码的氨基酸序列进行分析,预测结果如表4、图4所示。从中可以发现,3个BnGPDH 蛋白的α螺旋和无规则卷曲所占比例在42%左右,其次是延伸链所占比例约15%。
2.2.3 三个甘蓝型油菜GPDH基因编码蛋白跨膜结构分析 利用在线软件DAS(http://www.sbc.su.se/~miklos/DAS/)预测蛋白可能存在的跨膜结构区域,结果如表5所示。从中可以发现BnGPDH1与BnGPDH2蛋白跨膜结构域是完全一致的,与BnGPDH3的蛋白跨膜结构只有一个氨基酸的差别。三者的跨膜结构总体来说是相同的。
2.2.4 三个甘蓝型油菜GPDH基因编码蛋白的保守结构域分析 通过NCBI(http://www.ncbi.nlm.nih.gov/cdd)对BnGPDH1、BnGPDH2和BnGPDH3进行Blast分析其保守结构域,分析结果如图5所示。从图中可以发现,3个蛋白都由保守结构GpsA、NADB_Rossmann superfamily和NAD_Gly3P_dh_C superfamily组成,属于GPDH超基因家族。
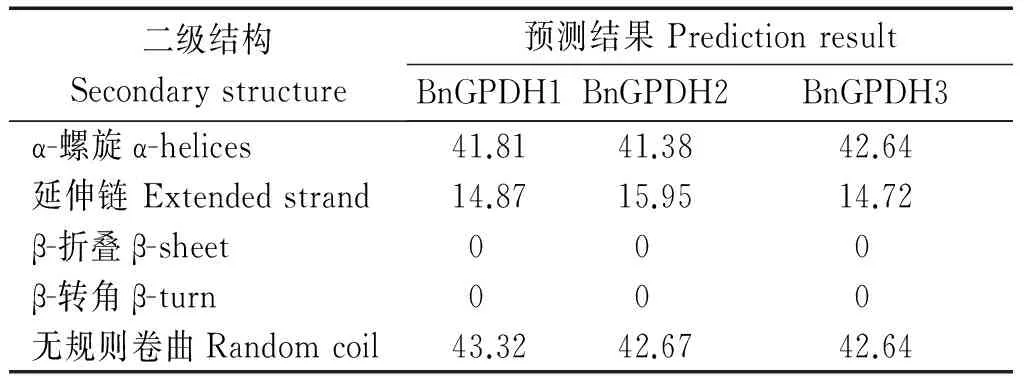
表4 甘蓝型油菜GPDH家族基因编码蛋白的二级结构预测结果

A.BnGPDH1;B.BnGPDH2;C.BnGPDH3。图5同。A.BnGPDH1;B.BnGPDH2;C.BnGPDH3. The same as
表5 甘蓝型油菜GPDH家族基因编码蛋白跨膜区域预测结果
Tab.5 Analysis of transmembrane region of proteins encoded byGPDHfamily genes inBrassicanapus

蛋白Protein编号No.N末端Nterminal跨膜区TransmembraneregionC末端Cterminal长度/bpLengthBnGPDH1/BnGP-DH2152GAWGSVFAA6092191PVIISL19663292IGAGMV29764382VG3832BnGPDH3150GAWGSVFAA5892189PIIISL19463290IGAGMV29564380VG3812

图5 甘蓝型油菜GPDH蛋白的保守结构域
2.2.5 三个甘蓝型油菜GPDH基因编码蛋白同源建模分析 经Swiss Model(https://www.swissmodel.expasy.org/)同源建模分析,发现BnGPDH1、BnGPDH2、BnGPDH3均能适应甘油3磷酸脱氢酶(Glycerol-3-phosp-hate dehydrogenase)模型。进一步说明3个基因是GPDH家族中的成员,模型如图6所示。
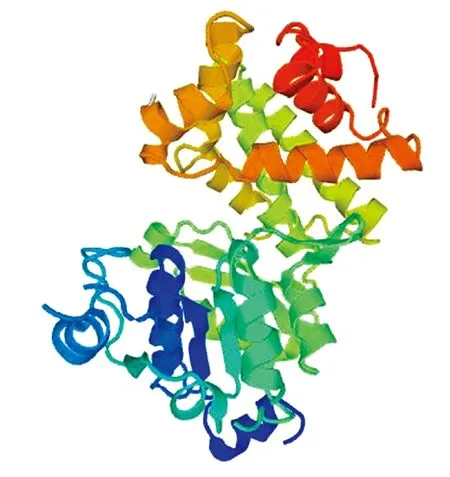
图6 GPDH基因的三级结构
2.3 三个甘蓝型油菜GPDH蛋白亚细胞定位预测
利用在线软件PSORT Predition(http://psort.hgc.jp/form.html)对蛋白亚细胞定位进行预测,3个蛋白的预测结果是一致的,该蛋白最有可能定位在细胞质膜,可能性高达79.0%,其次是微体(过氧化物酶)和高尔基体可能性30.0%,内质网膜可能性20.0%。
2.4 多种植物GPDH氨基酸序列分析比对
将BnGPDH1氨基酸序列作为参考序列,用NCBI数据库BlastP在线查找同源物种氨基酸序列,利用Mega 6.06把BnGPDH1、BnGPDH2、BnGPDH3的氨基酸序列与拟南芥(BAH20028.1)、木薯(OAY43223.1)、可可(XP_007028708.1)、蒺藜苜蓿(XP_003625105.2)、 桃树(XP_007202031.1)、木豆(KYP51998.1)、金钱橘(XP_006421155.1)、杨树(XP_002308924.1)、 菠菜(KNA11457.1)、木本棉(KHG04169.1)、赤豆(KOM34172.1)、 菜豆(XP_007162159.1)、蓖麻(EEF49622.1)、巨桉(KCW90121.1)、高粱(XP_002456915.1)的氨基酸序列进行UPGMA聚类分析,结果如图7所示。从图中可以发现,从左至右第4个节点处可以将聚类图分为5个大类,第Ⅰ类由甘蓝型油菜和木豆、菜豆、赤豆、蒺藜苜蓿、菠菜、拟南芥组成,第Ⅱ类由桃树、金钱橘、可可、木本棉组成,第Ⅲ类由木薯、杨树组成,第Ⅳ类仅巨桉,第Ⅴ类由蓖麻、高粱组成。甘蓝型油菜GPDH基因家族与拟南芥亲缘关系非常近,其次和菠菜、木豆、菜豆、赤豆、蒺藜苜蓿的亲缘关系较近。
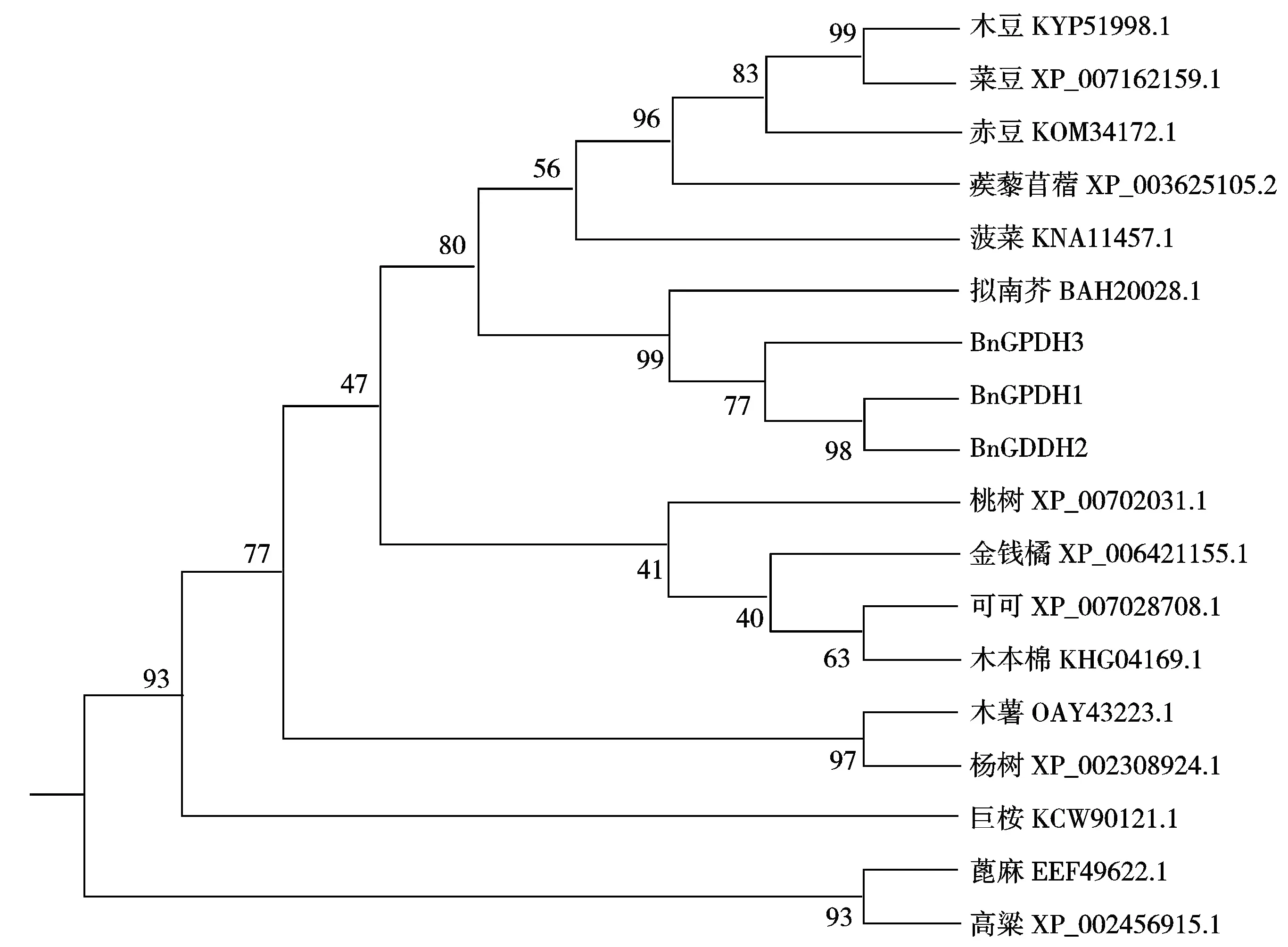
图7 多种植物已报道GPDH氨基酸聚类图
3 讨论与结论
研究植物脂肪合成中关键酶的作用对利用基因工程手段提高油菜含油量具有重要意义。刘野[14]从酵母中克隆GPD1和从拟南芥中克隆DGAT构建了种子特异表达载体;弭宪杰等[15]从蓖麻中克隆RcGPDH基因,功能分析表明RcGPDH基因可能对蓖麻种子油脂合成没有显著的作用,由此推测,蓖麻种子中可能还存在一个与AtGPDH基因高度同源的基因参与蓖麻TAG的合成。胡军[16]利用同源基因克隆法获得了甘蓝型油菜2个GPDH基因,拟南芥表达系在种子重量、种子含油量同非阳性对照比较无明显差异,增强了植物抗盐胁迫能力。张超[17]采用同源克隆法在甘蓝型油菜中克隆到了2个拷贝,基因组织表达分析显示BnG3PDH在种子油分积累高峰期高表达,在角果皮中表达量很低;高、低含油量材料中基因表达分析结果显示在油分积累关键时期BnG3PDH在高油材料种子的表达量要明显高于低含油量材料种子中基因的表达量。
2014年8月22日在科学杂志上公布甘蓝型油菜基因测序完成[18],为从基因组角度探讨油菜基因的协调进化规律及其对性状形成的影响以及多倍体优势形成机制提供了契机。以往对油菜基因的研究是采用同源克隆法,只研究了少数拷贝基因的表达情况且基因的染色体组定位也不清楚。作者首次通过拟南芥GPDH基因与油菜基因的共线性分析,找到油菜A、C基因组中位于胞质的4个GPDH基因家族成员。从性状优良的甘蓝型油菜双低品种湘油15号cDNA中克隆出来的4个不同的基因片段,并进行了测序。利用软件比对,对应序列的相似度达99.1%以上,初步证明了所克隆片段BnGPDH1 、BnGPDH2、BnGPDH3、BnGPDH4是甘蓝型油菜GPDH基因家族的成员,当进一步分析其氨基酸序列时,发现BnGPDH4核酸序列翻译成氨基酸序列时,序列中出现了终止密码子,由此推测BnGPDH4是GPDH基因家族成员,但是并不能合成GPDH蛋白,所以BnGPDH4不再做进一步的生物信息学分析。
在拟南芥中存在分别以FAD和NAD为辅酶的两类3-磷酸甘油脱氢酶[2,19]一类以FAD为辅酶的3-磷酸甘油脱氢酶(FAD-GPDH;EC1.199.5)是定位在线粒体内膜的外侧,另一类是以NAD为辅酶的3-磷酸甘油脱氢酶(NAD-GPDH,EC1.1.1.8)是定位在胞质和质体,这和本次研究中甘蓝型油菜GPDH基因家族进行亚细胞定位在胞质中的结论是相吻合的。
对这3个基因编码的蛋白理化性质预测分析,其编码的蛋白是中性蛋白,这与GPDH蛋白定位在细胞质的偏中性环境相吻合[20]。对其进行保守结构域分析可以看出都具有GpsA、NADB_Rossmann superfamily和NAD_Gly3P_dh_C superfamily保守结构域,这与其他对GPDH基因保守结构域的报道是一致的[21]。核苷酸聚类分析和氨基酸聚类分析都可以发现,来自A基因组的BnGPDH1和来自C基因组的BnGPDH2亲缘关系更近,在编码蛋白跨膜区域预测也有相同的结论。
利用RT-PCR从甘蓝型油菜湘油15中克隆GPDH基因家族位于细胞质中A基因组和C基因组的4个CDS分别命名为BnGPDH1、BnGPDH2、BnGPDH3、BnGPDH4,经过生物信息学分析鉴定,它们具有GPDH基因家族的特征,为甘蓝型油菜GPDH基因家族中的成员。
[1] 王汉中,殷 艳.我国油料产业形势分析与发展对策建议[J].中国油料作物学报,2014,36(3):414-421.
[2] Shen W,Wei Y,Dauk M,et al.Involvement of a glycerol-3-phosphate dehydrogenase in modulating the NADH [J].Plant Cell,2006,18(2):422-441.
[3] Yao Y,Yang L,Peng K T,et al.Glycerol and neutral lipid production in the oleaginous marine diatomPhaeodactylumtricornutumpromoted by over expression of glycerol-3-phosphate dehydrogenase[J].Biotechnology for Biofuels,2014,7(1):1-9.
[4] 秦 萌,徐 敏,刘倩楠,等.酿酒酵母细胞GUT2基因的研究进展[J].中国医学工程,2015,23(1):199-200.
[5] Hubmann G,Guillouet S,Nevoigt E.Gpd1 and Gpd2 fine-tuning for sustainable reduction of glycerol formation in Saccharomyces cerevisiae[J].Applied and Environmental Microbiology,2011,77(17):5857-5867.
[6] Kachroo A,Venugopal S,Lapchyk L,et al.Oleic acid levels regulated by glycerolipid metabolism modulate defense gene expression inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(14):5152-5157.
[7] Chandra-Shekara A,Venugopal S,Barman S,et al.Plastidial fatty acid levels regulate resistance gene-dependent defense signaling inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(17):7277-7282.
[8] Vigeolas H,Geigenberger P.Increased levels of glycerol-3-phosphate Lead to a stimulation of flux into triacylglycerol synthesis after supplying glycerol to developing seeds ofBrassicanapusL.in planta[J].Planta,2004,219(5):827-835.
[9] Roesler K,Shintani D,Savage L,et al.Targeting of theArabidopsishomomeric acetyl-coenzyme a carboxylase to plastids of rapeseeds[J].Plant Physiology,1997,113(1):75-81.
[10] Taylor D C,Katavic V,Zou J T,et al.Field testing of transgenic rapeseed cv.Hero transformed with a yeast sn-2 acyltransferase results in increased oil content,erucic acid contentand seed yield[J].Molecular Breeding :New Strategies in Plant Improvement,2002,8(4):317-322.
[11] Jako C,Kumar A,Wei Y D,et al.Seed-specific over-expression of anArabidopsiscDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight[J].Plant Physiology,2001,126(2):861-874.
[12] Mu J Y,Tan H L,Zheng Q,et al.LEAFY COTYLEDON1 is a key regulator of fatty acid biosynthesis inArabidopsis[J].Plant Physiology,2008,148(2):1042-1054.
[13] Tan H,Yang X,Zhang F,et al.Enhanced seed oil production in canola by conditional expression ofBrassicanapusLEAFY COTYLEDON1 and LEC1-LIKE in developing seeds[J].Plant Physiology,2011,156(3):1577-1588.
[14] 刘 野.海滨锦葵茎尖再生体系建立及GPD1和DGAT植物表达载体构建[D].大连:辽宁师范大学,2010.
[15] 弭宪杰,徐荣华,刘爱忠,等.蓖麻三磷酸甘油脱氢酶基因(RcGPDH)的克隆及功能分析[J].中国油料作物学报,2011,33(5):451-458.
[16] 胡 军.三磷酸甘油脱氢酶基因和甘油代谢对拟南芥种子含油量与根系发育的影响[D].武汉:华中农业大学,2013.
[17] 张 超.油菜甘油-3-磷酸脱氢酶基因的克隆及功能研究[D].南京:南京农业大学,2012.
[18] Chalhoub B,Denoeud F,Liu S,et al.Plant genetics.early allopolyploid evolution in the post-NeolithicBrassicanapusoilseed genome[J].Science,2014,345(6199):950-953.
[19] Shen W,Wei Y,Dauk M,et al.Identification of a mitochondrial glycerol-3-phosphate dehydrogenase fromArabidopsisthaliana:evidence for a mitochondrial glycerol-3-phosphate shuttle in plants[J].FEBS Letters,2003,536(1/3):92-96.
[20] Kurkdjian A,Guern J.Intracellular PH:measurement and importance in cell activity[J].Plant Biology,1989,40(40):271-303.
[21] Shen W,Li J,Dauk M,et al.Metabolic and transcriptional responses of glycerolipid pathways to a perturbation of glycerol 3-phosphate metabolism inArabidopsis[J].The Journal of Biological Chemistry,2010,285(30):22957-22965.
Cloning and Bioinformatics Analysis ofGPDHin Rapeseed
LIU Shaofeng,WANG Huihui,WU Kebin,XIONG Xinghua
(Crop Gene Engineering Key Laboratory of Hunan Province,Hunan Agricultural University,Changsha 410128,China)
To further study onGPDHofBrassicanapus,through the collinearity analysis of theGPDHfromArabidopsisthalianaandBrassicanapus:there are 4 copies ofGPDHof A genome and C genome in theBrassicanapuscalled as GSBRNA2T00132785001,GSBRNA2T00024258001,GSBRNA2T00058395001,GSBRN-A2T00019118001.Four cDNA were downloaded from GenBank,are named as:GPDH1,GPDH2,GPDH3 andGPDH4.Four pairs of primers were designed according to the sequence informations,and four nucleotide fragments were amplified from Xiangyou 15 full-length cDNA,designated asBnGPDH1,BnGPDH2,BnGPDH3,BnGPDH4.The result of nucleotide sequences and protein structure analysis by bioinformatics software and online system showed:Four CDS sequences length were 1 395,1 395,1 389,1 536 bp respectively.WhenBnGPDH4 is translated into the amino acid sequence,we found a stop codon in the middle ofBnGPDH4.Which isn′t an active protein.The number of amino acid of three other BnGPDH are 464,464 and 462 respectively.Secondary structure are consistant of the alpha helix(42%),random coil(42%)and extended chain(15%).The transmembrane structure of the three proteins was uniform.Their conservative domains consist of GpsA,NADB_Rossmann superfamily and NAD_Gly3P_dh_C superfamily,which belong to theGPDHsuperfamily.Homology modeling analysis showed that they were of model of Glycerol-3-phosphate dehydrogenase and located in cytoplasm by subcellular localization analysis.In terms of sequence composition,phylogenic tree,physico-chemical property,secondary structure and tertiary structure and subcellular localization,they have the characteristics ofGPDHsuperfamily.They should be the members ofGPDHsuperfamily.
GPDH;BrassicanapusL.;Bioinformatics analysis
2017-01-11
国家“973”计划项目(2015CB150200);湖南省科技计划项目(2014FJ1006-3)
刘少锋(1990-),男,湖南娄底人,在读硕士,主要从事油菜分子生物学研究。
熊兴华(1967-),男,湖南安乡人,副研究员,博士,主要从事油菜分子生物学及基因工程研究。
Q78;S635.03
A
1000-7091(2017)02-0109-08
10.7668/hbnxb.2017.02.017
