葡萄肌醇半乳糖苷合成酶基因VvGolS2-4的克隆及表达特性分析
2017-06-28冯睿杰侯丽霞
冯睿杰,侯丽霞,郭 扬,马 倩,刘 新
(青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛 266109)
葡萄肌醇半乳糖苷合成酶基因VvGolS2-4的克隆及表达特性分析
冯睿杰,侯丽霞,郭 扬,马 倩,刘 新
(青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛 266109)
为了研究葡萄肌醇半乳糖苷合成酶基因家族的特性,以抗低温品种左优红组培苗为材料,通过同源克隆技术,获得VvGolS2、VvGolS3和VvGolS4全长CDS,对其序列进行了生物信息学分析,同时利用实时定量PCR技术探究了3个基因的组织表达特性和响应逆境因子及相关信号分子的特性。结果显示:3个基因cDNA大小分别为954,978,1 011 bp,分别编码317,325,336个氨基酸序列;3个蛋白分子量分别为36.65,36.97,38.12 kDa;等电点分别为5.12,5.33和5.16,且均在C端含有一个疏水的五肽APXAA;实时荧光定量PCR证明,3个GolSs在葡萄不同组织中表达情况不同,VvGolS2和VvGolS4在叶片中表达量最高,而VvGolS3则在花和卷须中表达量最高;不同逆境因子及逆境信号分子均会影响VvGolS2、VvGolS3和VvGolS4基因的表达量,其中VvGolS2和VvGolS4基因的表达受盐诱导最明显,VvGolS3基因的表达受低温诱导最明显;另外,胁迫信号分子乙烯、过氧化氢和脱落酸均可诱导VvGolS2基因表达量上升,而VvGolS3基因的表达受脱落酸和乙烯的诱导,乙烯、过氧化氢和硫化氢则均可诱导VvGolS4基因表达量上升。综上推测,3个VvGolSs均与葡萄抵御逆境胁迫相关,但各自功能可能有所不同。
葡萄;肌醇半乳糖苷合成酶基因;基因克隆;表达特性分析
葡萄(VitisviniferaL.)是多年生落叶藤本浆果类果树,属葡萄科葡萄属,是我国主要的经济果树之一。随着葡萄基因组测序工作的完成,一些与葡萄抵御生物和非生物胁迫的基因被发掘和研究,这为从分子水平探讨葡萄抵御逆境胁迫的机制,进行遗传改良奠定了基础。低温、干旱和盐害是限制葡萄产业发展的主要逆境因子,近年来,人们先后克隆得到了VvWRKY18[1]、VvHsfHs[2]、VpPR10s[3]、VvBAP1[4]、VvCBF1[5]和VvGolS1[6]等与非生物胁迫相关基因并鉴定了其功能。葡萄对逆境胁迫的响应是一个复杂的信号传递网络,许多逆境相关基因的功能还需要探究。
寡糖是植物遭受逆境胁迫时产生的一类渗透调节物质,棉子糖系列寡糖是高等植物中含量仅次于蔗糖的一类可溶性糖。植物体内棉子糖系列寡糖的合成由棉子糖的合成开始,以半乳糖苷肌醇作为半乳糖基供体,依次向蔗糖、棉子糖、水苏糖转移半乳糖基生成棉子糖、水苏糖和毛蕊花糖。其中肌醇半乳糖苷由肌醇半乳糖苷合成酶(Galactinol synthase,GolS)催化肌醇和UDP-半乳糖合成,是这一通路的限速酶[7]。研究表明GolS是多基因家族[8-9],不同的GolS在抵御非生物胁迫中的作用各不相同[10]。如拟南芥中共有10个GolS家族成员,其中高温、干旱、盐胁迫下AtGolS1和AtGolS2的表达量上升,而AtGolS3基因表达受低温胁迫的诱导[11]。丹参3个SmGolS基因中,SmGolS1基因表达受高温的诱导,而高温和低温均可诱导SmGolS2的表达[8]。葡萄中GolS基因家族由VvGolS1、VvGolS2、VvGolS3和VvGolS4组成,Pillet等[6]从赤霞珠中克隆得到VvGolS1,并证明转录因子HsfA2以热依赖的形式激活VvGolS1启动子响应高温胁迫。但目前为止未见关于葡萄中其他GolS基因的研究报道,因此,本试验以抗低温品种左优红为材料,克隆得到VvGolS2、VvGolS3和VvGolS4,初步分析了其表达特性,以期为深入研究该基因家族成员的功能奠定基础。
1 材料和方法
1.1 葡萄组培材料及培养方法
以葡萄抗低温品种左优红为试验材料,以一年生新梢为供试外植体,消毒处理后接种于含有0.1 mg/L生长素(Auxin,IAA)的1/2 MS培养基上,置于培养室中培养,30~50 d后使用。消毒和培养方法见张广科等[4]。
1.2 试验材料及处理
取左优红大田苗一年生枝条的根、茎、叶、花芽、花、梢尖、卷须、以及幼果期、转色期、成熟期果实,提取总RNA,用于后续基因组织表达特异性的研究。
取正常生长4~5周龄的左优红葡萄组培苗分别经过甘露醇(Mannitol 200 mmol/L)、NaCl(150 mmol/L)、4 ℃、40 ℃、脱落酸(Abscisic acid,ABA 0.5 mmol/L)、过氧化氢(Hydrogen peroxide,H2O20.1%)、硫化氢(Hydrogen sulfide,H2S)供体硫氢化钠(Sodium hydrosulfide,NaHS 0.1 mmol/L)、乙烯(Ethylene,Eth)前体物质1-氨基环丙烷羧酸(1-aminocyclopropanecarboxylic acid,ACC 0.1 mmol/L)分别处理0,3,6,9,12,24 h后,提取叶片总RNA,利用实时荧光定量PCR技术检测VvGolS2、VvGolS3和VvGolS4基因表达量的变化。每组处理至少重复3次。
1.3 试验方法
1.3.1 总RNA的提取和cDNA合成 按照李希东等[12]方法提取葡萄总RNA,M-MLV反转录试剂盒合成cDNA第一条链作为模板。
1.3.2VvGolS2、VvGolS3、VvGolS4基因的克隆 根据NCBI网站公布的葡萄品种黑比诺基因组,搜索VvGolS2、VvGolS3和VvGolS4序列,并设计特异性引物(表1),PCR引物由上海桑尼生物工程有限公司合成。PCR反应程序如下:VvGolS2:94 ℃预变性5 min;94 ℃变性30 s,54.4 ℃退火30 s,72 ℃延伸1 min 10 s,35个循环;72 ℃延伸10 min,4 ℃保存;VvGolS3:94 ℃预变性5 min;94 ℃变性30 s,54.4 ℃退火30 s,72 ℃延伸1 min 10 s,35个循环;72 ℃延伸10 min,4 ℃保存;VvGolS4:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min 10 s,35个循环;72 ℃延伸10 min,4 ℃保存。PCR产物利用宝生物工程(大连)有限公司试剂盒回收,与pMD18-T载体连接。阳性克隆由上海桑尼生物工程有限公司测序。
1.3.3 VvGolS2、VvGolS3、VvGolS4的生物信息学分析 利用在线软件ProtParam(http://web.expasy.org/protparam/)对氨基酸序列进行分析;利用软件DNAMAN分析氨基酸序列的同源关系;利用软件MEGA 4.0采用N-J法构建进化树;利用在线软件WoLF PSORT(http://www.genscript.com/wolf-psort.html)进行亚细胞定位的预测。

表1 克隆基因所用引物序列
1.3.4VvGolS2、VvGolS3、VvGolS4基因表达分析 利用实时荧光定量PCR检测VvGolS2、VvGolS3和VvGolS4相对表达量变化,引物如表2。荧光实时定量 PCR程序为:95 ℃ 5 min;95 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,40个循环。Melt 曲线从72 ℃至99 ℃,第1步维持45 s,以后每升高1 ℃ 维持5 s。每样品进行3次重复。以Actin为内参对基因进行相对定量,VvGolS2、VvGolS3和VvGolS4表达量参考Livak等[13]的方法计算。
2 结果与分析
2.1 VvGolS2、VvGolS3和VvGolS4基因的克隆
根据NCBI网站公布的葡萄品种黑比诺基因中VvGolS2、VvGolS3、VvGolS4基因序列,利用生物学软件(Primer 5)设计特异性引物,以抗低温品种左优红cDNA为模板,扩增得到VvGolS2、VvGolS3和VvGolS4序列,结果如图1所示,分别在1 000 bp左右有清晰条带。

表2 荧光定量PCR反应引物序列
将上述扩增产物分别连接pMD18-T载体,提取重组质粒,经XbaⅠ和KpnⅠ双酶切验证,结果如图2所示,将正确的转化子送交测序,结果显示:VvGolS2扩增片段大小为954 bp,经DNAMAN软件分析可知,与GenBank中所提交品种黑比诺的基因序列一致性为98.75%;VvGolS3扩增片段大小为978 bp,与GenBank中所提交品种黑比诺的基因序列一致性为97.34%;VvGolS4扩增片段大小为1 011 bp,与GenBank中所提交品种黑比诺的基因序列一致性为99.60%。
2.2 VvGolS2、VvGolS3和VvGolS4生物信息学分析

M.DL2000 Marker;S1、S2、S3.VvGolS2、VvGolS3、VvGolS4扩增产物。M.DL2000 DNA Marker;S1,S2,S3.Sample of VvGolS2,VvGolS3,VvGolS4.

M.DL2000 DNA Marker; S1、S2、S3.VvGolS2、VvGolS3、VvGolS4酶切产物。M.DL2000DNA Marker;S1,S2,S3.Sample of VvGolS2,VvGolS3,VvGolS4.
2.2.1 VvGolS2、VvGolS3和VvGolS4蛋白序列分析 利用在线软件ProtParam对VvGolS2、VvGolS3和VvGolS4进行氨基酸组成分析。结果表明,VvGolS2、VvGolS3和VvGolS4的分子式组成分别为C1669H2522N420O481S15、C1684H2541N423O482S17、C1744H2616N428O492S21;氨基酸数分别为317,325和336;分子量分别为36.65,36.97,38.12 kDa;等电点分别为5.12,5.33和5.16;不稳定系数分别为37.97,40.53和38.75(40以下为稳定蛋白),推测VvGolS2和VvGolS4为稳定蛋白,VvGolS3为不稳定蛋白。
利用MEGA 4.0软件分别将VvGolS2、VvGolS3和VvGolS4与拟南芥、丹参、番茄、杨树、黄瓜、玉米、苜蓿中的GolSs氨基酸序列进行比对,结果显示葡萄中VvGolS2、VvGolS3和VvGolS4与多种植物中GolS同源,都具有保守的锰离子结合序列DXD(图3-A-C结构域Ⅰ)、一个相对保守的丝氨酸磷酸化位点(图3-A-C的*位置)以及C端末尾一个疏水性的五肽结构APXAA(图3-A-C结构域Ⅱ)。进化上,VvGolS2与玉米的ZmGolS1亲缘关系较近,同源性为68.31%;VvGolS3与丹参的SmGolS2亲缘关系较近,同源性为75.38%;VvGolS4与丹参的SmGolS1亲缘关系较近,同源性为77.15%(图3-D-F)。
2.2.2 VvGolS2、VvGolS3和VvGolS4蛋白的亚细胞定位预测 蛋白质的亚细胞定位有助于推测蛋白质执行生物学功能的位置,从而进一步推断蛋白质的具体功能。利用在线软件WoLF PSORT对VvGolS2、VvGolS3和VvGolS4进行了亚细胞定位的预测。结果显示VvGolS2定位于细胞质的预测值为8,定位于叶绿体的预测值为3,定位于细胞核、线粒体的预测值为1;VvGolS3定位于叶绿体的预测值为13;VvGolS4定位于细胞质的预测值为9,定位于叶绿体的预测值为3,定位于细胞核的预测值为1。推测VvGolS2和VvGolS4主要位于细胞质,少量位于叶绿体;VvGolS3主要位于叶绿体。进一步推测VvGolS3的主要功能可能与VvGolS2、VvGolS4有所差异。
2.3 VvGolS2、VvGolS3和VvGolS4的表达特异性分析
2.3.1VvGolS2、VvGolS3和VvGolS4的组织表达特性分析 以抗低温品种左优红为材料,检测VvGolS2、VvGolS3和VvGolS4在不同组织器官中的表达量,结果如图4示,VvGolS2在叶片、根、转色期果实、成熟期果实中表达量较高,在花、花芽、卷须和幼果中表达量较少;VvGolS3在梢尖和花中的表达量最高,在成熟期果实中表达量次之,在叶片中表达量较少。VvGolS4在叶片中表达量最高,而其他组织器官几乎检测不到其表达。



Ⅰ、Ⅱ分别表示GolS的锰离子结合序列和C端保守疏水五肽;*表示保守的丝氨酸磷酸化位点;AtGolS1. 拟南芥 At2g47180;AtGolS2.拟南芥 At1g56600;AtGolS3. 拟南芥 At1g09350;SmGolS1. 丹参 GQ245764;SmGolS2. 丹参 JF937200;SmGolS3. 丹参 JF937201;MfGolS1. 苜蓿 FJ607306;PtGolS. 毛果杨 XM_002320922.2;SlGolS1. 番茄 AF311943;CsGolS. 黄瓜 AY237112;ZmGolS1. 玉米 AF497507。
Ⅰ,Ⅱrepresentative manganese-binding motif and a conserved hydrophobic pentapeptide in the C-terminal region of GolS, * representative a conserved serine phosphorylation site; AtGolS1.ArabidopsisthalianaAt2g47180;AtGolS2.ArabidopsisthalianaAt1g56600;AtGolS3.ArabidopsisthalianaAt1g09350;SmGolS1.SalviamiltiorrhizaGQ245764;SmGolS2.SalviamiltiorrhizaJF937200;SmGolS3.SalviamiltiorrhizaJF937201;MfGolS1.MedicagofalcateFJ607306;PtGolS.PopulustrichocarpaXM_002320922.2;SlGolS1 .LycopersiconesculentumAF311943;CsGolS.CucumissativusAY237112;ZmGolS1.ZeamaysAF497507.
图3 葡萄与其他物种中GolSs氨基酸序列同源进化分析(A-C)和进化树(D-F)比较
Fig.3 Amino acid sequence alignment (A-C) and and phylogenetic tree (D-F) of GolSs in grapevine and other species

S.茎;R.根;L.幼叶;F.花;Fb.花芽;St.梢尖;T.卷须;Tf.幼果;V.转色果;M.成熟果。S.Stem;R.Root;L.Leaf;F.Flower;Fb.Flower bud;St.Shoot tip;T.Tendril;Tf.Tender fruit;V.Veraison;M.Mature.
2.3.2 几种逆境因子对VvGolS2、VvGolS3和VvGolS4表达量的影响 由图5可知,甘露醇和NaCl均可诱导VvGolS2的表达,其中NaCl诱导VvGolS2的表达最为显著,在处理12 h后达到最大值;VvGolS3的表达量受低温的强烈诱导,而不受其余逆境因子的诱导;高温、NaCl对VvGolS4表达量的诱导较为明显,分别在处理6,9 h后表达量达到最大值,其中又以NaCl的诱导效果最为显著,最大约为对照的84倍;低温和甘露醇对VvGolS4表达量的影响较小。推测VvGolS2和VvGolS4可能参与葡萄抵御多种非生物胁迫,特别是盐胁迫和温度胁迫;而VvGolS3可能参与应答低温胁迫。
2.3.3 几种逆境相关信号分子对VvGolS2、VvGolS3和VvGolS4表达量的影响 信号分子在植物抵御逆境胁迫中发挥着重要作用,本试验发现VvGolS2、VvGolS3和VvGolS4对不同逆境信号分子的响应有所不同(图6)。其中,ABA、Eth和H2O2均可诱导VvGolS2的表达,以ABA对VvGolS2表达的诱导最为强烈,在处理后6 h可达到约630倍;H2O2也可较强烈地诱导VvGolS2的表达,相对表达量在9 h达到22倍,而乙烯的供体Eth对VvGolS2的诱导效果较弱,9 h表达量约为7倍;VvGolS3的表达量受ABA的诱导最为强烈,6 h表达量约达到对照的27倍;乙烯对VvGolS3表达量的诱导效果较弱。不同的信号分子均可诱导VvGolS4的表达,其中以H2S、Eth和H2O2的诱导效果较为强烈。推测VvGolS2可能参与ABA和H2O2调控的葡萄抵御非生物胁迫的反应,VvGolS4可能参与H2S、Eth和H2O2介导的葡萄抵御非生物胁迫的反应;VvGolS3可能参与ABA相关的响应逆境胁迫的过程。
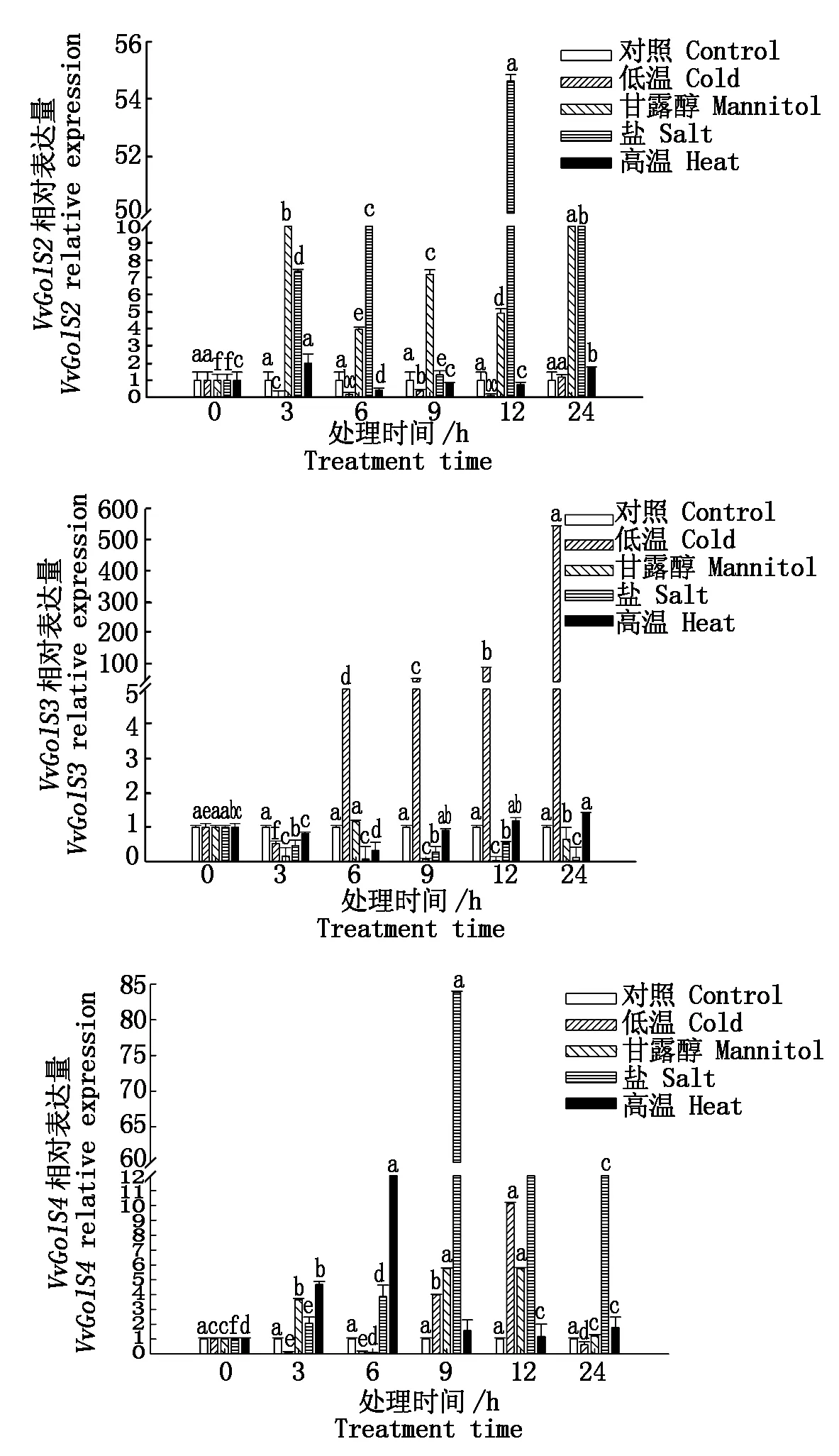
图5 几种逆境因子对葡萄叶片VvGolS2、VvGolS3和VvGolS4相对表达量的影响
3 讨论
棉子糖系列寡糖作为植物体内一种重要的渗透调节物质,在植物抵御生物、非生物胁迫过程中发挥着重要作用,其生物合成途径中的限速酶基因GolSs也越来越多地受到人们的重视。近年陆续从拟南芥[11]、玉米[14]、毛果杨[15]、丹参[8]和豌豆[16]中克隆得到GolSs基因并研究了功能。越来越多的证据证明GolSs在植物的抗逆反应、光合产物转运和种子发育中发挥重要作用[17]。最新研究表明葡萄中共有4个GolS家族成员,但目前为止尚未见对除VvGolS1外的葡萄GolS家族其他成员的克隆和表达特性分析。本试验以抗低温品种左优红为材料,克隆得到了VvGolS2、VvGolS3和VvGolS4。亚细胞定位预测显示,VvGolS2和VvGolS4均位于细胞质和叶绿体中,但VvGolS3位于叶绿体中,这暗示着3个基因的功能会存在差异。同源性分析发现,VvGolSs基因家族都具有一个保守的锰离子结合序列DXD和一个相对保守的丝氨酸磷酸化位点(拟南芥AtGolS2、番茄SlGolS1中该位点为丙氨酸),在C端均具有一个保守的疏水性五肽结构APXAA,绝大部分GolSs家族序列为APSAA,而VvGolS2中该五肽的丝氨酸被精氨酸所替代,其序列为APRAA;毛果杨PtrGolS9、小巢菜VhGolS2中该五肽的丝氨酸分别为苏氨酸、天冬酰胺所替代。

图6 几种逆境相关信号分子对葡萄叶片VvGolS2、VvGolS3和VvGolS4相对表达量的影响
为了初步了解3个基因的功能,利用荧光定量PCR检测了其组织表达特性。结果显示VvGolS2、VvGolS3和VvGolS4在不同组织器官中的表达情况存在差异。其中VvGolS2在叶片中表达量最高,根中其次,其他组织中表达较少;VvGolS4只在叶片中表达,其他组织中几乎检测不到;VvGolS3则在花、梢尖和成熟的果实等组织中表达量最高,叶片中的表达量最低,推测VvGolS3可能参与到花的发育过程。基因在不同组织中的表达与其功能密切相关,小巢菜种子发育期间VhGolS1和VhGolS2表达引起种子中棉子糖的积累,赋予种子抵御脱水胁迫的能力[18];毛果杨9个GolSs基因中PtrGolS4和PtrGolS6在根尖、茎、幼叶和成熟叶片中均有表达,而PtrGolS3和PtrGolS7则在根和茎中表达,9个基因在功能上也有所不同[15];丹参中3个GolS基因也表现出不同的表达特性[8];本试验中葡萄VvGolS2-4不同的组织表达特性暗示其功能可能有所不同。 有研究报道,不同干旱抗性的咖啡在受到水分胁迫时,其GolS的转录水平和棉子糖含量的积累也不相同[19],Saito等[20]证明低温下水稻OsGolS的表达量上调。那么葡萄中GolS家族成员是否也参与不同的逆境胁迫应答的过程,本试验进一步探讨了VvGolS2、VvGolS3和VvGolS4在高温、低温、干旱和高盐胁迫下的表达模式,发现高盐对VvGolS2和VvGolS4表达的诱导效果较明显;干旱对VvGolS2,高温和低温对VvGolS4表达的影响较大,VvGolS3则表现出对低温胁迫的专一性响应,其他逆境因子无法影响该基因的表达,而VvGolS4主要参与对高盐和温度胁迫的应答。说明不同VvGolS可能参与了不同的逆境响应。
植物响应逆境胁迫的过程是一个复杂的信号转导过程,许多重要的信号分子如ABA、乙烯、H2O2和H2S均参与植物响应非生物胁迫的信号转导途径。研究发现拟南芥中茉莉酸合成的前体物质亚麻酸可以诱导逆境下AtGolS1的表达,进而应答氧化胁迫等逆境胁迫[21];丹参中3个SmGolS基因均受ABA等激素的调控[8]。本试验发现不同信号分子均可不同程度诱导VvGolS2、VvGolS3和VvGolS4的表达,但诱导效果有所差异:ABA对VvGolS2表达的诱导最为强烈,对VvGolS3表达的诱导效果也较为明显,暗示VvGolS2和VvGolS3可能主要以ABA依赖形式参与响应胁迫;乙烯的前体物质Eth可诱导VvGolS2、VvGolS4的表达,表明其参与乙烯介导的生理反应。H2S是近年来发现的一类广泛参与植物响应逆境胁迫的气体信号分子[22],Fu等[23]发现来自L-/D-CDes途径的H2S参与葡萄抵御低温胁迫的过程。本试验中H2S的供体NaHS、盐和温度胁迫均可诱导VvGolS4的表达,表明VvGolS4可能参与H2S介导的响应温度胁迫和盐胁迫的信号通路。H2O2也是一种重要的逆境响应的信号分子,在本试验中VvGolS2和VvGolS4基因的表达可较为明显得被H2O2诱导,说明二者可能参与活性氧清除反应。VvGolS3的表达量则表现出受ABA的强烈诱导,说明参与ABA调控的葡萄抗逆反应。拟南芥AtGolS1和AtGolS2[11]、毛果杨中PtrGolS2、PtrGolS5-7[15]均被证明受ABA的诱导,旋蒴苣苔基因BhGolS1被证明受干旱和ABA的诱导,其启动子可与BhWRKY1结合,认为BhGolS1以ABA依赖的形式抵御脱水胁迫[24]。本试验结果显示,VvGolS3的表达受到低温和ABA的诱导,那么是否VvGolS3也受到了转录因子WRKY家族成员的调控,从而参与ABA依赖的低温信号转导通路需要深入研究。
葡萄GolS家族成员VvGolS2、VvGolS3和VvGolS4受逆境因子和激素因子的诱导,VvGolS2可能参与ABA依赖型的抗渗透胁迫途径,VvGolS4可能参与H2S和乙烯介导的抵御盐胁迫及温度胁迫的反应,而VvGolS3可能受ABA诱导参与抵御低温胁迫。有研究证实玉米中ZmGolS2可作为转录因子ZmDREB2A的下游靶基因响应干旱、高盐、高温等非生物胁迫[25],那么葡萄GolSs家族成员上游是否也存在不同的转录因子的调控,其具体的调控机制如何,还有待进一步研究。
[1] 肖培连,冯睿杰,侯丽霞,等.葡萄逆境胁迫相关WRKY18基因的克隆及表达特性分析[J].植物生理学报,2015(3):391-398
[2] Hu Y T,Han Y,Zhang K,et al.Identification and expression analysis of heat shock transcription factors in the wild Chinese grapevine(Vitispseudoreticulata)[J].Plant Physiology and Biochemistry:Ppb,2016,99(3):1-10.
[3] Wang L,Wei J,Zou Y,et al.Molecular characteristics and biochemical functions of VpPR10s fromVitispseudoreticulataassociated with biotic and abiotic stresses[J].International Journal of Molecular Sciences,2014,15(10):19162-19182.
[4] 张广科,肖培连,侯丽霞,等.葡萄VvBAP1基因的克隆及表达特性分析[J].植物生理学报,2014,50(6):829-834.
[5] Siddiqua M,Nassuth A.VitisCBF1 andVitisCBF4 differ in their effect onArabidopsisabiotic stress tolerance,development and gene expression[J].Plant,Cell & Environment,2011,34(8):1345-1359.
[6] Pillet J,Egert A,Pieri P,et al.VvGOLS1 and VvHsfA2 are involved in the heat stress responses in grapevine berries[J].Plant & Cell Physiology,2012,53(10):1776-1792.
[7] 李 芳,汪晓峰.植物中棉子糖系列寡糖代谢及其调控关键酶研究进展[J].西北植物学报,2008,28(4):852-859.
[8] Wang D,Yao W,Song Y,et al.Molecular characterization and expression of three galactinol synthase genes that confer stress tolerance inSalviamiltiorrhiza[J].Journal of Plant Physiology,2012,169(18):1838-1848.
[9] Zhuo C,Wang T,Lu S,et al.A cold responsive galactinol synthase gene fromMedicagofalcata(MfGolS1)is induced by myo-inositol and confers multiple tolerances to abiotic stresses[J].Physiologia Plantarum,2013,149(1):67-78.
[10] Nishizawa A,Yabuta Y,Shigeoka S.Galactinol and raffinose constitute a novel function to protect plants from oxidative damage[J].Plant Physiology,2008,147(3):1251-1263.
[11] Taji T,Ohsumi C,Iuchi S,et al.Important roles of drought-and cold-inducible genes for galactinol synthase in stress tolerance inArabidopsisthaliana[J].The Plant Journal :for Cell and Molecular Biology,2002,29(4):417-426.
[12] 李希东,侯丽霞,刘 新,等.H2O2与葡萄VvIPK2基因表达及其低温胁迫响应的关系[J].园艺学报,2011,38(6):1052-1062.
[13] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408
[14] Gu L,Han Z X,Zhang L F,et al.Functional analysis of the 5′ regulatory region of the maizeGALACTINOLSYNTHASE2 gene[J].Plant Science,2013,213(3):38-45.
[15] Zhou J,Yang Y,Yu J,et al.Responses ofPopulustrichocarpagalactinol synthase genes to abiotic stresses[J].Journal of Plant Research,2014,127(2):347-358.
[16] Lahuta L E,Pluskota W E,Stelmaszewska J,et al.Dehydration induces expression ofGALACTINOLSYNTHASEandRAFFINOSESYNTHASEin seedlings of pea(PisumsativumL.)[J].Journal of Plant Physiology,2014,171(14):1306-1314.
[17] Zhou T,Zhang R,Guo S D.Molecular cloning and characterization ofGhGolS1,a novel gene encoding galactinol synthase from cotton(Gossypiumhirsutum)[J].Plant Molecular Biology Reporter,2012,30(3):699-709.
[18] Gojto E,Pupel P,Lahuta L,et al.The acquisition of desiccation tolerance in developingViciahirsutaseeds coincides with an increase in galactinol synthase expression and soluble α-D-galactosides accumulation[J].Journal of Plant Physiology,2015,184:37-48.
[19] Santos T,De Lima R,Nagashima G,et al.Galactinol synthase transcriptional profile in two genotypes ofCoffeacanephorawith contrasting tolerance to drought[J].Genetics and Molecular Biology,2015,38(2):182-190.
[20] Saito M,Yoshida M.Expression analysis of the gene family associated with raffinose accumulation in rice seedlings under cold stress[J].Journal of Plant Physiology,2011,168(18):2268-2271.
[21] Mata-Pérez C,Sánchez-Calvo B,Begara-Morales J,et al.Transcriptomic profiling of linolenic acid-responsive genes in ROS signaling from RNA-seq data inArabidopsis[J].Frontiers in Plant Science,2015,6:122.
[22] García-Mata C,Lamattina L.Gasotransmitters are emerging as new guard cell signaling molecules and regulators of leaf gas exchange[J].Plant Science :an International Journal of Experimental Plant Biology,2013,201-202:66-73.
[23] Fu P N,Wang W J,Hou L X,et al.Hydrogen sulfide is involved in the chilling stress response inVitisviniferaL.[J].Acta Societatis Botanicorum Poloniae,2013,82(4):295-302.
[24] Wang Z,Zhu Y,Wang L,et al.A WRKY transcription factor participates in dehydration tolerance inBoeahygrometricaby binding to the W-box elements of the galactinol synthase(BhGolS1)promoter[J].Planta,2009,230(6):1155-1166.
[25] Gu L,Zhang Y,Zhang M,et al.ZmGOLS2,a target of transcription factor ZmDREB2A,offers similar protection against abiotic stress as ZmDREB2A[J].Plant Molecular Biology,2016,90(1/2):157-170.
Gene Cloning and Expression Analysis of Galactinol Synthase GeneVvGolS2-4 in Grape
FENG Ruijie,HOU Lixia,GUO Yang,MA Qian,LIU Xin
(College of Life Science,Qingdao Agricultural University,Key Lab of Plant Biotechnology in Universities of Shandong Province,Qingdao 266109,China)
Using homology cloning method,the full-length cDNA of galactinol synthase geneVvGolS2,VvGolS3 andVvGolS4 were cloned fromVitisviniferacultivar Zuoyouhong tissue culture seedling.The analysis ofVvGolS2,VvGolS3 andVvGolS4 sequencing indicated that three genes were 954,978 and 1 011 bp ranging in size,coded as 317,325,336 amino acids respectively with molecular weight were 36.65,36.97,38.12 kDa and the isoelectric point were 5.12,5.33,5.16 respectively.Three VvGolSs all possessed a conserved hydrophobic APXAA pentapeptide domain in the C-terminal region.Real-time PCR analysis showed that threeVvGolSswere expressed different in all tested tissues,with the highest expression ofVvGolS2 andVvGolS4 in leaves,andVvGolS3 was highly expressed in flowers and tendrils. Using tissue culture seedling,the relative expression levels ofVvGolS2,VvGolS3 andVvGolS4 after different stresses or different stress singling factors treatment were checked.TheVvGolS2 andVvGolS4 were highly induced by salt stress,while theVvGolS3 was only induced by low temperature.Moreover,VvGolS2 was significantly induced by stress-related signal molecules,such as abscisic acid(ABA),ethylene(ACC),and hydrogen peroxide(H2O2).TheVvGolS4 was induced by ACC,H2O2and H2S,and theVvGolS3 was induced by ABA and ACC.Together,these results suggested that these threeVvGolSswere involved in abiotic stresses resistance in grape with different functions.
Vitisvinifera;Galactinol synthase gene;Gene clone;Expression analysis
2017-01-11
国家自然科学基金项目(31572107;31540090;31401844)
冯睿杰(1991-),男,山西太原人,硕士,主要从事葡萄生理与分子生物学研究。冯睿杰、侯丽霞为同等贡献作者。
刘 新(1966-),女,山东莱阳人,教授,主要从事葡萄生理与分子生物学研究。
Q78
A
1000-7091(2017)02-0087-09
10.7668/hbnxb.2017.02.014
