柠条锦鸡儿CkLEA4-1基因的克隆及表达分析
2017-06-28滑璐玢于秀敏王瑞刚宝力德
滑璐玢,于秀敏,杨 杞,王瑞刚,宝力德
(内蒙古农业大学 生命科学学院,内蒙古 呼和浩特 010018)
柠条锦鸡儿CkLEA4-1基因的克隆及表达分析
滑璐玢,于秀敏,杨 杞,王瑞刚,宝力德
(内蒙古农业大学 生命科学学院,内蒙古 呼和浩特 010018)
为研究胚胎发育晚期蛋白(LEA)在柠条中的生物学功能,从已构建的柠条锦鸡儿干旱胁迫抑制削减杂交文库中筛选到一条LEA蛋白编码基因,并采用RT-PCR法进行克隆。所得LEA基因的开放阅读框(ORF)长1 119 bp,编码373个氨基酸的蛋白质,命名为CkLEA4-1。结合序列比对与系统进化分析结果,推断CkLEA4-1属于5族LEA蛋白。利用实时荧光定量PCR技术对CkLEA4-1在干旱、高盐等逆境胁迫条件下的表达情况进行初步研究,结果表明,CkLEA4-1受到不同程度的诱导,推测该基因可能与柠条锦鸡儿响应逆境胁迫有关。研究还成功构建了CkLEA4-1的过表达载体pCanG-CkLEA4-1,得到转基因纯合体株系,为进一步研究柠条锦鸡儿CkLEA4-1基因的功能提供了材料。
柠条锦鸡儿;LEA;基因克隆;表达分析
在植物整个生命周期中,干旱、盐碱和冻害成为限制植物生长发育的重要逆境因子,在长期的进化过程中植物为抵御这些环境胁迫,形成了特定、复杂的调控机制[1-2]。其中胚胎发育晚期蛋白(Late embryogenesis abundant,LEA)就是植物在遭遇逆境时诱导合成的一系列功能蛋白,具有保护植物体、维持其生命代谢的功能。LEA蛋白最早由Dure等[3]在棉花子叶中发现,由于在胚胎发育晚期大量积累而得名。起初研究者们认为LEA蛋白是广泛存在于高等植物种子中的一类蛋白,可以在种子成熟脱水过程中保护植物的组织细胞免受脱水伤害。经过长期研究发现LEA蛋白并不只在植物种子中大量表达,当植物在受到干旱、高盐、低温、紫外等非生物胁迫时也会大量表达,且并不表现出组织特异性[4]。同样在极端耐辐射异常球菌[5]、蓝藻[6]、线虫[7]等生物中也发现了LEA蛋白,由此可见LEA蛋白不只存在植物中,在微生物甚至一些无脊椎动物中也可能普遍存在。
LEA蛋白分子量较低,一般为10~30 kDa,富含亲水性氨基酸,如甘氨酸、丙氨酸、丝氨酸等,因此具有较高的亲水性和热稳定性[8]。经大量研究发现,在植物抵抗非生物胁迫的过程中,LEA蛋白能起到水分缓冲液、分子屏障、酶保护剂、与金属离子结合、防止细胞聚集、抗氧化性和膜连接的作用[9]。
LEA蛋白家族庞大,分类方法繁多。Baker和Dure等最早提出LEA蛋白的命名方法,即用大写字母“D”为前缀表示从cDNA文库中筛选得到,后面用数字表示不同序列的LEA蛋白,如D-11、D-19、D-29等[10-11];Bray等[12]根据LEA蛋白序列的保守结构将其分为6族,从1族(Group 1)到6族(Group 6);而由于研究不断深入,一些非典型LEA蛋白被发现,之前的分类方法显得有些不足,于是 Hundertmark等[4]参照Pfam数据库对植物LEA蛋白命名方法及LEA蛋白的基元序列将其分为9类,分别是Dehydrin、LEA_1、LEA_2、LEA_3、LEA_4、LEA_5、SMP、AtM、PvLEA18。
柠条锦鸡儿(CaraganakorshinskiiKom.)为锦鸡儿属多年生灌木,根系庞大,具有耐风蚀、不怕沙埋的特点,在内蒙古地区分布极广。柠条锦鸡儿的另一大优势为抗逆性极强,能抵御-30~-40 ℃的严寒,同时其抗旱、抗热能力也极强,开始受热害的温度高达46 ℃,抗热极限温度可达49 ℃,因此柠条锦鸡儿具有广泛的适应性,是荒漠、荒漠草原地区优良的防沙固沙植物[13]。此外,柠条锦鸡儿枝叶繁茂,产量高,营养丰富,适口性好,是家畜的优良饲用灌木[14-15]。由于柠条锦鸡儿具有极强的抗逆性和很大的应用价值,因此,对柠条锦鸡儿的研究受到重视,对其抗逆分子机制的研究也受到更多的关注,一些抗逆相关的基因逐渐被克隆并进行功能研究[16-18]。本试验以柠条锦鸡儿为材料,采用RT-PCR技术克隆得到一条LEA蛋白编码基因,并对该基因进行生物学分析;利用实时荧光定量PCR技术对其在不同逆境胁迫下的表达量进行了定量分析;成功构建了高效植物表达载体,并筛选得到纯合体株系,为后续研究提供了材料。
1 材料和方法
1.1 植物材料及载体
柠条锦鸡儿种子采自内蒙古四子王旗;野生型拟南芥(Arabidopsisthaliana)Columbia-0生态型(Col-0)、植物表达载体pCanG-HA、农杆菌感受态GV3101均由植物分子生物学实验室提供;克隆载体pEASY-Blunt simple、大肠杆菌感受态购于TransGen;T4DNA连接酶和限制性内切酶等购于Thermo公司。
1.2 植物处理方法
挑选饱满、无虫蛀的柠条锦鸡儿种子播种于装有蛭石和营养土(2/1)的培养钵中,置于25 ℃、16 h光照/8 h黑暗、光照强度7 000~8 000 lx的环境中进行培养。
取长势一致的30 d龄柠条幼苗进行胁迫处理并提取RNA。胁迫处理主要包括干旱、脱水和NaCl 3种处理方式。处理方法:①干旱处理:停止浇水进行干旱处理,当幼苗呈现严重萎蔫的现象时复水,复水时间为干旱14~16 d,在刚停止浇水时取样并设为第0天(0 d),之后分别在停止浇水后的第4天(4 d)、第8天(8 d)、第12天(12 d)、第16天(16 d)、复水后1 d(re-1 d)取样;②脱水处理:将柠条幼苗从蛭石中小心移出并用清水冲洗干净(尽量避免损伤幼苗),摆放于滤纸上置于植物房进行晾晒处理,并分别在晾晒0,3,6,12,24 h取样;③NaCl处理:将小苗根部浸泡于300 mmol/L的NaCl溶液中进行盐胁迫处理,并在浸泡0,3,6,12,24 h时取样。每种处理每个时间点取3株柠条锦鸡儿幼苗,且每种处理需重复3次。取样时采集幼苗地上部分液氮速冻,保存于-80 ℃冰箱用于RNA提取。
1.3 柠条锦鸡儿总RNA提取及反转录
柠条锦鸡儿幼苗样品总RNA提取采用TRIzol试剂(Invitrogen公司),依照说明书进行操作。用超微量紫外分光光度计Q5000检测RNA浓度,1%浓度的琼脂糖凝胶电泳检测RNA质量。选电泳条带清晰完整并且OD260/230值为1.9~2.0的RNA,采用RNA PCR kit(TaKaRa 公司)进行cDNA第一链的合成,以上操作按试剂盒说明进行。
1.4 CkLEA4-1基因全长cDNA的克隆
从本实验室已构建好的柠条锦鸡儿干旱胁迫抑制削减杂交文库(SSH)得到一条LEA基因序列[19],利用Primer5设计引物见表1,小写部分是酶切位点所在位置,正向CkLEA4-1-F所加酶切位点是SalⅠ,反向CkLEA4-1-R所加酶切位点是SacⅠ。
以柠条锦鸡儿cDNA为模板,CkLEA4-1-F和CkLEA4-1-R为引物,用高保真酶Primer STAR(TaKaRa公司)进行PCR扩增。扩增条件:98 ℃预变性3 min;98 ℃变性15 s,58.5 ℃退火30 s,72 ℃延伸1.5 min,72 ℃补充延伸10 min,30个循环。1%琼脂糖凝胶电泳检测扩增产物,切胶后用胶回收试剂盒(GK2043,GENEray公司)进行回收。将胶回收产物连入克隆载体pEASY-Blunt Simple(TransGen公司),热激法转化大肠杆菌感受态Trans5α(TransGen公司),挑取阳性克隆进行菌落PCR验证后将菌液送测序。本试验所用引物(表1)和菌液测序均由上海生工生物工程技术服务有限公司完成。

表1 试验所用引物及序列
1.5 CkLEA4-1基因生物信息学分析
CkLEA4-1基因核苷酸序列翻译以及亲水性分析采用DNAMAN软件。利用ExPASy(http://www.expasy.org/proteomics)数据库中ProtParam软件推导氨基酸序列的分子量、理论等电点以及对氨基酸残基数等理化性质进行分析。用NCBI网站GenBank数据库的Blast程序将CkLEA4-1编码的氨基酸序列与其他植物的LEA蛋白进行比对分析,并使用Mega5进行系统进化分析。
1.6 不同胁迫处理CkLEA4-1基因表达分析
1.7 植物过表达载体构建
参照质粒小提试剂盒(TIANGEN公司)步骤提取含有目的基因的重组质粒,经内切酶SalⅠ和SacⅠ酶切后,将目的片段插入到由CaMV35S启动子驱动的植物表达载体pCanG-HA中,酶切验证正确后将正确的重组质粒转化农杆菌GV3101,挑取阳性克隆进行PCR鉴定。
1.8 拟南芥遗传转化及纯合体筛选
用浸花法将重组表达载体pCanG-CkLEA4-1转入野生型拟南芥,用卡那霉素(25 mg/L)筛选阳性植株。得到转基因植株T3后取样提取总RNA,反转录为cDNA,通过实时荧光定量PCR检测转基因株系中的基因表达量,具体方法同1.6。
2 结果与分析
2.1 CkLEA4-1基因的克隆及序列分析
在干旱SSH文库中得到CkLEA4-1基因序列,通过NCBI Blast进行比对后发现该序列具有完整的开放阅读框(ORF),设计基因特异性引物CkLEA4-1-F和CkLEA4-1-R,以柠条锦鸡儿的cDNA为模板,利用高保真酶Prime STAR进行PCR扩增,获得大小约为1 000 bp的片段(图1)。测序结果显示,去除所加保护碱基后,得到的序列长度为1 133 bp(图2),图2中下划线部分是引物及酶切位点。经DNAMAN软件分析,CkLEA4-1基因ORF长1 119 bp,起始密码子为ATG,终止密码子为TAA,共编码373个氨基酸(图2)。

1、2.PCR 产物 ;M.DL5000。1,2.PCR products ;M.DL5000.
2.2 生物信息学分析
用ExPASy数据库中的ProtParam工具对CkLEA4-1编码的氨基酸序列进行预测,结果显示CkLEA4-1编码的蛋白分子量为40.881 kDa。蛋白质富含丙氨酸(Ala 16.6%)、赖氨酸(Lys 10.7%)、天冬氨酸(Asp 9.7%)、谷氨酸(Glu 8.8%)、丝氨酸(Ser 7.5%),而色氨酸(Trp 0.8%)、半胱氨酸(Cys 0.5%)、脯氨酸(Pro 0.5%)含量较低,该蛋白负电荷氨基酸总数69个,正电荷氨基酸总数55个,是一种酸性蛋白,理论等电点为5.12。
《水土保持定额》中计量名称“一般石方开挖(风钻钻孔)”、“坡面石方开挖”、“基础石方开挖”、“沟槽石方开挖”、“坑石方开挖”等中所运用“炸药、雷管、导火索”等火工品,基层中、小型水土保持建设中已基本禁止运用,但《水土保持定额》中却没有其它先进替代工艺。

粗体字母表示起始密码子ATG和终止密码子TAA(*);下划线部分为引物。The bold letters show ATG and TAA(*);The underline letters show the primers.
用DNAMAN软件对CkLEA4-1编码的多肽链进行亲水性分析,第20位的亮氨酸(Leu)分值最高为3.044,疏水性最强;第58位的谷氨酸(Glu)分值最低为-2.656,亲水性最强。而且ProtParam程序中该蛋白的平均疏水指数(GRAVY)为-0.923,由此可见该蛋白为亲水蛋白(图3)。
用SOPMA在线软件预测CkLEA4-1蛋白的二级结构,其中292个氨基酸形成α-螺旋,所占比例高达78.28%;47个氨基酸形成无规则卷曲,所占比例为12.60%;18个氨基酸形成延伸链,所占比例为4.83%;16个氨基酸形成β-转角,所占比例为4.29%。
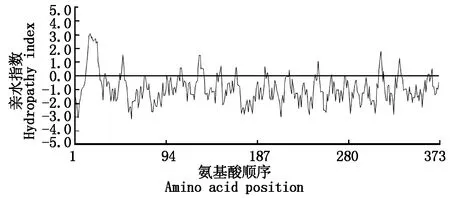
0值以上的部分表示疏水区域;0值以下的部分表示亲水区域。
2.3 CkLEA4-1蛋白的系统进化树分析
将CkLEA4-1基因编码的氨基酸序列在NCBI上进行Blast比对,发现该LEA蛋白与豆科模式植物蒺藜苜蓿(Medicagotruncatula)LEA(XP_003612026.1)的同源性为54%,亲缘关系最近;其次为鹰嘴豆(CicerarietinumL.)D-29(XP_004509269.1)和塔里哈花生(Arachisipaensis)D-29(XP_016206502.1),与其他植物中的LEA蛋白,如枣(Ziziphusjujuba)D-29( XP_015890004.1)、朝鲜变种蓟(Cynaracardunculusvar.scolymus)LEA-3(KVH92360.1)、葡萄(VitisviniferaL.)D-29(XP_002266501.1)等的同源性较低,这些序列大部分为第5组LEA蛋白,且第5组LEA蛋白具有物种间同源性低的特点[20]。用MEGA5软件构建系统进化树发现,CkLEA4-1与蒺藜苜蓿LEA(XP_003612026.1)聚类在一起,与同为豆科的鹰嘴豆D-29(XP_004509269.1)亲缘关系也较近(图4),因此,推断CkLEA4-1为第5族LEA蛋白。
2.4 CkLEA4-1基因在不同非生物逆境胁迫下的表达分析
利用荧光定量PCR技术对CkLEA4-1基因在不同胁迫下的表达情况进行分析,结果显示在不同的胁迫条件下CkLEA4-1都被不同程度的诱导表达(图5)。
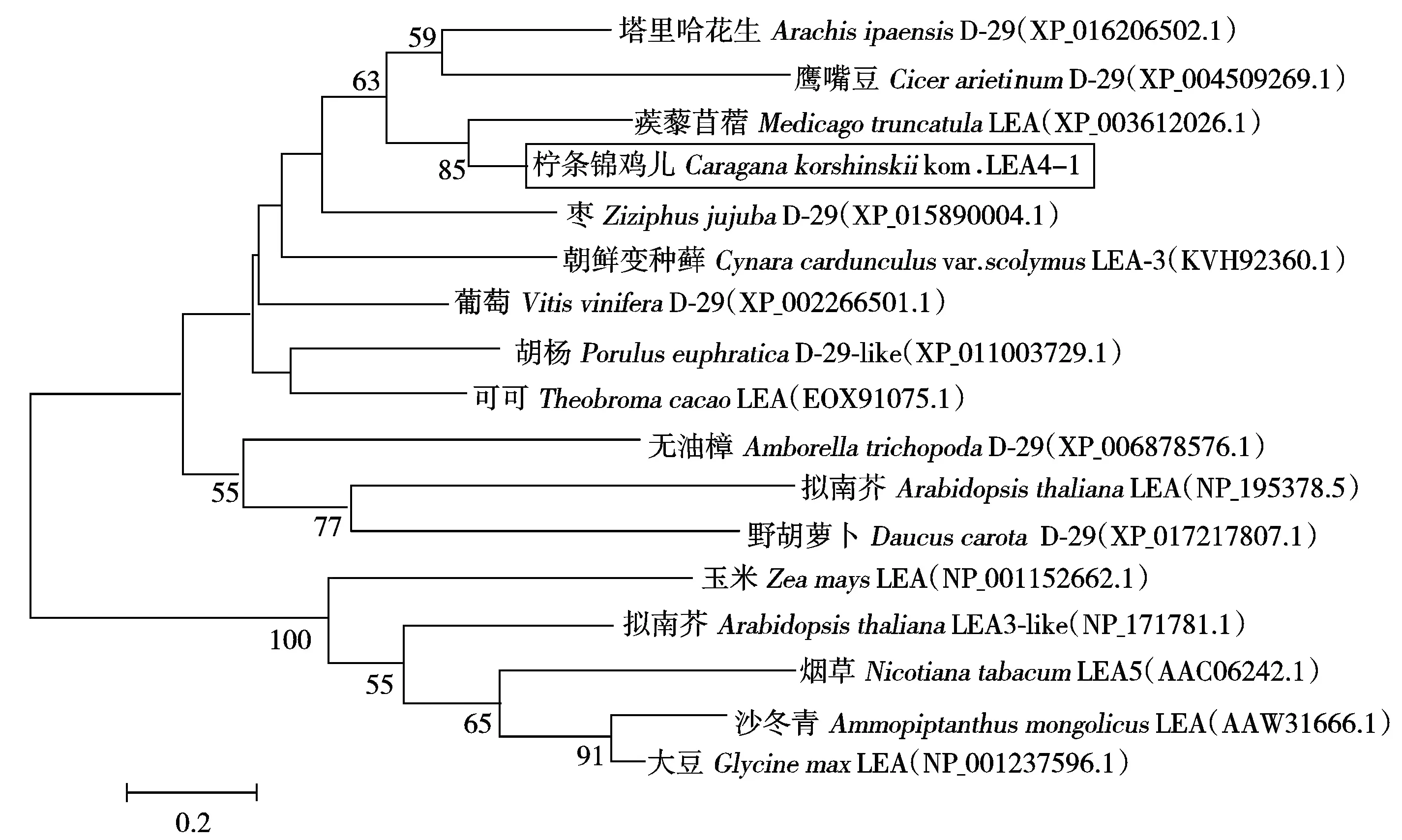
括号内为氨基酸登录号;分支上的数字表示Bootstrap验证中基于1 000次重复该节点的可信度;标尺表示演化距离。The accession No.was given in bracket;The numbers on the branches repr esent the reliability percent of bootstrap values based on 1 000 replications;Scaleplate represents the evolution distance of these plants.
由图5可以看出,CkLEA4-1对脱水和土壤干旱处理的响应较为明显,脱水处理过程中,CkLEA4-1的表达水平持续上升,24 h达到未处理时的110倍;在土壤干旱处理的过程中,CkLEA4-1的表达水平也持续上升,在16 d时达到最高,为未处理的31倍,并在复水1 d后表达水平又迅速回落;NaCl处理后,CkLEA4-1的表达水平虽没有干旱胁迫下的表达水平高,但在3 h达到未处理时的8倍,并一直保持高水平表达,在24 h达到未处理时的16倍。综上所述,CkLEA4-1在干旱胁迫下可被强烈诱导,对盐胁迫也有一定的响应。

图5 qRT-PCR检测不同处理条件下CkLEA4-1基因的表达
2.5 pCanG-CkLEA4-1植物表达载体的构建
对带有目的基因片段的克隆载体pEASY-CkLEA4-1用SalⅠ和SacⅠ进行双酶切(图6-A),然后将酶切产物连接到线性化的表达载体pCanG-HA中。构建好pCanG-CkLEA4-1重组表达载体后用SalⅠ和SacⅠ双酶切鉴定,能够切出目的片段,说明表达载体构建成功(图6-B)。
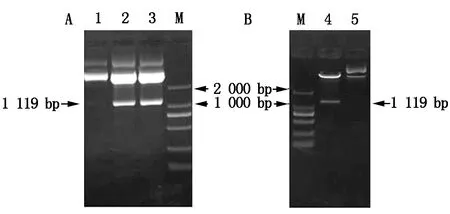
A.pEASY-CkLEA4-1酶切结果;B.pCanG-CkLEA4-1酶切鉴定结果;M.DL2000;1,5.质粒对照;2,3.pEASY-CkLEA4-1酶切;4.SalⅠ和SacⅠ酶切鉴定。
A.pEASY-CkLEA4-1enzymes digestion result;B.pCanG-CkLEA4-1 enzymes digestion result;M.DL2000;1,5.Vector control;2,3.pEASY-CkLEA4-1 digestion;4.Digested withSalⅠandSacⅠ.
图6 pCanG-CkLEA4-1表达载体的构建与鉴定
Fig.6 The construction and identification of pCanG-CkLEA4-1 recombinant vector
2.6 转基因纯合体植株鉴定
将得到的重组植物表达载体pCanG-CkLEA4-1转入野生型拟南芥,由于pCanG-CkLEA4-1载体带有Kan+抗性,通过卡那霉素筛选得到T3阳性植株13个株系。取T3纯合体转基因拟南芥幼苗的叶片提取总RNA,并反转录为cDNA,通过实时荧光定量PCR检测CkLEA4-1在转基因株系中的相对表达水平(图7)。

图7 过表达CkLEA4-1拟南芥株系表达水平的实时荧光定量PCR检测
3 结论与讨论
LEA蛋白作为一类重要的抗逆蛋白颇受关注,相关研究也日益增多,而柠条锦鸡儿由于具有较强的适应性和抗逆性,已成为中国北方生态环境治理的优选灌木[21],因此,对柠条锦鸡儿LEA基因的研究进行功能分析,不仅可以揭示柠条锦鸡儿抗逆性分子机理,而且可以为抗逆育种提供优良基因。
本试验从杨杞等[19]构建的SSH文库中筛选并克隆得到的柠条锦鸡儿CkLEA4-1基因经NCBI Blast比对后发现,该基因没有明显的保守结构域,比对所得到的同源序列多为其他物种的D-29蛋白,按照Bray等[12]的分类方法D-29蛋白即为5族LEA蛋白,且CkLEA4-1与其他序列的同源性较低,这也符合第5族LEA蛋白间同源性较低的特点[20]。分析其二级结构,发现该蛋白和其他大多数LEA蛋白一样,N端氨基酸残基主要形成α-螺旋,C端氨基酸残基形成无规则卷曲[22]。蛋白结构决定其性质和功能,LEA蛋白富含α-螺旋,在胁迫条件下可能形成高度螺旋折叠,而这样的结构又可以稳定脂膜或功能蛋白,阻止水分大量散失,将外界环境对细胞内代谢的影响降到最低[23]。而在Baker等[24]的研究中发现D29 LEA蛋白中存在由11个氨基酸组成的重复基元序列,此类序列可形成氨基酸盐桥,充实蛋白质结构,提高细胞液中的离子强度,进而使植物抵抗干旱的能力增强或减轻干旱给植物带来的伤害。
LEA蛋白作为一种抗逆蛋白具有多种功能,如大多数LEA蛋白具有稳定细胞膜、清除活性氧自由基、结合金属离子等功能[25]。有研究表明,许多LEA蛋白可以提高植物抗旱、耐盐的能力。Sharma等[26]将一种野花生的第5组C亚组LEA蛋白AdLEA在模式植物烟草中过表达发现,其可通过提高植物叶绿素含量,降低脂质过氧化反应来提高植物对干旱、盐胁迫以及氧胁迫的耐受性。Boucher等[27]发现苜蓿的第5组 LEA蛋白MtPM25在干旱期间可以起到保护作用并在修复机制中也占有重要位置。Amara等[28]发现在渗透胁迫条件下,将玉米基因在玉米中过表达后发现,转基因株系幼苗的叶片和根系比野生型的大,相对含水量也更高,而且在受到氧胁迫时转基因株系叶绿素损失降低、产生的丙二醛更少。Liu等[29]发现低温、渗透胁迫、氧胁迫及一些分子信号如ABA、SA、MeJA可诱导ZmLEA5C的表达,然而高盐却可以明显抑制ZmLEA5C的转录,这与其他LEA蛋白不同。在烟草(NicotianatabacumL.)和酵母(Yeast)(GS115)中过表达ZmLEA5C可以提高其对渗透胁迫和低温胁迫的耐受力。Mowla等[30]将拟南芥的AtLEA5转入对氧敏感的酵母突变株Δyap1发现,Δyap1的氧胁迫耐受性提高。AtLEA5不同于其他典型的LEA基因,并不在种子中表达,且在短日照条件下生长的拟南芥,AtLEA5转录水平表现出一定的昼夜节律性,在光照条件下受到抑制而在黑暗条件下富集。在拟南芥中过表达AtLEA5可使植物根长增长,生物量增大。
CkLEA4-1是第5组LEA蛋白,该组LEA蛋白受干旱、盐、紫外等胁迫诱导[31],因此推测其可能与柠条锦鸡儿抗旱性等密切相关。为了验证这一设想,分别检测了CkLEA4-1在干旱等不同逆境胁迫下的表达情况,结果显示CkLEA4-1在干旱、高盐等胁迫下都被不同程度地诱导。其中对干旱胁迫的响应最为显著,在0~16 dCkLEA4-1的表达量持续升高,并在16 d达到峰值,达到未处理水平的30多倍,但re-1 d后出现明显回落,暗示CkLEA4-1在植物对干旱的抵抗过程中可能发挥着重要作用。而在盐胁迫条件下,CkLEA4-1的表达量总体呈上升趋势,胁迫处理6 h的表达量达到了未处理时的13.6倍,之后在胁迫12 h表达水平略有下降,为未处理时的9.8倍,但仍较胁迫3 h时的表达量高,并且在胁迫24 hCkLEA4-1的表达量回升,且达到未处理时的16.8倍,这一趋势与小麦的TaLEA4在盐胁迫条件下的趋势相同[32-33]。因此,CkLEA4-1在受高盐胁迫过程中也发挥一定作用。为了进一步揭示该基因在柠条锦鸡儿抵抗干旱和高盐胁迫的功能,笔者构建了该基因的双元表达载体并在拟南芥中过表达,现已得到纯合体株系。而在检测转基因纯合体株系中CkLEA4-1基因表达量时发现,各株系间CkLEA4-1的表达量存在差异,其中表达量最高的3个株系分别为OE-5、OE-35和OE-18。造成这种株系差异的因素主要有2个,分别为位置效应和转基因沉默,而造成本研究株系差异的主要原因可能是位置效应[34]。位置效应是由于外源基因随机整合到宿主染色体,使目的基因的表达受到不同的染色质结构和表达调控元件的影响[35-36]。因此有的株系CkLEA4-1基因表达量较高而有个别株系CkLEA4-1基因几乎不表达。综上所述,在已得到的纯合体中选表达量最高的3个株系OE-5、OE-35和OE-18进行后续的抗逆性研究。
[1] 高 宇,张晓霞,李 彬,等.国内外旱作农业研究进展[J].北方农业学报,2016,44(1):102-108.
[2] Bartels D,Sunkar R.Drought and salt tolerance in plants[J].Critical Reviews in Plant Sciences,2005,24(1):23-58.
[3] Dure L,Greenway S C,Galau G A.Developmental biochemistry of cottonseed embryogenesis and germination:changing messenger ribonucleic acid populations as shown byinvitroandinvivoprotein synthesis[J].Biochemistry,1981,20(14):4162-4168.
[4] Hundertmark M,Hincha D K.LEA(Late Embryogenesis Abundant)proteins and their encoding genes inArabidopsisthaliana[J].Bmc Genomics,2008,9(9):1-22.
[5] Makarova K S,Aravind L,Wolf Y I,et al.Genome of the extremely radiation-resistant bacteriumDeinococcusradioduransviewed from the perspective of comparative genomics[J].Microbiology and Molecular Biology Reviews,2001,65(1):44.
[6] Tanaka S,Ikeda K,Miyasaka H.Isolation of a new member of group 3 late embryogenesis abundant protein gene from a halotolerant green alga by a functional expression screening with cyanobacterial cells[J].FEMS Microbiology Letters,2004,236(1):41-45.
[7] Browne J,Tunnacliffe A,Burnell A.Plant desiccation gene found in a nematode[J].Nature,2002,416(6876):38-38.
[8] Shih M D,Hoekstra F A,Hsing Y C.Late embryogenesis abundant proteins[J].Advances in Botanical Research,2008,48(2008):211-255.
[9] 白永琴,杨青川.LEA蛋白研究进展[J].生物技术通报,2009(9):1-7.
[10] Iii L D,Crouch M,Harada J,et al.Common amino acid sequence domains among the LEA proteins of higher plants[J].Plant Molecular Biology,1989,12(5):475-486.
[11] Dure L.A repeating 11-mer amino acid motif and plant desiccation[J].The Plant Journal :for Cell and Molecular Biology,1993,3(3):363-369.
[12] Bray E A.Molecular responses to water deficit[J].Plant Physiology,1994,103(4):1035-1040.
[13] 马其东.柠条锦鸡儿[N].中国花卉报,2003-05-20(007).
[14] 吴高升,赵书元,刘 忠.内蒙古柠条种类及利用的调查研究[J].中国草原,1986(1):34-40.
[15] 姜 超,刘 璋,刘根科.不同杀虫剂防除柠条豆象田间药效试验[J].北方农业学报,2016,44(2):60-62.
[16] 杨 杞,尹佳佳,王 颖,等.柠条锦鸡儿CkLEA1基因克隆及表达分析[J].中国生物工程杂志,2013,33(5):93-99.
[17] 张燕娜,于秀敏,杨 杞,等.柠条锦鸡儿CkLEA4基因克隆及表达分析[J].西北植物学报,2014,34(1):47-53.
[18] Wang X E,Chen X F,Liu Y,et al.CkDREBgene inCaraganakorshinskiiis involved in the regulation of stress response to multiple abiotic stresses as an AP2/EREBP transcription factor[J].Molecular Biology Reports,2011,38(4):2801-2811.
[19] 杨 杞,张 涛,王 颖,等.干旱胁迫下柠条锦鸡儿叶片SSH文库构建及CkWRKY1基因克隆[J].林业科学,2013,49(7):62-68.
[20] Tolleter D,Jaquinod M,Mangavel C,et al.Structure and function of a mitochondrial late embryogenesis abundant(LEA)protein are revealed by desiccation[J].2007,19(5):1580-1589.
[21] 王 赞,李 源,陆景伟,等.中国柠条锦鸡儿资源表型多样性研究[J].华北农学报,2008,23(S1):59-61.
[22] Battaglia M,Olvera-Carrillo Y,Garciarrubio A,et al.The enigmatic LEA proteins and other hydrophilins[J].Plant Physiology,2008,148(1):6-24.
[23] 赵晓鑫,刘美芹,师 静,等.沙冬青AmLEA5基因的生物信息学分析及非生物胁迫下的表达模式[J].植物遗传资源学报,2013,14(3):492-500.
[24] Baker J,Van Dennsteele C,Dure L.Sequence and characterization of 6 Lea proteins and their genes from cotton[J].Plant Molecular Biology,1988,11(3):277-291.
[25] Kosova K,Vitamvas P,Prasil I T.Expression of dehydrins in wheat and barley under different temperatures[J].Plant Science,2011,180(1,SI):46-52.
[26] Sharma A,Kumar D,Kumar S,et al.Ectopic expression of an atypical hydrophobic group 5 LEA protein from wild peanut,arachis diogoi confers abiotic stress tolerance in tobacco[J].PLoS One,2016,11(3):e0150609.
[27] Boucher V,Buitink J,Xiao D L,et al.MtPM25 is an atypical hydrophobic late embryogenesis-abundant protein that dissociates cold and desiccation-aggregated proteins[J].Plant,Cell & Environment,2010,33(3):418-430.
[28] Amara I,Capellades M,Ludevid M D,et al.Enhanced water stress tolerance of transgenic maize plants over-expressing LEA Rab28,gene[J].Journal of Plant Physiology,2013,170(9):864-873.
[29] Liu Y,Wang L,Jiang S S,et al.Group 5 LEA protein,ZmLEA5C,enhance tolerance to osmotic and low temperature stresses in transgenic tobacco and yeast[J].Plant Physiology and Biochemistry,2014,84:22-31.
[30] Mowla S B,Cuypers A,Driscoll S P,et al.Yeast complementation reveals a role for anArabidopsisthalianalate embryogenesis abundant(LEA)-like protein in oxidative stress tolerance[J].Plant Journal,2006,48(5):743-756.
[31] 刘 洋,邢 鑫,李德金.LEA蛋白的分类与功能研究进展[J].生物技术通报,2011(8):36-43.
[32] 刘露露,陈 雷,张春艳,等.两个小麦LEA基因的特征及其对非生物胁迫的响应[J].中国农业科学,2014,47(19):3736-3745.
[33] 张胜博,刘景辉,李立军,等.燕麦AsNAC1耐盐基因的克隆及初步验证[J].北方农业学报,2016,44(5):1-7.
[34] 孔莹莹.利用新型转基因载体消除植物转基因中的同源共抑制现象[D].杭州:浙江大学,2012.
[35] She W J,Lin W Q,Zhu Y B,et al.The gypsy insulator of drosophila melanogaster,together with its binding protein suppressor of hairy-wing,facilitate high and precise expression of transgenes inArabidopsisthaliana[J].Genetics,2010,185(4):1141-1150.
[36] Singer S D,Liu Z R,Cox K D.Minimizing the unpredictability of transgene expression in plants:the role of genetic insulators[J].Plant Cell Reports,2012,31(1):13-25.
Clone and Expression Analysis ofCkLEA4-1 fromCaraganakorshinskiiKom.
HUA Lubin,YU Xiumin,YANG Qi,WANG Ruigang,BAO Lide
(College of Life Sciences,Inner Mongolia Agricultural University,Huhhot 010018,China)
In order to research the biological function of the LEA protein,a gene encoding LEA protein from the suppression subtractive hybridization library ofCaraganakorshinskiiKom.was screened and cloned by using RT-PCR method.The open reading frame(ORF)of the gene length was 1 119 bp,encoded a protein of 373 amino acids,namedCkLEA4-1.Based on sequence alignment and phylogenetic analysis,it was inferred that CkLEA4-1 belonged to group 5 late embryogenesis abundant protein(LEA).The expression ofCkLEA4-1 under high salt and drought conditions were detected by Real-time quantitative PCR,the results showed thatCkLEA4-1 could be induced at different levels,which suggested that the gene might be involved in stress response ofCaraganakorshinskiiKom..The over-expression vector pCanG-CkLEA4-1 ofCkLEA4-1 was constructed successfully,and the transgenic homozygous lines were obtained,which provided materials for the further study ofCkLEA4-1 gene function inCaraganakorshinskiiKom..
CaraganakorshinskiiKom.;LEA;Gene cloning;Expression analysis
2016-10-14
国家自然科学基金项目(31560199;31360169);内蒙古自治区科技创新团队(201503004);内蒙古自治区草原英才团队
滑璐玢(1990-),女,山西阳高人,在读硕士,主要从事植物生物化学与分子生物学研究。
宝力德(1961-),男,内蒙古西乌珠穆沁人,副教授,博士,主要从事生物化学与分子生物学研究。
S793.3
A
1000-7091(2017)02-0096-08
10.7668/hbnxb.2017.02.015
