血清二胺氧化酶含量与大鼠急性脊髓损伤后肠道运动功能的关系①
2017-06-28杨森杨拯鄢靖欣徐洲徐文坚田海燕代小琳杨平
杨森,杨拯,鄢靖欣,徐洲,徐文坚,田海燕,代小琳,杨平
血清二胺氧化酶含量与大鼠急性脊髓损伤后肠道运动功能的关系①
杨森,杨拯,鄢靖欣,徐洲,徐文坚,田海燕,代小琳,杨平
目的测定急性脊髓损伤大鼠血清中二胺氧化酶(DAO)的含量,同时观察肠道运动功能的变化和肠黏膜屏障损伤的程度。方法45只Sprague-Dawley大鼠随机分为打击组(A组)、假手术组(B组)和对照组(C组),每组15只。采取改良Allen打击法(10 g×25 mm)损伤大鼠T10脊髓节段。术后1 d、3 d、7 d分别对各组大鼠进行后肢功能BBB评分,测定大鼠回肠肌电慢波及平滑肌收缩,并做回肠HE染色,ELISA试剂盒测定血清DAO含量。结果脊髓损伤后1 d、3 d和7 d,A组BBB评分显著低于C组(P<0.001),B组与C组无显著性差异(P>0.05)。脊髓损伤后1 d、3 d,A组慢波频率和振幅低于C组(P<0.05),收缩频率和振幅低于C组(P<0.05),B组与C组无显著性差异(P>0.05);脊髓损伤后7 d,三组肌电慢波频率和振幅、收缩的频率和振幅均无显著性差异(P>0.05)。A组回肠黏膜水肿、倒伏,炎性细胞浸润,黏膜下间隙增大。A组肠黏膜损伤Chiu评分高于B组和C组(P<0.05)。脊髓损伤后1 d、3 d,A组大鼠血清DAO含量高于C组(P<0.05),B组与C组无显著性差异(P>0.05);脊髓损伤后7 d,三组间血清DAO含量均无显著性差异(P>0.05)。结论血清DAO含量可以反映大鼠急性脊髓损伤后肠道的运动功能和黏膜损伤程度。
脊髓损伤;二胺氧化酶;肠道运动功能;黏膜损伤;大鼠
[本文著录格式]杨森,杨拯,鄢靖欣,等.血清二胺氧化酶含量与大鼠急性脊髓损伤后肠道运动功能的关系[J].中国康复理论与实践,2017,23(6):634-640.
CITED AS:Yang S,Yang Z,Yan JX,et al.Relationship between serum diamine oxidase content and intestinal motility after acute spinal cord injury[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(6):634-640.
临床上,脊髓损伤(spinal cord injury)后患者常出现胃肠功能障碍、大小便失禁、运动和感觉功能障碍、性功能障碍[1-3]。神经源性肠道功能障碍远比神经源性膀胱障碍和性功能障碍对患者身心健康和生活质量的影响严重,也是致残的常见原因之一[4-5]。脊髓损伤后动物实验研究表明,脊髓损伤后早期小鼠的肠道电活动减弱,收缩力降低,肠黏膜的损伤呈渐进性加重[6]。在临床上,患者脊髓损伤后肠道的损伤程度和运动情况如何,一直缺乏相对特异性的血清学分子检测指标。
二胺氧化酶(diamine oxidase,DAO)在小肠绒毛上皮细胞中含量丰富,主要作用为降解肠道中的组胺样物质和组胺,避免组胺引起的过敏样症状发生;外周血液中的DAO在肝脏被灭活[7]。文献报道,肠缺血、炎症、上皮受损都将导致血浆中DAO含量上升[8]。若小肠黏膜损伤严重,大量的DAO进入到外周血循环中[9]。DAO通过降解多胺,调节细胞有丝分裂和减数分裂,从而促进细胞的增殖[10-11]。血浆中DAO含量与急性肠系膜缺血和炎症性肠病造成的上皮损伤程度呈正相关,而且还可用于胃肠道其他疾病的评估。动物实验研究表明,DAO可以是一些抗癌药对肠黏膜损伤程度的血清分子标志物[12-14]。本实验中,我们探究血清中的DAO含量是否能成为监测大鼠急性脊髓损伤后神经源性肠道功能障碍的指标,为临床上患者脊髓损伤后,测定血清DAO含量,判断肠道运动功能和黏膜损伤程度提供动物实验依据。
1 材料与方法
1.1 材料
水合氯醛,批号20100920:成都市科龙化工试剂厂。氯化钠注射液,批号140914906:武汉滨州双鹤药业有限责任公司。葡萄糖注射液,批号1008296K:安徽双鹤药业有限责任公司。注射用青霉素钠,批号140403:太极集团西南药业股份有限公司。DAO试剂盒,批号201507:武汉基因美生物科技有限公司。HC-2518高速离心机:安徽中科中佳科学仪器有限公司。680酶标仪、洗板机:BIO-RAD,USA。BL-420F生物机能实验系统:成都泰盟有限公司。EclipseE200光学显微镜:尼康仪器有限公司。KD-T电脑生物组织摊烤片机:浙江省金华市科迪仪器设备有限公司。TC-120型智能程控生物组织自动脱水机:湖北孝感市泰维电子设备有限公司。RM2235切片机:LEICA公司。电子天平:赛多利斯科学仪器(北京)有限公司。HRDP-80AB电热恒温培养箱:青岛海尔特种电冰箱有限公司。
1.2 实验动物
健康成年Sprague-Dawley大鼠45只,体质量180~220 g,由四川省医学科学院四川省人民医院实验动物研究所提供,许可证号SCXK(川)2013-15。用亚甲基蓝和苦味酸将大鼠进行标记,亚甲基蓝表示十位,苦味酸表示个位,从大鼠左前爪开始标记,记为1,随后依次将左侧腹部、左后爪、颈部、腹部、尾部、右前爪、右侧腹部、右后爪、分别记为2、3、4、5、6、7、8、9。得到大鼠1~45的编号,在随机数字表中查询数字,采用随机数表法随机将大鼠分为打击组(A组)、假手术组(B组)和对照组(C组),每组15只。
1.3 方法
手术前观察大鼠运动功能正常后,3.5%水合氯醛350 mg/kg腹腔注射麻醉。仔细观察大鼠麻醉后呼吸频率、心跳节律、肌肉放松程度。大鼠完全麻醉后,俯卧位固定于鼠板上,去除背部胸椎部位的毛,碘伏消毒,铺上无菌洞巾。确定T10位置,以T10棘突为中心在大鼠背部正中做一长约1~2 cm的切口,暴露棘突和椎板。用手术刀紧靠棘突两边切开背部肌肉,去除T10椎骨上的肌肉,注意勿损伤椎旁血管。用有齿镊咬除T10棘突,无齿镊剥开锥板剔除椎旁软组织,暴露脊髓。用自制数字式脊髓损伤动物模型制备仪打击大鼠脊髓T10节段,打击强度为10 g×25 mm。打击后即见大鼠双后肢和躯体发生不同程度抽搐,鼠尾痉挛性摆动,随后完全松弛,脊髓打击部位血管明显充血。模型制备成功。打击完毕后逐层缝合切口,腹腔注射葡氯钠2 ml(葡萄糖注射液和氯化钠注射液1∶1)补液和青霉素钠1 ml(8×104U)预防感染。待大鼠清醒后放回饲养笼中单笼饲养。术后3 d内,每天早上定时腹腔注射葡氯钠与青霉素钠。饲养环境保持适宜的温度和湿度,定时清洁笼具,并保持大鼠身体干燥;每天挤压膀胱排尿3次,至大鼠恢复自主排尿。
A组施行以上的手术操作步骤,B组剥离椎板不打击,C组不切皮和剥离椎板,也不注射青霉素和葡氯钠。
1.4 评定方法
于造模术后1 d、3 d、7 d,随机取各组动物5只进行以下测试。
1.4.1 BBB评分
术后的1 d、3 d和7 d分别对各组大鼠进行BBB评分。采用盲法观察其后肢运动情况,联合考察大鼠后肢各关节活动、后肢的步态和协调功能。取左右两侧肢体评分平均值,作为最后得分。
1.4.2 肠平滑肌肌电慢波活动
3.5 %水合氯醛350 mg/kg腹腔注射麻醉大鼠后开腹,在距回盲瓣2 cm回肠处肠壁肌层平行插入一对银丝电极,两电极相距约5 mm,参考电极夹于皮下,石蜡绝缘纱布覆盖腹腔;另一端经生物电放大器引入到BL-420F生物机能实验系统。待电活动稳定10 min后开始记录。扫描速度1.00 s/div,电增益500 mV,时间常数3 s,高频滤波20 Hz。连续记录30 min。对每只大鼠慢波数据样本剪接基线平稳的波形,随机截取10个时间段以上,对所比较分析的波形取相同的下限,计算每只大鼠慢波的频率和振幅的均值。
1.4.3 平滑肌收缩
在回盲部以上剪取回肠2 cm,轻微清除大部分肠内容物后,固定于装有37℃台式液的恒温平滑肌槽内,另一端连接张力换能器,打开BL-420F生物机能实验系统测定回肠平滑肌收缩活动,待波形出现类似正弦波后开始记录,扫描速度1.00 s/div,电增益1000 mV,时间常数10 s,高频滤波20 Hz。
1.4.4 肠组织HE染色
3.5 %水合氯醛350 mg/kg腹腔注射麻醉大鼠后,迅速打开大鼠腹腔取回盲瓣上2 cm处回肠组织1~2 cm,用生理盐水轻柔冲洗肠内容物,无菌滤纸吸干表面水分。放置于4%多聚甲醛于4℃冰箱中固定18 h以上。石蜡包埋,切片,梯度酒精水化,HE染色,脱水,中性树脂封片。待树脂干片后,光镜下观察组织形态学改变,采用盲法根据肠黏膜损伤Chiu评分标准进行评定。
1.4.5 血清DAO含量
大鼠3.5%水合氯醛350 mg/kg腹腔注射麻醉,立即开腹,腹主动脉取全血,37℃恒温培养箱中静置30 min,3500 r/min离心10 min,取上清液置于-20℃保存。待用时取出置于室温下30 min,ELISA试剂盒测定,具体操作步骤按照说明书进行。
1.5 统计学分析
采用SPSS 17.0软件处理数据。实验结果均用(xˉ±s)表示,各组间均数比较采用单因素方差分析(One-wayANOVA)和SNK检验。显著性水平α=0.05。
2 结果
2.1 一般情况
术后1 d,A组大鼠静卧少动,双后肢运动无力,肌张力下降几乎为零,无明显进食和饮水活动;不能进行自主排尿,经人工按摩膀胱辅助排尿后,部分大鼠出现严重血尿。B组大鼠运动功能稍差。C组大鼠运动功能,饮食和饮水均正常。
术后3 d,A组大鼠正常进食和饮水,双后肢的运动功能有所恢复,肌张力有所升高;绝大多数大鼠能自主排尿;部分大鼠血尿轻微且仍未恢复自主排尿功能,其余大鼠尿液均正常。B、C组大鼠活动良好,排尿排便正常,状态佳。
术后7 d,A组大鼠伤口痊愈,未见感染、化脓;双后肢运动未完全恢复;所有大鼠均可自主排尿。B、C组大鼠活动良好,排尿排便正常,状态佳。
2.2 BBB评分
A组BBB评分显著低于C组(P<0.001)。B组和C组BBB评分无显著性差异(P>0.05)。见表1。
2.3 肠平滑肌肌电慢波活动
大鼠急性脊髓损伤后1 d和3 d,A组与C组相比,肠道的肌电慢波频率显著降低(P<0.001),慢波振幅降低(P<0.05)。B组和C组肌电慢波频率和振幅无显著性差异(P>0.05)。损伤后7 d,三组肌电慢波的频率和振幅均无显著性差异(P>0.05)。见图1、表2。
2.4 肠收缩力活动
大鼠急性脊髓损伤后1 d、3 d,A组与C组相比,肠道收缩振幅和频率降低(P<0.05)。B组和C组相比,肠道收缩力的振幅和频率无显著性差异(P>0.05)。脊髓损伤后7 d,三组肠道收缩力的振幅和频率均无显著性差异(P>0.05)。见图2、表3。
2.5 肠组织HE染色及黏膜评分
大鼠急性脊髓损伤后1 d,A组的肠黏膜充血、水肿,毛细血管破裂出血,黏膜下间隙增宽,有的甚至延伸至基底部,上皮细胞脱落,大量的中性粒细胞浸润,派氏淋巴结增生和出血。
脊髓损伤后1 d、3 d,A组肠黏膜损伤Chiu评分高于B组和C组(P<0.05)。7 d后A组的肠黏膜损伤程度减轻,黏膜下的间隙变窄,出血减少,水肿减轻。见表4、图3。
2.6 血清DAO含量
大鼠急性脊髓损伤后1 d、3 d,与C组相比,A组大鼠血清DAO含量升高(P<0.01)。B组与C组相比,血清DAO含量无显著性差异(P>0.05)。大鼠急性脊髓损伤后7 d,三组间血清DAO含量均无显著性差异(P>0.05)。见表5。
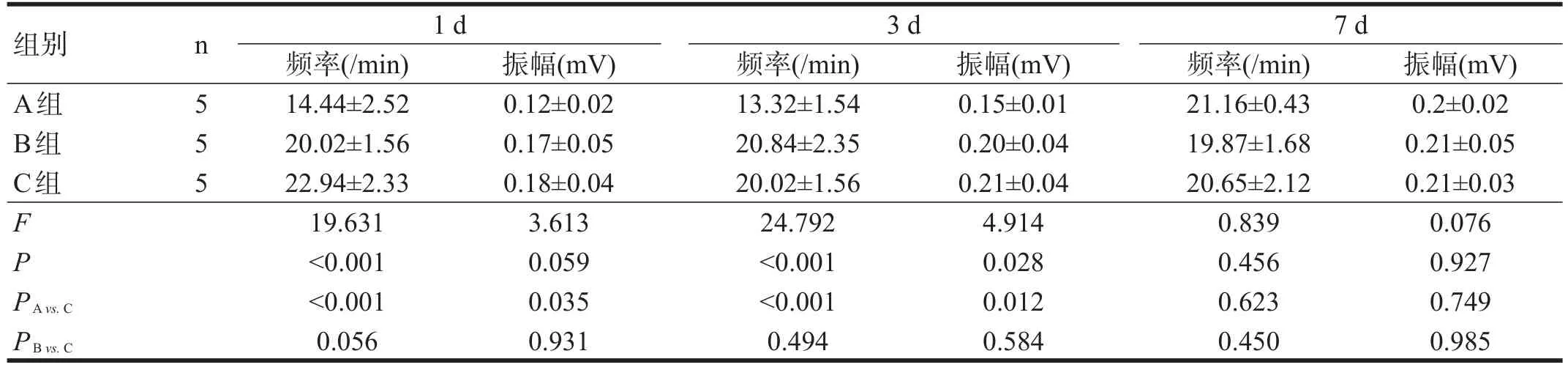
表2 各组急性脊髓损伤后回肠肌电慢波比较
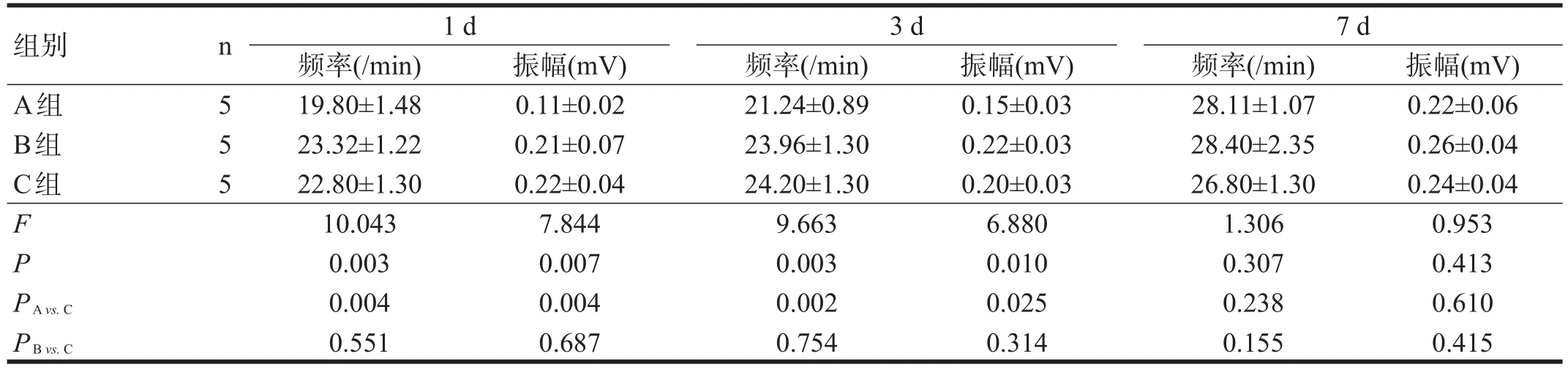
表3 各组急性脊髓损伤后平滑肌收缩比较

表4 各组肠黏膜损伤Chiu评分比较

表5 各组血清DAO的含量比较(pg/ml)
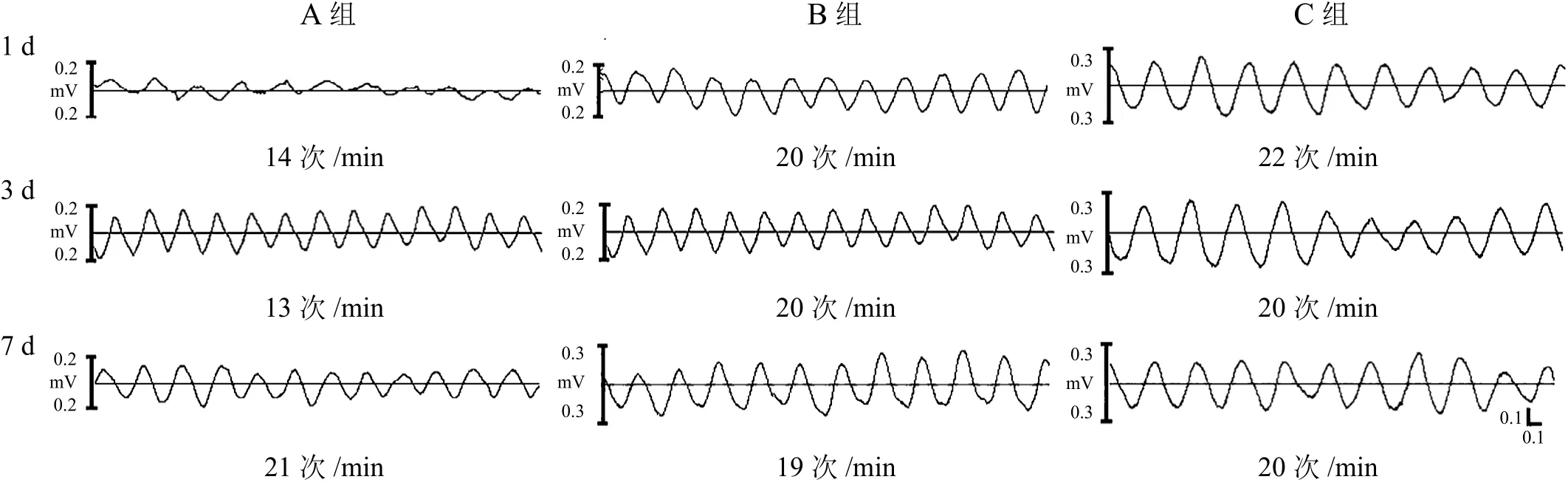
图1 大鼠急性脊髓损伤后肠道肌电慢波变化

图2 大鼠急性脊髓损伤后肠道平滑肌收缩力的变化
3 讨论
脊髓损伤是骨科常见的一种严重性损伤,可导致患者肢体运动和感觉功能部分或全部丧失,排便功能障碍,出现便秘、腹胀、大便失禁、排便耗时延长、精神压力增加等一系列问题,不仅严重影响患者自身生活质量,也给家庭和社会带来沉重的负担[15-16]。近年来临床上关于急性脊髓损伤后的神经源性肠道障碍(neurogenic bowel dysfuncation)报道越来越多[17-19],临床医师对于脊髓损伤后的康复治疗和管理体系也越来越全面和细致[20-21],同样也受到基础科研人员的重视。脊髓损伤后,为了医生的精确诊断和提高患者的生活质量,美国脊髓损伤协会制定了标准的国际指南[22]。脊髓损伤后最先出现的就是自主神经系统的紊乱[23],然而在临床上一直缺乏监测急性脊髓损伤后肠道运动功能和肠黏膜损伤程度相对特异性的血清学指标。
DAO在肠黏膜上皮细胞中含量丰富,它调控细胞的有丝分裂和减数分裂,调节肠上皮细胞内组胺样物质的氧化转氨基作用,灭活组胺,减轻肠道的过敏反应和胃酸的分泌,其在血液中的含量或活性能够反映肠道机械屏障的完整性和黏膜受损伤程度。有文献报道[12-14],血清DAO含量可以监测抗癌药对肠黏膜损伤程度。生理状态下循环血液中的DAO被肝脏灭活。Luk等[24]研究发现,血清DAO活性与动物小肠黏膜DAO含量有相关性;另有研究表明,血浆DAO含量与急性肠缺血、炎症性肠病和肠系膜缺血造成上皮损伤呈正相关[25-28]。本研究发现,大鼠急性脊髓损伤后1 d和3 d,血清DAO含量明显升高;脊髓损伤后7 d,血清DAO含量降至正常水平。

图3 急性脊髓损伤后肠组织HE染色结果(200×)
肠肌电慢波是激发肠道蠕动的自发电流,可分为慢波和动作电位两种[29]。有研究显示,不完全性肠梗阻和小鼠早期脊髓损伤后,肠道的慢波振幅和频率降低[30]。肠道的动作电位易受到肠壁顺应性、胃肠激素和肠道自主神经系统影响,所以本实验只记录肠道起搏细胞(intestinal cajal cell,ICC)产生的慢波活动。文献报道[6],肠黏膜受损后肠道的肌电活动减弱,脊髓损伤后早期肠黏膜损伤程度呈渐进性加重。本研究发现,在脊髓损伤的早期,肠道慢波电位的振幅和频率显著降低,血清DAO的含量也降低;而在后期,慢波电位的频率和幅度恢复,血清DAO的含量正常。提示在急性脊髓损伤后早期,血清DAO含量与肠肌电慢波活动相关,血清DAO可以反映脊髓损伤后早期肠道的肌电慢波活动。
肠平滑肌收缩力能很好地反映肠道的运动功能。有研究指出[31-32],位于肠肌丛及其环形肌黏膜下边缘的ICC是胃肠慢波活动的起搏器和传导者,对胃肠道的动力起着重要的作用;在某些病理生理情况下,ICC网络或细胞数量的缺失和减少是导致胃肠动力紊乱的原因。脊髓损伤后大鼠肠道的ICC数量降低。因而脊髓损伤大鼠肠收缩力可以反应出大鼠肠道运动的状况。本研究发现,在大鼠急性脊髓损伤后1 d和3 d,肠道的收缩力降低,并且肠平滑肌收缩功能障碍和急性脊髓损伤后肠黏膜损伤程度相关;脊髓损伤后7 d血清DAO含量与肠道收缩均恢复正常。提示急性脊髓损伤后早期血清DAO含量与肠道收缩力相关。
肠组织HE染色显示,脊髓损伤早期肠黏膜上皮脱落,绒毛变钝,炎性粒细胞浸润,黏膜下基底出现间隙。肠黏膜损伤Chiu评分升高;而后期黏膜损伤恢复。
综上所述,急性脊髓损伤后早期,大鼠的运动功能丧失,后肢瘫痪,肠肌电慢波、收缩力均降低,肠黏膜的损伤程度严重,血清DAO含量升高。而在后期,大鼠的后肢运动功能有所恢复,肠的蠕动功能和电生理活动均有所加强,血清DAO含量降低。血清DAO含量可以反映大鼠急性脊髓损伤后肠道运动功能和肠黏膜的损伤程度。
[1]刘金辉,易满.肠道功能训练用于脊髓损伤患者的临床效果评价[J].世界最新医学信息文摘,2015,15(101):102-104.
[2]崔勇,段佩琰,刘劲松.肠道训练联合饮食指导对脊髓损伤患者肠道康复效果的影响[J].中国现代药物应用,2016,10(1): 212-213.
[3]陈红霞.脊髓损伤患者肠道功能重建[J].吉林医学,2013,34 (17):3460-3461.
[4]朱黎婷,朱毅,张文毅,等.中医药在脊髓损伤神经源性肠道功能障碍的研究进展[J].世界华人消化杂志,2012,20(35): 3549-3557.
[5]徐青,高飞,王磊,等.脊髓损伤后肠道功能障碍:美国临床实践指南解读[J].中国康复理论与实践,2010,16(1):83-86.
[6]梁羽,李灿,罗兰,等.脊髓损伤后早期小鼠肠道功能的变化[J].中国康复理论与实践,2015,21(2):148-152.
[7]D'Agostino L,Ciacci C,Capuano G,et al.Metabolic fate of plasma diamine oxidase:evidence of isolated and perfused rat liver uptake[J].Digestion,1986,34(4):243-250.
[8]Cakmaz R,Büyükaşık O,Kahramansoy N,et al.A combination of plasma DAO and citrulline levels as a potential marker for acute mesenteric ischemia[J].Libyan J Med,2013,8:1-6.
[9]Luk GD,Bayless TM,Baylin SB.Diamine oxidase(histaminase).A circulating marker for rat mucosal maturation and integrity[J].J Clin Invest,1980,66(1):66-70.
[10]Kusche J,Lorenz W,Schmidt J.Oxidative deamination of biogenic amines by intestinal amine oxidases:histamine is specially inactivated by diamine oxidase[J].Physiol Chem,1975,356 (10):1485-1486.
[11]Baylin SB,Stevens SA,Shakir KM.Association of diamine oxidase and ornithine with maturing cells in rapidly proliferating epithelium[J].Biochim Biophys Acta,1978,541(3): 415-419.
[12]Fukudome I,Kobayashi M,Dabanaka K,et al.Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5-fluorouracil treatment in rats[J].Med Mol Morphol, 2014,47(2):100-107.
[13]Moriyama K,Kouchi Y,Morinaga H,et al.Diamine oxidase, a plasma biomarker in rats to GI tract toxicity of oral fluorouracil anti-cancer drugs[J].Toxicology,2006,217(2-3):233-239.
[14]Miyoshi J,Miyamoto H,Goji T,et al.Serum diamine oxidase activity as a predictor of gastrointestinal toxicity and malnutrition due to anticancer drugs[J].J Gastroenterol Hepatol,2015, 30(11):1582-1590.
[15]林丽芳.不完全性脊髓损伤患者肠道功能评估与重建[J].当代护士,2014(6):50-51.
[16]胡菊华.电话追踪访视普外科病人存在的问题与对策[J].南方护理学报,2005,12(3):90-91.
[17]刘浩,白春宏.脊髓损伤病人肠道管理[J].创伤外科杂志, 2014,16(1):79-81.
[18]冯桂莲,李佩霞.脊髓损伤患者肠道康复护理浅识[J].实用中医药杂志,2010,26(5):342-343.
[19]李静.脊髓损伤患者神经源性肠道阶段化整体管理模式的建立及效果评价[J].中国当代医药,2012,19(4):5-9.
[20]叶水林,黄怀,沈彤,等.早期康复介入对脊髓损伤患者膀胱肠道功能的影响[J].长春中医药大学学报,2014,30(4): 690-692.
[21]李轲.25例脊髓损伤患者的肠道功能训练分析[J].中国现代医生,2015,53(17):85-91.
[22]Krassioukov A,Biering-Sorensen CF,Donovan W,et al.International Standards to Document Remaining Autonomic Function after Spinal Cord Injury(ISAFSCI),first edition 2012[J]. Top Spinal Cord Inj Rehabil,2012,18(3):282-296.
[23]Hou S,Rabchevsky AG.Autonomic consequences of spinal cord injury[J].Compr Physiol,2014,4(4):1419-1453.
[24]Luk GD,Bayless TM,Baylin SB.Plasma postheparin diamine oxidase.Sensitive provocative test for quantitating length of acute intestinal mucosal injury in the rat[J].J Clin Invest,1983,71(5):1308-1315.
[25]Honzawa Y,Nakase H,Matsuura M,et al.Clinical significance of serum diamine oxidase activity in inflammatory bowel disease:importance of evaluation of small intestinal permeability[J].Inflamm Bowel Dis,2011,17(2):23-25.
[26]Hilsden RJ,Meddings JB,Hardin J,et al.Intestinal permeability and postheparin plasma diamine oxidase activity in the prediction of Crohn's disease relapse[J].Inflamm Bowel Dis, 1999,5(2):85-91.
[27]Cai C,Li W,Chen J,et al.Diamine oxidase as a marker for diagnosis of superior mesenteric arterial occlusion[J].Hepatogastroenterology,2012,59(113):155-158.
[28]Karabulut KU,Narci H,Gul M,et al.Diamine oxidase in diagnosis of acute mesenteric ischemia[J].Am J Emerg Med, 2013,31(2):309-312.
[29]Seidl H,Gundling F,Pehl C,et al.Multiple intraluminal impedance measurement and manometry in the jejunum of healthy subjects:a new tool for diagnosis of small bowel motility[J].Digestion,2010,81(3):172-180.
[30]Chang IY,Glasgow NJ,Takayama I,et al.Loss of interstitial cells of Cajal and development of electrical dysfunction in murine small bowelobstruction[J].J Physiol,2001,536(2): 555-568.
[31]Lee JC,Thuneberg L,Berezin I,et al.Generation of slow waves in membrane potential is an intrinsic property of interstitial cell of Cajal[J].Am J Physiol,1999,40(2):409-423.
[32]Ordög T,Ward SM,Sanders KM.Interstitial cells of cajal generate electrical slow waves in the murine stomach[J].J Physiol,1999,518(Pt 1):257-269.
Relationship between Serum Diamine Oxidase Content and Intestinal Motility afterAcute Spinal Cord Injury
YANG Sen,YANG Zheng,YAN Jing-xin,XU Zhou,XU Wen-jian,TIAN Hai-yan,DAI Xiao-lin,YANG Ping
School of Basic Medical Sciences,Chengdu Medical College,Chengdu,Sichuan 610500,China
YANG Ping.E-mail:920192655@qq.com
Objective To measure the level of diamine oxidase(DAO),and observe the intestinal motor and mucosal barrier injury after acute spinal cord injury(SCI)in rats.Methods A total of 45 Sprague-Dawley rats were randomly divided into SCI group(group A,n=15), sham group(group B,n=15)and control group(group C,n=15).SCI model was established with Allen's strike mode(10 g×25 mm)by striking T10spinal segment in rats.One day,three days and seven days after SCI,hind limb motor function was assessed with Basso-Beattie-Bresnahan(BBB)Scale in each group,the myoelectric slow wave and ileum smooth muscle contractility were measured in rats,ileum tissues were tested with HE staining,and the DAO content of serum was tested with ELISA kit.Results One day,three days and seven days after SCI,the BBB score was significantly lower in group A than in groups B and C(P<0.001).One day,three days after SCI,the frequency and amplitude of both slow wave and contractility were lower in group A than in groups B and C(P<0.05);seven days after SCI,there was no significant difference among three groups(P>0.05).Group A showed ileal mucosal edema,lodging,inflammatory cell infiltration,and submucosal gap increase.The Chiu's score of intestinal mucosal injury was higher in group A than in groups B and C(P<0.05),as well as the serum DAO content one day and three days after SCI(P<0.05),and no significant difference was found in the serum DAO content among three groups seven days after SCI(P>0.05).Conclusion Serum DAO content may respond to the intestinal motor function and mucosal injury after acute SCI in rats.
spinal cord injury;diamine oxidase;intestinal motor function;mucosal injury;rats
R651.2
A
1006-9771(2017)06-0634-07
2016-10-19
2016-12-04)
10.3969/j.issn.1006-9771.2017.06.003
1.四川省教育厅科研计划重点项目(No.16ZA0296);2.成都医学院大学生创新实验计划项目(No.CXJS201309);3.四川省科技厅应用基础研究项目(No.2015JY0205);4.四川省卫生和计划生育委员会普及应用项目(No.17PJ591)。
成都医学院,四川成都市610500。作者简介:杨森(1993-),男,汉族,四川绵阳市人,主要研究方向:脊髓损伤后肠道动力障碍机制。通讯作者:杨平(1977-),男,辽宁盘锦市人,博士,副教授,主要研究方向:基础医学。E-mail:920192655@qq.com。
