超声联合微泡对不同凝龄富血小板血栓和富红细胞血栓的溶栓效果
2017-06-28王世飞景远文李海瑞黄驰雄卢永康宾建平
王世飞,景远文,李海瑞,黄驰雄,卢永康,宾建平*
(1.南方医科大学南方医院心内科,广东 广州 510515;2.深圳市孙逸仙心血管医院,广东 深圳 518112)
超声联合微泡对不同凝龄富血小板血栓和富红细胞血栓的溶栓效果
王世飞1,景远文1,李海瑞1,黄驰雄1,卢永康2,宾建平1*
(1.南方医科大学南方医院心内科,广东 广州 510515;2.深圳市孙逸仙心血管医院,广东 深圳 518112)
目的 探讨超声联合微泡对不同凝龄富血小板血栓(PRT)和富红细胞血栓(ERT)的溶栓效果。方法 分别于体外和大鼠体内颈总动脉制备不同凝龄的PRT和ERT。离体及在体实验均分为4组,即离体PRT 3 h组、离体PRT 24 h组、离体ERT 3 h组、离体ERT 24 h组及在体PRT 3 h组、在体PRT 24 h组、在体ERT 3 h组、在体ERT 24 h组;分别于体外循环装置和大鼠颈总动脉血栓模型中进行超声联合微泡溶栓实验,并采集超声图像。行病理组织学检查以验证血栓成分。离体实验主要分析溶栓后管腔横截面积增加百分比及溶栓率,在体实验主要分析溶栓后血管再通率及颈总动脉血流速度。结果 溶栓治疗后,离体及在体实验显示:PRT 3 h组与ERT 3 h组管腔横截面积增加百分比[(121.12±13.21)% vs (130.09±15.34)%]、溶栓率[(39.83±7.09)% vs (42.14±5.17)%]、血管再通率(83.33% vs 91.67%)及颈总动脉血流速度[(0.21±0.02)m/s vs (0.22±0.01)m/s]差异均无统计学意义(P均>0.05)。PRT 24 h组与ERT 24 h组比较、PRT 24 h组与PRT 3 h组比较、ERT 24 h组与ERT 3 h组比较,管腔横截面积增加百分比、溶栓率、血管再通率、颈总动脉血流速度均下降(P均<0.05)。与ERT 24 h组比较,PRT 24 h组管腔横截面积增加百分比、溶栓率、血管再通率及颈总动脉血流速度均下降(P均<0.05)。结论 超声联合微泡对溶解离体及在体大鼠颈总动脉PRT和ERT的效果随血栓凝龄的增加而下降,且以PRT为著。
血栓凝龄;超声检查;微泡;血小板;红细胞;溶栓
研究[1-6]证实,超声联合微泡可有效溶解体外血栓及冠状动脉、大脑中动脉、下肢静脉等大血管血栓,其主要机制为超声的空化效应。但各研究中血栓形成时间相对较均一,主要在3~6 h以内[1-6],而临床多数患者血栓形成的时间差异较大,从数小时至数十小时不等。本课题组前期研究[7]表明超声联合微泡可有效溶解富血小板血栓(platelet-rich thrombus, PRT)和富红细胞血栓 (erythrocyte-rich thrombus, ERT),改善大鼠急性缺血性脑卒中模型的预后。本实验拟分别在体外循环装置和大鼠颈总动脉血栓模型中探讨超声联合微泡对不同凝龄PRT和ERT的溶栓效果,以期为超声联合微泡溶栓治疗时间窗的选择提供有价值的参考依据。
1 材料与方法
1.1实验材料 SPF级雄性Sprague Dawley(SD)大鼠66只(购于南方医科大学实验动物中心),体质量250~300 g。脂质微泡由南方医科大学药学院提供,平均粒径(2.03±1.18)μm,浓度约2.0×109/ml~4.3×109/ml。本实验经动物实验伦理委员会审批。
1.2血栓体外实验
1.2.1PRT的制备 将5只SD大鼠以3%戊巴比妥钠溶液腹腔注射麻醉,抽取主动脉血,加入4%柠檬酸钠溶液抗凝,1300 rpm离心10 min,分别吸取上层富血小板血浆及下层红细胞悬液混合,加入凝血酶促凝。夹闭橡皮管下端,经上端加入已混匀促凝剂的富血小板血浆。共制备14个血栓样本。血栓制备后于4℃分别放置3 h(离体PRT 3 h组,7个样本)和24 h(离体PRT 24 h组,7个样本),使血栓充分凝固、收缩。
1.2.2ERT的制备 将5只SD大鼠以3%戊巴比妥钠溶液腹腔注射麻醉,抽取主动脉血。夹闭橡皮管下端,经上端加入主动脉血。共制备14个血栓样本。血栓制备后于4℃分别放置3 h(离体ERT 3 h组,7个样本)和24 h(离体ERT 24 h组,7个样本),使血栓充分凝固、收缩。
1.2.3离体血栓组织学检查 体外血栓制备后,以10%中性甲醛固定,常规石蜡包埋切片,HE染色,进行光学显微镜下观察。以戊二醛固定,进行电子显微镜下观察。在离体PRT 3 h组、离体PRT 24 h组、离体ERT 3 h组和离体ERT 24 h组中,每组随机抽取2个样本进行组织学检查。
1.2.4体外循环装置溶栓实验 安装体外循环溶栓装置(图1)。以恒流泵维持装置内PBS溶液流速为20 cm/s,并以水浴锅维持温度为37℃。以微量输液泵经侧孔注入脂质微泡,持续30 min。超声辐照采用Siemens Sequoia 512超声仪,4V1C型探头,频率2 MHz,机械指数1.9,间歇辐照模式(辐照10 s,间歇10 s),持续30 min。在离体PRT 3 h组、离体PRT 24 h组、离体ERT 3 h组和离体ERT 24 h组中,每组5个样本进行超声联合微泡溶栓实验。

图1 体外溶栓装置示意图
1.2.5体外血栓超声检查 采用Siemens Sequoia 512超声仪,15L8探头,频率2 MHz,分别于溶栓前及溶栓后即刻采集各组离体血栓的二维超声图像,测量溶栓前后的管腔横截面,计算管腔横截面增加百分比,管腔横截面增加百分比=(溶栓后管腔横截面面积-溶栓前管腔横截面面积)/溶栓前管腔横截面面积×100%。
1.2.6溶栓率 对各组离体血栓均于溶栓前及溶栓后即刻分别以电子天平测量其平均湿重,计算溶栓率。溶栓率=(溶栓前质量-溶栓后质量)/溶栓前质量×100%。
1.3SD大鼠颈总动脉血栓在体实验
1.3.1建立PRT模型 将28只SD大鼠以3%戊巴比妥钠溶液腹腔注射麻醉,逐层钝性分离颈总动脉。将浸泡有10%三氯化铁溶液的滤纸片置于颈总动脉下方,约10 min后撤去滤纸,即可形成PRT[8],从而建立大鼠颈总动脉PRT模型。建模后3 h和24 h者即为在体PRT 3 h组(n=14)和在体PRT 24 h组 (n=14)。
1.3.2建立ERT模型 将28只SD大鼠以3%戊巴比妥钠溶液腹腔注射麻醉,逐层钝性分离颈总动脉。短暂夹闭颈总动脉近端及远端(间隔约0.5 cm),向夹闭的颈总动脉内注射少量凝血酶,约2 min后松开夹闭动脉,即可形成ERT[9],从而建立大鼠颈总动脉PRT模型。建模后3 h和24 h者即为在体ERT 3 h组(n=14)和在体ERT 24 h组(n=14)。
1.3.3在体血栓组织学检查 于在体PRT 3 h组、在体PRT 24 h组、在体ERT 3 h组和在体ERT 24 h组中,每组随机抽取2只进行组织学检查。取大鼠颈总动脉行冰冻切片,经预冷丙酮溶液固定后常规行HE染色及免疫组化染色(标记血小板GP Ⅱb/Ⅲa),以判断小鼠颈总动脉动脉内是否形成相应的血栓。
1.3.4在体血栓模型溶栓实验 对在体PRT 3 h组、在体PRT 24 h组、在体ERT 3 h组和在体ERT 24 h组各12只颈总动脉血栓SD大鼠模型,均以微量输液泵经尾静脉注入0.2 ml脂质微泡,在25 min分钟内输注完毕。采用Siemens Sequoia 512超声仪进行超声辐照,4V1C型探头,频率2 MHz,机械指数1.9,间歇辐照模式(辐照10 s,间歇10 s),持续30 min。
1.3.5在体血栓超声图像采集 采用Siemens Sequoia 512超声仪,15L8探头,频率2 MHz。分别于超声联合微泡溶栓治疗前及治疗后即刻采集颈总动脉二维超声图像及脉冲多普勒图像,观察溶栓后大鼠颈总动脉血流情况,可探及血流则认为血管再通,并测量血流速度。计算在体血栓各组的再通率,再通率=颈总动脉再通大鼠数量/总数量×100%。
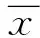
2 结果
2.1体外实验
2.1.1体外血栓组织学检查 离体PRT 3 h组及离体PRT 24 h组血栓均可见血小板小梁结构,并见散在红细胞;离体ERT 3 h组及离体ERT 24 h组血栓均可见大量红细胞,并见散在纤维蛋白网格。随着血栓凝龄增加,PRT和ERT均凝固、收缩,组织学表现为红细胞间隙变小,纤维蛋白网更加致密(图2)。
2.1.2离体血栓超声表现 声像图显示溶栓后离体血栓各组管腔横截面均较溶栓前增大(图3)。离体PRT 24 h组与离体PRT 3 h组 [(58.43±12.28)% vs (121.12±13.21)%]比较、离体ERT 24 h组与离体ERT 3 h组 [(95.35±16.47)% vs (130.09±15.34)%]比较,溶栓后管腔横截面增加百分比均下降,差异均有统计学意义(P均<0.05)。离体PRT 24 h组与离体ERT 24 h组比较,溶栓后管腔横截面增加百分比减小,差异有统计学意义(P<0.05)。离体PRT 3 h组与离体ERT 3 h组溶栓后管腔横截面增加百分比差异无统计学意义(P>0.05)。
2.1.3溶栓率 离体PRT 24 h组与离体PRT 3 h组[(20.04±8.19)% vs (39.83±7.09)%]比较、离体ERT 24 h组与离体ERT 3 h组[(35.21±5.26)% vs (42.14±5.17)%]比较,溶栓率均出现下降,差异有统计学意义(P均<0.05)。离体PRT 24 h组与离体ERT 24 h组比较,溶栓率降低,差异有统计学意义 (P<0.05)。离体PRT 3 h组与离体ERT 3 h组溶栓率差异无统计学意义(P>0.05)。
2.2在体实验
2.2.1在体血栓组织学检查 在体PRT 3 h组及在体PRT 24 h组颈总动脉管腔中均见大量血小板小梁形成的交差网状结构;在体ERT 3 h组及在体ERT 24 h组均可见大量红细胞,而血小板含量较少。见图4。
2.2.2在体血栓超声表现 声像图显示在体血栓各组SD大鼠溶栓前颈总动脉内均可见血栓形成(图5)。溶栓后在体PRT 3 h组、在体ERT 3 h组、在体PRT 24 h组和在体ERT 24 h组颈总动脉再通率分别为83.33%(10/12)、91.67%(11/12)、41.67%(5/12)和66.67%(8/12);各组血栓成功再通模型中颈总动脉血流速度分别为(0.21±0.02)m/s、(0.22±0.01)m/s、(0.13±0.02)m/s和(0.16±0.01)m/s。溶栓后在体PRT 3 h组与在体ERT 3 h组血管再通率及血流速度差异无统计学意义(P均>0.05)。在体PRT 24 h组与在体PRT 3 h组比较、在体ERT 24 h组与在体ERT 3 h组比较,血管再通率及血流速度均下降,差异有统计学意义(P均<0.05)。与在体ERT 24 h组比较,在体PRT 24 h组血管再通率及血流速度均降低,差异有统计学意义(P均<0.05)。
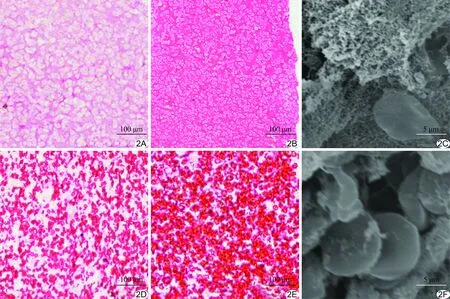
图2 体外血栓组织学检查 A~C.光学显微镜下离体PRT 3 h(HE,×100)、24 h(HE,×100)及电子显微镜下离体PRT 24 h(×3 000)可见血小板小梁结构及散在红细胞,随血栓凝龄增加PRT更加致密化; D~F.光学显微镜下离体ERT 3 h(HE,×100)、24 h(HE,×100)及电子显微镜下离体ERT 24 h(×3 000)可见大量红细胞及散在的纤维蛋白网,随血栓凝龄增加ERT更加致密化
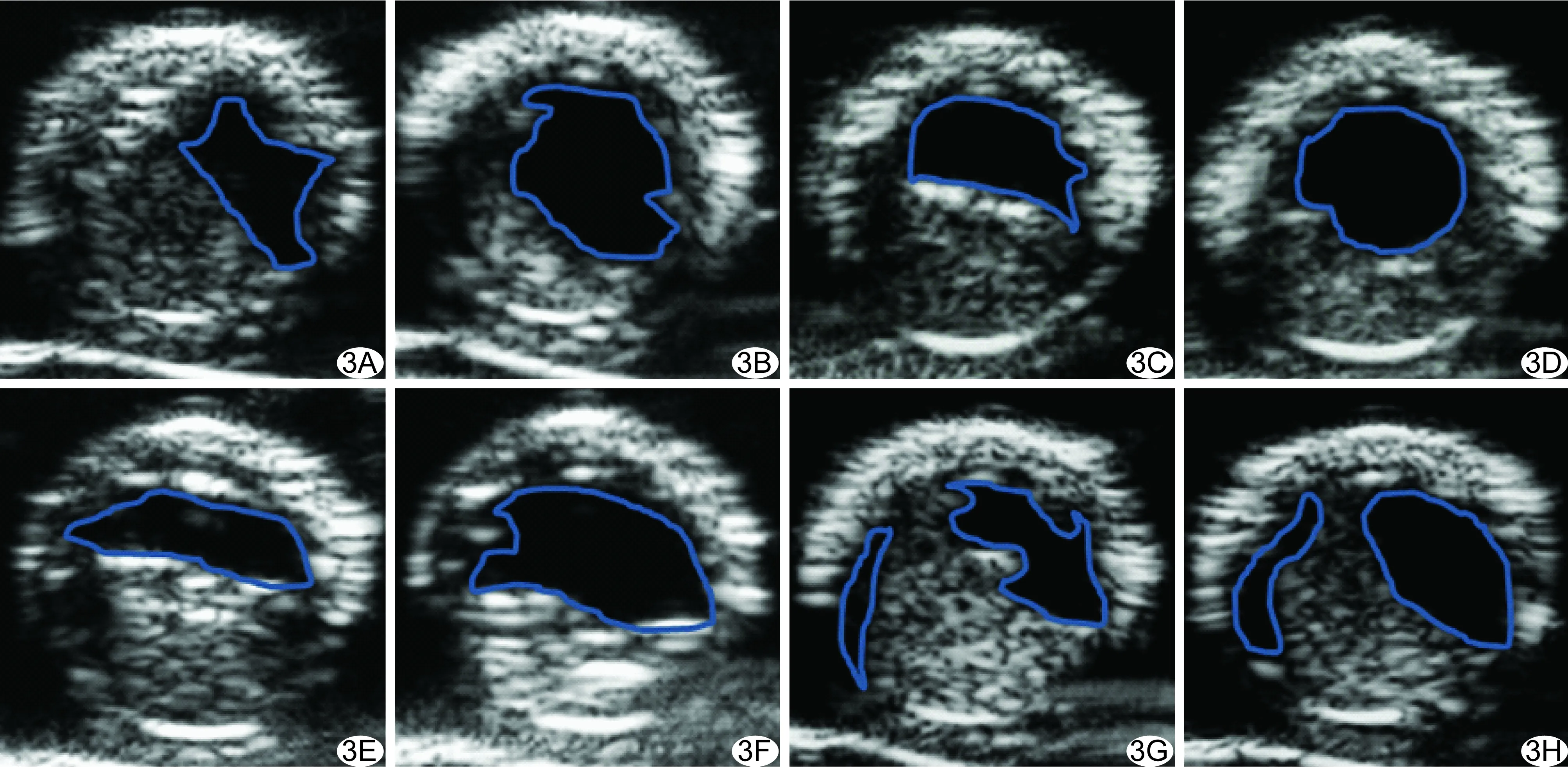
图3 PRT及ERT超声联合微泡治疗前后管腔横截面二维超声图像 A、B.PRT治疗前和治疗后3 h; C、D.PRT治疗前和治疗后24 h; E、F.ERT治疗前和治疗后3 h; G、H.ERT治疗前和治疗后24 h
3 讨论
本研究主要在体外模型和大鼠体内颈总动脉血栓模型中探讨超声联合微泡对不同凝龄PRT和ERT的溶栓效果,结果表明超声联合微泡能够明显溶解PRT及ERT,其溶栓效果随血栓凝龄的增加而下降,超声联合微泡溶解新鲜PRT及ERT效果相似,而随着血栓凝龄的增加,其对2种血栓的溶栓效果均下降,其中以PRT更明显。
图4 在体大鼠颈总动脉血栓模型组织学检查 A、B.HE染色(A)光学显微镜下(×100)PRT 24 h组可见大量血小板小梁形成交差网状结构,免疫组化染色(B)显示血小板含量较高; C、D.HE染色(C)光学显微镜下(×100)ERT 24 h组可见大量红细胞,免疫组化染色(D)显示大量红细胞,血小板含量少

图5 在体大鼠颈总动脉血栓模型超声联合微泡溶栓效果 治疗前后大鼠颈总动脉管腔二维超声(A~J)及脉冲多普勒超声(K~O)图像,超声联合微泡治疗后颈总动脉再通、血流速度增加
临床患者血栓形成时间不同[10-11]。本研究发现,超声联合微泡溶栓效果随血栓凝龄的增加而下降。理论上,新鲜血栓内部水分较多,纤维蛋白网稀疏,结构较疏松,内部存在较多微孔道,可为微泡进入血栓内部提供通道,从而增强超声联合微泡治疗的溶栓效果;随着血栓凝龄的增加,血栓逐渐收缩、致密,血栓内水分及微孔道减少,使得进入血栓内部的微泡减少,且微泡仅与血栓表面接触,加之血栓结构的变化可影响超声对血栓的生物学效应,因此超声联合微泡治疗对陈旧血栓的溶栓效果较差。本研究中,随着血栓凝龄的增加,PRT和ERT均更加致密化,超声联合微泡的溶栓效果下降,与Xie等[12]的研究相似。与ERT相比,超声联合微泡溶解陈旧PRT的效果受血栓凝龄增加的影响更大,原因在于PRT血小板含量较多,而血小板活化可引起血栓明显收缩[13]。随着血栓凝龄的增加,陈旧PRT较ERT更致密,微泡进入血栓内部通道进一步减少,微泡仅能在血栓表面与血栓发生相互作用,因此超声联合微泡对其溶解能力更差。
有研究[14]报道,在体外提高超声溶栓机械指数(机械指数为3)可提高其对血栓凝龄较大血栓的溶栓效果,但高机械指数在体内可能对微血管产生破坏作用,严重情况下可导致局部出血。为确保良好的溶栓效果及减少溶栓的不良反应,进行超声联合微泡溶栓应尽量在血栓形成的早期进行,尤其是针对PRT,溶栓越早进行效果越好。
总之,本实验结果表明超声联合微泡溶解PRT和ERT的效果随血栓凝龄的增加而下降,血栓凝龄越小溶栓效果越好,尤其以PRT为甚。
[1] 高原,郭梦娇,高文宏,等.不同声学参数对血栓内微泡介导的超声辅助溶栓效果的影响.中国医学影像技术,2015,31(12):1783-1786.
[2] Mathias W Jr, Tsutsui JM, Tavares BG, et al. Diagnostic ultrasound impulses improve microvascular flow in patients with STEMI receiving intravenous microbubbles. J Am Coll Cardiol, 2016,67(21):2506-2515.
[3] 陈向辉,Seunghan Ha,崔凯,等.长脉冲超声条件下脂质体微泡协同rt-PA溶解微血栓.中国医学影像技术,2014,30(12):1769-1772.
[4] Wu J, Xie F, Lof J, et al. Utilization of modified diagnostic ultrasound and microbubbles to reduce myocardial infarct size. Heart, 2015,101(18):1468-1474.
[5] Xie F, Gao S, Wu J, et al. Diagnostic ultrasound induced inertial cavitation to non-invasively restore coronary and microvascular flow in acute myocardial infarction. PloS One, 2013,8(7):e69780.
[6] Xie F, Slikkerveer J, Gao S, et al. Coronary and microvascular thrombolysis with guided diagnostic ultrasound and microbubbles in acute ST segment elevation myocardial infarction. J Am Soc Echocardiogr, 2011,24(12):1400-1408.
[7] Lu Y, Wang J, Huang R, et al. Microbubble-mediated sonothrombolysis improves outcome after thrombotic microembolism-induced acute ischemic stroke. Stroke, 2016,47(5):1344-1353.
[8] Wang YX, Dong N, Wu C, et al. Lipopolysaccharide attenuates thrombolysis in batroxobin-induced lung vasculature fibrin deposition but not in ferrous chloride-induced carotid artery thrombus in rats: Role of endogenous PAI-1. Thromb Res, 2003,111(6):381-387.
[9] Gold HK, Yasuda T, Jang IK, et al. Animal models for arterial thrombolysis and prevention of reocclusion. Erythrocyte-rich versus platelet-rich thrombus. Circulation, 1991,83(6 Suppl):IV26-IV40.
[10] Carol A, Bernet M, Curos A, et al. Thrombus age, clinical presentation, and reperfusion grade in myocardial infarction. Cardiovasc Pathol, 2014,23(3):126-130.
[11] Kramer MC, Van der Wal AC, Koch KT, et al. Presence of older thrombus is an independent predictor of long-term mortality in patients with ST-elevation myocardial infarction treated with thrombus aspiration during primary percutaneous coronary intervention. Circulation, 2008,118(18):1810-1816.
[12] Xie F, Everbach EC, Gao S, et al. Effects of attenuation and thrombus age on the success of ultrasound and microbubble-mediated thrombus dissolution. Ultrasound Med Biol, 2011,37(2):280-288.
[13] Sutton JT, Ivancevich NM, Perrin SR Jr, et al. Clot retraction affects the extent of ultrasound-enhanced thrombolysis in an ex vivo porcine thrombosis model. Ultrasound Med Biol, 2013,39(5):813-824.
[14] Zhang X, Owens GE, Cain CA, et al. Histotripsy thrombolysis on retracted clots. Ultrasound Med Biol, 2016,42(8):1903-1918.
Efficacy of microbubble-enhanced sonothrombolysis on platelet-rich thrombi and erythrocyte-rich thrombi of different ages
WANGShifei1,JINGYuanwen1,LIHairui1,HUANGChixiong1,LUYongkang2,BINJianping1*
(1.DepartmentofCardiology,NanfangHospitalofSouthernMedicalUniversity,Guangzhou510515,China; 2.DepartmentofCardiology,ShenzhenSunYat-senCardiovascularHospital,Shenzhen518112,China)
Objective To investigate the efficacy of microbubble-enhanced sonothrombolysis on platelet-rich thrombi (PRT) and erythrocyte-rich thrombi (ERT) in different ages. Methods PRT and ERT in different ages were prepared both in vitro and in vivo of common carotid artery in rats. All the participants were divided into 8 groups with 4 in vitro and another 4 in vivo experiment, including PRT 3 h, PRT 24 h, ERT 3 h, ERT 24h in vitro groups and PRT 3 h, PRT 24 h, ERT 3 h, ERT 24 h in vivo groups. Microbubble-enhanced sonothrombolysis was carried out in both in vitro and in vivo experiments, and the ultrasonic images were collected. The components of PRT and ERT were identified by histopathological examination. The percentage increase of luminal cross sectional area and lytic ratio in vitro, and the recanalization rate and mean blood flow velocity of common carotid artery in vivo were mainly analyzed. Results After sonothrombolysis, both in vitro and in vivo experiment showed there was no statistically significant difference of the percentage increase of luminal cross sectional area ([121.12±13.21]% vs [130.09±15.34]%), lytic ratio ([39.83±7.09]% vs [42.14±5.17]%), recanalization rate (83.33% vs 91.67%) and blood flow velocity of common carotid artery ([0.21±0.02]m/s vs [0.22±0.01]m/s) between PRT 3 h group and ERT 3 h group (bothP>0.05). PRT 24 h group compared with EPR 24 h group, PRT 24 h group compared with PRT 3 h group, as well as ERT 24 h group compared with ERT 3 h group, the percent increase of luminal cross sectional area, lytic ratio, recanalization rate and blood flow velocity of common carotid artery reduced (allP<0.05). Conclusion The efficacy of microbubble-enhanced sonothrombolysis on PRT and ERT in vitro and in vivo of of rat common carotid artery model decrease with the increase of thrombus age, especially for the PRT.
Thrombolysis age; Ultrasonography; Microbubbles; Platelet; Erythrocyte; Thrombolysis
国家自然科学基金面上项目(81571689)。
王世飞(1991—),男,江西九江人,硕士,医师。研究方向:超声微泡溶栓。E-mail: shifeiw@qq.com
宾建平,南方医科大学南方医院心内科,510515。E-mail: jianpingbin@hotmail.com
2016-09-27
2017-02-26
R445.1; R-332
A
1003-3289(2017)06-0832-06
10.13929/j.1003-3289.201609127
