花背蟾蜍性腺抗氧化酶对稀土尾矿库污染胁迫的响应
2017-06-27司万童蒋海明栗利曼刘莎刘菊梅沈渭寿朱晓东
司万童,蒋海明,栗利曼,刘莎,刘菊梅,沈渭寿,朱晓东
1. 南京大学环境学院污染控制与资源化利用国家重点实验室,南京 2100232. 环境保护部南京环境科学研究所,南京 2100423. 内蒙古科技大学生命科学与技术学院,包头 014010
花背蟾蜍性腺抗氧化酶对稀土尾矿库污染胁迫的响应
司万童1,2,3,蒋海明3,栗利曼3,刘莎3,刘菊梅3,沈渭寿2,*,朱晓东1,#
1. 南京大学环境学院污染控制与资源化利用国家重点实验室,南京 2100232. 环境保护部南京环境科学研究所,南京 2100423. 内蒙古科技大学生命科学与技术学院,包头 014010
本研究以花背蟾蜍(Bufo Raddei)作为实验动物,以某稀土尾矿库周边受污染的水域湿地为研究样地,以相对无污染的小白河黄河湿地自然保护区为对照样地。通过检测两地花背蟾蜍精巢和卵巢的脏器系数、MDA和GSH含量、SOD、GSH-Px、GST、CAT和GR活性、T-AOC等相关指标。研究花背蟾蜍性腺抗氧化酶对该稀土尾矿库污染胁迫的响应效应。结果显示:与黄河湿地相比,稀土尾矿库湿地复合污染对花背蟾蜍精巢和卵巢脏器系数的影响差异不显著。稀土尾矿库花背蟾蜍精巢和卵巢中MDA含量、GPx、GST和CAT活性显著高于黄河湿地(P<0.05),而GSH含量表现出相反的趋势。精巢中T-AOC显著高于卵巢(P<0.01),但相同组织在两地间差异不显著。结果表明该稀土尾矿库复合污染对花背蟾蜍精巢和卵巢抗氧化能力有一定的毒害效应,且精巢和卵巢对污染胁迫的响应有明显的差异性。在应对稀土尾矿库湿地复合污染胁迫时,精巢更倾向于调用SOD-CAT系统的抗氧化机制,而在卵巢内GSH系统发挥作用更大。
尾矿库;花背蟾蜍;精巢;卵巢;脏器系数;抗氧化;毒性效应
近年来,随着各种矿产资源的相继开采,为社会带来巨大的经济效益和方便的同时,也产生大量的废矿渣和废液[1]。其中含有大量未完全利用的重金属、稀土元素以及放射性元素等多种污染物质。这些废弃物大多堆积在一些尾矿库中,由于大多数尾矿都是露天开放式存放,废液会通过尾矿库体和库基渗漏,随地表水和地下水扩散,加上裸露的矿渣粉尘随风飞扬飘散,严重污染了周边水体和土壤环境[2]。
花背蟾蜍(Bufo raddei)属于两栖类动物,皮肤具有较强的渗透性,因此对环境中污染物尤其是水体和沉积物污染具有极强的灵敏性,是一种良好的生物监测指示物种,常被用来评估环境复合污染引起的综合生物学效应[3-5]。已经有相关研究表明重金属会对两栖类生物的跳跃能力、骨骼发育、生长发育、抗氧化能力等都会产生一定的负面影响[6-8],并且会增加花背蟾蜍的死亡率和畸形率[4,8-9]。有关污染物对两栖类性腺的研究主要集中在性腺发育分化、组织学形态观察和精巢酶活性、毒性效应等方面[3,10-12],而有关稀土尾矿库复合污染对花背蟾蜍性腺抗氧化能力的毒性效应以及抗氧化酶对污染胁迫的响应方面的研究报道较少。
因此,本实验选取内蒙古某稀土尾矿库周边受污染的水域和相对无污染的黄河湿地自然保护区作为对照样地,以花背蟾蜍为实验动物,以花背蟾蜍精巢和卵巢的脏器系数和抗氧化相关酶系统和物质作为生物标志物监测指标,包括丙二醛(malondialdehyde, MDA)含量,和在抗氧化生化反应中重要的反应物质谷胱甘肽(glutathione, GSH)含量,超氧化物岐化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、谷胱甘肽S-转移酶(glutathione S-transferase, GST)、过氧化氢酶(catalase, CAT)以及谷胱甘肽还原酶(glutathione reductase, GR)活性和总体抗氧化能力(total antioxidant capacity, T-AOC)。探讨该稀土尾矿库复合污染对花背蟾蜍性腺抗氧化能力的毒性效应以及抗氧化酶对污染胁迫的响应,为两栖类动物的保护和当地稀土尾矿库污染监测、防控和评价提供参考依据。
1 材料与方法(Materials and methods)
1.1 实验样地
研究样地选择内蒙古包头市某稀土尾矿库周边由渗漏水形成的受污染水域湿地;对照样地选择相对无污染的黄河自然保护区小白河湿地(图1)。
图1 稀土尾矿库和黄河湿地样地Fig. 1 The sampling sites of rare earth tailings wetland and the Yellow River wetland
尾矿库地势北高南低,地下水流向为从东北到西南[13]。渗漏水在尾矿库南侧形成了大约1×105m2的水域湿地,黄河在流经包头小白河时,形成了十几个小型湿地。本研究分别在尾矿库南侧和小白河两地选择了地形比较规则,采样比较容易的地方作为实验样地,两处样地设置大小均约为1万m2。
1.2 水体和底泥中的污染物分析
测定了两地水体和底泥(0~20 cm)中的污染物元素。其中重金属镉、铬、铜、镍、铅和锌元素含量采用原子吸收分光光度法测定,砷元素含量采用原子荧光法测定。元素分析测试时进行空白实验(消解时不加土壤样品)和有证标准物质(土壤成分分析标准物质,GBW07407)的分析测试,进行质量控制。所有结果满足实验室质控要求,标准偏差控制在±10%之间。
1.3 实验动物采集与解剖
于2015年5月初分别在两地采集刚刚结束冬眠而未抱对的花背蟾蜍,每个样地分别挑选雌、雄蟾蜍各18只。统计结果显示雌性体重为25.70~31.47 g,体长为6.6~7.5 cm;雄性体重为15.40~20.18 g,体长为5.3~5.6 cm。将2个样地采集到的蟾蜍带回实验室,雌雄蟾蜍随机各取8只,每2只做为一个平行实验,各做4个平行实验(n=4)。当天采用双毁髓法处死,解剖后摘取精巢和卵巢组织置于冰浴磷酸缓冲液(PBS)中待用。
1.4 动物指标测定
对精巢和卵巢称重并计算性腺脏器系数。根据精巢和卵巢的质量按照1∶99的比例加入预冷的PBS缓冲液(pH=7.0)迅速匀浆(冰浴),匀浆液转置于50 mL EP管中,4 ℃,2 000 r·min-1离心10 min。取上清液进行MDA和GSH含量、SOD、GSH-Px、GST、CAT和GR活性、T-AOC等8种指标的测定。所有指标均采用南京建成生物试剂盒测定,实验步骤均按照试剂盒说明书操作。
1.5 数据统计与分析
利用SPSS 17.0进行数据统计与分析,数据均以平均值±标准偏差表示。利用One-way ANOVA进行数据比较。
2 结果(Results)
经检测发现,表1中的各项污染物质在尾矿库周边湿地水体和底泥中均显著(P<0.05)高于黄河湿地,这与当地的地理环境有很大关系。该处地势北高南低,潜层地下水流向为东北至西南,导致尾矿库渗漏水在南侧大量聚集,水体中污染物含量较高。加上常年以西北风为主,尾矿库中裸露的矿渣粉尘随风扩散,导致污染物在周边湿地底泥中大量沉积和富集。
由图2可知与黄河样地相比,尾矿库样地花背蟾蜍精巢与卵巢的脏器系数差异不显著,可见尾矿库复合污染对花背蟾蜍性腺的脏器系数并没有造成显著影响。由图3到图10可知,两大样地的花背蟾蜍性腺中,尾矿库湿地的花背蟾蜍的MDA含量显著高于黄河湿地(P<0.01),精巢的MDA含量显著高于卵巢(P<0.01)。SOD活性在尾矿库湿地的蟾蜍精巢中显著高于黄河湿地(P<0.01),但在卵巢内两地差异不显著。GSH含量在尾矿库湿地的花背蟾蜍中显著低于黄河湿地(P<0.05),精巢显著低于卵巢(P<0.01)。GR活性两地间相比和组织间相比差异均不显著。GSH-Px和GST活性变化趋势相似,在尾矿库湿地蟾蜍精巢和卵巢中均显著高于黄河湿地(P<0.05),但同地精巢和卵巢间差异不显著。CAT活性在尾矿库湿地的花背蟾蜍中显著高于黄河湿地(P<0.01)。T-AOC能力表现为精巢显著高于卵巢(P<0.01),但同组织两地间差异不显著。
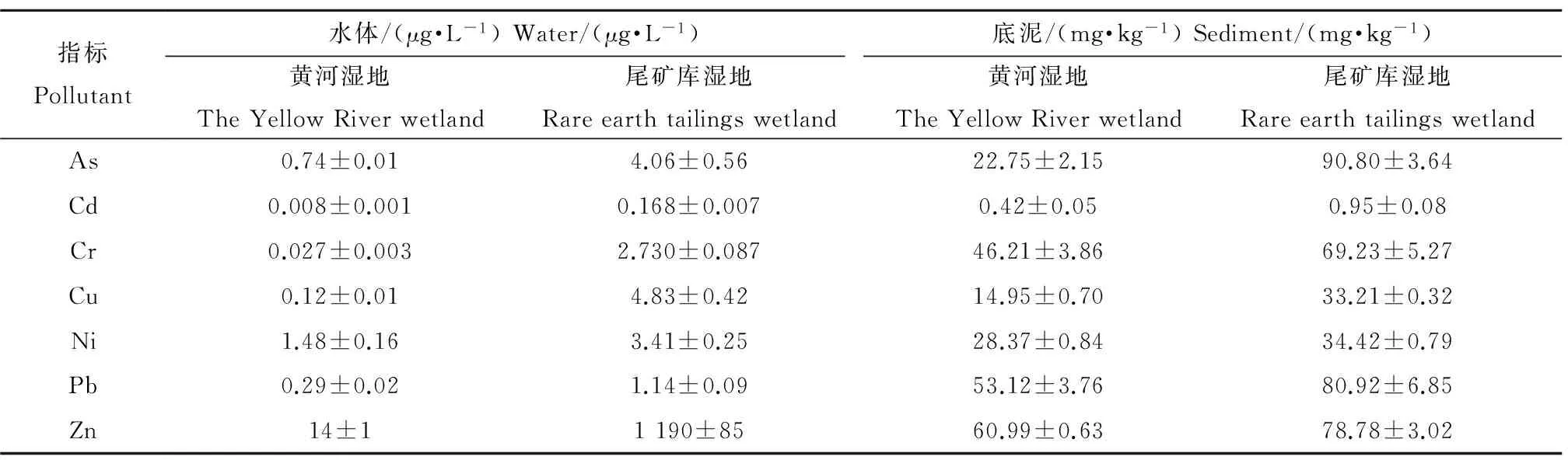
表1 黄河和尾矿库周边湿地中水体和底泥污染物浓度(Mean±SD, n=3)Table 1 The pollutant concentrations in the water and sediment of the Yellow River and tailings wetlands (Mean±SD, n=3)
3 讨论(Discussion)
通常情况下,生物体内氧自由基的生成与清除处于动态平衡。如果体内产生的自由基得不到及时有效的清除,就会通过损伤生物大分子破坏细胞的结构和功能,造成氧化损伤。氧化损伤是环境污染物引起生物毒性一个重要机理。其中MDA是生物体内的脂质过氧化产物,可以很好反映生物体内精巢和卵巢的氧化损伤程度。由实验结果可知,尾矿库样地精巢和卵巢中MDA含量都高于黄河样地,可能与尾矿库湿地中水体和底泥污染程度高有很大关系(表1)。由于花背蟾蜍精巢和卵巢长期受到污染胁迫,导致其体内脂质过氧化反应更加严重[14]。Mendoza-Wilson等[15]和苗菲菲等[16]研究泥鳅的抗氧化能力时发现,当抗氧化系统长期不能及时清除自由基而或自由基超过一定阈值,就会对机体造成脂质过氧化反应。另外精巢中的脂质过氧化水平显著高于卵巢(P<0.01),表明精巢受到的毒害效应更加严重。
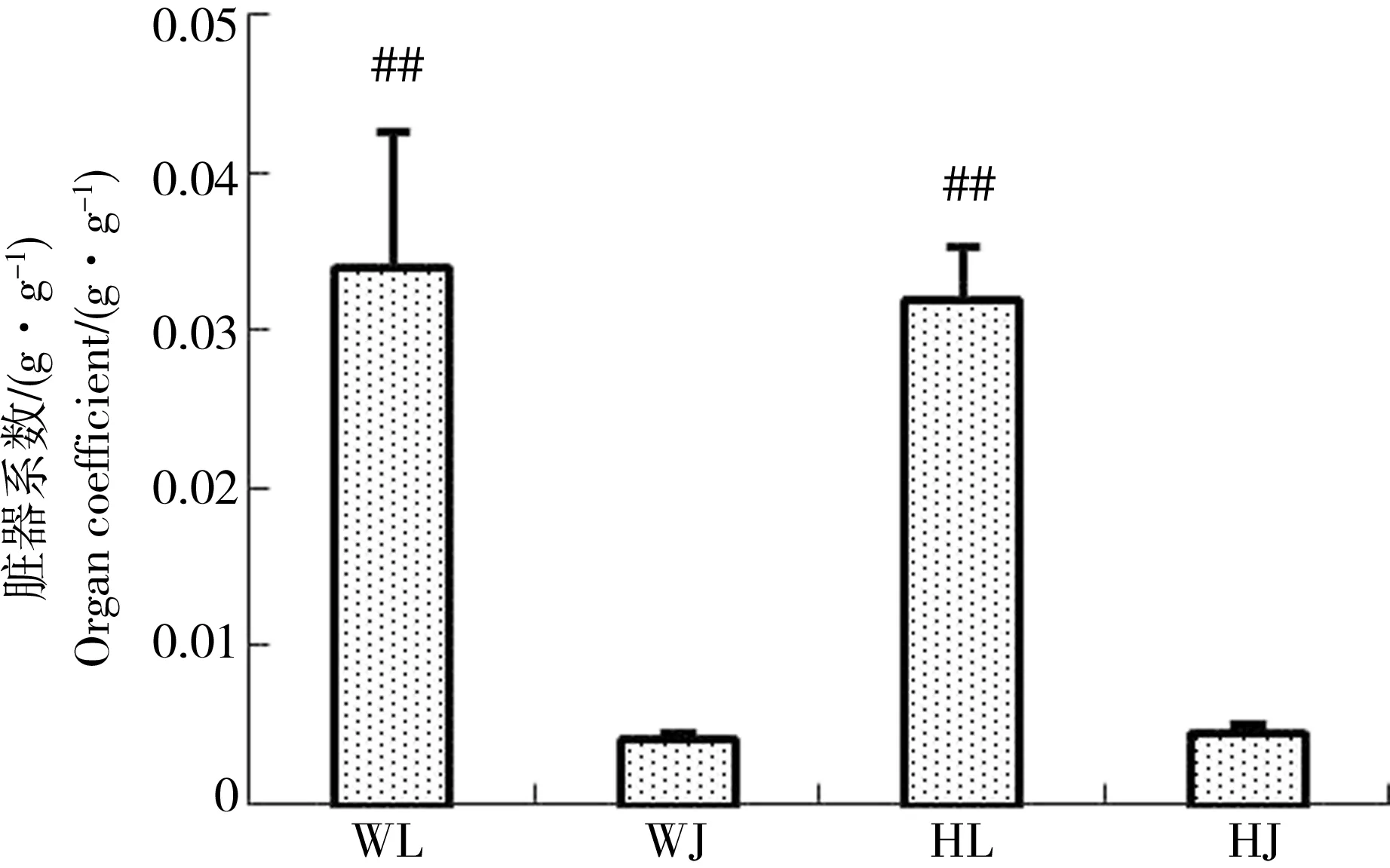
图2 花背蟾蜍精巢、卵巢脏器系数注:WL表示尾矿库蟾蜍卵巢;WJ表示尾矿库蟾蜍精巢;HL表示黄河蟾蜍卵巢;HJ表示黄河蟾蜍精巢;## 表示相同湿地不同性腺组织间相比差异显著(P<0.01)。下同。Fig. 2 The organ coefficients of B. raddei testis and ovariesNote: WL indicates toad’s ovary in tailings wetland; WJ indicates toad’s testis in tailings wetland; HL indicates toad’s ovary in the Yellow River wetland; HJ indicates toad’s testis in the Yellow River wetland. ## indicates significant differences between the different sex gland tissues in the same wetland at P<0.01 level. The same below.
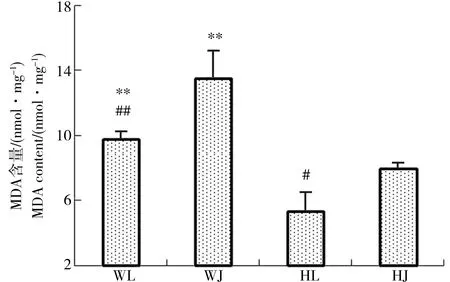
图3 花背蟾蜍精巢、卵巢MDA含量注:**表示相同性腺组织不同湿地间相比差异显著(P<0.01);# 表示相同湿地不同性腺组织间相比差异显著(P<0.05)。下同。Fig. 3 The MDA contents of B. raddei testis and ovariesNote: ** indicates significant differences between the different wetlands in the same sex gland tissue at P<0.01; # indicates significant differences between the different sex gland tissues in the same wetland at P<0.05 level. The same below.
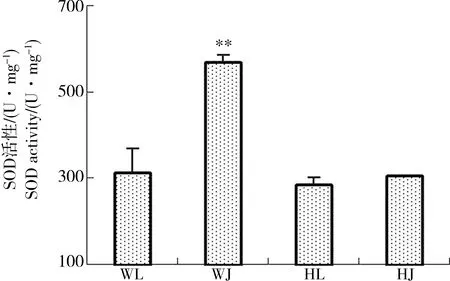
图4 花背蟾蜍精巢、卵巢SOD活性Fig. 4 The SOD activities of B. raddei testis and ovaries
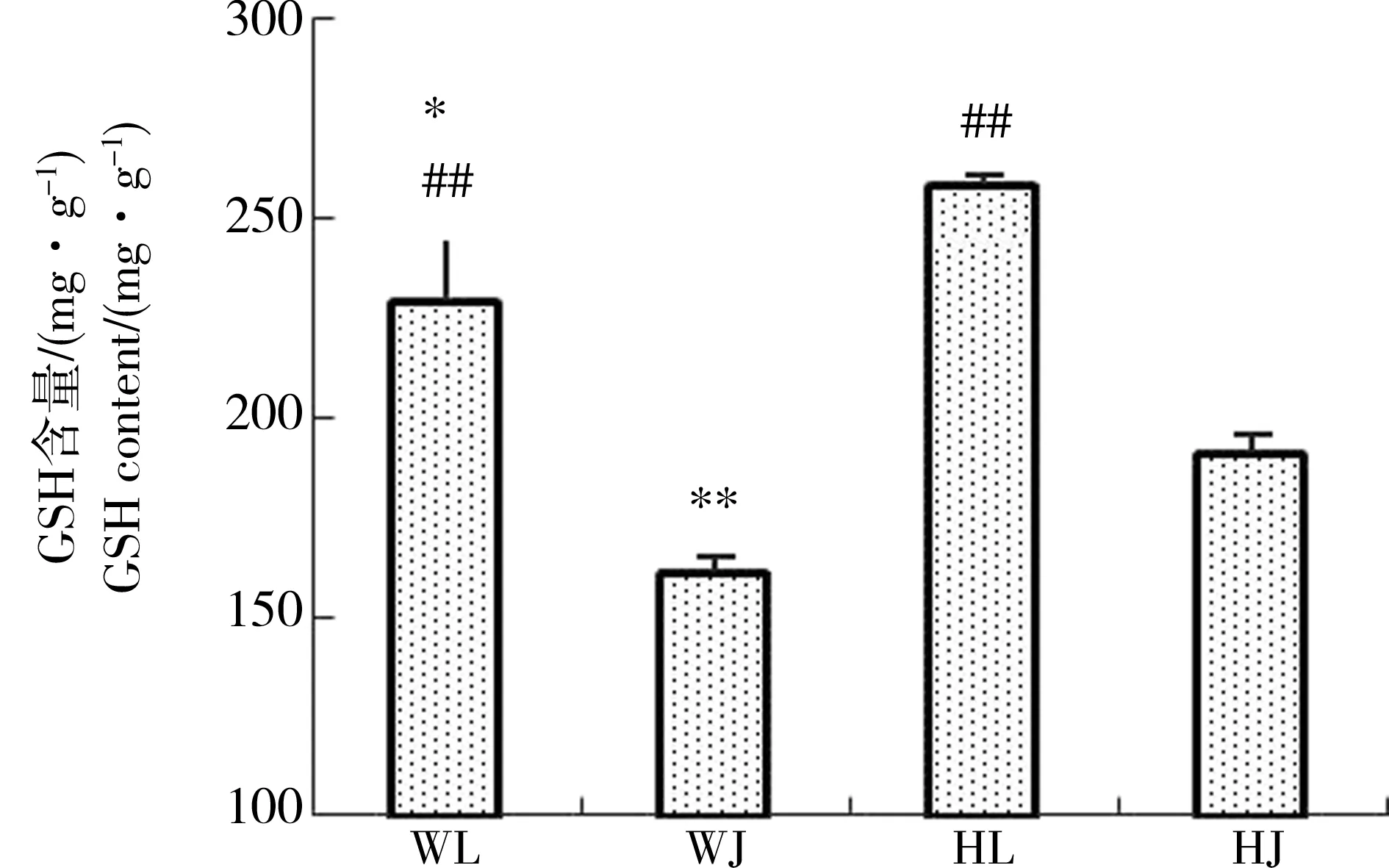
图5 花背蟾蜍精巢、卵巢GSH含量注:*表示相同性腺组织不同湿地间相比差异显著(P<0.05)。下同。Fig. 5 The GSH contents of B. raddei testis and ovariesNote: * indicates significant differences between the different wetlands in the same sex gland tissue at P<0.05. The same below.
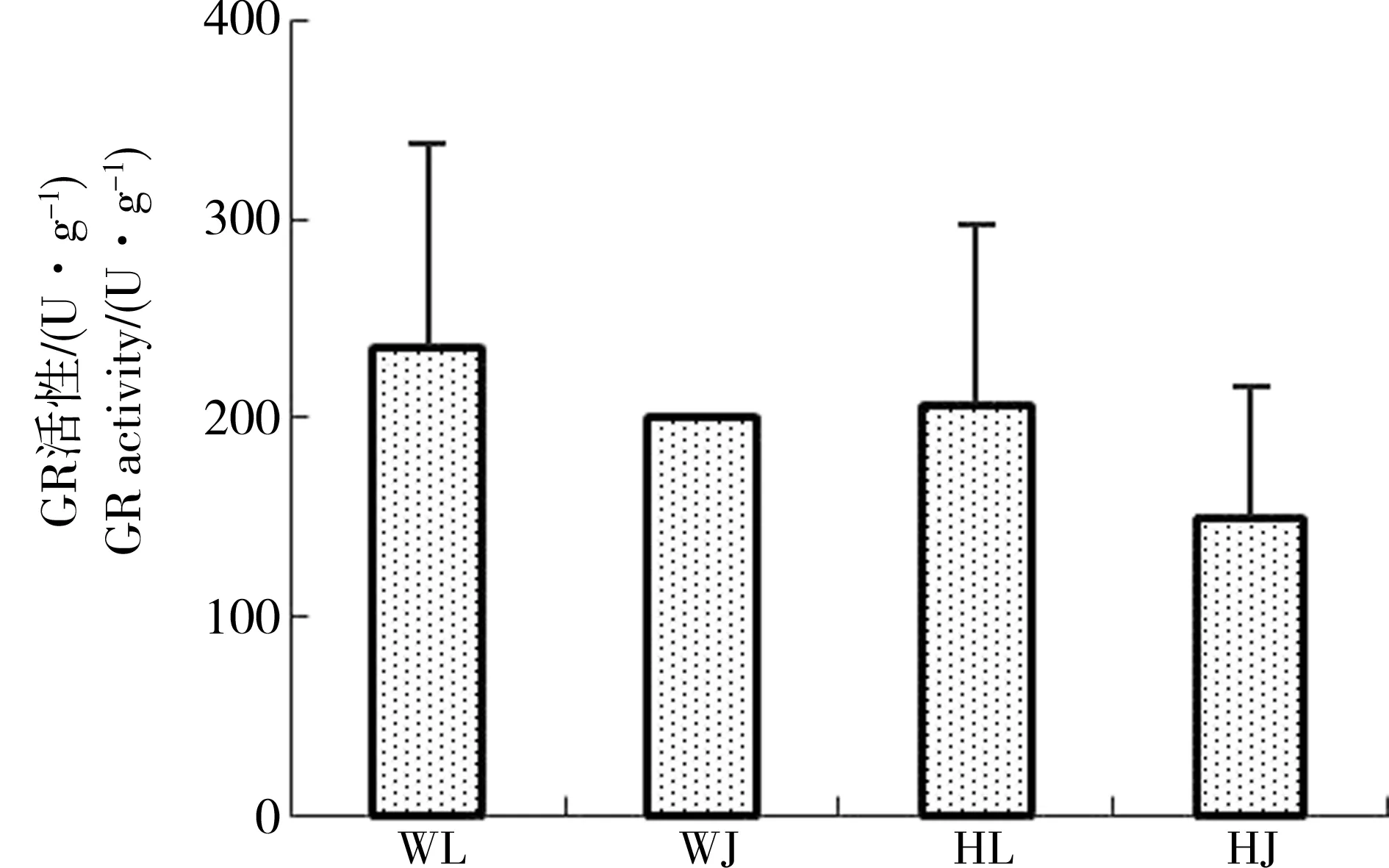
图6 花背蟾蜍精巢、卵巢GR活性Fig. 6 The GR activities of B. raddei testis and ovaries
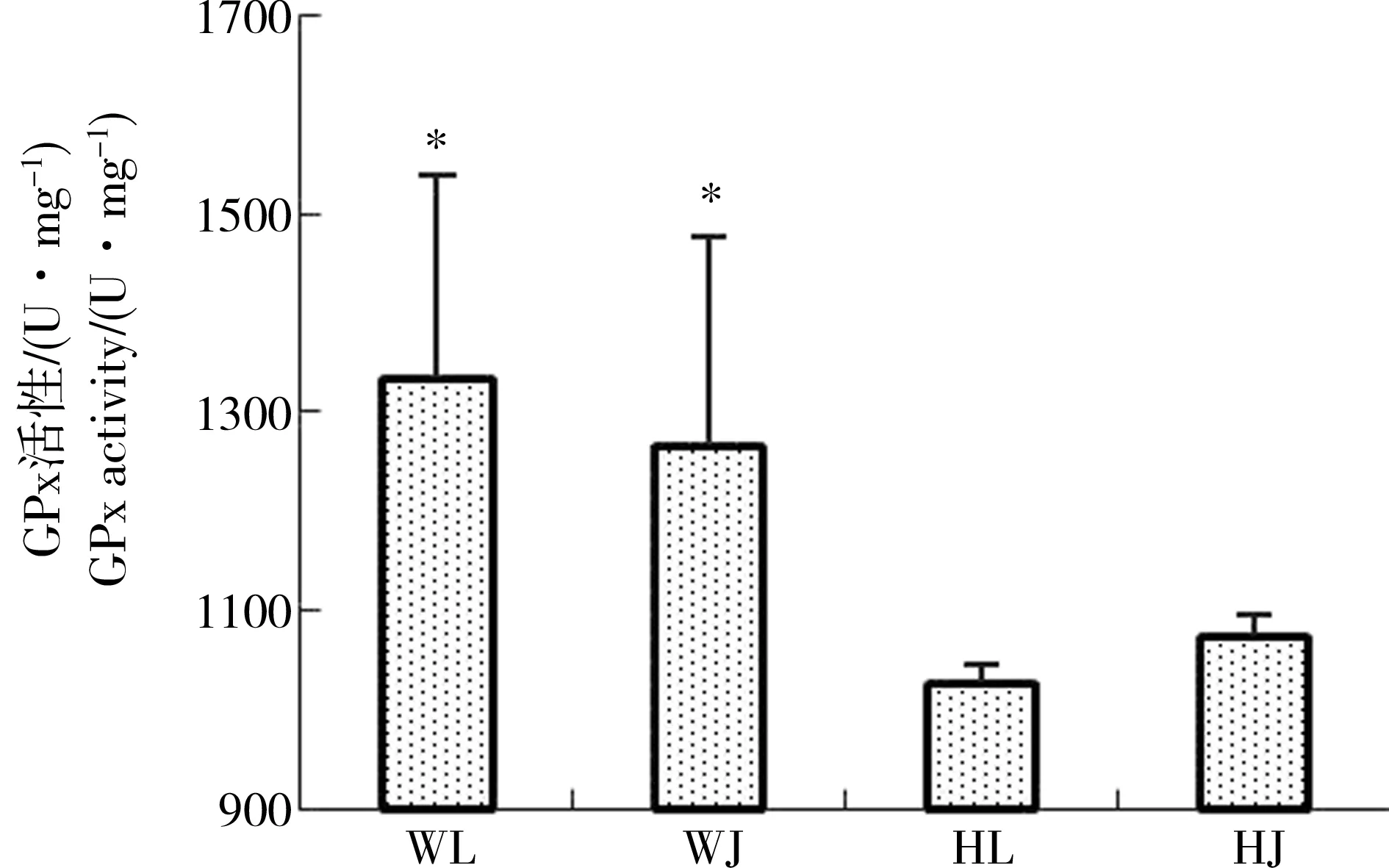
图7 花背蟾蜍精巢、卵巢GSH-Px活性Fig. 7 The GSH-Px activities of B. raddei testis and ovaries
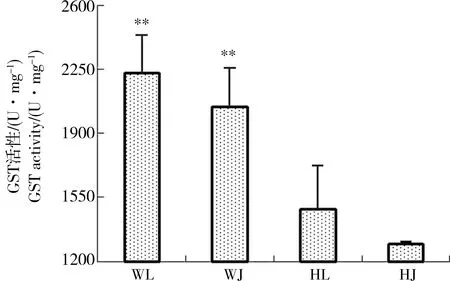
图8 花背蟾蜍精巢、卵巢GST活性Fig.8 The GST activities of B. raddei testis and ovaries
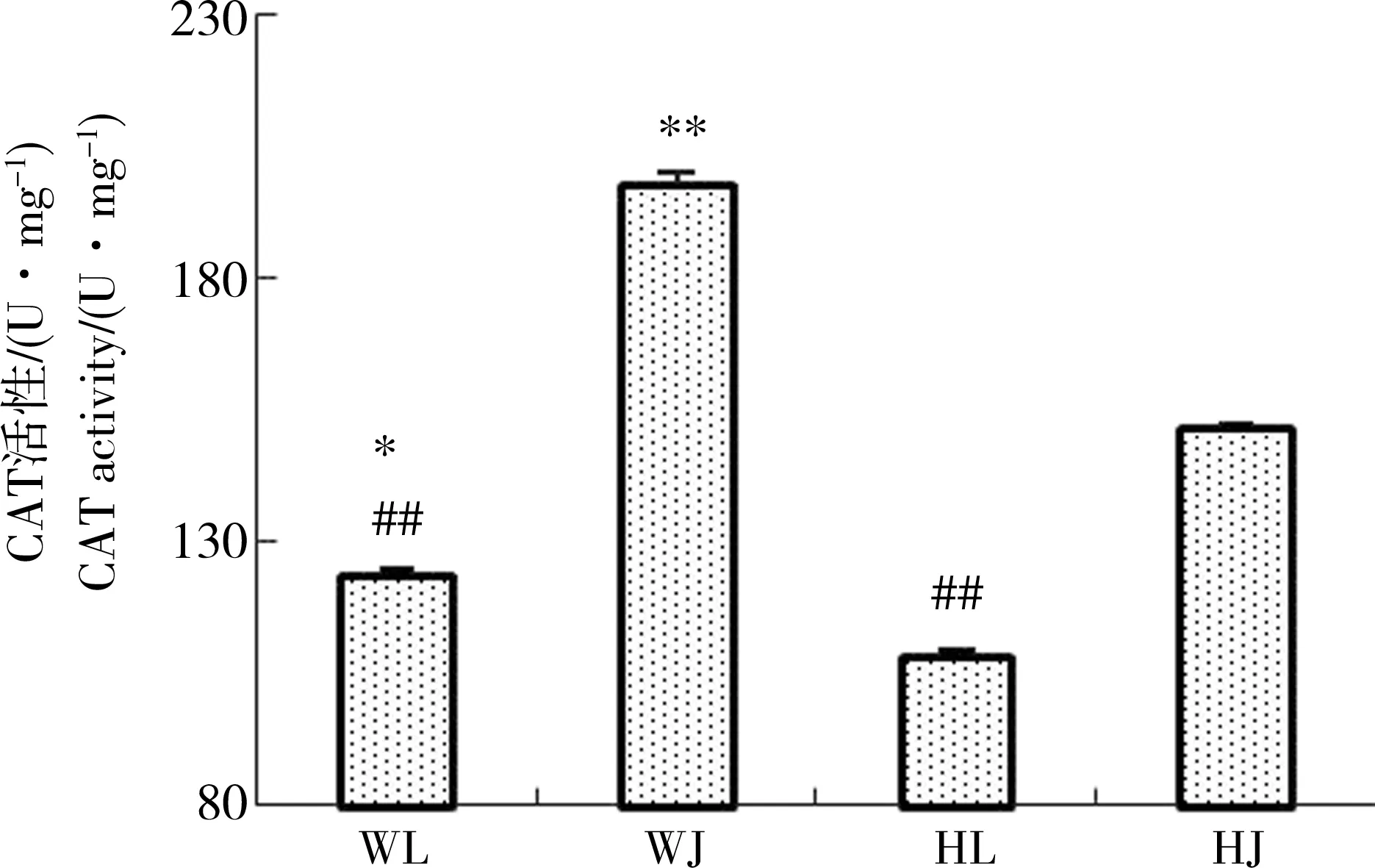
图9 花背蟾蜍精巢、卵巢CAT活性Fig. 9 The CAT activities of B. raddei testis and ovaries

图10 花背蟾蜍精巢、卵巢T-AOC含量Fig. 10 The T-AOC contents of B. raddei testis and ovaries
生物体内主要通过抗氧化酶系统和清除剂来清除氧自由基[17]。SOD和GSH都是生物体内重要的抗氧化剂和自由基清除剂,当生物体受到外界胁迫,体内产生大量有害自由基后,就可通过这2种酶以及相关酶的联合作用来消除。其中SOD是生物个体在清除体内由新陈代谢产生的自由基的主要物质,主要催化过氧化氢反应将体内多余的超氧自由基还原,继而由CAT和GSH-Px进一步还原为无害的水。GSH是重要的抗氧化剂和自由基清除剂,不仅是GSH-Px与GST这2种酶分解过氧化物必需的反应底物,也是GR酶的反应产物。其中GR在生物机体的氧化还原反应中有非常重要的作用,GST是生物体内一类与肝脏解毒密切相关的酶类[17],GSH在这些酶的催化作用下,不仅可以清除体内过多自由基、过氧化物,而且可以通过转移作用将体内有害物质排出体外,进而达到抗氧化损伤的作用。
本实验通过2个湿地比较发现,稀土尾矿库湿地花背蟾蜍精巢中SOD、GSH-Px、GST和CAT活性都显著高于黄河湿地,可能是由于SOD活性受到稀土尾矿库湿地中各类污染物质的诱导而上升[15],进而使得CAT和GSH-Px活性升高,将过多的氧自由基进行了分解,来应对外界环境的变化,这是一种应激反应[19]。卵巢的SOD活性和精巢里的GSH-Px活性差异不显著,可能由于不同的酶在不同组织中对环境变化响应程度不同所致。尾矿库样地花背蟾蜍精巢和卵巢中GSH含量低于黄河样地,而与其相关的酶类GSH-Px和GST活性与黄河湿地相比均有所升高(图5、6和7),并且GR活性小于GSH-Px和GST活性,可见GSH生成速度小于其消耗速度,表明稀土尾矿库湿地水体污染对花背蟾蜍精巢和卵巢的抗氧化能力有明显的影响。
另外,尾矿库样地的精巢和卵巢相比,尾矿库湿地蟾蜍精巢中SOD、CAT活性和MDA含量均显著高于卵巢(P<0.01),表明蟾蜍精巢主要通过SOD和CAT来应对外界污染胁迫。而卵巢中的GSH含量和GST活性显著高于精巢(P<0.01)。与精巢相比,卵巢内涉及到GSH家族抗氧化酶系统普遍有较高的浓度或活性,表明在受到外界环境胁迫时,精巢可能更倾向于采用SOD-CAT抗氧化系统,而卵巢中GSH系统发挥的作用更大一些。这表明当受到环境污染胁迫时花背蟾蜍体内氧化应激系统具有一定的组织差异性,这可能与精、卵巢的结构和功能不同有很大关系。同时当地复合污染中不同污染物质对精、卵巢中各类抗氧化物酶活性的影响作用也存在差异。T-AOC代表机体内各种酶性和非酶性抗氧化能力的总体水平,其强弱与生物体自身的健康程度有着直接关系。由本实验结果可知,尾矿库样地精巢和卵巢T-AOC能力与黄河样地相比较大,但差异不显著。整体而言,在一定程度上可以看出花背蟾蜍在长期受到尾矿库湿地水体污染的影响下,机体内部受到了氧化损伤,并且能够通过多种应激途径共同作用来对污染胁迫做出响应,增强自身的氧化能力,调整机体更好地去适应生存环境。
综上,该稀土尾矿库周边湿地水土复合污染对本土花背蟾蜍的精巢和卵巢组织造成了明显的氧化损伤作用,具有显著的生态毒性效应。在对抗逆境的过程中,蟾蜍精巢和卵巢对污染胁迫的响应方式和应激途经具有组织差异性,精巢更倾向于SOD-CAT系统的抗氧化机制,而卵巢中GSH系统发挥作用更大。
[1] 陈文韬, 徐红娇, 张乃明, 等. 某铜矿尾矿库对周围环境影响污染评价研究[J]. 环境科学导刊, 2015, 34(2): 96-101
Chen W T, Xu H J, Zhang N M, et al. Impact assessment of heavy metal pollution of a copper ore mine tailings pond on the surrounding environment [J]. Environmental Science Survey, 2015, 34(2): 96-101 (in Chinese)
[2] 姚高扬, 华恩祥, 高柏, 等. 南方某铀尾矿区周边农田土壤中放射性核素的分布特征[J]. 生态与农村环境学报, 2015(6): 963-966
Yao G Y, Hua E X, Gao B, et al. Distribution characteristics of radionuclides in soils around tailings dump sites of a uranium mining field in south China [J]. Journal of Ecology and Rural Environment, 2015(6): 963-966 (in Chinese)
[3] 马玲, 陆宇燕. 花背蟾蜍性腺分化的组织学观察[J]. 沈阳师范大学学报: 自然科学版, 2011, 29(2): 288-292
Ma L, Lu Y Y. Histological observation of Bufo raddei gonadal differentiation [J]. Journal of Shenyang Normal University: Natural Science Edition, 2011, 29(2): 288-292 (in Chinese)
[4] Si W T, Zhang W Y, Lv Y, et al. Heavy metal removal in a constructed wetland and benefits for the development of the toad Bufo raddei [J]. Polish Journal of Environmental Studies, 2014, 23(6): 2207-2215
[5] Huang D J, Zhang Y M, Wang Y J, et al. Assessment of the genotoxicity in toad Bufo raddei exposed to petro chemical contaminants in Lanzhou Region, China [J]. Mutation Research, 2007, 629: 81-88
[6] 冯磊, 戴昕鹏, 张军, 等. 重金属污染条件下花背蟾蜍跳跃能力与骨骼肌ATP酶和AChE活性变化研究[J]. 四川动物, 2012, 31(4): 553-557
Feng L, Dai X P, Zhang J, et al. Changes of the locomotor performance and activities of ATPase and AChE of Bufo raddei under the stress of heavy metal pollution [J]. Sichuan Journal of Zoology, 2012, 31(4): 553-557 (in Chinese)
[7] 江彬强, 陈伟庭, 李东风. 重金属离子对黑框蟾蜍蝌蚪生长发育的影响[J]. 华南师范大学学报: 自然科学版, 2008, 5(2): 100-105
Jiang B Q, Chen W T, Li D F. Effect of heavy metal ion on growth of tadpole of toad (Bufo melanostictus schneide) [J]. Journal of South China Normal University: Natural Science Edition, 2008, 5(2): 100-105 (in Chinese)
[8] 黄德军, 张迎梅, 赵东芹, 等. 重金属镉对花背蟾蜍蝌蚪生长发育的影响[J]. 兰州大学学报: 自然科学版, 2004, 40(2): 81-83
Huang D J, Zhang Y M, Zhao D Q, et al. Effect of cadmium on the development of tadpoles of the Bufo raddei [J]. Journal of Lanzhou University: Natural Sciences Edition, 2004, 40(2): 81-83 (in Chinese)
[9] 周虹, 路爱平, 黄来旺, 等. 重金属污染对蛙蟾类毒性的研究进展[J]. 四川动物, 2009, 28(5): 785-793
Zhou H, Lu A P, Huang L W, et al. A review on the toxicity of heavy metal pollution to anura [J]. Sichuan Journal of Zoology, 2009, 28(5): 785-793 (in Chinese)
[10] 贾秀英, 董爱华. 镉、铅对蟾蜍精巢毒作用的酶学研究[J]. 生态学报, 2004, 24(10): 2329-2333
Jia X Y, Dong A H. Effects of cadmium and lead on testicular enzymes of Bufo bufo gargarizans [J]. Acta Ecologica Sinica, 2004, 24(10): 2329-2333 (in Chinese)
[11] 李新红, 赵文阁, 郭玉民, 等. 中国林蛙性腺的发育及温度对其性别分化的影响[J]. 动物学研究, 2010, 22(5): 351-356
Li X H, Zhao W G, Guo Y M, et al. Development of sexual gland and influence of temperature on sexual differentiation in Rana chensinensis [J]. Zoological Research, 2010, 22(5): 351-356 (in Chinese)
[12] 汪美贞, 贾秀英. 铅对雄性生殖毒性的研究进展[J]. 动物学杂志, 2006, 41(1): 123-127
Wang M Z, Jia X Y. Reproductive toxicity of lead in males [J]. Chinese Journal of Zoology, 2006, 41(1): 123-127 (in Chinese)
[13] 屠显章, 刘学敏, 王泽斌, 等. 包钢尾矿场区潜水弥散试验与水质模型[J]. 工程勘察, 1988(4): 28-32
Tu X Z, Liu X M, Wang Z B, et al. Groundwater dispersion test and water quality model of the Baotou steel tailing area [J]. Engineering Investigation, 1988(4): 28-32 (in Chinese)
[14] 宋刚, 张迎梅, 朱丽娜, 等. 黄河上游环境污染对花背蟾蜍抗氧化酶活性及丙二醛含量的影响[J]. 四川动物, 2007, 26(2): 434-437
Song G, Zhang Y M, Zhu L N, et al. Effects of upper yellow river pollution on antioxidant enzymes activities and malondialdehyde content of Bufo raddei [J]. Sichuan Journal of Zoology, 2007, 26(2): 434-437 (in Chinese)
[15] Mendoza-Wilson A M, Castro-Arresondo S I, Balandran-Quintana R R. Computational study of the structure-free radical scavenging relationship of procyanidins [J]. Food Chemistry, 2014, 161: 155-161
[16] 苗菲菲, 司万童, 刘菊梅, 等. 尾矿库渗漏水导致泥鳅氧化损伤与DNA损伤的研究[J]. 广东农业科学, 2012, 16: 162-164
Miao F F, Si W T, Liu J M, et al. Study on oxidative damage and DNA damage in Misgurnus anguillicaudatus caused by the tailing lake seepage [J]. Guangdong Agricultural Sciences, 2012, 16: 162-164 (in Chinese)
[17] 李瑷伶, 蓝昕, 司万童, 等. 己烯雌酚对染镉草鱼GSH-Px、SOD和MDA影响的研究[J]. 农业环境科学学报, 2008, 27(1): 350-353
Li A L, Lan X, Si W T, et al. Effect of diethylstilbestrol on GSH-Px, SOD and MDA of grass carp exposed to cadmium [J]. Journal of Agro-environment Science, 2008, 27(1): 350-353 (in Chinese)
[18] 张婧菲, 王恬. 姜黄素对谷胱甘肽代谢酶诱导及抗氧化机制研究进展[J]. 食品科学, 2012, 33(21): 359-362
Zhang J F, Wang T. Research progress in induction of glutathione metabolic enzymes by curcumin and its antioxidant mechanism [J]. Food Science, 2012, 33(21): 359-362 (in Chinese)
[19] Heink A E, Parrish A N, Thorgaard G H, et al. Oxidative stress among SOD-1 genotypes in rainbow trout(Oncorhynchus mykiss) [J]. Aquatic Toxicology, 2014, 156: 1-9
◆
The Response of Antioxidant Enzyme inBuforaddeiGonad to Rare Earth Tailings Pollution Stress
Si Wantong1,2,3, Jiang Haiming3, Li Liman3, Liu Sha3, Liu Jumei3, Shen Weishou2,*, Zhu Xiaodong1,#
1. State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210042, China2. Nanjing Institute of Environmental Science, Ministry of Environmental Protection, Nanjing 210042, China3. School of Life Science and Technology, Inner Mongolia University of Science and Technology, Baotou 014010, China
30 March 2016 accepted 8 June 2016
This study uses Bufo raddei as the experimental animal. The polluted wetland at south side of a rare earth tailing was chosen as the study site, and the Yellow River’s Xiaobaihe wetland as the control site. The indicators including organ coefficients, MDA and GSH contents, and SOD, GSH-Px, GST, CAT and GR activities, and T-AOC were measured to study the response of antioxidant system in Bufo raddei gonad to rare tailings pollution stress. The results showed that the testis and ovary organ coefficients of B. raddei in rare earth tailings site had no obvious difference compared with that in the Yellow River site. The MDA contents, and GPx, GST and CAT activities in testis and ovary of B. raddei in rare earth tailings site were significantly higher than that in the Yellow River site (P<0.01), while the GSH contents were lower than that in the Yellow River site. In both tailings and the Yellow River sites, T-AOC in the testis were significantly higher than that in the ovary (P<0.05), but there was no obvious difference between two sites in the same organ. The results indicated that the pollution of this rare earth tailing had certain toxic effects on antioxidant capacities in the testis and ovary of B. raddei. The testis’ and ovary’s antioxidant enzymes showed different responses to the rare tailings pollution stress. The SOD/CAT antioxidant system contributed more to the tolerance to the stress in the testis, while the GSH-related antioxidant enzymes play a more important role in the ovary of B. raddei.
tailings; Bufo raddei; testis; ovary; organ coefficient; antioxidant; toxic effect
国家科技基础性工作专项(2014FY110800);国家自然科学基金(31460142);中国博士后科学基金面上项目(2015M571663);内蒙古科技大学创新基金青年学术骨干培养专项(2015QNGG05)
司万童(1986-),男,副教授,研究方向为生态毒理学和环境生物学,E-mail: siwt02@163.com
*通讯作者(Corresponding author), E-mail: shenweishou@163.com
10.7524/AJE.1673-5897.20160330005
2016-03-30 录用日期:2016-06-08
1673-5897(2017)2-209-07
X171.5
A
沈渭寿(1958—),男,生态学博士,研究员,主要研究方向为生态保护与修复。
共同通讯作者简介:朱晓东(1963—),男,环境科学博士,教授,主要研究方向为城市生态规划与管理。
# 共同通讯作者(Co-corresponding author), E-mail: xdzhu@nju.edu.cn
司万童, 蒋海明, 栗利曼, 等. 花背蟾蜍性腺抗氧化酶对稀土尾矿库污染胁迫的响应[J]. 生态毒理学报,2017, 12(2): 209-215
Si W T, Jiang H M, Li L M, et al. The response of antioxidant enzyme in Bufo raddei gonad to rare earth tailings pollution stress [J]. Asian Journal of Ecotoxicology, 2017, 12(2): 209-215 (in Chinese)
