亚高寒草甸植物群落种多度分布关系及相似性对氮磷添加的响应
2017-06-27杨莹博李忠明李海伟沈禹颖
杨莹博,白 荣, 李 爽, 李忠明, 李海伟, 沈禹颖
兰州大学 草地农业生态系统国家重点实验室 草地农业科技学院,兰州 730000
亚高寒草甸植物群落种多度分布关系及相似性对氮磷添加的响应
杨莹博,白 荣, 李 爽, 李忠明, 李海伟, 沈禹颖*
兰州大学 草地农业生态系统国家重点实验室 草地农业科技学院,兰州 730000
以青藏高原亚高寒草甸为研究对象,采用随机区组设计,通过连续4a添加N、P,研究了不同施肥(N、P、N+P)处理下群落物种丰富度、种多度分布模式以及群落相似性的变化特征。结果显示:(1) N、N+P连续添加4年后,随N素添加水平的增加,草地植物群落物种丰富度逐渐降低(P<0.001);种多度分布曲线的斜率逐渐增大;N+P添加处理对植物群落物种丰富度和种多度分布(SAD)曲线的影响较单独N添加处理更显著,如N15P15处理下群落物种丰富度的降幅最大,达对照群落的65.5%;(2)单一N或N+P处理中,不同添加量间的植被组成趋异,而相同添加量的植被组成趋同(stress level = 0.152);(3) N、N+P添加引起刷状根的丛生型禾本科植物逐渐在植物群落中占据优势;(4) P素添加对群落物种丰富度、种多度分布曲线、群落相似性和不同生长型组成及比例的影响不显著;(5)植物生长型特征和N/P添加处理可解释56.97%植物群落的物种多度分布特征。这些结果表明:亚高寒草甸地区N添加引起植物群落组成的重新排序、优势种的变化、SAD曲线逐渐陡峭,群落的相似性增加;N富集时,添加P素会增加 N 素的利用效率,且群落结构受N、P供应水平的影响。
青藏高原;氮磷添加;物种丰富度;生物多样性;群落结构;生长型
生物因子间及其对非生物因子的相互竞争共同决定植物种的局域分布和多度。种多度分布(species abundance distribution, SAD)模式是描述生态群落结构的基础指标,可直观展现群落内各物种出现的比率[1]。20世纪初,生态学家便开始利用SAD模式刻画动物、植物及微生物群落结构[2-3],并试图用理论模型来阐释其产生机制[4- 7]。由于SAD模式仅强调群落整体的结构组成,并不涉及具体物种的差别[1],具有相同SAD模式的群落并不一定具有相同的群落组成;而以群落相似性为基础的排序分析能更加清晰的展现物种组成及其比例差异引起的植物群落结构分异特征。
物种间适合程度上的生态位分化对群落的构建模式有重要影响,因为植物对养分的竞争能力大小、空间扩展能力、繁殖能力均与其植株形态、根系分布等生长型特征有密切关系[8-9]。例如,直立丛生型的植物凭借其自身株高优势截获更多的光,促进植株对养分的吸收竞争能力;根茎型植物在养分匮乏时可以补充维持植株的生长。据此,可以认为物种的生长型对于群落组成的多度分布的影响也是不同的[10-11]。
富营养化、大气氮沉降等现象通过改变植物原有的土壤环境,从而对草地植被群落组成和结构产生直接影响[12-13]。过去的观测实验研究多次报道,N肥添加通常会增加群落的初级生产力,进而降低群落的物种丰富度[14- 16]。同样,P素富集会产生毒害作用,致使群落物种多样性丧失[17-18]。基于已有的大量研究结果,Elser等. 通过Meta分析指出,不论在陆地、海域,还是淡水生态系统,N和P共同限制着群落的生产力[19]。传统观念认为,N是青藏高原草地生态系统主要的限制性营养元素。而在养分循环的过程中,通过N的固定效应,N又与P素有密不可分的关联性[19- 21]。因而通过N、P添加开展相应研究,分析草地植物群落结构的变化,将有助于理解植物群落对N、P富集的响应机制,具有重要的现实意义[22]。
本文选择青藏高原亚高寒草甸群落为对象,通过添加N、P两种营养元素,并设置不同添加量,拟探讨以下几个问题: 1)不同水平的元素供应对植物群落结构发展趋势的影响;2) 不同元素添加处理对植物群落的物种多度分布模式的影响;3) 哪种生态学机制调控群落结构的上述变化?
1 材料与方法
1.1 试验地概况
试验地点选在兰州大学高寒草甸与湿地生态系统定位研究站(34°55′N、102°53′E,海拔 2900m),位于甘肃省甘南藏族自治州合作市郊区。该区域属亚高寒湿润区,年均降水量约 550 mm,年均气温2.4℃,月均温从1月的- 22 ℃—8月的26℃,每年的6—9月是植物生长的旺盛期。土壤为典型的钙质土,弱碱性。植被类型为多年生草本植物占优势的亚高寒草甸,具体有垂穗披碱草(Elymusnutans)、矮嵩草(Kobresiahumilis)、冷地早熟禾(Poacrymophila)、中华羊茅(Festucasinensis)等,主要伴生种有川甘蒲公英(Taraxacumlugubre)、甘青老鹳草(Geraniumpylzowianum)以及花苜蓿(Melissilusruthenicus)等。研究站1999年围封至今,禁牧前植被主要以矮嵩草、中华羊茅、甘青蒿(Artemisiatangutica)、鹅绒委陵菜 (Potentillaanserina) 为主。
1.2 试验设计与野外调查
N、P添加试验于 35 m×53 m的匀质样区进行,设N、P、N+P三类养分添加处理,其中每类处理各设3个添加量梯度(5、10、15g/m2),共9种添加组合(N5、N10、N15;P5、P10、P15;N5P5、N10P10、N15P15);设对照组(CK)。各处理3个重复,共计30个小区。小区大小5m×5m,其间设有1m缓冲带。每个小区内固定0.5m×0.5m的样方,用于长期观测。选用肥料为:尿素(CON2H4,N%=46%)和磷酸二氢钠(NaH2PO4,P%=44.60%)。自2009年开始,每年8月下旬选择阴雨天均匀撒施。施肥前,样区土壤(0—30cm)基况如下:每g干土中全氮含量为(3.739±0.052) mg,全磷含量为(0.649±0.01) mg。
野外植被调查于2013年7月下旬进行。用人工计数法确定并记录固定样方的物种及每个物种的多度。
1.3 数据分析
用单因素方差分析法(One Way ANOVA)分析了N、P、N+P添加各处理植物群落的物种丰富度差异,多重比较采用了LSD检验N、P、N+P添加处理和对照之间的差异性。以不同处理下固定样方为目标群落,以物种的相对盖度数据为基础,绘制不同处理下植物群落的种多度分布图。用非度量多维尺度分析(non-metric multidimensional scaling, NMDS)检验了各养分添加处理对植物群落相似性的影响。生长型根据植株的茎和根的生态型划定,分为株生长型(包括丛生型CS、分枝型ED、直立型EG、莲座型BRo)和根生长型(包括根茎型R、刷状根型BR、直根型TR)。用冗余分析(RDA)检验生长型和物种丰富度对物种多度的影响[11]。所有的统计分析均使用R ver.3.2.0 (R Development Core Team)软件进行。
2 结果与分析
2.1 氮磷添加对植物群落物种丰富度和种多度曲线的影响
对照群落的物种丰富度平均为48,与之相比,连续N、P添加4年后,随单一N添加水平的增加,群落的物种丰富度分别为44、33、30,呈显著降低趋势(F=42.6,P<0.001),降幅分别为6.3%、29.6%、37.3%,其中对照与N5处理、N10与N15处理间的群落物种丰富度变化差异不明显;N+P添加处理下,群落的物种丰富度随施肥量的增加而显著降低(F=16.4,P<0.001),具体为37、29、16,降幅分别为21.1%、38.7%、65.5%,比单独添加N元素各处理中物种丰富度的降幅大;P添加处理间群落的物种丰富度差异不显著(F=5.7,P0.05)(图1)。
随N素添加水平的增加,植物群落SAD曲线模式的斜率逐渐增加,其中N+P添加处理对群落SAD曲线的影响较N单独添加的效果显著(图2);单一P添加各处理间,植物群落SAD曲线的斜率差异不明显(图1)。
对照样方中,相对盖度最高的3个物种依次是甘青老鹳草(34%)、多枝黄芪(Astragaluspolycladus)(21.3%)和高山唐松草(Thalictrumalpinum)(21%)。单一N素添加后,随N添加水平的增加,禾草逐渐成为群落的优势种。N5处理下,群落中相对盖度最高的3个物种依次是甘青老鹳草(22.3%)、矮嵩草(21.5%)和野胡萝卜(Daucuscarota)(18.5%);N10处理下,群落中相对盖度最高的3个物种依次是矮藨草(Scirpuspumilus)(34%)、高山唐松草(13%)和甘青老鹳草(12%);N15处理下,群落中相对盖度最高的3个物种依次是垂穗披碱草(30%)、甘青老鹳草(22%)和中华羊茅15%。单一P素添加群落中,植物群落中的优势种随机变化。P5处理下,相对盖度最高的3个物种依次是甘青老鹳草(23%)、甘肃马先蒿(Pediculariskansuensis)(22%)和矮嵩草(20%);P10处理下,相对盖度最高的3个物种依次是中华羊茅(25.3%)、甘青蒿(22.6%)和川甘蒲公英(16.7%);P15处理下,相对盖度最高的3个物种依次是喉毛花 (Comastomapulmonarium)(21.3%)、甘青老鹳草(15.3%)和中华羊茅(12.3%)。N+P耦合添加群落中,随营养元素添加量的增加,植物群落中禾本科牧草逐渐居于绝对的优势地位。N5P5处理下,对盖度排前三位的物种依次为甘青老鹳草(22%)、高山唐松草(15.7%)和花苜蓿(12.7%);N10P10处理下,相对盖度最高的3个物种依次是中华羊茅(26.6%)、甘青老鹳草(22.6%)和甘青蒿(22%);N15P15处理下,相对盖度排前三位的物种依次为中华羊茅(56%)、冷地早熟禾(22%)和野胡萝卜(9.6%)。单一N与N+P耦合添加群落中,禾本科牧草的增加响应更为显著。
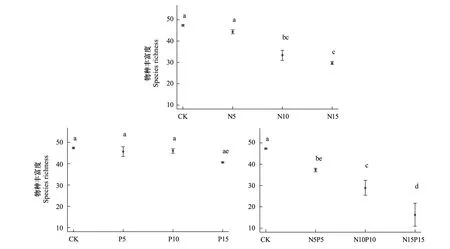
图1 资源添加各处理对植物群落物种丰富度的影响Fig.1 The differences of species richness of plant communities to N, P, and N+P additionsCK: 对照,control;N5,5g/m2氮元素添加,5g/m2 nitrogen addion; N10,10g/m2氮元素添加,10g/m2 nitrogen addion; N15,15g/m2氮元素添加,15g/m2 nitrogen addion; P5,5g/m2磷元素添加,5g/m2 phosphorus addion; P10,10g/m2磷元素添加,10g/m2 phosphorus addion; P15,15g/m2磷元素添加,15g/m2 phosphorus addion; N5P5,5g/m2氮元素和5g/m2磷元素添加,5g/m2 nitrogen and 5g/m2 phosphorus addion; N10P10,10g/m2氮元素和10g/m2磷元素添加,10g/m2 nitrogen and 10g/m2 phosphorus addion; N15P15,15g/m2氮元素和15g/m2磷元素添加,15g/m2 nitrogen and 15g/m2 phosphorus addion.
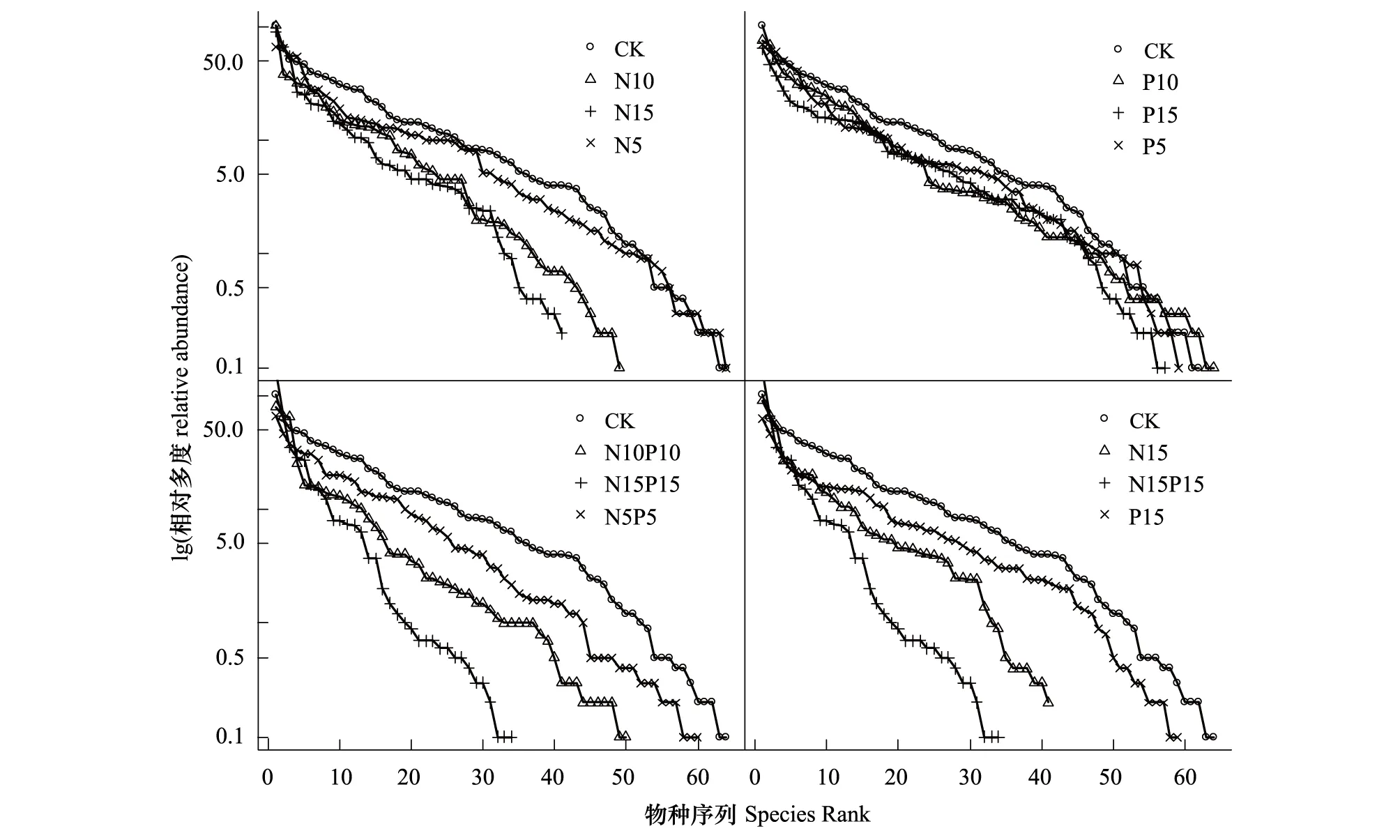
图2 N、P添加植被群落的物种多度分布(SAD)曲线Fig.2 The species-abundance distribution curve (SAD) of plant communities to N, P, and N+P additionsCK(对照)、N(氮添加) 、P(磷添加);N、P后的数字5、10、15代表添加量梯度(5、10、15 g/m2)
2.2 氮磷添加对植物群落相似性的影响
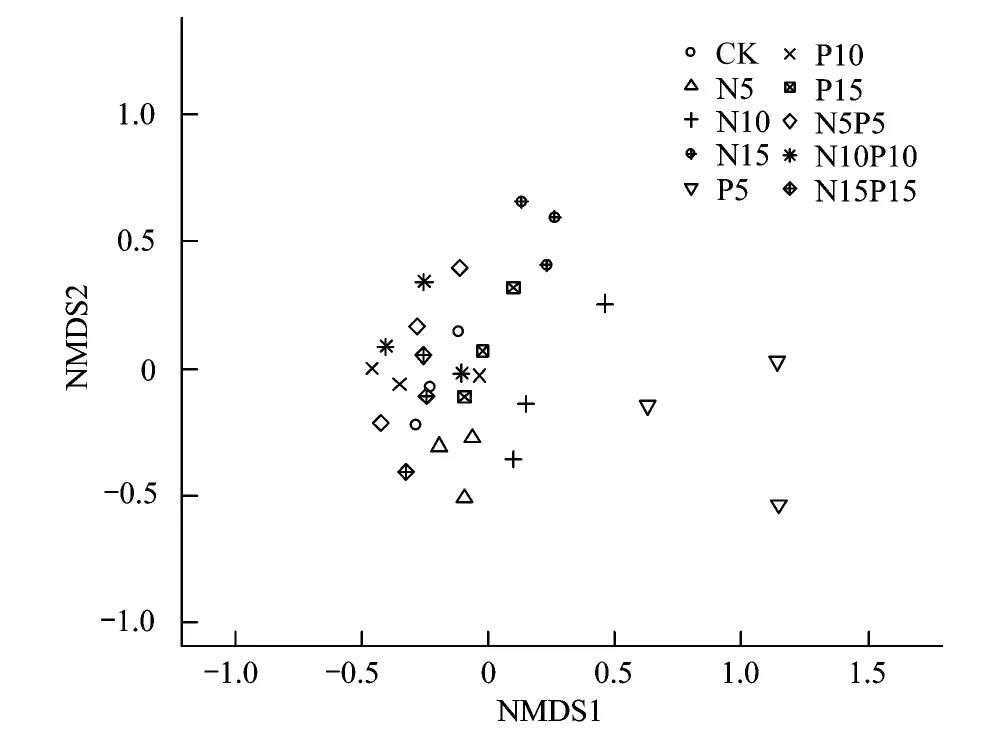
图3 N、P添加处理植被群落的非度量多维尺度分析(NMDS)排序图Fig.3 Ordination diagram of non-metric multidimensional scaling (NMDS) of plant communities to N, P, and N+P additions
从NMDS排序分析发现,不同的养分添加及同一养分不同添加水平可显著影响植被群落组成(图3)。由于本次NMDS排序分析得到的协强系数水平为0.152,这说明此排序结果可较好地解释养分添加各处理植物群落组成的差异。从该二维排序图可以看到,植物群落按照不同处理进行排列,同一处理的植物群落排列在一起。单一养分添加条件下,相同N添加水平的植被趋同,而不同的N添加水平的植被趋异;P10和P15水平的植被趋同,而P5水平的植被分布与之趋异。N+P耦合下3个添加水平的植被整体趋同。
2.3 植物群落不同生长型对氮磷添加的响应
在所有群落的株生长型中,直立型物种的丰富度最高(图4);而根生长型中,各类群间的物种数比例均匀(图5)。无论株生长型,还是根生长型,单一N和混合N+P添加条件下,各生长型的物种丰富度均随养分添加量的增加而降低,N+P复合添加处理下降幅更大(P<0.05);而单一P添加对群落各生长型的物种丰富度影响不显著(P0.05)(图4,图5)。
群落各生长型的相对盖度变化与丰富度变化存在一定差异(图4,图5)。对于所有群落而言,除N15处理外,直立型植物显著高于群落中其它株生长型植物的相对盖度(图4);而根生长型中的直根系类群盖度比例最小,且随着N、N+P施肥量的增加而降低(图5)。对于株生长型而言,单一N和混合N+P添加条件下,群落中莲座状和分枝型植物的相对盖度随元素添加量的增加表现出不同程度的降低;而丛生型的植物则不同程度的增加;直立型植物在N10和N10P10处理下显著高于对照,却在N15和N15P15处理下低于对照(图4)。对于根生长型而言,N添加条件下,根茎型和刷状根物种的相对盖度比例较直根类植物高,其中N10处理下,群落中刷状根和直根类植物的比例显著低于根茎型植物,群落以根茎型植物群为优势群;N+P混合添加量最大的条件下,群落中根茎型和直根类植物的比例显著低于刷状根植物,群落以刷状根生长型类群为优势群(图5)。单一P添加对群落各生长型的物种相对盖度影响不显著(P0.05)(图4,图5)。

图4 N、P添加对植物群落物种株生长型间物种丰富度和相对盖度的影响Fig.4 Effects of N, P, and N+P additions on species richness and relative coverage of different stem growth-forms plants
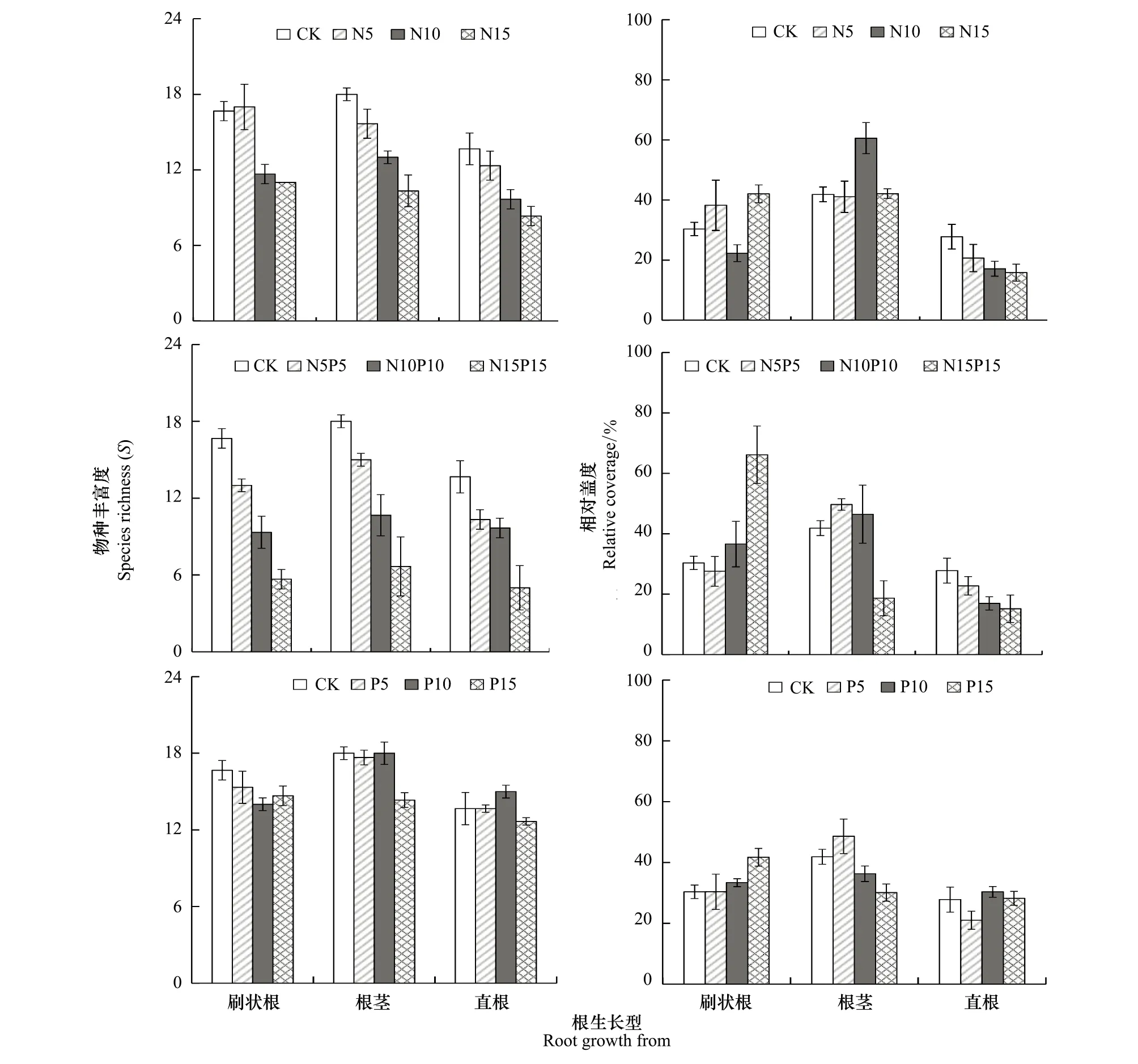
图5 N、P添加对植物群落物种根生长型间物种丰富度和相对盖度的影响Fig.5 Effects of N, P, and N+P additions on species richness and relative coverage of different root growth-forms plants
2.4 植物生长型特征和群落物种丰富度对群落物种多度分布的影响
由图6可见,植物生长型特征和元素添加处理对群落物种多度分布的总解释量为56.97%。RDA排序图中心位置聚集度高的物种为样区常见种,而排序图边缘位置散在分布的物种在与其最近距离的样方中占有绝对优势地位,对该样方在排序图中的位置具有决定作用。物种丰富度与第一轴的相关性最高;各生长型中,根茎型、丛生型和刷状根的物种与第一轴相关性最高,直立型和莲座状与第二轴的相关性最高。所有生长型的变量中,直立型和莲座型与根茎型的相关性最高,与物种丰富度呈显著正相关关系;丛生型和刷状根的相关性较高,与物种丰富度呈显著负相关关系。丛生型和刷状根的物种与N10P10、N15P15处理下的样方相关度很高,直立型和莲座型的物种与对照、P5和N5处理的样方间的关系紧密。例如,具有刷状根的丛生型植物垂穗披碱草在N15占有绝对优势,中华羊茅在N10P10、N15P15占有绝对优势,分别形成典型的单优势种的群落结构。
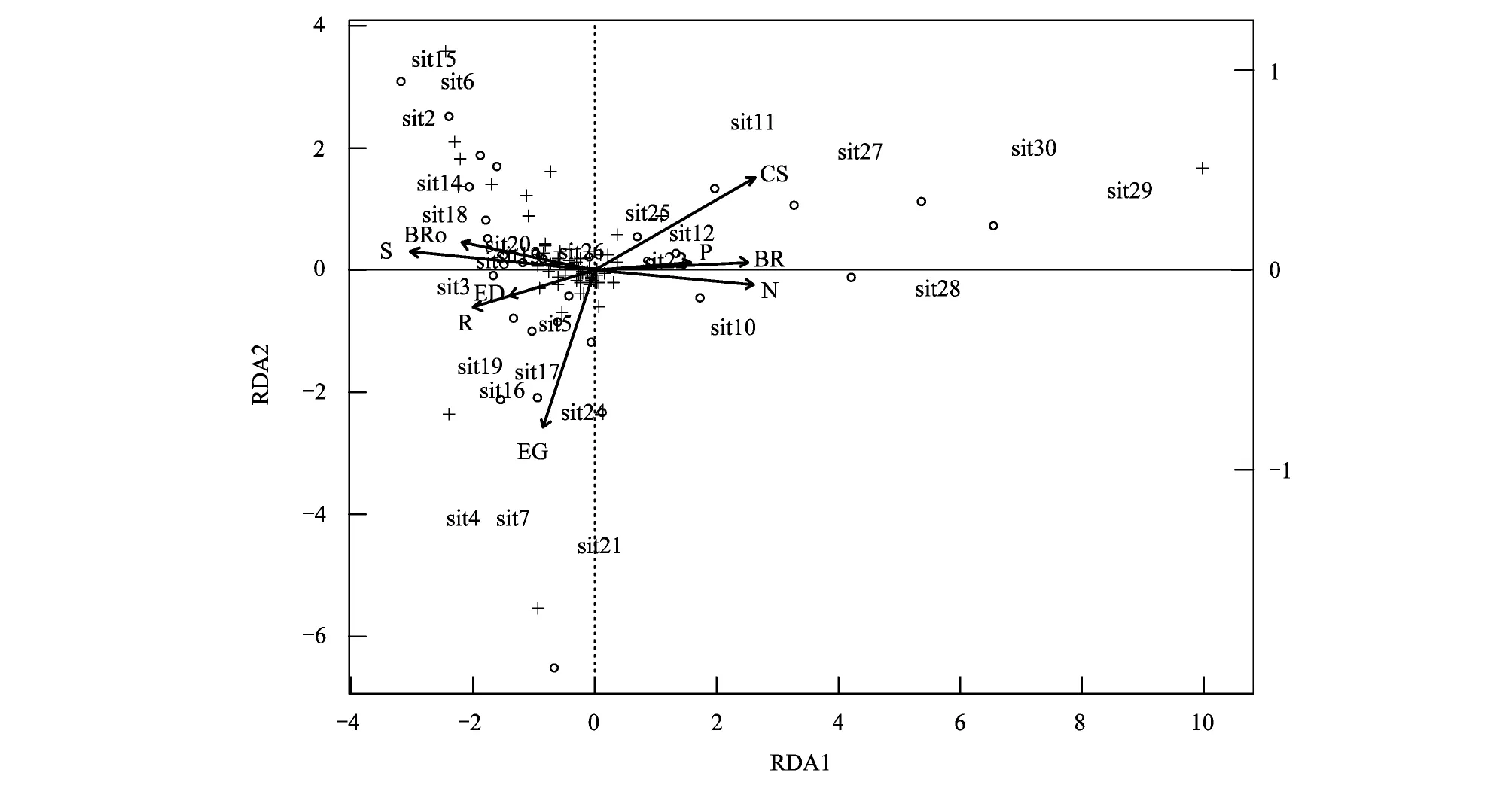
图6 N、P添加后植物群落物种生长型和丰富度与物种多度的冗余分析(RDA)排序图Fig.6 Ordination diagram of redundancy analysis (RDA) of plants growth-forms and species richness and species abundance to N, P, and N+P additions+代表物种;sit1- 30代表十个处理的样方: sit1- 3(CK),sit4- 6(N5),sit7- 9(N10),sit10- 12(N15),sit13- 15(P5),sit16- 18(P10),sit19- 21(P15),sit22- 24(N5 P5),sit25- 27(N10 P10),sit25- 27(N15 P15);CS(丛生型)、ED(分枝型)、EG(直立型)、BRo(莲座型)、R(根茎型)、BR(刷状根型)、TR(直根型);S(物种丰富度)、N(氮添加水平)、P(磷添加水平)
3 讨论
本样地施肥2年后,N处理下植被群落的生产力增加、物种丰富度降低,究其原因可能是生境和土壤的理化性质的差异所造成的[23]。养分添加4年后,随N素添加量的增加,植物群落的物种丰富度逐步降低,且其降幅在高N供应水平下尤为显著,而P素添加对植物群落物种丰富度的影响不显著,表明N富集会导致青藏高原亚高寒草甸植物群落的物种丧失。此结果与大量有关N富集研究的结论一致,其对象从陆地生态系统到水生生态系统,从高寒草甸到荒漠草原,从海洋生态系统到淡水系统[19,24-25]。其中与地上生物量紧密相关的光资源限制是解释N富集后物种多样性丧失的主要机制之一[20,26-27]。
本研究结果所见,植物群落物种丰富度的降幅对N+P同时添加的敏感性要大于N单独添加(图1,图2)。这说明N、P两种营养元素可能共同影响着青藏高原亚高寒草甸植物群落的生产力和物种组成。因为陆地生态系统中高比例的N素添加会逐渐降低N素限制,而增加其它养分的限制,此时添加P素会增加 N 素的利用效率[28]。这与资源-维度假说一致[29]。Harpole 和 Tilman选用N、P、K和水4种资源作为添加因子,在加州草原检验了此假说[13],发现随添加资源数目的增加,环境的生态位维度降低,导致草地群落生物量的增加和物种多样性的降低;并且依赖于N、P、K的限制等级,物种丰富度与生产力的关系可能会不同。这说明N富集条件下,多种养分共同调节着群落生产力与多样性[30]。
在本研究中,随着N添加量的增加,植物群落的SAD曲线由平缓转向陡峭,群落的均匀性降低。然而这些结果却与传统的正向演替轨迹背道而驰[31]。群落正向演替初期,物种组成简单,并具有明显的优势“等级”。随着演替的进行,系统变得越来越复杂,此时中间类型的物种占据了群落的大部分,在SAD曲线上表现为典型的S型曲线。大量观测实验研究表明N素富集的过程,尤其是在生产力增加的过程中,群落逐渐以部分物种为优势。这是因为高N环境(低pH)将会引起土壤中其它元素不足或释放,并有可能增加毒害作用,而最适应这些新环境的物种很可能不同于适应先前低氮环境的物种[19]。本文研究再次验证了此观点,N添加明显提高了丛生型、刷状根型的禾本科物种在群落中的优势度,尤其是在高氮含量添加处理后,群落中禾草的优势度尤为显著。在亚高寒草甸生态系统中,禾草类植物以其株高优势和刷状的根系特征,具有对水分和光的强竞争能力,成为优势建群种[15]。
植物生长型特征和元素添加方式及添加量引起的群落间物种丰富度的差异对群落物种多度分布和相似性特征有决定性贡献。本研究中,不同生长型的物种对N、P添加的响应不同。莲座状、根茎型的物种仅与低N及P添加群落相关性较高,表明其对N添加的敏感性较高。因为随着土壤环境中可被植物直接利用的有效N含量的增加,环境中的各养分比例发生变化,原有群落中大多适应低N环境的物种多度比例降低甚至消失,只有少数适应高N环境具有丛生型、刷状根型的物种比例升高,群落中的优势种和稀有种发生周转,群落结构发生变化[16]。N、P添加4年后,获得不同数量N的样方物种组成趋异,获取相同数量N的样方相似性增加。究其原因,N及其它养分有效性的变化、群落间物种数的差异、群落初始物种组成的差异和不同植物对N富集的敏感度不同,可影响到N添加梯度下群落相似性的变化[32]。研究结果还发现,即使相同N素添加量条件下,N+P添加与N单独添加的群落间在排序图中也存在一定的距离而分异,这是因为N单独添加,使群落的限制性因素转化为P素的限制,而N+P添加补充了P需求,从而导致群落优势种不同,决定了其相似性的差异[13]。
综上所述,得出以下结论:在青藏高原的亚高寒草甸地区,N是主要的限制因素。随N添加量的增加,植物群落的物种丰富度逐渐丧失,其中莲座状与分枝型的直根类植物逐渐减少,丛生型、刷状根型的植物成为群落的优势群(如垂穗披碱草、中华羊茅),从而引起群落组成的重新排序(包括物种的周转和丧失、优势种的变化及其相对多度的转化),导致植物群落的SAD曲线逐渐陡峭,群落的相似性增加;P素单一添加对植物群落的影响不显著;而N+P添加可补充单一N添加引起的P限制,增加 N 素的利用效率,群落的变化更显著。植物间生长型特征的分化和N、P添加引起的物种丰富度的变化对植物群落物种多度分布模式的解释量高达56.97%。
[1] McGill B J, Etienne R S, Gray J S, Alonso D, Anderson M J, Benecha H K, Dornelas M, Enquist B J, Green J L, He F L, Hurlbert A H, Magurran A E, Marquet P A, Maurer B A, Ostling A, Soykan C U, Ugland K I, White E P. Species abundance distributions: moving beyond single prediction theories to integration within an ecological framework. Ecology Letters, 2007, 10(10): 995- 1015.
[2] Arrhenius O. Statistical investigations in the constitution of plant associations. Ecology, 1923, 4(1): 68- 73.
[3] Fisher R A, Corbet A S, Williams C B. The relation between the number of species and the number of individuals in a random sample of an animal population. Journal of Animal Ecology, 1943, 12(1): 42- 58.
[4] May R M. Patterns of species abundance and diversity//Coday M L, Diamond J M, eds. Ecology and Evolution of Communities. Cambridge, MA: Harvard Universiy Press, 1975: 81- 120.
[5] Marquet P A, Keymer J E, Cofré H. Breaking the stick in space: of niche models, metacommunities and patterns in the relative abundance of species//Blackburn G A, Gaston K J, eds. Macroecology: Concepts and Consequences. Oxford, UK: Blackwell, 2003: 64- 84.
[7] Hubbell S P. The unified neutral theory of biodiversity and biogeography. Princeton: Princeton University Press, 2001.
[8] Silvertown J. Plant coexistence and the niche. Trends in Ecology & Evolution, 2004, 19(11): 605- 611.
[9] McKane R B, Johnson L C, Shaver G R, Nadelhoffer K J, Rastetter E B, Fry B, Giblin A E, Kielland K, Kwiatkowski B L, Laundre J A, Murray G. Resource-based niches provide a basis for plant species diversity and dominance in arctic tundra. Nature, 2002, 415(6867): 68- 71.
[10] 袁秀, 马克明, 王德. 黄河三角洲植物生态位和生态幅对物种分布-多度关系的解释. 生态学报, 2011, 31(7): 1955- 1961.
[11] 韩大勇, 杨允菲. 松嫩草地植物群落物种多度-分布关系及其解释. 生物多样性, 2014, 22(3): 348- 357.
[12] Suding K N, Collins S L, Gough L, Clark C, Cleland E E, Gross K L, Milchunas D G, Pennings S. Functional-and abundance-based mechanisms explain diversity loss due to N fertilization. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(12): 4387- 4392.
[13] Harpole W S, Tilman D. Grassland species loss resulting from reduced niche dimension. Nature, 2007, 446(7137): 791- 793.
[14] Stevens C J, Dise N B, Mountford J O, Gowing D J. Impact of nitrogen deposition on the species richness of grasslands. Science, 2004, 303(5665): 1876- 1879.
[15] Ren Z W, Li Q, Chu C J, Zhao L Q, Zhang J Q, Ai D, Yang Y B, Wang G. Effects of resource additions on species richness and ANPP in an alpine meadow community. Journal of Plant Ecology, 2010, 3(1): 25- 31.
[16] Clark C M, Cleland E E, Collins S L, Fargione J E, Gough L, Gross K L, Pennings S C, Suding K N, Grace J B. Environmental and plant community determinants of species loss following nitrogen enrichment. Ecology Letters, 2007, 10(7): 596- 607.
[17] Ceulemans T, Merckx R, Hens M, Honnay O. A trait-based analysis of the role of phosphorus vs. nitrogen enrichment in plant species loss across North-west European grasslands. Journal of Applied Ecology, 2011, 48(5): 1155- 1163.
[18] Ceulemans T, Merckx R, Hens M, Honnay O. Plant species loss from European semi-natural grasslands following nutrient enrichment-is it nitrogen or is it phosphorus? Global Ecology and Biogeography, 2013, 22(1): 73- 82.
[19] Elser J J, Bracken M E S, Cleland E E, Gruner D S, Harpole W S, Hillebrand H, Ngai J T, Seabloom E W, Shurin J B, Smith J E. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems. Ecology Letters, 2007, 10(12): 1135- 1142.
[20] Hautier Y, Niklaus P A, Hector A. Competition for light causes plant biodiversity loss after eutrophication. Science, 2009, 324(5927): 636- 638.
[21] Herbert D A, Rastetter E B, Gough L, Shaver G R. Species diversity across nutrient gradients: an analysis of resource competition in model ecosystems. Ecosystems, 2004, 7(3): 296- 310.
[22] 宾振钧, 张仁懿, 张文鹏, 徐当会. 氮磷硅添加对青藏高原高寒草甸垂穗披碱草叶片碳氮磷的影响. 生态学报, 2015, 35(14): 4699- 4706.
[23] 齐瑞, 杨莹博, 任正炜, 张仁懿, 王刚. 青藏高原亚高寒草甸植物群落对氮磷添加的响应. 中国科技论文在线.[2012- 12-06]. http://www.paper.edu.cn/releasepaper/content/201212- 63.
[24] Niu K C, Luo Y J, Choler P, Du G Z. The role of biomass allocation strategy in diversity loss due to fertilization. Basic and Applied Ecology, 2008, 9(5): 485- 493.
[25] 李文娇, 刘红梅, 赵建宁, 修伟明, 张贵龙, 皇甫超河, 杨殿林. 氮素和水分添加对贝加尔针茅草原植物多样性及生物量的影响. 生态学报, 2015, 35(19): 6460- 6469.
[26] Borer E T, Seabloom E W, Gruner D S, Harpole W S, Hillebrand H, Lind E M, Adler P B, Alberti J, Anderson T M, Bakker J D, Biederman L, Blumenthal D, Brown C S, Brudvig L A, Buckley Y M, Cadotte M, Chu C, Cleland E E, Crawley M J, Daleo P, Damschen E I, Davies K F, DeCrappeo N M, Du G, Firn J, Hautier Y, Heckman R W, Hector A, HilleRisLambers J, Iribarne O, Klein J A, Knops J M, La Pierre K J, Leakey A D, Li W, MacDougall A S, McCulley R L, Melbourne B A, Mitchell C E, Moore J L, Mortensen B, O′Halloran L R, Orrock J L, Pascual J, Prober S M, Pyke D A, Risch A C, Schuetz M, Smith M D, Stevens C J, Sullivan L L, Williams R J, Wragg P D, Wright J P, Yang LH. Herbivores and nutrients control grassland plant diversity via light limitation. Nature, 2014, 508(7497): 517- 520.
[27] Tilman D. Species richness of experimental productivity gradients: how important is colonization limitation? Ecology, 1993, 74(8): 2179- 2191.
[28] Chapin III F S. The mineral nutrition of wild plants. Annual Review of Ecology and Systematics, 1980, 11: 233- 260.
[29] Hutchinson G E. Concluding remarks. Cold Spring Harbor Symposia on Quantitative Biology, 1957, 22: 415- 427.
[30] Venterink H O. Does phosphorus limitation promote species-rich plant communities? Plant and Soil, 2011, 345(1/2): 1- 9.
[31] Bazzaz F A. Plant species diversity in old-field successional ecosystems in southern Illinois. Ecology, 1975, 56(2): 485- 488.
[32] Inouye R S, Tilman D. Convergence and divergence of old-field vegetation after 11 yr of nitrogen addition. Ecology, 1995, 76(6): 1872- 1887.
Responses of species abundance distribution and community similarity to nitrogen and phosphorus additions in a subalpine meadow
YANG Yingbo, BAI Rong, LI Shuang, LI Zhongming, LI Haiwei, SHEN Yuying*
StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730000,China
Nitrogen (N) and phosphorus (P) addition can cause species richness loss in grassland ecosystems. However, few studies have reported the changes in species abundance distribution (SAD) patterns and the development direction of plant communities after fertilization. In the present study, for 4 years, a randomized block design experiment, using N and/or P fertilizers at different concentrations, was conducted in a subalpine meadow in Qinghai-Tibet. With data from the fourth year observation, we analyzed the effects of N, P, and N+P additions on species richness, SAD, and community similarity. We also evaluated the contributions of species richness and plant growth form on community structure and species abundance. Results indicated that within the N or N+P addition treatments, community species richness significantly decreased (P<0.001), the slope of SAD patterns tended to be steeper with higher levels of N addition after four years of treatment. The community species richness and SAD curve responses were more significant in treatments with combined N+P addition than in those with only N addition. For example, in plots with N supply, mean species richness was 44 at an N level of 5 g/m2, 33 at 10 g/m2, and 30 at 15 g/m2. In contrast, in plots with N+P supply, mean species richness values were 37, 29, and 16 at the three N+P addition levels, respectively. Plots with 15 g/m2N+P addition showed the largest extent in species richness loss, which could be 65.5% of the mean control plot species richness. Another result was that in plots with the same resource (single N or combined N+P) addition, vegetation composition diverged among treatments with different N concentrations, whereas vegetation composition converged between treatments with the same N concentrations (stress level = 0.152). Furthermore, in the N and N+P addition plots, gramineous plants with brushy roots and caespitose stems gradually became dominant. In contrast, plants with the characteristic of rosette-like leaves, and straight branches, stems, rhizomes, and roots gradually decreased in the plant community. In addition, the responses of community species richness, SAD curves, and community similarity to P addition were not significant (P0.05). Finally, 56.97% of SAD could be explained by differences in plant growth forms and changes of species richness, induced by the different treatments. Species richness was positively related to plants with rosette-like leaves and rhizomes, but a remarkable negative correlation existed between species richness and plants with brushy roots and caespitose stems. These results suggest that N addition induces a series of changes in plant community composition. These changes include species loss and rearrangement, dominant species turnover and changes of relative abundance of community species (i.e., a change in the slope of the SAD curve). Furthermore, communities tend to be more similar at the same level of N supply, and more divergent at different levels of N addition. Under the condition of N accumulation, P addition could promote the use efficiency of N, and this effect can be amplified with increasing concentrations of N supply. Overall, the community structure was affected by multiple resources and resource supply levels in this subalpine meadow.
Qinghai-Tibetan Plateau; N,P additions; species richness; biodiversity; community structure; growth forms
10.5846/stxb201512072446
国家自然科学青年基金项目(31601984,41101524);国家公益性行业科研专项(201203006);教育部长江学者和创新团队发展计划资助项目(IRT13019);中央高校基本科研业务费专项资助项目(lzujbky- 2012-08, lzujbky- 2015- 191)
2015- 12- 07;
2016- 12- 27
杨莹博,白荣, 李爽, 李忠明, 李海伟, 沈禹颖.亚高寒草甸植物群落种多度分布关系及相似性对氮磷添加的响应.生态学报,2017,37(7):2290- 2299.
Yang Y B, Bai R, Li S, Li Z M, Li H W, Shen Y Y.Responses of species abundance distribution and community similarity to nitrogen and phosphorus additions in a subalpine meadow.Acta Ecologica Sinica,2017,37(7):2290- 2299.
*通讯作者Corresponding author.E-mail: yy.shen@lzu.edu.cn.
