美国南卡罗来纳州森林湿地十种典型植物凋落叶的分解特征
2017-06-27李巧玲
李巧玲,曾 辉,2,*
1 北京大学深圳研究生院, 深圳 518055 2 北京大学城市与环境学院, 北京 100871
美国南卡罗来纳州森林湿地十种典型植物凋落叶的分解特征
李巧玲1,曾 辉1,2,*
1 北京大学深圳研究生院, 深圳 518055 2 北京大学城市与环境学院, 北京 100871
凋落叶分解是控制森林湿地物质循环的重要生态过程,是全球C、N等元素循环的重要一部分。以美国南卡罗来纳州10种典型植物的凋落叶为研究对象,通过2a的分解实验测定分解阶段凋落叶的生物量残留率、分解速率常数k和C、N残留百分比,探讨初始凋落叶化学性质对分解速率常数k的影响。结果表明:(1)十种凋落叶生物量在两年内降解至初始的14.5%—66.2%,种间差异可达4倍以上;分解速率常数k在0.26—1.64 a-1之间,针叶分解速率<阔叶分解速率;(2)分解速率常数k与初始凋落叶酸溶性组分(AS)极显著正相关(P<0.001),与初始C含量、酸不溶组分(AIF)和AIF/N比均显著负相关(P<0.05);(3)凋落叶C残留百分比持续下降至10.2%—66.1%,而N残留百分比因物种与分解阶段不同呈现不同变化规律。结果表明,森林湿地中凋落叶初始C组分差异是其分解速率的种间极大差异的主要原因,评估森林湿地的C、N循环应充分考虑种间差异。
森林湿地;凋落叶;分解速率常数;初始碳组分;C、N元素
Li Qiaoling1, Zeng Hui1,2,*
森林湿地是陆生生态系统和水生生态系统之间的过渡带[1],由于其地表长期或季节性处于过湿或积水状态,与非森林湿地相比,具有更高生产力、更活跃的元素循环和生物地球化学循环[2]。凋落叶的分解使营养元素从凋落叶回归土壤,决定着植物对营养元素的可得到性[3]和土壤有机质的形成[4],影响湿地生态系统作为元素库的营养元素循环功能[5]和全球C、N等元素的循环,是生态系统物质循环和能量流通的重要环节[6]。
湿地和非湿地森林生态系统中凋落叶的分解由3个因素共同决定:化学因素即凋落物的化学组成、物理因素即气候和环境条件、生物因素如参与分解的微生物和无脊椎动物等[7]。其中,凋落叶的初始化学组成是控制分解速率和分解模式的关键因素[8-9]。研究表明:初始化学性质指标如木质素含量[10]、初始元素浓度尤其是N、P元素浓度[3, 11]、C/N比[11- 13]、N/P比[14]、木质素/N[15]、初始C组分中非极性提取物、水溶性组分和酸溶性组分等[16- 18]与分解速率有显著相关关系。与非森林湿地不同的是,水文条件是湿地生态系统环境条件中最重要的因素,它控制着有机质的产生和转变过程[19]。季节性湿润的水文状况促进凋落叶中化学物质溶解和元素的释放、提供异养微生物分解所需的水分[20-21],导致同等条件下,森林湿地的凋落叶分解速率比非森林湿地高[3]。目前大部分凋落叶分解实验在非森林湿地进行,对陆地生态系统中凋落叶的分解特征和机制的了解较为深入,但是对森林湿地凋落叶分解的机制和特征研究较少,探索森林湿地凋落叶的分解过程对了解森林湿地生物地球化学循环具有重要意义。
Hobcaw Barony自然保护区位于南卡罗来纳州乔治敦县以东6 km的区域,受人类活动的干扰少[22]。从20世纪80年代开始成为浅滩鸟类聚居地,有南卡罗来纳州最大的鸟类集群,是鸟类的重要保护地[23],此外也是野生昆虫和水生生物重要栖息地[24-25],对维持生物多样性发挥着重要作用。同时该自然保护区也是研究淡水森林沼泽(swamp),潮汐森林沼泽(tidal swamp)和滨海盐沼湿地(salt marsh)元素循环的一个典型区域[26- 29]。本文选取Hobcaw Barony自然保护区中的Pate淡水森林湿地作为研究样地,分析该样地内十种典型植物凋落叶的分解特征和种间差异,为深入了解森林湿地的凋落叶分解过程、种间分解差异的成因提供理论基础。
1 材料与方法
1.1 研究区概况
凋落叶分解实验在Hobcaw Barony自然保护区(70.8 km2)北部的季节性淡水湿地Pate样地进行(2.83 km2)。Hobcaw Barony自然保护区位于美国东南海岸南卡罗来纳州乔治敦县内(Georgetown,South Carolina),Winyah bay(美国东岸第三大流域入海口)以北,地理坐标79°12′33.37”W,33°22′2.88”N,海拔20—25 m,具有典型的亚热带气候带“冬暖夏热”的气候特点;年平均降水量为1312 mm,1月最低温度为-2.5 ℃,7月最高温度为30 ℃[29]。Pate样地由克莱姆森大学与Wallace F. Pate环境研究与教育基金共同管理,是美国东南部典型的季节性针阔叶混合森林湿地。该样地中低洼地主要植物群落以落羽杉属(Taxodium spp.)和蓝果树属(Nyssa spp.)的乔木种为主,包含美国水松(bald cypress;Taxodiumdistichum),水紫树(water tupelo;Nyssaaquatica),红花槭(red maple;Acerrubrum),洋白蜡(green ash;Fraxinuspennsylvanica),北美枫香(sweetgum;Liquidambarstyraciflua)等。周围过渡地区和旱地包括松属(Pinus spp.),栎属(Quercus spp.),槭属(Acer spp.),榆属(Ulmus spp.)等乔木。样地内水位有季节性波动变化,冬季后期处于高水位状态,夏季至秋末处于低水位状态,通常情况下水位高于土壤表面50 cm,但严重旱季期水位降至低于地表1 m以下[30]。
1.2 实验材料
本研究收集研究区内10种典型植物的凋落叶作为研究对象,包括水紫树(water tupelo,NyssaaquaticaL.),红花槭(red maple,AcerrubrumL.),泡泡树(pawpaw,Asiminatriloba(L.) Dunal),美洲朴(hackberry,CeltisoccidentalisL.),洋白蜡(green ash,FraxinuspennsylvanicaMill.),北美枫香(sweetgum,LiquidambarstyracifluaMill.),长叶松(longleaf pine,PinuspalustrisMill.),美国梧桐(sycamore,PlatanusoccidentalisL.),美国水松(bald cypress,Taxodiumdistichum(L.) Rich.)以及美国榆(American elm,UlmusamericanaL.)。其中长叶松,美国水松,水紫树的凋落叶在研究样地收集,而其他树种的凋落叶由于在原生样地难以采集足够数量,则在离样地西北方向约150km的南卡罗来纳州Congaree国家森林湿地公园中类似的生境中收集得到。所有凋落叶均使用悬空的收集网收集,凋落叶在1个月内转移到实验室进行处理。预实验比较Congaree国家森林湿地公园中与Pate样地中的同种凋落叶并没有显著的化学性质差异。
1.3 实验方法
1.3.1 实验设计
把凋落叶并按物种分离后,剪掉叶柄置于50 ℃烘箱(德国Memmert,Beschickung Loading Modell 100—800)里烘干72 h。使用15个20 cm × 15 cm 尼龙分解袋(孔径0.15 mm)分装每种凋落叶,每袋称入约3.00 g干燥后的凋落叶。2011年11月25日把分解袋放置在Hobcaw Barony自然保护区(70.8 km2)北部的季节性淡水湿地Pate样地凋落物表层,并使用钢丝固定分解袋位置。于30d、61d、194d、370d、735d后收集得每种植物叶片样品各3袋,用低温超纯水(4 ℃)洗净表面的泥沙,把凋落叶放置于50 ℃烘箱烘72 h,称重并记录结果。
1.3.2 样品处理
预处理:用植物研磨仪(德国Retsch,ZM 200)研磨干燥后的样品并过200目尼龙筛;
C、N元素测定:用CHN元素分析仪(德国Elementar,vario EL cube)测定不同分解阶段样品的C、H、N元素含量;
灰分测定:准确称量20.0 mg样品置于马弗炉(德国Nabertherm,LE 6/11/B150)中575 ℃烧4 h,测得各样品的灰分含量百分比,用于计算样品的生物量;
C组分测定:采用Ryan等[31]的方法,改良实验用的材料,将定性滤纸换成PATE 0.45m的滤膜,测得初始样品的3种初始C组分的含量(可提取物,记为extractives;酸可溶组分,记为acid soluble fraction, 或AS;酸不溶组分,记为acid insoluble fraction,或AIF)。具体步骤为:称取经研磨过筛的干燥样品30 mg左右,记为m0;常温下用氯仿甲醇提取3 h后过滤,105℃烘干24 h,干燥容器内冷却至常温,称重记为m1;用72%的硫酸常温下处理经氯仿甲醇提取并烘干过的样品,过滤,并用95 ℃超纯水冲洗滤渣至pH=7,105 ℃烘干24 h,干燥容器内冷却至常温,称得剩余残渣的重量m2;剩余残渣置于马弗炉中550 ℃烧灰4 h,冷却至常温称得灰分重量m3。各初始C组分计算公式如下[31]:



1.3.3 数据分析
分解速率常数(k)、生物量分解50%所需时间、生物量分解95%所需时间可通过以下公式进行计算,k:Wt/W0=e-kt,T1/2=0.693/k,T95=3/k。
W0代表凋落物的初始质量,Wt代表某段时间凋落物的质量,t是凋落物的分解时间;T1/2表示生物量分解50%所需要的时间;T95表示生物量分解95%所需要的时间[32]。
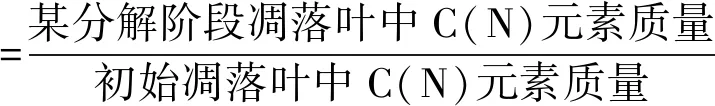
本研究用方差分析和S-N-K法对凋落叶生物量残留率进行多重比较;用一元线性回归和相关分析探讨分解速率常数与凋落叶初始化学性质指标的相关关系,用SigmaPlot作图。
2 结果
10种凋落叶的生物量残留率(排除了灰分)如图 1所示。10种凋落物的生物量残留率变化规律一致,均表现为生物量随着时间的推移而减少。经过2a的分解后,凋落叶的残留率由小到大依次为:泡泡树 (14.5%)美洲朴 (17.3%) < 红花槭 (29.0%)水紫树 (37.6%) < 美国榆 (55.7%)北美枫香 (56.8%)美国水松 (59.7%)美国梧桐 (62.4%)洋白蜡 (62.5%)长叶松 (66.2%;表1)。

图1 10种凋落叶分解过程中生物量残留率的动态变化图Fig.1 Percent of remaining biomass at different decomposition stages for 10 foliar litters
2.2 凋落叶分解速率
根据Olson建立的凋落物分解指数衰减模型[32]对10种凋落叶的分解速率进行模拟,拟合的各凋落叶的分解速率常数见表 1。分解速率常数k越大,对应凋落叶分解速率越大,分解50%和95%的生物量所需时间越短。10种凋落叶的k值差异较大,在0.26—1.64a-1范围内;分解50%和95%的生物量所需时间由短至长为:泡泡树 < 美洲朴 < 红花槭 < 水紫树 < 美国榆 < 北美枫香 < 美国水松 < 洋白蜡 < 长叶松美国梧桐。这一结果与2年后凋落叶的生物量残留率大小顺序相比,除洋白蜡的相对大小顺序有变化外,其他植物的相对大小顺序保持不变。

表1 10种凋落叶生物量残留率、分解速率常数k的多重比较表
k:分解速率常数;T1/2: 凋落叶分解一半初始生物量所需的时间,T95: 凋落叶分解95%的初始生物量所需的时间:T1/2=0.693/k;T95=3/k;表中生物量残留率不同的小写字母表示种间有显著差异;S-N-K检验的显著性水平是0.05
2.3 凋落叶初始化学组成
10种凋落叶的初始C组分为(表 2):可提取物在0.1%—14.8%范围内,酸溶性组分在48.0%—73.1%范围内,酸不溶组分在22.2%—51.6%范围内。分解速率常数k与初始C组分的关系如图 2:分解速率常数k与初始酸溶性组分极显著正相关(P<0.01),与酸不溶组分极显著负相关(P<0.01),与可提取物不相关(P0.05)。分解速率常数k与初始C、N元素含量的关系如图 3:分解速率常数k与初始C含量、初始AIF/N显著负相关(P<0.05),与初始N元素含量、C/N比、初始灰分含量无显著相关性。

表2 10种凋落叶的初始C组分、C、N及灰分含量、C/N和AIF/N
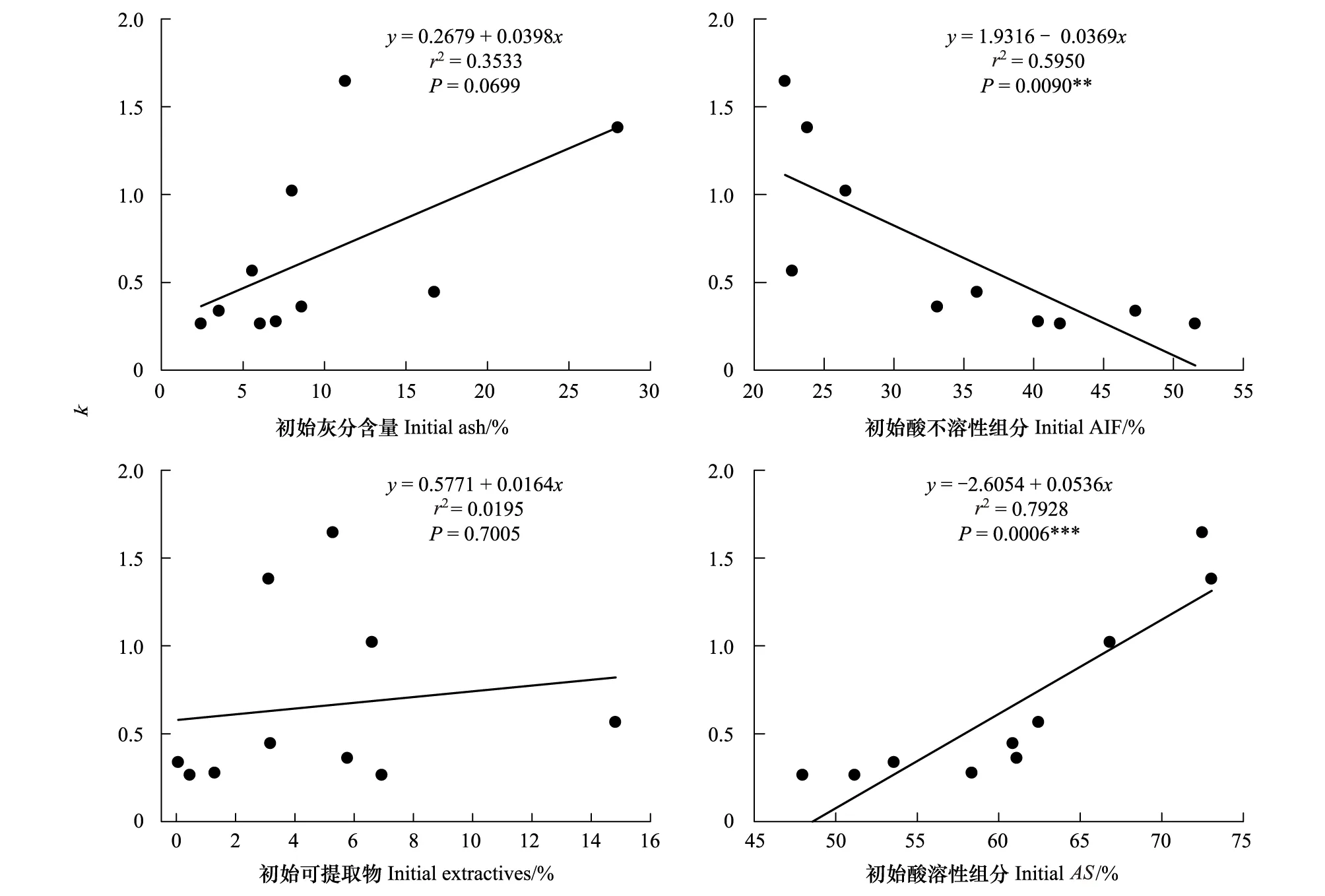
图2 分解速率常数与初始灰分和C组分的回归图Fig.2 Relationship between initial ash, carbon fractions and decomposition rate constant using simple linear regression

图3 分解速率常数与初始C、N元素指标的回归图Fig.3 Relationship between initial C, N indicators and decomposition rate constant using simple linear regression
2.4 C、N残留百分比动态及C/N比
不同植物的C、N残留百分比动态存在差异,但C残留百分比和C/N比变化有类似的规律(图 4)。所有植物的C残留百分比在经过两年的分解后均降低,其中,泡泡树的C残留百分比下降最多,最终的C残留百分比降低至10.2%;长叶松的C残留百分比下降最少,最终的C残留百分比高达66.1%。C残留百分比有相同的变化规律:在分解的前一个月,C残留百分比急剧降低,在第2个月内降低速率减缓,从分解的第3个月到第24个月内,除美国榆在最后12个月内C残留百分比降低量很小之外,其余九种凋落叶的C残留百分比均大幅度降低。C残留百分比的降低规律说明10种凋落叶的C残留量在分解过程中一致降低。
分解两年后,不同植物的N残留百分比有差异,在20%—142%范围内(图 4)。其中,北美枫香和美国榆的N残留百分比大于100%,分解两年后的N含量较初始N含量有所增加;泡泡树、美洲朴、长叶松、红花槭和美国水松的N残留百分比小于100%,分解两年后的N含量低于初始N含量;美国梧桐、洋白蜡和水紫树的N残留百分比在100%附近,分解两年后的N含量与初始N含量接近。在分解过程中,N残留百分比呈现“先增加,后降低”、“持续降低”和“持续增加”的变化规律,说明N元素呈现“先固持,后释放”、 “持续释放”、“持续固持”3种模式。其中,水紫树、美国梧桐、长叶松的N元素“先固持,后释放”,美国榆和北美枫香的N元素则“持续固持”,红花槭、美洲朴、美国水松、泡泡树和洋白蜡的N元素“持续释放”。
最后,石里克最大的问题是他对直观哲学提出的疑难亦可以反问于他自身:既然体验与认识有本质区别,那么概念的配列能保持事实的本来面貌吗?概念与对象的一义性判断之网如何能够达成?换句话说,既然体验与认识有本质区别,那么体验与认识又是如何能结合为一个具有统一性的系统呢?这一问题可以称为知识论中的超越问题。石里克大方地承认概念一义性的判断之网,并不能保证对事物的实在本质的知识,想获取事物的本质知识恰恰是直观哲学的错误。然而,直观哲学的本质论恰恰是以悬置事物的存在为前提,所以直观哲学绕开了实在本质的问题,而石里克却以事物的存在为事实,那么实在本质的问题就成为石里克认识论难以解决却如影随形的难题。
10种凋落叶的C/N比值在16—118范围内,分解两年后的C/N比较初始C/N比有所降低。在整个分解过程中,长叶松和北美枫香的C/N比始终高于其他八种植物凋落叶。C/N比变化规律呈现出一致性:除长叶松的C/N比“先增加,后降低”外,其他植物凋落叶的C/N在分解期内持续降低,最终C/N比在20—40范围内。
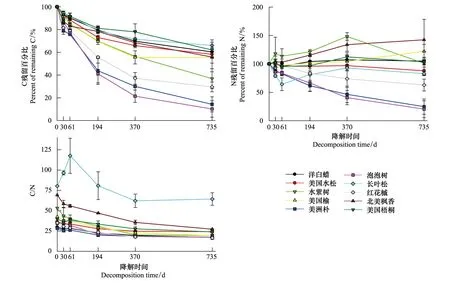
图4 10种凋落叶的C、N残留百分比和C/N比动态图Fig.4 Percent of remaining C, N and C/N ratio at different decomposition stages
3 讨论
3.1 凋落叶分解速率规律及成因
此前的研究表明:裸子植物的针叶比被子植物的阔叶分解慢[33-34],常绿树的叶片比落叶树的叶片分解慢[33]。本研究中,裸子、常绿植物长叶松针叶的分解速率常数为k=0.26a-1,小于除美国梧桐以外的其他8种被子、阔叶植物,进一步验证了在森林湿地这一分解速率差异规律仍然成立。这一分解速率差异与凋落叶的理化性质有关:阔叶树种可溶性组分含量高,在森林湿地由于长期水淹,分解速率较快;而针叶树由于叶面积较小、叶片抗张强度大[35]、木栓层、角质层和蜡质层含量高[36]等因素,淋溶作用不明显,分解主要依靠微生物作用,分解速率较慢。但是,有研究表明:阔叶树和针叶树凋落叶的分解速率差异仅存在于分解开始的1—3a,之后两者的分解速率接近[8],这或许与凋落叶的阶段性分解特征有关。
初始化学组成是控制凋落叶分解速率的重要因子[3]。本研究发现:分解速率常数k与初始AIF/N和初始AIF含量负相关,这一研究结果与Bray等人在陆地生态系统做的研究结论一致[16],说明初始AIF/N、初始AIF含量与分解速率的负相关性不受植物物种和生态系统类型的影响。本研究中,分解速率常数k与初始C含量负相关的研究结果与Barbhuiya等人在亚热带常绿森林[11]、Shaw等人在亚高山草甸[15]的研究结果相同,进一步阐明初始C含量高不利于凋落叶的分解。
一些研究者认为,凋落叶的初始N浓度和C/N比能显著影响凋落物分解速率[11, 37]。我国多种森林凋落物分解速率均与凋落物初始N浓度显著正相关[38],且C/N比能解释70.2%的分解速率差异[39]。但本研究中,森林湿地10种凋落叶的分解速率与初始N含量和C/N比并无相关性,这与森林湿地的高生产力有关。分解初期,N是微生物繁殖不可缺少的元素,丰富的N含量促进微生物的繁殖和生命活动,加速凋落物分解[40],因而初始N浓度高有利于凋落物分解;但森林湿地中地表和土壤中的N含量较陆地系统高,已经能满足微生物繁殖和分解的N需求,因而初始凋落叶中的N含量对分解速率的影响并不显著。
凋落物初始C组分对分解速率的影响与C组分的类型有关。本研究中,分解速率与可提取物没有相关性,与酸溶性组分正相关,与酸不溶性组分负相关。这与森林湿地的水文特征和凋落叶分解的阶段性有关。森林湿地由于季节性积水,凋落叶中可提取物在分解初期迅速溶解,对两年内的分解速率影响不显著;酸溶性组分的主要组成物质是高分子碳水化合物、纤维素和半纤维素[31],不溶于水,在分解过程中逐渐释放,对凋落物分解速率有显著促进作用;酸不溶性组分主要由木质素组成[31],在分解后期对凋落物的抑制作用逐渐明显,从而与分解速率负相关。
3.2 凋落叶C、N残留量变化规律及成因
此前的研究表明:C残留量在分解过程中的变化规律无物种特异性[41],N残留量的变化规律与初始化学性质有关[42]。本研究中,10种凋落叶的C残留量在分解期内一致降低,这是因为在分解期内,以容易被微生物分解的非结构性物质如糖类、淀粉为主要降解物质,伴随着凋落叶干重的减少,C元素逐渐释放[41]。10种凋落叶的N元素呈现“先固持,后释放”、“持续固持”和“持续释放”3种模式。凋落物初始的化学性质,尤其是初始N含量影响了N元素的固持和释放[42]。在凋落叶分解过程中,N元素会遵循一般的“先释放,后固持”的变化规律[43-44],但是,对于初始N含量高的凋落叶,会在分解初期开始N释放,而初始N含量不足的凋落叶会固持N元素[44]。本研究中,除美国梧桐外,美国水松、红花槭、美洲朴、泡泡树和洋白蜡在两年的分解期内,N元素呈现一致释放规律,且这些植物的初始N含量大于1%;水紫树、长叶松和北美枫香在分解开始时先固定N,其对应的初始N含量小于1%,这一实验规律进一步证明:初始N含量对分解过程中N元素变化规律有影响。并因此初步推断,对于本实验的森林湿地,影响N元素变化动态的初始N含量阈值为1%。
3.3 植物群落演替对元素周转的可能影响
本文研究种间凋落物分解速率差异的其中一个目的是为了探讨植物群落演替是否加速或减慢了元素的周转速率。本样地在过去十多年内红花槭和北美枫香的密度与基础面积均有明显下降,美国水松的密度与基础面积有明显上升,而其它树种未出现较大变化[30]。本研究中发现美国水松与北美枫香的凋落叶分解速率相当,均快于红花槭,暗示着本研究区的植物群落演替可能减少红花槭凋落叶的产生并稍微减缓凋落物C周转的速率。虽然红花槭比美国水松的凋落叶更快地释放更多的N,但是北美枫香比美国水松的凋落叶可固持更多的N,起到一定抵消作用。因此本研究区的植物群落演替不一定会改变整体的凋落物N营养释放速率。
4 结论
本研究发现:研究样地中两年内不同物种的凋落叶分解速率差异可达4倍之差,其差异与凋落叶的初始化学性质有关。较高的凋落叶初始酸溶性组分利于凋落叶快速分解,而较高的酸不溶组分、初始C含量和AIF/N比则可能引起凋落叶分解缓慢。元素残留变化规律中,C的残留百分比均随时间逐渐降低,其变化速率取决于不同物种的初始化学性质;N的残留百分比变化规律因初始凋落叶N含量的高低不同,而呈现“先增加,后降低”、“持续增加”、“持续降低”3种模式。凋落叶中C元素的分解速率种间差异可能对样地内植物群落演替过程中的C元素周转有一定影响。因此,森林湿地中凋落叶初始C组分差异是其分解速率的种间极大差异的主要原因,评估森林湿地的C、N循环应充分考虑种间差异。
致谢:感谢多伦多大学物理和环境科学系王俊坚博士的实验设计、指导及写作建议,感谢美国克莱姆森大学布鲁克滨海生态与森林科学研究所周达诚教授、William H. Conner教授在实验过程中提供的支持和帮助。
[1] Mitsch W J, Gosselink J G. Wetlands. 4th ed. Hoboken, NJ: Wiley, 2007.
[2] Hopkinson C S. A comparison of ecosystem dynamics in freshwater wetlands. Estuaries, 1992, 15(4): 549- 562.
[3] Guo X L, Lu X G, Tong S Z, Dai G H. Influence of environment and substrate quality on the decomposition of wetland plant root in the Sanjiang Plain, Northeast China. Journal of Environmental Sciences, 2008, 20(12): 1445- 1452.
[4] 郭剑芬, 杨玉盛, 陈光水, 林鹏, 谢锦升. 森林凋落物分解研究进展. 林业科学, 2006, 42(4): 93- 100.
[5] Pyzoha J E, Callahan T J, Sun G, Trettin C C, Miwa M. A conceptual hydrologic model for a forested Carolina bay depressional wetland on the Coastal Plain of South Carolina, USA. Hydrological Processes, 2008, 22(14): 2689- 2698.
[6] 王健健, 王永吉, 来利明, 赵学春, 王飞, 申国珍, 赖江山, 鲁洪斌, 赵春强, 郑元润. 我国中东部不同气候带成熟林凋落物生产和分解及其与环境因子的关系. 生态学报, 2013, 33(15): 4818- 4825.
[7] Berg B, Laskowski R. Litter Decomposition: A Guide to Carbon and Nutrient Turnover. Amsterdam, Boston: Academic Press, 2006.
[8] De Marco A, Spaccini R, Vittozzi P, Esposito F, Berg B, De Santo A V. Decomposition of black locust and black pine leaf litter in two coeval forest stands on Mount Vesuvius and dynamics of organic components assessed through proximate analysis and NMR spectroscopy. Soil Biology and Biochemistry, 2012, 51: 1- 15.
[9] Berg B, McClaugherty C. Plant Litter. 2nd ed. Berlin: Springer Verlag, 2008.
[10] Thevenot M, Dignac M F, Rumpel C. Fate of lignins in soils: a review. Soil Biology and Biochemistry, 2010, 42(8): 1200- 1211.
[11] Barbhuiya A R, Arunachalam A, Nath P C, Khan M L, Arunachalam K. Leaf litter decomposition of dominant tree species of Namdapha National Park, Arunachal Pradesh, northeast India. Journal of Forest Research, 2008, 13(1): 25- 34.
[12] Li L J, Zeng D H, Yu Z Y, Fan Z P, Yang D, Liu Y X. Impact of litter quality and soil nutrient availability on leaf decomposition rate in a semi-arid grassland of Northeast China. Journal of Arid Environments, 2011, 75(9): 787- 792.
[13] de Neiff A P, Neiff J J, Casco S L. Leaf litter decomposition in three wetland types of the Paraná River floodplain. Wetlands, 2006, 26(2): 558- 566.
[14] Arunachalam A, Upadhyaya K, Arunachalam K, Pandey H N. Litter decomposition and nutrient mineralization dynamics in two bamboo species growing in a 9-year-old "JHUM" fallow. Journal of Tropical Forest Science, 2005, 17(1): 33- 44.
[15] Shaw M R, Harte J. Control of litter decomposition in a subalpine meadow-sagebrush steppe ecotone under climate change. Ecological Applications, 2001, 11(4): 1206- 1223.
[16] Bray S R, Kitajima K, Mack M C. Temporal dynamics of microbial communities on decomposing leaf litter of 10 plant species in relation to decomposition rate. Soil Biology and Biochemistry, 2012, 49: 30- 37.
[17] Li X F, Han S J, Zhang Y. Foliar decomposition in a broadleaf-mixed Korean pine (PinuskoraiensisSieb. et Zucc) plantation forest: the impact of initial litter quality and the decomposition of three kinds of organic matter fraction on mass loss and nutrient release rates. Plant and Soil, 2007, 295(1/2): 151- 167.
[18] Hirobe M, Sabang J, Bhatta B K, Takeda H. Leaf-litter decomposition of 15 tree species in a lowland tropical rain forest in Sarawak: decomposition rates and initial litter chemistry. Journal of Forest Research, 2004, 9(4): 341- 346.
[19] Sun Z G, Liu J S. Nitrogen cycling of atmosphere-plant-soil system in the typicalCalamagrostisangustifoliawetland in the Sanjiang Plain, Northeast China. Journal of Environmental Sciences, 2007, 19(8): 986- 995.
[20] Battle M J, Golladay S W. Hydroperiod influence on breakdown of leaf litter in cypress-gum wetlands. The American Midland Naturalist, 2001, 146(1): 128- 145.
[21] Capps K A, Graça M A S, Encalada A C, Flecker A S. Leaf-litter decomposition across three flooding regimes in a seasonally flooded Amazonian watershed. Journal of Tropical Ecology, 2011, 27(2): 205- 210.
[22] Brockington L G. Plantation between the Waters: A Brief History of Hobcaw Barony. Charleston, SC: The History Press, 2006.
[23] Shepherd P, Crockett T, De Santo T L, Bildstein K L. The impact of Hurricane Hugo on the breeding ecology of wading birds at Pumpkinseed Island, Hobcaw Barony, South Carolina. Colonial Waterbirds, 1991, 14(2): 150- 157.
[24] Chow A T, Chong J H, Cook M, White D. Vanishing fireflies: a citizen science project promoting scientific inquiry and environmental stewardship. Science Education & Civic Engagement, 2014, 6(1): 23- 31.
[25] Allen D M, Luthy S A, Garwood J A, Young R F, Dame R F. Nutrient subsidies from nekton in salt marsh intertidal creeks. Limnology and Oceanography, 2013, 58(3): 1048- 1060.
[26] Krauss K W, Duberstein J A, Doyle T W, Conner W H, Day R H, Inabinette L W, Whitbeck J L. Site condition, structure, and growth of baldcypress along tidal/non-tidal salinity gradients. Wetlands, 2009, 29(2): 505- 519.
[27] Wang J J, Jiao Y, Rhew R, Chow A T. Haloform formation in coastal wetlands along a salinity gradient at South Carolina, United States. Environmental Chemistry, 2016, in press, doi: 10.1071/EN15145.
[28] Wilson A M, Morris J T. The influence of tidal forcing on groundwater flow and nutrient exchange in a salt marsh-dominated estuary. Biogeochemistry, 2012, 108(1/3): 27- 38.
[29] Chow A T, Dai J N, Conner W H, Hitchcock D R, Wang J J. Dissolved organic matter and nutrient dynamics of a coastal freshwater forested wetland in Winyah Bay, South Carolina. Biogeochemistry, 2013, 112(1/3): 571- 587.
[30] Conner W H, Song B, Williams T M, Vernon J T. Long-term tree productivity of a South Carolina coastal plain forest across a hydrology gradient. Journal of Plant Ecology, 2011, 4(1/2): 67- 76.
[31] Ryan M G, Melillo J M, Ricca A. A comparison of methods for determining proximate carbon fractions of forest litter. Canadian Journal of Forest Research, 1990, 20(2): 166- 171.
[32] Olson J S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322- 331.
[33] Cornwell W K, Cornelissen J H C, Amatangelo K, Dorrepaal E, Eviner V T, Godoy O, Hobbie S E, Hoorens B, Kurokawa H, Pérez-Harguindeguy N, Quested H M, Santiago L S, Wardle D A, Wright I J, Aerts R, Allison S D, van Bodegom P, Brovkin V, Chatain A, Callaghan T V, Díaz S, Garnier E, Gurvich D E, Kazakou E, Klein J A, Read J, Reich P B, Soudzilovskaia N A, Vaieretti M V, Westoby M. Plant species traits are the predominant control on litter decomposition rates within biomes worldwide. Ecology Letters, 2008, 11(10): 1065- 1071.
[34] Augusto L, De Schrijver A, Vesterdal L, Smolander A, Prescott C, Ranger J. Influences of evergreen gymnosperm and deciduous angiosperm tree species on the functioning of temperate and boreal forests. Biological Reviews, 2015, 90(2): 444- 466.
[35] Pérez-Harguindeguy N, Díaz S, Cornelissen J H C, Vendramini F, Cabido M, Castellanos A. Chemistry and toughness predict leaf litter decomposition rates over a wide spectrum of functional types and taxa in central Argentina. Plant and Soil, 2000, 218(1/2): 21- 30.
[36] 曾锋, 邱治军, 许秀玉. 森林凋落物分解研究进展. 生态环境学报, 2010, 19(1): 239- 243.
[37] Bijayalaxmi Devi N, Yadava P S. Influence of climate and litter quality on litter decomposition and nutrient release in sub-tropical forest of Northeast India. Journal of Forestry Research, 2010, 21(2): 143- 150.
[38] 唐仕姗, 杨万勤, 殷瑞, 熊莉, 王海鹏, 王滨, 张艳, 彭艳君, 陈青松, 徐振峰. 中国森林生态系统凋落叶分解速率的分布特征及其控制因子. 植物生态学报, 2014, 38(6): 529- 539.
[39] Zhang D Q, Hui D F, Luo Y Q, Zhou G Y. Rates of litter decomposition in terrestrial ecosystems: global patterns and controlling factors. Journal of Plant Ecology, 2008, 1(2): 85- 93.
[40] Polyakova O, Billor N. Impact of deciduous tree species on litterfall quality, decomposition rates and nutrient circulation in pine stands. Forest Ecology and Management, 2007, 253(1/3): 11- 18.
[41] Mfilinge P L, Atta N, Tsuchiya M. Nutrient dynamics and leaf litter decomposition in a subtropical mangrove forest at Oura Bay, Okinawa, Japan. Trees, 2002, 16(2/3): 172- 180.
[42] van Huysen L T, Harmon M E, Perakis S S, Chen H. Decomposition and nitrogen dynamics of15N-labeled leaf, root, and twig litter in temperate coniferous forests. Oecologia, 2013, 173(4): 1563- 1573.
[43] Hobbie S E, Vitousek P M. Nutrient limitation of decomposition in Hawaiian forests. Ecology, 2000, 81(7): 1867- 1877.
[44] Parton W, Sliver W L, Burke I C, Grassens L, Harmon M E, Currie W S, King J Y, Adair E C, Brandt L A, Hart S C, Fasth B. Global-scale similarities in nitrogen release patterns during long-term decomposition. Science, 2007, 315(5810): 361- 364.
Leaf litter decomposition of ten plant species in a forested wetland in South
Carolina, USA
1PekingUniversityShenzhenGraduateSchool,Shenzhen518055,China2CollegeofUrbanandEnvironmentalSciences,PekingUniversity,Beijing100871,China
Forested wetland is a critical transition zone between terrestrial and aquatic ecosystems. The zone is characterized by high productivity and an active biogeochemical cycle, and it likely exhibits carbon (C) and nitrogen (N) turnover rates that are different from those of non-flooding upland forests. Furthermore, leaf litter decomposition is a vital ecological process that controls C and N cycling in forested wetlands. However, because most litter decomposition studies have focused on non-flooding forests, less is known about the C and N dynamics during litter decomposition in mixed forested wetlands. In the present study, a two-year litter decomposition experiment was performed in a representative freshwater forested wetland in Georgetown, South Carolina, USA for the leaf litters of 10 local plant species:Nyssaaquatica,Acerrubrum,Asiminatriloba,Celtisoccidentalis,Fraxinuspennsylvanica,Liquidambarstyraciflua,Pinuspalustris,Platanusoccidentalis,Taxodiumdistichum, andUlmusamericana. The C and N contents of the initial and decomposed litter samples were measured, and the initial litter samples were also measured for their chemical composition, including extractives, acid soluble, acid insoluble, and ash fractions. Percentages of remaining biomass, C, and N and the decomposition rate constant (k) were also calculated and linked to the initial mass and C and N contents, as well as to each litter′s initial chemical composition. The results showed that after two years of decomposition, the percentage of remaining biomass varied largely across species and accounted for from 14.5% to 66.2% of the initial biomass (up to 4-times difference across species). Meanwhile,kranged from 0.26 a-1forP.palustristo 1.64 a-1forA.trilobaand was greater for broadleaf litter than coniferous litter. In addition,kwas also positively correlated with initial acid soluble fraction (AS) of the litter and negatively correlated with initial C content, acid insoluble fraction (AIF), and AIF/N, which indicated that the initial chemistry of litter was a key factor in determining decomposition rate. Similarly, the remaining C content gradually decreased to 10.2%—66.1% of the initial C content, with the greatest loss inA.trilobaand the lowest inP.palustris. In contrast, the N content was either immobilized or mineralized during the decomposition process, depending on plant species and decomposition stage. For example, the N content ofN.aquatica,P.occidentalis, andP.palustriswas immobilized during early decomposition and was released at later stages. However, N was consistently immobilized in the litter samples ofU.americanaandA.rubrumand was consistently released from the litter samples ofA.triloba,C.occidentalis,F.pennsylvanica,L.styraciflua, andT.distichum. Thus, the present study demonstrated that, similar to the litter decomposition of non-flooding forests, initial litter chemistry could explain the large variation observed in the decomposition rates of different plant species at individual sites. In addition, there are also large differences in the C and N dynamics during the decomposition of litter from plant species. Accordingly, our study highlights the importance of fully considering inter-species differences when evaluating the C and N cycling of forested wetlands.
forested wetland; leaf litter; decomposition rate constant; initial carbon fractions; C and N
10.5846/stxb201511192344
国家自然科学基金资助项目(31321061)
2015- 11- 19; 网络出版日期:2016- 08- 30
李巧玲,曾辉.美国南卡罗来纳州森林湿地十种典型植物凋落叶的分解特征.生态学报,2017,37(7):2342- 2351.
Li Q L, Zeng H.Leaf litter decomposition of ten plant species in a forested wetland in South Carolina, USA.Acta Ecologica Sinica,2017,37(7):2342- 2351.
*通讯作者Corresponding author.E-mail: zengh@pkusz.edu.cn
