Ⅰ型和Ⅱ型乳头状肾细胞癌的影像学表现及其差异
2017-06-27戴辰晨丁玉芹曹颖丽周建军
戴辰晨 丁玉芹 曹颖丽 周建军△
(1复旦大学附属中山医院放射科 上海 200032; 2上海市影像医学研究所 上海 200032;3复旦大学上海医学院影像医学系 上海 200032)
Ⅰ型和Ⅱ型乳头状肾细胞癌的影像学表现及其差异
戴辰晨1,2,3丁玉芹1,2,3曹颖丽1,2,3周建军1,2,3△
(1复旦大学附属中山医院放射科 上海 200032;2上海市影像医学研究所 上海 200032;3复旦大学上海医学院影像医学系 上海 200032)
目的 探讨Ⅰ型和Ⅱ型乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)的影像学表现及其差异。 方法 回顾性分析经手术病理证实的47例PRCC患者资料,其中Ⅰ型21个病灶,Ⅱ型27个病灶(1例患者左肾含2个病灶)。所有患者术前均行肾脏CT或MRI平扫及动态增强检查。对PRCC的形态学特征、肿瘤外侵征象、增强CT表现进行定性和定量分析。采用独立样本t检验对病灶最大径、三期CT值及皮髓交界期△CT、实质期△CT进行比较,采用Pearsonχ2检验或Fisher确切概率法对分类变量进行比较。结果 一般形态学上,Ⅱ型PRCC平均最大径大于Ⅰ型(t=-2.604,P=0.013),密度/信号更不均匀(χ2=14.928,P=0.000),更易出现囊变或坏死(χ2=5.598,P=0.018),且程度更明显(χ2=4.769,P=0.029);在CT图像上,两型之间出血和钙化征象的差异均无统计学意义。分别有66.7%Ⅱ型PRCC和23.8%Ⅰ型PRCC出现乳头结节,两型之间的差异有显著统计学意义(χ2=8.694,P=0.003)。在肿瘤外侵表现方面,除边界征象外,Ⅱ型较Ⅰ型PRCC更易发生肾周脂肪侵犯、肾窦侵犯及转移(P<0.05)。在增强CT表现方面,两型在皮髓交界期CT值、皮髓交界期△CT的差异均有统计学意义(t=-2.674,P=0.012;t= -3.109,P=0.005),而在平扫期CT值、实质期CT值、实质期△CT上的差异均无统计学意义。结论 Ⅰ型和Ⅱ型PRCC在形态学特征、肿瘤外侵征象及强化程度上有一定差异,部分Ⅱ型肿瘤具有侵袭性生物学行为,预后更差。
肾肿瘤; 乳头状肾细胞癌; 鉴别诊断; 断层摄影术,X线计算机
肾肿瘤发病率逐年提高,大多数为肾透明细胞癌,文献报道较多,相关研究较为深入。乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是肾细胞癌的一种少见亚型,约占全部肾细胞癌的10%~15%。传统观念认为PRCC是预后较好的低度恶性肿瘤,随着临床病例不断积累和分子基因的逐步进展,对PRCC的认识逐步加深,尤其是在病理学将PRCC分成Ⅰ型和Ⅱ型后,对相关影像学表现的认识得到进一步深化。目前鲜有国内文献报道两型之间的鉴别诊断,且已知文献的病例数有限[1-2]。本文回顾性分析21个Ⅰ型和27个Ⅱ型PRCC病灶的影像学资料,重点探讨两型PRCC的影像学表现及其差异,为术前鉴别诊断和预后分析提供临床参考信息。
资 料 和 方 法
患者资料 回顾性分析复旦大学附属中山医院2009年7月至2016年6月期间,经手术病理证实、PACS系统有CT或MRI图像的47例PRCC患者资料,共计48个病灶(其中1例患者有2个病灶)。左肾27个,右肾21个。男性36例,女性11例,年龄31~79岁,平均年龄(58.3±12.3)岁。检查前所有患者均签署知情同意书。
检查方法 30例患者行CT平扫加增强检查,11例患者行MRI平扫加增强检查,6例患者同时行CT、MRI平扫加增强检查。 CT扫描方案:常规平扫后,采用双筒高压注射器经肘静脉注射对比剂碘普胺(浓度为370 mg/mL,剂量为1.5 mL/kg,注射流率为3 mL/s),分别在开始注射对比剂后25~30 s及80~90 s行肾脏皮髓交界期、实质期扫描。MRI扫描序列包括FSE T2WI和屏气容积内插法抑脂T1WI平扫加增强,对比剂为Gd-DTPA (计量为0.1 mmol/kg,注射流率2 mL/s),动脉期、实质期扫描时间与CT扫描相仿。
图像分析 由两名放射科医师对病灶最大径、囊变或坏死、出血、钙化、乳头结节、均匀性、边界、肾周侵犯、肾窦侵犯、转移(静脉瘤栓、淋巴结及远处脏器转移)等征象及增强CT,三期CT值及皮髓交界期△CT、实质期△CT进行统计和分析。一旦发现乳头结节,则定义此病灶含有乳头结节。由于MRI对出血评估受到出血时间影响且对钙化的显示有一定局限性,本研究仅讨论其在CT图像上的表现。所有病例均与病理结果对照分析。两位医师意见不一致时协商达成一致意见。ROI (region of interest)置于病灶实质部分强化最明显的区域,避开钙化、囊变及坏死区等区域,ROI在动态增强前后各期取相同的大小及位置,以保证所测值的可比性。皮髓交界期△CT=CT皮髓交界期-CT平扫;实质期△CT=CT实质期-CT平扫。
统计学方法 采用SPSS 20.0对患者临床特征及病灶CT、MRI表现进行统计分析,连续变量根据正态性检验及方差齐性检验结果,若符合正态分布,采用两独立样本t检验,分类变量采用Pearsonχ2检验或Fisher确切概率法进行检验;所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
临床资料 Ⅰ型PRCC患者平均年龄(58.5±12.0)岁,男女比例为18∶3;Ⅱ型平均年龄(54.7±12.5)岁,男女比例为20∶7;Ⅰ型和Ⅱ型肿瘤平均最大径分别为(2.7±1.3)cm和(4.3±2.8 )cm,差异有统计学意义(t=-2.604,P=0.013)。因体检发现Ⅰ型16个,Ⅱ型有20个,其他均因出现临床症状就诊时被发现,两者之间差异无统计学意义(P>0.05)。此外,6个出现转移病例均为Ⅱ型,2个经病理证实出现脉管浸润和肾门淋巴结转移,3个分别出现肺、肝脏、骶骨转移同时伴有淋巴结转移,1个同时出现了肾静脉、下腔静脉血栓及头颅转移。
一般形态学及肿瘤外侵征象分析 Ⅰ型21个,Ⅱ型27个。10个Ⅰ型PRCC (47.6%)密度或信号不均匀(图1F),6个病灶内囊变或坏死(28.5%),其中明显囊变或坏死2个。26个Ⅱ型PRCC (96.3%)密度或信号不均匀,17个囊变或坏死(63.0%),其中明显囊变或坏死10个(图1B、1E)。17个Ⅰ型和19个Ⅱ型PRCC的CT图像显示,Ⅰ型病灶出血和钙化的发生率为23.5% (4/17)和5.9% (1/17),Ⅱ型病灶出血和钙化的发生率分别为36.9% (7/19)和21.1% (4/19)(图1B)。5个Ⅰ型(23.8%)和18个Ⅱ型(66.7%) PRCC含有乳头结节(图1C、1D、1E、1H)。Ⅰ型病灶边界均较清晰,1个(4.8%)出现肾周侵犯,未发生肾窦侵犯及转移。Ⅱ型病灶中4个(14.9%)边界模糊,12个(44.4%)出现肾周侵犯,6个(22.2%)转移病灶均发生肾窦侵犯(图1A)。两型之间在病灶的囊变或坏死、乳头结节、不均匀性及发生肾周侵犯、肾窦侵犯、转移等方面的差异有统计学意义,余征象差异无统计学意义(表1、2)。

表1 Ⅰ型和Ⅱ型PRCC的一般形态学特征比较
(1)The former showed the number of cystic degeneration or necrosis and the latter showed the number of obvious cystic degeneration or necrosis.(2)Only counted the number of lesions in CT.

表2 Ⅰ型和Ⅱ型PRCC的肿瘤外侵征象比较
增强CT表现 除3个明显出血病灶影响测量,CT平扫期PRCC平均CT 值为(34.8±8.6) HU,其中Ⅰ型为(33.2±9.6) HU,Ⅱ型为(36.0±7.8)HU,两型之间差异无统计学意义;皮髓交界期和实质期平均CT 值分别为(58.9±22.6) HU和(67.2±23.1) HU,其中Ⅰ型分别为(47.7±13.8) HU和( 61.4±15.7) HU;Ⅱ型分别为(67.2±24.5) HU和(71.5±26.9) HU,两型之间在皮髓交界期CT值及△CT的差异有显著统计学意义(t=-2.674,P=0.012;t=-3.109,P=0.005),在平扫期、实质期CT值及△CT差异无统计学意义(表3,图1G、1H、1I)。
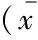
表3 Ⅰ型及Ⅱ型PRCC的CT平扫、增强及强化程度的比较
△C=Corticomedullary attenuation-Unenhanced attenuation;△N=Nephrographic attenuation-Unenhanced attenuation
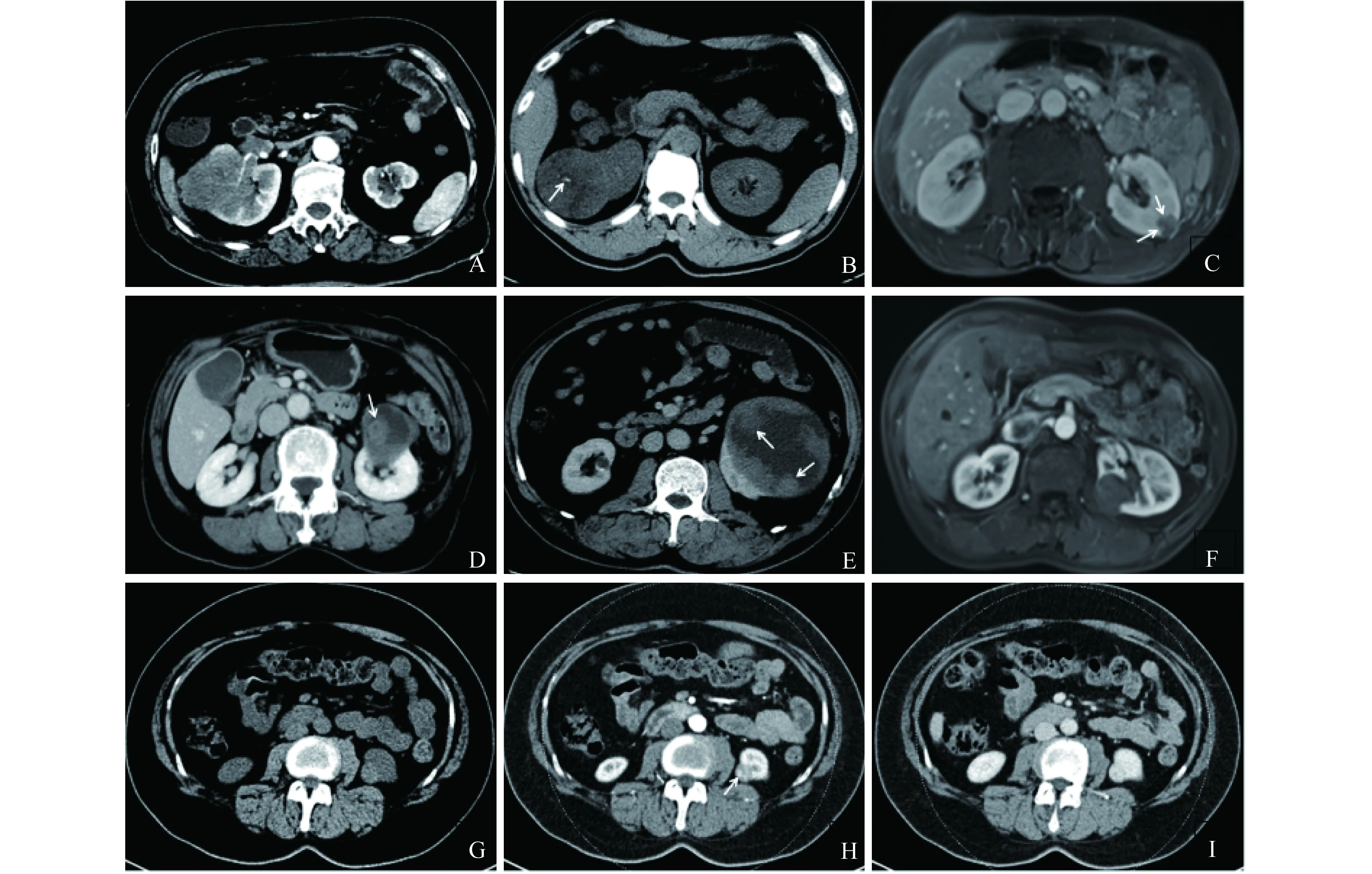
A:Type Ⅱ PRCC,the tumor might extended into central region as well as perirenal space with indistinct margins,and there were also tumor thrombus in right renal vein and lymph node metastasis pathologically.B:Type Ⅱ PRCC,tumor density was heterogeneous with obvious cystic degeneration or necrosis,there was spot calcification (arrow) in the center of the lesions.C-E and H:Different performance of papillary nodule.C:Type Ⅰ PRCC,multiple spot-like enhancing foci (arrow).D:Type Ⅱ PRCC,single,large papillary nodule (arrow).E:Type Ⅱ PRCC,multiple papillary nodules around within the lesion (arrow).F:Type Ⅰ PRCC,homogeneous,showed mild enhancement on artery phase in MR.G and I:Type Ⅱ PRCC,the tumor demonstrated high-attenuation on plain CT scan (G) and obvious enhancement on venous phase,whose density was close to the renal parenchyma.H:Type Ⅱ PRCC,single,small papillary nodule (arrow).
图1 Ⅰ型及Ⅱ型PRCC的影像学特点
Fig 1 Imaging features of type Ⅰ and type Ⅱ PRCC
讨 论
概述 PRCC 预后与肿瘤的分型密切相关[3]。Ⅰ型PRCC核分级较低,CK7、MUC1、TOP2α多阳性[4],以染色体倍增为特征[5],包括7号、17号染色体等,同时伴有Y 染色体缺失,主要和MET基因突变有关[6];Ⅱ型PRCC核分级较高,AgNOR、MYC、Ki-67多为阳性,染色体畸形,基因突变复杂多样。随着对PRCC分子基因的深入研究,Linehan等[6]指出 CDKN2A、CIMP基因突变与 Ⅱ型PRCC不良预后息息相关;即使PRCC转移发生率较肾透明细胞癌低,但对于进展期PRCC,靶向药物的治疗疗效明显低于肾透明细胞癌[7]。本组中6个发生转移的病例均为Ⅱ型,平均最大径为9.2 cm (6.4~15.6 cm),稍大于Egbert[8]等报道的平均大小7.2 cm。Yamada等[9]研究报道部分II型PRCC有向肾窦生长趋势。本组发生转移的病灶均发生不同程度肾窦侵犯,其中4个病灶边界模糊,与正常肾实质分界不清(图1A),说明发生肾窦侵犯和边界模糊的肿瘤高度提示Ⅱ型PRCC,符合其高侵袭性特点。
一般形态学差异 (1)肿瘤大小:本组中Ⅰ型PRCC多较Ⅱ型小,71.4% (15/21) Ⅰ型肿瘤≤3 cm,Ⅱ型仅占40.7%,与Yamada等[9]报道相仿,这可能与Ⅱ型肿瘤生长更快,发现时肿瘤已较大有关。(2)囊变或坏死:PRCC易囊变或坏死,与肿瘤易形成囊腔结构和营养不良性坏死有关[10],也可能与肿瘤生长速度与肿瘤滋养血管不对称有关。本组中最大径>3 cm的PRCC大多发生不同程度的囊变或坏死,与Vikram[7]等报道相仿。在最大径≤3 cm肿瘤中,仅有1个Ⅰ型(7.1%,1/14)发生微小的囊变或坏死,而Ⅱ型中45.5% (5/11)出现囊变或坏死,且范围更大,程度更明显,说明Ⅱ型肿瘤更易发生囊变、坏死,且程度更明显(图1B、1E)。(3)钙化:本组Ⅰ型较Ⅱ型钙化发生率低,与Egbert等[8]报道相仿,主要表现为病灶中央或周围点状钙化(图1B)。(4)乳头结节:PRCC易出现乳头结节,推测与病理上经典的乳头状结构有关[11]。本研究中,乳头结节可表现为多发微小结节(图1C)、单发的大小不等结节(图1D、1H),还可表现沿四周分布的多发结节(图1E)。我们认为,乳头结节可作为PRCC特征性表现,有助于提示PRCC的诊断及与其他亚型肾癌的鉴别诊断,此结果也待于进一步研究证实。本组中Ⅱ型PRCC出现乳头结节的概率明显高于Ⅰ型,可能与Ⅰ型PRCC含有纤细的管状乳头结构,表面覆盖单层小细胞,Ⅱ型PRCC乳头结构表面覆盖丰富的细胞结构有关。
增强CT表现比较 PRCC为乏血供肿瘤,强化程度明显低于透明细胞癌,大多呈渐进性轻度强化[12]。Yamada等[9]报道Ⅰ型和Ⅱ型PRCC在强化程度上有所重叠,不能很好区分。而本组中,Ⅱ型PRCC在皮髓交界期较Ⅰ型明显强化,两型之间有一定差异。我们分析认为,一方面与Ⅱ型肿瘤内毛细血管密度高于Ⅰ型有关[13],另一方面可能与Ⅱ型PRCC更易出现乳头结节,且与乳头结节内造影剂充填有关[14]。我们还发现,少数Ⅱ型肿瘤可明显强化,稍低于或接近于同期正常肾实质(图1G、1I),与多数恶性肿瘤强化程度相近,说明此征象有助于提示Ⅱ型PRCC的诊断,也反映其恶性程度更高。
主要鉴别诊断 (1)肾透明细胞癌:富血供肿瘤,密度混杂,强化显著,呈“快进快出”表现,出血、坏死和囊变明显,对于极少数不典型透明细胞癌,与Ⅱ型PRCC鉴别困难;(2)嫌色细胞癌:起源于肾髓质,密度相对均匀,少数病灶内可见出血、坏死或囊变,强化程度介于肾透明细胞癌和PRCC之间;(3)肾囊肿:直径较小(≤1.5 cm)或有伪强化表现的复杂囊肿有时与Ⅰ型PRCC的鉴别困难,MRI可以提供更多有价值的信息[15]。
总之,与Ⅰ型PRCC相比,Ⅱ型PRCC病灶更大,欠均匀,出现囊变或坏死概率更大,且更为明显,更易出现乳头结节,强化程度更明显。此外,发生肾窦侵犯、边界模糊、较大的Ⅱ型肿瘤具有侵袭性生物学行为,易转移,预后差。对于部分PRCC,两种亚型的影像学表现重叠之处较多,鉴别困难,最终明确诊断依赖于手术病理。
[1] 段崇锋,姜天娇,高耸,等.乳头状肾癌亚型的CT鉴别诊断价值[J].临床放射学杂志,2014,33(2):234-237.
[2] 陈杰,曲源,陈永丽,等. CT在乳头状肾癌亚型鉴别诊断中的应用价值[J].临床放射学杂志,2015,34(12):1940-1944.
[3] ANTONELLI A,TARDANICO R,BALZARINI P,etal.Cytogenetic features,clinical significance and prognostic impact of type 1 and type 2 papillary renal cell carcinoma[J].CancerGenetCytogenet,2010,199(2):128-133.
[4] FERNANDES DS,LOPES JM.Pathology,therapy and prognosis of papillary renal carcinoma[J].FutureOncol,2015,11(1):121-132.
[5] TWARDOWSKI PW,MACK PC,LARA PJ.Papillary renal cell carcinoma:current progress and future directions[J].ClinGenitourinCancer,2014,12(2):74-79.
[6] LINEHAN WM,SPELLMAN PT,RICKETTS CJ,etal.Comprehensive molecular characterization of papillary renal-cell carcinoma[J].NEnglJMed,2016,374(2):135-145.
[7] VIKRAM R,NG CS,TAMBOLI P,etal.Papillary renal cell carcinoma:radiologic-pathologic correlation and spectrum of disease[J].Radiographics,2009,29(3):741-754,755-757.
[8] EGBERT ND,CAOILI EM,COHAN RH,etal.Differentiation of papillary renal cell carcinoma subtypes on CT and MRI[J].AJRAmJRoentgenol,2013,201(2):347-355.
[9] YAMADA T,ENDO M,TSUBOI M,etal.Differentiation of pathologic subtypes of papillary renal cell carcinoma on CT[J].AJRAmJRoentgenol,2008,191(5):1559-1563.
[10] 周俊林,赵建洪,李晓鸣,等.乳头状肾细胞癌的CT表现与病理分析[J].中华放射学杂志,2008,42(11):1215-1217.
[11] 张永欢,贺慧颖.乳头状肾细胞癌组织学分型的探讨及其临床病理学观察[J].中华病理学杂志,2015,44(11):761-766.
[12] YOUNG JR,MARGOLIS D,SAUK S,etal.Clear cell renal cell carcinoma:discrimination from other renal cell carcinoma subtypes and oncocytoma at multiphasic multidetector CT[J].Radiology,2013,267(2):444-453.
[13] BEHNES CL,BREMMER F,HEMMERLEIN B,etal.Tumor-associated macrophages are involved in tumor progression in papillary renal cell carcinoma[J].VirchowsArch,2014,464(2):191-196.
[14] GUREL S,NARRA V,ELSAYES KM,etal.Subtypes of renal cell carcinoma:MRI and pathological features[J].DiagnIntervRadiol,2013,19(4):304-311.
[15] DILAURO M,QUON M,MCINNES MD,etal.Comparison of contrast-enhanced multiphase renal protocol CT versus MRI for diagnosis of papillary renal cell carcinoma[J].AJRAmJRoentgenol,2016,206(2):319-325.
Imaging performance and differences of type Ⅰ and type Ⅱ papillary renal cell carcinoma
DAI Chen-chen1,2,3, DING Yu-qin1,2,3, CAO Ying-li1,2,3, ZHOU Jian-jun1,2,3 △
(1DepartmentofRadiology,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2ShanghaiMedicalImagingInstitution,Shanghai200032,China;3DepartmentofMedicalImaging,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China)
Objective To identify the imaging performance and differences between type Ⅰ and type Ⅱ papillary renal cell carcinoma (PRCC). Methods Data of 21 lesions of type Ⅰ,27 lesions of type Ⅱ (1 patient had 2 lesions) in 47 patients was retrospectively analyxed.All patients with pathologically proven PRCC were examined by contrast CT or MRI preoperatively.The morphological features,outside invasion signs and performance on contrast-enhanced CT were compared by qualitative and quantitative studies.The maximum diameter of tumors and CT values,△CT values in corticomedullary and nephrographic phase were analyzed by two-samplet-test,classified variable were compared by the Pearsonχ2test or the Fisher exact test. Results On morphological behaviors,type Ⅱ PRCC were
significantly larger than type Ⅰ PRCC (t=-2.604,P=0.013),more heterogeneous (χ2=14.928,P=0.000),greater probability to show cystic degeneration or necrosis (χ2=5.598,P=0.018) with more severity (χ2=4.769,P=0.029).There was no significant difference in hemorrhage and calcification between the two types observed by contrast-enhanced CT.Respectively,66.7 % of type Ⅱ PRCC and 23.8% of type Ⅰ PRCC had papillary nodule,with obviously significant difference (χ2=8.694,P=0.003).In outside invasion signs,except for margins,type Ⅱ had more easily invaded peripheral fat,renal sinus and distant metastasis compared with type Ⅰ (P<0.05).On contrast-enhanced CT,there were significant differences in CT values and △CT values in corticomedullary phase between the two types (t=-2.674,P=0.012;t=-3.109,P=0.005).And there were no significant difference in unenhanced and nephrographic phase. Conclusions There were certain difference in morphological features,outside invasion signs and enhancement degree between type Ⅰ and type Ⅱ PRCC,and part of type Ⅱ PRCC had aggressive biological behaviors with worse prognosis.
renal neoplasms; papillary renal cell carcinoma; differential diagnosis; tomography,X-ray computer
R737.11, R445.3
A
10.3969/j.issn.1672-8467.2017.03.007
2016-08-12;编辑:段佳)
上海市自然科学基金(14ZR1438400)
△Corresponding author E-mail:zhou.jianjun@zs-hospital.sh.cn
*This work was supported by the Natural Science Foundation of Shanghai (14ZR1438400).
