北京地区家养犬隐孢子虫感染情况的调查
2017-06-26张颖欣周梦洁余仲佳陈思媛王丽娅于咏兰
张颖欣,周梦洁,余仲佳,陈思媛,王丽娅,于咏兰
(中国农业大学动物医学院,北京 100193)
北京地区家养犬隐孢子虫感染情况的调查
张颖欣,周梦洁,余仲佳,陈思媛,王丽娅,于咏兰*
(中国农业大学动物医学院,北京 100193)
为探索适用于宠物临床检测隐孢子虫的方法,并了解北京地区宠物犬隐孢子虫感染情况,于2015年1月-2015年12月,在中国农业大学教学动物医院收集来自北京各个地区的家养犬粪便共104例,分别采用改良抗酸染色法、饱和蔗糖漂浮法以及套式PCR扩增隐孢子虫SSU rRNA基因进行隐孢子虫检测。结果显示,PCR方法适用于临床犬粪便中隐孢子虫的检测,而形态学方法仅能检测出纯化后卵囊。北京地区家养犬隐孢子虫感染率为3.85%(4/104),虫种均为犬隐孢子虫(C.canis)。对不同年龄段的犬隐孢子虫感染率进行统计分析后发现,不同年龄段的家养犬隐孢子虫感染率差异显著(P<0.05),6月龄以下幼犬易感,不同性别、居住地区的家养犬隐孢子虫阳性率无显著差异(P>0.05)。
犬;隐孢子虫;感染率;调查
隐孢子虫(Cryptosporidium)可广泛寄生于人、哺乳动物及禽类等260余种脊椎动物的肠道中,部分虫种具有宿主特异性[1]。Tyzzer于1907年首次在小鼠胃腺细胞中发现鼠隐孢子虫(C.muris),直到1973年首次在免疫缺陷的幼儿体内发现该病原,其感染性才得到证实[2]。后续隐孢子虫感染在各个国家均出现过不同程度的流行,其对人类健康产生严重威胁,同时也带来了巨大的经济损失。据美国疾病控制中心估计,每年有大约1 500万人腹泻,其中有超过3万人是由隐孢子虫感染引起的[3]。感染隐孢子虫的犬只可通过粪-口传播至人,造成免疫缺陷人群患隐孢子虫病,表现为水样腹泻,严重可导致死亡。其中犬易感的虫种包括犬隐孢子虫(C.canis)、微小隐孢子虫(C.parvum)和火鸡隐孢子虫(C.meleagridis),均为人畜共患虫种[4-6]。
随着人们生活水平的提高,越来越多的宠物犬成为一些家庭的重要成员,据欧瑞信息公司报告,中国至少拥有2 700万宠物犬。犬所携带的人畜共患病原具有威胁人类健康的风险,因此,研究犬隐孢子虫具有重要的公共卫生意义。北京市家养犬数量极多,对于犬隐孢子虫流行病学调查具有必要性。由于隐孢子虫的自限性特点,患犬或不表现出任何的临床症状。同时虫体卵囊微小,在粪便中易与酵母菌形态混淆,因此国内小动物临床关于宠物犬隐孢子虫感染的报道较少。
国内调查犬隐孢子虫多采用检查卵囊的方法,主要有饱和蔗糖溶液漂浮法、福尔马林-乙酸乙酯离心沉淀法、改良抗酸染色法、卢戈式碘液染色比色法、金胺-酚染色法。其中,饱和蔗糖溶液漂浮法和改良抗酸染色法最常用,这两种方法成本低、操作简便,缺点在于敏感性不够高,易出现假阴性。免疫学诊断方面,常用ELISA法来检测犬血清中隐孢子虫特异性抗体。聚合酶链反应(PCR)是一种灵敏度高的分子生物学检测方法,可用于大量样本的检测,并可确定隐孢子虫种的基因型和亚型,进行种系发育分析。其缺点在于费用高,耗时长。本研究旨在通过随机收集临床家养犬的粪便,比较形态学和PCR技术的隐孢子虫检测敏感性,评估北京地区家养犬隐孢子虫的感染情况,为临床诊断及防控提出科学建议。
1 材料与方法
1.1 样本采集
本试验于2015年1月至2015年12月在中国农业大学教学动物医院随机收集家养犬粪便样品,共计104份,这些样品来自于北京13个地区的健康犬和腹泻犬,其中1月龄~6月龄犬粪便样品58份,6月龄以上犬粪便样本46份;公犬粪样72份,母犬粪样32份。犬种有泰迪、德国牧羊犬、拉布拉多、比格犬、雪纳瑞、边牧、吉娃娃等。采集粪便方式为直肠推注生理盐水,抽取粪便5 mL(约10 g)。样品按1∶1与25 g/L重铬酸钾溶液混合,检测前均置4℃冰箱保存待检。
1.2 隐孢子虫卵囊形态学检测
本试验分别采用改良抗酸染色法和饱和蔗糖溶液漂浮法对纯化后卵囊(中国农业科学院上海兽医研究所陈兆国研究院实验室惠赠)和粪便样品进行隐孢子虫卵囊形态学检测。
取粪便-重铬酸钾混合液5 mL,3 000 r/min离心5 min,弃上清,沉淀加蒸馏水重悬,再次3 000 r/min 离心5 min,弃上清,重复3次,至上清液无色透明,留沉淀待检。
1.2.1 改良抗酸染色法 染液配制:甲液:石炭酸复红4 g,950 mL/L乙醇20 mL,苯酚8 g,双蒸水100 mL;乙液:孔雀绿0.2 g,蒸馏水100 mL;100 mL/L硫酸脱色液:纯硫酸10 mL,蒸馏水90 mL。
染色步骤:取少量上述沉淀,2.5 cm~3 cm粪便涂片,自然风干,滴加甲液2滴~3滴,覆盖粪便膜,染色5min后,蒸馏水轻轻冲洗多余染料,滴加脱色液,20 s后蒸馏水冲洗干净,最后滴加2滴~3滴乙液,洗耳球吹匀,染色3 min,蒸馏水洗去多余染液,蘸干。染好的玻片置于光学显微镜下镜检,油镜下观察到玫瑰红色圆形或椭圆形卵囊,周围一圈不着色区域,内可见子孢子及残核形态,即可判为阳性。
1.2.2 饱和蔗糖溶液漂浮法 溶液按照石炭酸7.0 mL,白糖500 g,蒸馏水320 mL配制,加热后溶解,冷却后装瓶待用。取上述剩余的沉淀物,加饱和蔗糖溶液重悬至2 mL,以3 000 r/min离心10 min,然后用吊环与液面平行接触以蘸取表面液膜,抖落于载玻片上,加盖玻片,于高倍镜下检测,观察到粉红色圆形或椭圆形卵囊,周围呈现淡绿色折光性,内隐约可见子孢子和残核的凹凸结构,即可判为阳性。
1.3 PCR检测
采用QIAamp®DNA Stool Mini Kit提取粪便总DNA:取2 mL粪便-重铬酸钾混合溶液按照上述步骤洗去其中的重铬酸钾,取0.2 g或200 μL沉淀加入2 mL离心管中,加入1.4 mL ASL,涡旋1 min混匀后,于液氮与热水(80℃)反复冻融5次,而后按照试剂盒操作说明进行后续步骤提取DNA。
参照Xiao L H等[7]合成隐孢子虫SSU rRNA 基因引物,由三博远志生物科技公司合成,引物序列见表1。 SSU rRNA的两轮扩增体系为:2×TaqStarmix 12.5 μL,ddH2O 9.5 μL,第1轮引物SSU-F2、SSU-R2各1 μL,模板DNA液体1 μL,总体系25 μL(第2轮引物为SSU-F3、SSU-R4;模板为第1轮PCR产物1 μL)。两轮反应条件均为:94℃ 5 min;94℃ 45 s,55℃ 60 s,72℃ 45 s,35个循环,72℃ 10 min;4℃终止反应。PCR扩增产物用10 g/L琼脂糖凝胶进行电泳检测,阳性PCR产物送检,采用正、反双向测序由北京三博远志生物技术有限责任公司完成。将本试验SSU rRNA基因产物测序后的序列在GenBank数据库中搜索相关序列进行比对,分析序列间的同源性。
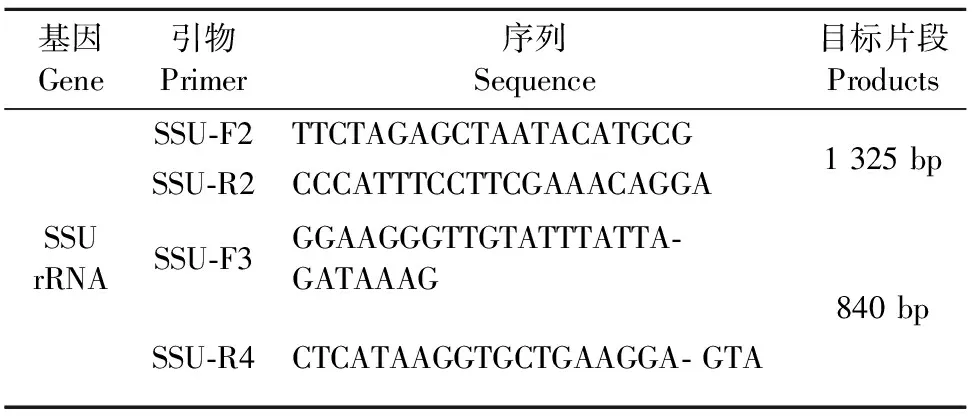
表1 本研究所用引物信息
1.4 统计学处理分析
所得数据使用SPSS 21.0统计软件进行处理,计数资料用例数和率表示。采用单因素方差分析,分别比较年龄、性别、品种以及饲养管理等因素对隐孢子虫感染率的影响。
2 结果
2.1 改良抗酸染色法镜检结果
所检查的104份犬粪便样品结果均为阴性,纯化卵囊染色结果为阳性,镜下卵囊呈椭圆球形,为玫瑰红色,可见棕黑色残体颗粒(图1)。
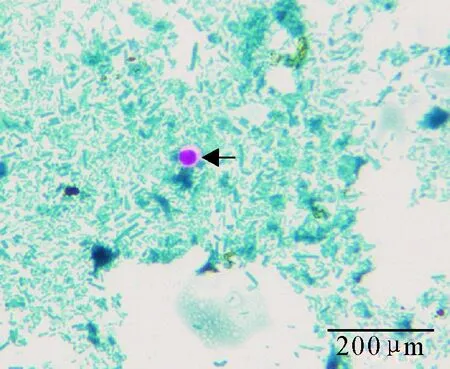
图1 纯化卵囊改良抗酸染色后结果
2.2 饱和蔗糖溶液漂浮法镜检结果
所检测的104份犬粪便样品结果均为阴性,纯化卵囊染色结果为阳性,卵囊呈椭圆球形,呈玫瑰红色,外有一圈亮绿色折光带(图2)。
2.3 隐孢子虫SSU rRNA基因检测结果
对104个临床收集的粪便样本进行隐孢子虫SSU rRNA基因检测,结果显示,4份样本为隐孢子虫阳性,凝胶电泳结果见图3,阳性产物送检测序后比对结果均为C.canis。

图2 纯化卵囊饱和蔗糖溶液漂浮法染色后结果
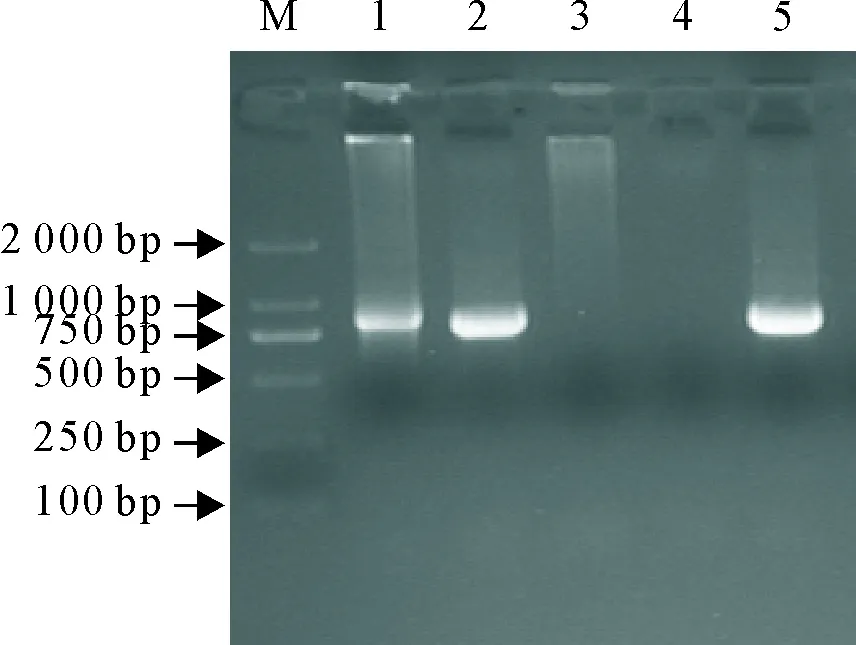
M.DNA标准 DL 2 000;1~2.SSU rRNA阳性样品;3.SSU rRNA 阴性样品;4.阴性对照;5.阳性对照
M.DNA Marker DL 2 000;1-2.SSU rRNA positive samples;3.SSU rRNA negative sample;4.Negative control;5.Positive control
图3 SSU rRNA 基因PCR扩增产物结果
Fig.3 PCR products ofCryptosporidiumSSU rRNA gene
2.4 风险因子评估
仅发现年龄因素对隐孢子虫感染率影响显著(P<0.05),低于6月龄的幼犬隐孢子虫感染率明显高于6月龄以上的犬只。
而犬只性别、品种、食物、饮水、免疫、体内驱虫等因素均对隐孢子虫感染率无显著影响(P>0.05)。
3 讨论
本研究中采用改良抗酸染色法镜检犬粪便样品中的隐孢子虫均为阴性,但对纯化后卵囊溶液制片染色后,可在镜下能清晰分辨玫瑰红色的的卵囊,与周围蓝绿色背景对比明显,表明此方法适用于隐孢子虫卵囊检测,但是临床样本的低检出率或是由于粪便含虫量过少,敏感性较差。该方法不需要特殊设备,操作简单,费用低,故在目前流行病学调查中使用较为广泛。董和平等[8]通过采用此法对郑州地区犬隐孢子虫进行调查,报道感染率为2.59%;王菊花等[9]采用此法对合肥地区进行调查,犬隐孢子虫感染率为28.99%。
而采用饱和蔗糖溶液漂浮法对临床粪便样品中隐孢子虫卵囊进行检测,发现结果均为阴性,同改良抗酸染色一样,此法亦能检测出纯化后卵囊溶液中的隐孢子虫卵囊,表明其敏感性较差,且镜检时易与酵母菌等微生物或脂肪滴相混淆,故特异性不强。Clarke等[10]将饱和蔗糖溶液漂浮法和离心集卵法结合起来,提高了卵囊的回收率和活性,可作为提高检出率的参考方法。国内采用此法进行流行病学调查结果显示,合肥地区犬隐孢子虫感染率为10.34%[11];四川地区隐孢子虫感染率为4.3%[4]。而本试验低检出率或可归因于北京地区家养犬隐孢子虫感染率较低,或临床收集的犬粪便量较少,富集卵囊较少,故检出率过低。
套式PCR检测方法是目前国内外流行病学调查中最主要的方法,本试验采用此法调查得到北京地区犬隐孢子虫感染率为3.85%,敏感性与特异性明显高于形态学检测。同时PCR可用于大量样品的检测,对于粪便中卵囊含量较少的无症状带虫者或轻度症状的病例的检测也较为敏感。通过此法的报道结果显示,河南地区犬隐孢子虫感染率为3.8%[12],黑龙江地区为4.5%[13],均接近于本试验结果,调查地区和犬群或是存在感染率差异的原因。国外不同犬群的隐孢子虫感染率,分别为法国2.9%[14],荷兰8.7%[15],巴西2.2%[16],日本7.2%[17]意大利3.3%[6],其感染率的差异或许与各个国家的发展情况和地理位置有关。
本研究所收集的样本虽然都收集于中国农业大学动物医院,但犬只来源广泛地覆盖了北京的13个行政区域,因此在地理位置上具有一定的代表性。经单因素方差分析各个风险因子,仅发现年龄对隐孢子虫感染具有显著影响,且低于6月龄的幼犬感染率明显高于成犬(P<0.05),与文献报道中6月龄以内幼犬的隐孢子虫感染率较高相符合[18]。而其他因素未见显著性差异。
将所得阳性序列测序比对后发现,北京地区家养犬携带的隐孢子虫全部是C.canis,而该虫种为犬主要易感,此结果也与国内外其他报道一致[19]。尽管C.canis主要感染犬,但是也有其在病人体内发现的报道[20],具有潜在的人畜共患危害。在国内外报道中,犬易感虫种包括C.canis、C.muris、C.meleagridis和C.hominis,本试验结果与该报道相符[9]。而C.hominis是人易感的虫种,在本次研究中尚未发现,该虫种与C.parvum作为世界范围内隐孢子虫病重点研究的对象,具有非常重要的公共卫生学意义。而C.canis是具有一定的人畜共患风险的隐孢子虫虫种,其公共卫生学意义比较有限[21]。参考文献:
[1] Xiao L,Fayer R,Ryan U,et al.Cryptosporidiumtaxonomy:recent advances and implications for public health[J].J Clin Microbiol Rev,2004,17(1):72-97.
[2] Nime F A,Burek J D,Page D L,et al.Acute enterocolitis in a human being infested with the protozoanCryptosporidium[J].Gastroenterology,1976,70(4):592-598.
[3] Fayer R,Morgan U,Upton S J,et al.Epidemiology ofCryptosporidium:transmission,detection and Identification[J].Int J Parasitol,2000,30(12):1305-1322.
[4] 胡 霖.四川省部分地区犬贾第虫和隐孢子虫分子遗传特征及其种系发育研究[D].四川雅安:四川农业大学,2011.
[5] Fayer R,Xiao L,Trout J M,et al.Cryptosporidiumcanisn.sp.from domestic dog[J].J Parasitol,2001,87(6):1415-1422.
[6] Giangaspero A,Lorio R,Paoletti B,et al.Molecular evidence forCryptosporidiuminfection in dogs in Central Italy[J].Parasitol Res,2006,99(3):297-299.
[7] Xiao L,Escalante L,Yang C,et al.Phylogenetic analysis ofCryptosporidiumparasites based on the small-subunit rRNA gene locus[J].Appl Environ Microbiol,1999,65(4):1578-1583.
[8] 董和平,张龙现,宁长申,等.郑州地区犬隐孢子虫病流行病学调查及动物感染试验[J].中国兽医科学,2007,10:854-858.
[9] 王菊花,李培英,薛秀恒,等.合肥市犬隐孢子虫感染情况初步调查[J].中国兽医寄生虫病,2008,16(5):20-23.
[10] Clarke S C,McIntyre M.Acid-fast bodies in faecal smears stained by the modified Ziehl-Neelsen technique [J].Br J Biomed Sci,2001,58(1):7-10.
[11] 于丽萍,李培英,顾有方,等.合肥地区犬隐孢子虫病流行病学调查[J].安徽科技学院学报,2009,23(1):15-18.
[12] Jian F C,Qi M,He X Y,et al.Occurrence and molecular characterization ofCryptosporidiumin dogs in Henan Province,China[J].BMC Vet Res,2014,10:26-30.
[13] Lia W,Li Y J,Song M X,et al.Prevalence and genetic characteristics ofCryptosporidium,EnterocytozoonbieneusiandGiardiaduodenalisin cats and dogs in Heilongjiang province,China[J].Vet Parasitol,2015,208:125-134.
[14] Osman M,Bories J,Safadi D,et al.Prevalence and genetic diversity of the intestinal parasitesBlastocystissp.andCryptosporidiumspp.in household dogs in France and evaluation of zoonotic transmission risk[J].Vet Parasitol,2015,214(1-2):167-170.
[15] Overgaauw P,Zutphen L,Hoek D,et al.Zoonotic parasites in fecal samples and fur from dogs and cats in The Netherlands[J].Vet Parasitol,2009,163(1-2):115-122.
[16] Mundim M,Rosa L,Faria E,et al.Prevalence ofGiardiaduodenalisandCryptosporidiumspp.in dogs from different living conditions in Uberlndia,Brazil[J].Vet Parasitol,2007,144(3-4):356-359.
[17] Itoh N,Oohashi Y,Ichikawa-Seki M,et al.Molecular detection and characterization ofCryptosporidiumspecies in household dogs,pet shop puppies,and dogs kept in a school of veterinary nursing in Japan[J].Vet Parasitol,2013,200(3-4):284-288.
[18] Denholm K M,Haitjema H,Gwynne B J,et al.ConcurrentCryptosporidiumandparvovirusinfections in a puppy[J].Aust Vet J,2001,79(2):98-101.
[19] Lupo J P,Langer-Curry R C,Robinson M A,et al.Cryptosporidiummurisin a Texas canine population[J].Am J Trop Med Hyg,2008,78(6):917-921.
[20] Xiao L,Cama V A,Cabrera L,et al.Possible transmission ofCryptosporidiumcanisamong children and a dog in a household[J].J Clin Microbiol ,2007,45(6):2014-2016.
[21] Ryan U,Fayer R,Xiao L.Cryptosporidiumspecies in humans and animals:current understanding and research needs[J].Parasitology,2014,141(13):1667-1685.
Investigation on Infection ofCryptosporidiumin Domestic Dogs of Beijing
ZHANG Ying-xin,ZHOU Meng-jie,YU Zhong-jia,CHEN Si-yuan,WANG Li-ya,YU Yong-lan
(CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing,100193,China)
The purposes of this study were to compare the methods for detectingCryptosporidiumspp.in small animal clinical diagnosis and to determine the prevalence ofCryptosporidiumspp.of domestic dogs in Beijing.104 fecal samples of domestic dogs (located in 13 different regions) were collected in China Agricultural University Veterinary Teaching Hospital during the period from Jan 2015 to Dec 2015 and were detected forCryptosporidiumspp.by modified acid fast stain,Sheater's sugar flotation technique and nested polymerase chain reaction (PCR) targeting the small subunit (SSU) rRNA coding region,followed by direct sequencing of the PCR products and analysis of the sequences obtained for genotyping.The result showed that nested-PCR could be applied to clinical detection ofCryptosporidiumin dog feces and morphological methods could only detect purified oocysts.The prevalence of dogs infected withCryptosporidiumspp.in Beijing was 3.85%(4/104).All of the 4 sequence samples were identified asC.canis.In domestic dogs,the differences of prevalence among different ages were statistically significant(P<0.05) and puppies below 6 months were more susceptive.No significant correlation (P>0.05) was observed between gender and location of residence.
dog;Cryptosporidiumspp.; infection rate; investigation
2016-10-06
国家级大学生创新创业训练计划项目(201510019073)
张颖欣(1995-),女,四川成都人,本科生,主要从事动物医学研究。*通讯作者
S852.7
B
1007-5038(2017)06-0120-04
