重组UBC13对RAW264.7炎症因子mRNA表达的影响
2017-06-26扆妍妍陶佳丽段马魁姜俊兵
张 亮,扆妍妍,陶佳丽,段马魁,姜俊兵
(山西农业大学动物科技学院,山西太谷 030801)
重组UBC13对RAW264.7炎症因子mRNA表达的影响
张 亮,扆妍妍,陶佳丽,段马魁,姜俊兵*
(山西农业大学动物科技学院,山西太谷 030801)
为了研究重组蛋白UBC13对RAW264.7小鼠巨噬细胞炎症因子mRNA表达量的影响,采用噻唑蓝(MTT)法检测UBC13对RAW264.7细胞活力的影响,qPCR法检测不同浓度UBC13(20、10、5 μg/mL)在不同时间点(3、6、9、12、24 h)对RAW264.7细胞产生的IL-6、IL-1β、TNF-α 和COX-2 4种炎症因子mRNA表达量的影响。结果表明,在整个试验时间范围内IL-6、IL-1β、TNF-α和COX-2 mRNA表达量呈现逐步降低的趋势;与细胞对照组组相比,在24 h时IL-6、IL-1β、TNF-α 和COX-2 mRNA表达量显著降低(P<0.05)。说明重组蛋白UBC13作用于RAW264.7细胞24 h时能够明显抑制RAW264.7细胞中IL-6、IL-1β、TNF-α 和COX-2的mRNA表达,并且具有药物剂量依赖性。
UBC13;小鼠巨噬细胞;炎症因子;基因表达
泛素化是蛋白质翻译后的重要修饰方式。泛素结合酶(E2)家族中,UBC13是唯一能够参与Lys63多聚泛素链形成的泛素结合酶,并参与调节信号转导和其他细胞过程,例如DNA损伤修复,激活和调节天然免疫系统和获得性免疫系统[1]。泛素结合酶UBC13与其他2种不具有催化功能的小分子蛋白Mms2和Uev1A形成Lys63泛素链,这2种小分子又被称为E2样配体蛋白。其中UBC13-Mms2二聚物参与细胞核内Lys63泛素链的形成负责DNA损伤应答[2],而UBC13-Uev1A二聚物参与胞浆内Lys63泛素链的形成是核转录因子κB(NF-κB)激活的必要因素[3-4]。
巨噬细胞除了参与炎症反应,还是天然免疫和获得性免疫系统中重要成员。巨噬细胞的主要作用是吞噬外来病原微生物和分泌促炎因子,如IL-6、IL-1β、TNF-α、COX-2和iNOS。本试验以实验室前期研究为背景,利用重组蛋白UBC13作用于RAW264.7细胞,探讨其对RAW264.7细胞相关炎症因子mRNA表达量的影响,为后期关于重组蛋白UBC13免疫调节功能的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞 小鼠巨噬细胞RAW264.7细胞系,中国科学院上海细胞库产品。
1.1.2 主要试剂 重组蛋白UBC13由山西农业大学临床兽医学实验室提供;二甲基亚砜(DMSO),Solarbio公司产品;胎牛血清(FBS),Biological Industries公司产品;DMEM培养基,Hyclone公司产品;噻唑蓝(MTT),Amresco公司产品;0.25%胰酶,Gibco公司产品;Trizol试剂,Invitrogen公司产品;反转录试剂盒,TaKaRa公司产品;2×SYBR Green qPCR Master Mix,Biotool公司产品。
1.1.3 主要仪器 多功能酶标仪,Molecular Devices公司产品;倒置荧光显微镜,Olympus公司产品;CO2细胞培养箱,Heal force公司产品;ABI 7500定量PCR仪,Life公司产品;核酸蛋白浓度测定仪,NanoDrop公司产品。
1.2 方法
1.2.1 细胞培养与处理 RAW264.7细胞复苏后用含有100 U/mL青霉素、100 μg/mL链霉素和10% FBS的DMEM培养基于5% CO2、37℃培养箱培养。待细胞生长至90%时,弃去孔内的培养基,进行药物处理试验。
1.2.2 MTT法检测细胞活力 生长对数期的RAW264.7细胞以4×105个/mL密度接种于96孔板,待细胞生长至90%时加入不同浓度UBC13蛋白溶液(320、160、80、40、20、10、5 μg/mL)。以细胞组为对照,每组设置6个重复。24 h后每孔加入20 μL MTT (0.5 mg/mL),继续培养4 h弃去孔内培养基,每孔加入100 μL DMSO,37℃培养20 min后酶标仪490 nm波长处读取吸光值。
1.2.3 特异性引物设计 采用NCBI在线引物设计工具进行特异性引物设计,小鼠IL-6、IL-1β、TNF-α、COX-2和β-actin基因序列和产物大小见表1。

表1 本试验所用引物序列
1.2.4 细胞总RNA的提取与反转录 生长对数期的RAW264.7细胞以4×105个/mL密度接种于6孔板,待细胞生长至90%时,按以下方式进行分组。细胞组:只加2%的DMEM培养基;试验组:每组加入不同浓度的UBC13蛋白溶液(20、10 、5 μg/mL)。分别于3、6、9、12、24 h共5个时间点收集细胞,按照Invitrogen Trizol试剂说明书提取细胞总RNA,Nanodrop测定RNA浓度及纯度。根据反转录试剂盒说明进行cDNA合成:去除gDNA,1 μg RNA中加入gDNA Eraser 1 μL,5×gDNA Eraser buffer 1 μL,用ddH2O将总体积补齐至10 μL 42℃反应2 min; cDNA合成,向已去除DNA的样品中加入PrimeScript RT Enzyme Mix I 1 μL,RT Prime Mix 1 μL,5×PrimeScript buffer 4 μL,ddH2O 4 μL。
1.2.5 qPCR法检测UBC13对细胞炎症因子表达量的影响 根据2×SYBR Green qPCR Master Mix试剂盒说明书,取10 μL 2×SYBR Green qPCR Master Mix,上下游引物各1 μL,1 μL cDNA和7 μL dH2O进行扩增。采用ABI 7500 Real-time PCR系统进行扩增:95℃ 30 s,95℃ 5 s,60℃ 34 s,共40个循环,然后经过95℃ 15 s,60℃ 1 min,95℃ 30 s及60℃ 15 s进行熔解曲线分析。每个样品3个重复。以β-actin为内参基因,根据Ct值,采用2-△△CT法分别进行计算。
1.2.6 统计学分析 数据采用GraphPad Prism 5软件进行统计学分析,利用One-way analysis of variance (ANOVA)方法确定各组间的差异性,P<0.05表示差异有统计学意义,数据以“平均数±标准差”表示。
2 结果
2.1 UBC13对RAW264.7细胞活性影响
结果如图1所示,高浓度UBC13蛋白对RAW264.7细胞活性有显著抑制作用。故筛选RAW264.7细胞存活率为90%以上的UBC13蛋白浓度为试验浓度,筛选得到的药物浓度分别为20、10、5 μg/mL。
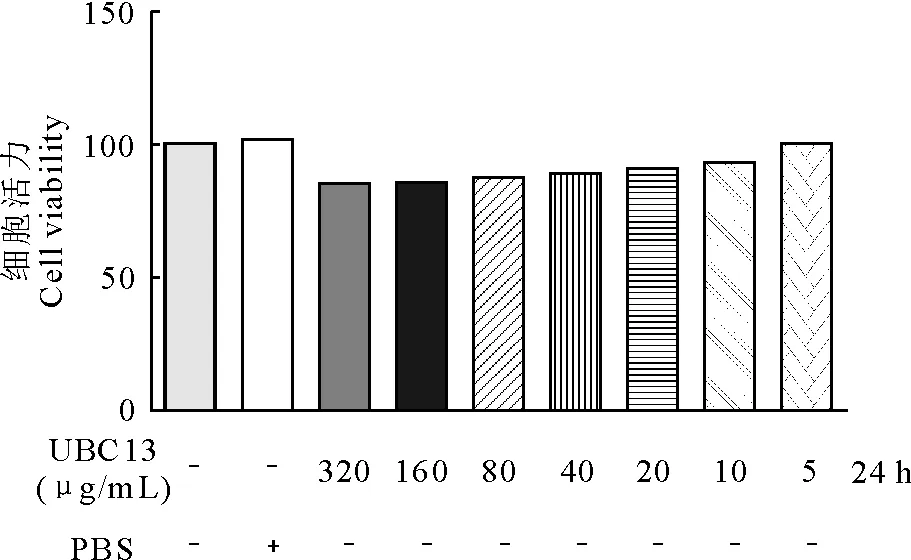
图1 UBC13对细胞活力的影响
2.2 UBC13对RAW264.7细胞TNF-α mRNA表达量的影响
结果如图2所示,药物作用3 h和6 h时,药物处理组各组TNF-α mRNA表达量均高于正常组,其中3 h 10 μg/mL组和5 μg/mL组TNF-α mRNA表达量显著高于正常组(P<0.05);6 h药物处理组各组TNF-α mRNA表达量显著高于正常组(P<0.05);药物作用9 h时,药物处理组各组TNF-α mRNA表达量与正常组相比无显著性差异(P>0.05),其中20 μg/mL组TNF-α mRNA表达量低于正常组,10 μg/mL组和5 μg/mL组TNF-α mRNA表达量高于正常组;药物作用12 h时,药物处理组各组TNF-α mRNA表达量均低于正常组,但无显著性差异(P>0.05);药物作用24 h时,药物处理组各组TNF-α mRNA表达量显著低于正常组(P<0.05)。且各时间点TNF-α mRNA表达量的变化均体现出药物浓度依赖性。
2.3 UBC13对RAW264.7细胞IL-6 mRNA表达量的影响
药物作用3 h、6 h和9 h时,药物处理组各组IL-6 mRNA表达量均高于正常组,其中3 h 10 μg/mL组IL-6 mRNA表达量显著高于正常组(P<0.05);6 h 10 μg/mL组和5 μg/mL组IL-6 mRNA表达量显著高于正常组(P<0.05);9 h 10 μg/mL组IL-6 mRNA表达量显著高于正常组(P<0.05);药物作用12 h时,药物处理组各组IL-6 mRNA表达量均低于正常组,其中20 μg/mL组和10 μg/mL组IL-6 mRNA表达量显著低于正常组(P<0.05);药物作用24 h时,药物处理组各组IL-6 mRNA表达量显著低于正常组(P<0.05)。且各时间点IL-6 mRNA表达量的变化总体上具有药物浓度依赖性(图3)。

*P<0.05,**P<0.01,***P<0.001
图2 UBC13作用不同时间后TNF-α mRNA相对表达量
Fig.2 Relative expression levels of TNF-α mRNA at different time after UBC13 treatment
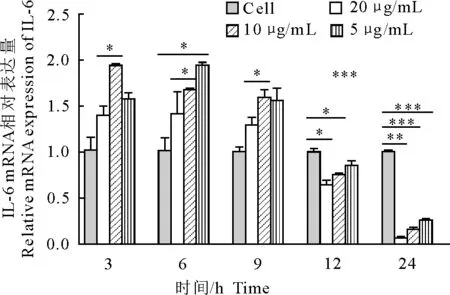
*P<0.05,**P<0.01,***P<0.001
图3 UBC13作用不同时间后IL-6 mRNA相对表达量
Fig.3 Relative expression levels of IL-6 mRNA at different time after UBC13 treatment
2.4 UBC13对RAW264.7细胞COX-2 mRNA表达量的影响
结果如图4所示,药物作用3 h时,药物处理组各组COX-2 mRNA表达量显著高于正常组(P<0.05);药物作用6 h时,20 μg/mL组COX-2 mRNA表达量低于正常组,10 μg/mL组和5 μg/mL组COX-2 mRNA表达量高于正常组,其中5 μg/mL组COX-2 mRNA表达量显著高于正常组(P<0.05);药物作用9 h时,20 μg/mL组和10 μg/mL组COX-2 mRNA表达量均低于正常组,5 μg/mL组COX-2 mRNA表达量显著高于正常组(P<0.05);药物作用12 h时,药物处理组各组COX-2 mRNA表达量均低于正常组,其中20 μg/mL组和10 μg/mL组COX-2 mRNA表达量显著低于正常组(P<0.05);药物作用24 h时,药物处理组各组COX-2 mRNA表达量均显著低于正常组(P<0.05)。且各时间点COX-2 mRNA表达量的变化均体现出药物浓度依赖性。
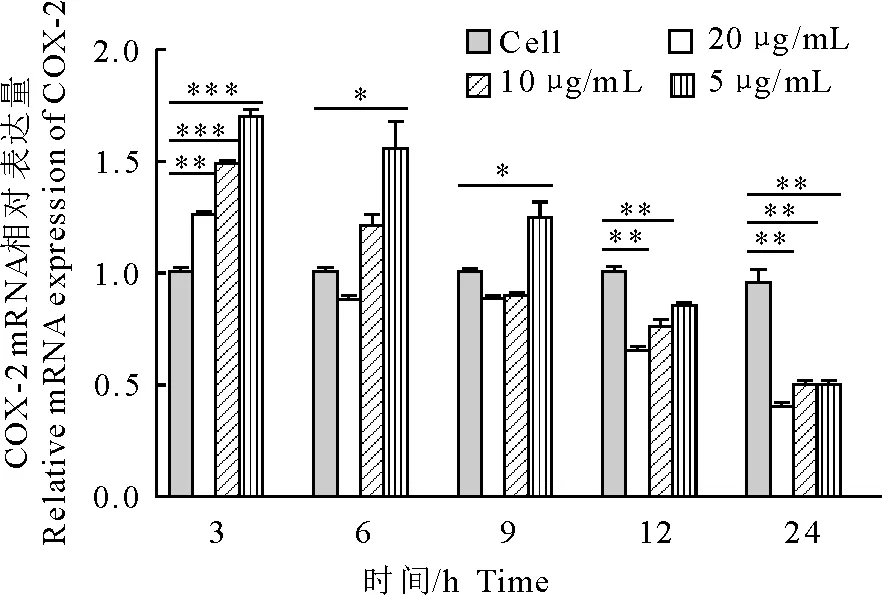
*P<0.05,**P<0.01,***P<0.001
图4 UBC13作用不同时间后COX-2 mRNA相对表达量
Fig.4 Relative expression levels of COX-2 mRNA at different time after UBC13 treatment
2.5 UBC13对RAW264.7细胞IL-1β mRNA表达量的影响
结果如图5所示,药物作用3 h和6 h时,药物处理组各组IL-1β mRNA表达量均高于正常组,其中6 h 10 μg/mL组和5 μg/ml组IL-1β mRNA表达量显著高于正常组(P<0.05);药物作用9 h时,20 μg/mL组和10 μg/mL组IL-1β mRNA表达量均低于正常组,其中20 μg/mL组IL-1β mRNA表达量显著低于正常组(P<0.05),5 μg/mL组IL-1β mRNA表达量显著高于正常组(P<0.05);药物作用12 h时,药物处理组各组IL-1β mRNA表达量均低于正常组,其中20 μg/mL组IL-1β mRNA表达量显著低于正常组(P<0.05);药物作用24 h时,药物处理组各组IL-1β mRNA表达量显著低于正常组(P<0.05)。且各时间点IL-1β mRNA表达量的变化均体现出药物浓度依赖性。
3 讨论
炎症是由细菌感染或化学损伤引发的一个复杂过程,在抵抗各种病原微生物入侵中起关键作用[5-6]。此外,炎症反应是机体产生的一种自我保护性反应。细菌感染和化学损伤引起的损伤导致细胞炎症因子的产生,包括单核细胞和巨噬细胞产生的TNF-α和IL-6。然而过度的炎症反应又会引发自身免疫性疾病,例如系统性红斑狼疮[7]。所以,保持免疫环境稳定是维持机体生理功能正常的基本要求。在炎症过程中,巨噬细胞是天然免疫系统的主要组成部分。巨噬细胞的活化是动物天然免疫系统激活的首要反应,被激活的巨噬细胞能够通过LPS/TLR4-NF-κB通路产生的TNF-α、NO和IL-6参与机体免疫调节[8]。本试验首先检测重组蛋白UBC13对RAW264.7细胞活力的影响,MTT实验结果表明,药物浓度在20 μg/mL以内对细胞无明显的毒副作用,所以选择20 μg/mL、10 μg/mL和5 μg/mL浓度进行后续试验。
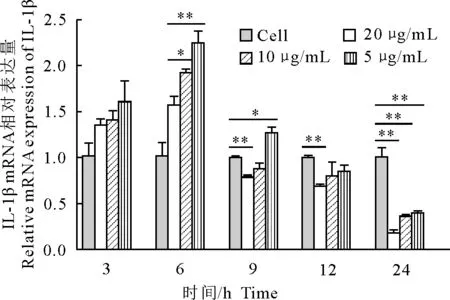
*P<0.05,**P<0.01,***P<0.001
图5 UBC13作用不同时间后IL-1β mRNA相对表达量
Fig.5 Relative expression levels of IL-1β mRNA at different time after UBC13 treatment
细胞因子是一类具有广泛生物学活性且功能复杂的小分子蛋白质,TNF-α主要由单核巨噬细胞产生,被视为炎症反应中最为重要的细胞因子之一,能够引起急性炎症性疾病并引发组织损伤[9-10]。IL-6也是诱导炎症反应的主要细胞因子,它能促进淋巴细胞的分化,同其他炎性因子协同作用放大炎症反应[11]。环氧化酶-2(COX-2)是机体催化花生四稀酸转变为前列腺素的限速酶,具有放大炎症反应的作用[12-13]。因此,IL-6、IL-1β、TNF-α 和COX-2作为炎症标志物,对验证药物是否具有免疫调节功能存在指导性作用。试验结果显示,在整个试验时间点范围内IL-6、IL-1β、TNF-α 和COX-2 mRNA表达量呈现逐步降低的趋势,并且各时间点基因表达量的变化体现出一定的药物剂量依赖性。其中,3、6、9 h时药物组各因子mRNA表达量总体要高于正常组,但是个别药物组各因子mRNA表达量已经低于正常组;12 h时,药物组各因子mRNA表达量低于正常组;24 h 药物组各因子mRNA表达量显著低于正常组;以上结果说明重组蛋白UBC13在24 h对炎症因子mRNA的表达量有一定的抑制作用。但是UBC13在不同时间点对各因子mRNA表达量的影响具体机制还需进一步验证。
[1] Chen Z J,Sun L J.Nonproteolytic functions of ubiquitin in cell signaling[J].Mol Cell,2009,33 (3):275-286.
[2] Andersen P L.Distinct regulation of Ubc13 functions by the two ubiquitin-conjugating enzyme variants Mms2 and Uev1A[J].J Cell Biol,2005,170 (5):745-755.
[3] Hofmann R M,Pickart C M.In vitro assembly and recognition of Lys-63 polyubiquitin chains[J].J Biol Chem,2001,276 (30):27936-27943.
[4] Hofmann R M,Pickart C M.Noncanonical MMS2-encoded ubiquitin-conjugating enzyme functions in assembly of novel polyubiquitin chains for DNA repair[J].Cell,1999,96 (5):645-653.
[5] Calder P C.n-3 polyunsaturated fatty acids,inflammation,and inflammatory diseases[J].Am J Clin Nutr,2006,83 (6 Suppl):77-109.
[6] Ran S,Montgomery K E.Macrophage-mediated lymphangiogenesis:the emerging role of macrophages as lymphatic endothelial progenitors[J].Cancers,2012,4 (3):618-657.
[7] Paterson H M,Murphy T J,Purcell E J,et al.Injury primes the innate immune system for enhanced Toll-like receptor reactivity[J].J Immunol,2003,171 (3):1473-1483.
[8] Zong A,Cao H,Wang F.Anticancer polysaccharides from natural resources:A review of recent research[J].Carbohydr Polym,2012,90 (4):1395-1410.
[9] Ahmad S F,Ansari M A,Zoheir K M,et al.Regulation of TNF-α and NF-κB activation through the JAK/STAT signaling pathway downstream of histamine 4 receptor in a rat model of LPS-induced joint inflammation[J].Immunobiology,2015,220 (7):889.
[10] Yamanaka H.TNF as a target of inflammation in rheumatoid arthritis.[J].Endoc Metab Immune Disord Drug Targets,2015,15 (2):129-134
[11] Hong S H,Ondrey F G,Avis I M,et al.Cyclooxygenase regulates human oropharyngeal carcinomas via the proinflammatory cytokine IL-6:a general role for inflammation[J].FASEB J,2000,14 (11):1499-1507.
[12] Wang D,Dubois R N.The role of COX-2 in intestinal inflammation and colorectal cancer[J].Oncogene,2010,29 (6):781.
[13] Li H,Bradbury J A,Dackor R T,et al.Cyclooxygenase-2 regulates Th17 cell differentiation during allergic lung inflammation[J].Am J Respir Crit Care Med,2011,184 (1):37-49.
Effects of Recombinant UBC13 on mRNA Expressions of Inflammatory Cytokines in RAW264.7 Cells
ZHANG Liang,YI Yan-yan,TAO Jia-li,DUAN Ma-kui,JIANG Jun-bing*
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu,Shanxi,030801,China)
To investigate the effects of recombinant UBC13 on mRNA expressions of the inflammatory cytokines in RAW264.7 cells,the viability of cells was measured by using MTT assay.qPCR method was used to detect the effects of different concentrations (20,10, 5 μg/mL) of UBC13 on the mRNA expression levels of IL-6,IL-1β,TNF-α and COX-2 at 3,6,9,12,24 h.The results showed that the mRNA expressions of IL-6,IL-1β,TNF-α and COX-2 decreased gradually at the whole stage of the experiment.The mRNA expressions of IL-6,IL-1β,TNF-α and COX-2 were significantly decreased in UBC13 treatment group at 24 h (P<0.05),comparing with the cell group.Our results indicated that the UBC13 could significantly inhibits the mRNA expressions of IL-6,IL-1β,TNF-α and COX-2 in RAW264.7 cells at 24 h in a dose-dependent manner.
UBC13; RAW264.7; inflammatory cytokine; gene expression
2017-01-21
山西省科技攻关项目(20100312016)
张 亮(1990-),男,内蒙古鄂尔多斯人,硕士研究生,主要从事动物生化与分子免疫学研究。*通讯作者
S852.2
A
1007-5038(2017)06-0020-04
