猪繁殖与呼吸综合征病毒主要流行毒株检测方法的建立
2017-06-26郭振华陈鑫鑫郭军庆乔松林
郭振华,陈鑫鑫,郭军庆,乔松林
(河南省农业科学院动物免疫学重点实验室,河南郑州 450002)
研究论文
猪繁殖与呼吸综合征病毒主要流行毒株检测方法的建立
郭振华,陈鑫鑫,郭军庆,乔松林*
(河南省农业科学院动物免疫学重点实验室,河南郑州 450002)
旨在建立针对猪繁殖与呼吸综合征病毒田间主要流行毒株的鉴别诊断方法。通过比对当前田间主要流行毒株的基因序列,分别设计了针对ORF5基因的通用引物和针对Nsp2基因的鉴别引物。RT-PCR结果显示,两对引物针对不同的毒株均可以扩增出特异性的目的条带,通用引物可以用来检测田间主要的流行毒株,鉴别引物可以区分当前田间主要流行的不同毒株。所建立的检测方法具有良好的特异性和敏感性,可以方便地应用于猪繁殖与呼吸综合征病毒的分子流行病学监控和快速检测诊断,具有良好的应用价值。
猪繁殖与呼吸综合征病毒;ORF5基因;Nsp2基因;反转录-聚合酶链反应
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的,以母猪繁殖障碍和不同年龄段的猪呼吸系统疾病为主要特征的传染性疫病[1]。美国在1987年首次报道了PRRS的发生,欧洲在1991年分离到了PRRSV,随后本病在世界范围内广泛流行[2]。PRRSV属于动脉炎病毒科(Arteriviridae),动脉炎病毒属(Arterivirus),有囊膜,基因组为单股正链RNA,大小约15 kb,有11个开放阅读框(open reading frame,ORF),编码16个非结构蛋白和8个结构蛋白[3]。
基于基因组序列及抗原特性差异,PRRSV可以分为两大基因型,即以欧洲型毒株LV为代表的基因Ⅰ型和以美洲型毒株VR-2332为代表的基因Ⅱ型。随着PRRSV毒株的不断变异,每个基因型又分为若干个亚型或者谱系(lineage)[1,4,5]。我国在1996年,由郭宝清等首次分离到了PRRSV,命名为CH-1株,随后PRRSV在我国各地呈流行性状态。分子遗传学分析显示,我国流行的毒株主要属于美洲型[6]。2006年,由高致病性猪繁殖与呼吸综合征病毒(Highly pathogenic PRRSV,HP-PRRSV)导致的PRRS在我国暴发并大范围流行,给我国养猪业造成了巨大损失。代表性毒株JXA1基因组分析显示,HP-PRRSV的Nsp2编码区具有特征性的不连续30个氨基酸的缺失(481位和533-561位氨基酸)[7]。之后的分子流行病学研究显示,HP-PRRSV逐步成为田间流行的优势毒株[5]。2013年以来,一种新的PRRSV变异毒株在田间被检测到,代表性毒株分子遗传学分析显示,该流行毒株与北美地区流行毒株具有很近的遗传距离,与北美地区流行的代表性毒株NADC30在Nsp2编码区具有一致的缺失模式——不连续131个氨基酸的缺失(323-433位、482位、504-522位氨基酸),随后的分子流行病学研究显示,NADC30-like毒株在我国多个地区呈流行态势[8-11]。
因此,目前我国田间流行的PRRSV毒株大致分为3类,即以CH-1a为代表的经典类毒株(CH-1a-like strains),以JXA1位代表的HP-PRRSV类毒株(HP-PRRSV),以JL580为代表的NADC30-like类毒株(NADC30-like strains)。PRRSV的快速检测和毒株种类的确定,对于PRRS的防控具有重要的指导意义。目前基于RT-PCR和RT-qPCR技术建立了多种检测不同PRRSV流行毒株的方法,如针对欧洲型、美洲型和高致病性PRRSV的鉴别诊断[12]。但毒株的确定往往要依赖于ORF5基因的序列测定和分子进化树分析,对技术人员要求较高,得到结果也需要更长的时间。本研究通过对田间主要流行的代表性毒株进行序列比对分析,设计了针对ORF5基因的通用引物,主要用于不同美洲型毒株的检测;同时根据当前主要流行毒株Nsp2编码区特征性的碱基序列缺失模式,设计了一对鉴别引物,通过比较RT-PCR产物片段的大小,可以快速确定PRRSV毒株类别的检测方法。该方法具有良好的敏感性和特异性,具有较好的临床应用价值。
1 材料与方法
1.1 材料
1.1.1 毒株 引物设计参考毒株及GenBanK登录号分别为:CH-1a(AY032626)、BJ-4(AF331831)HuN4(EF635006)、JXA1(EF112445)、NADC30(JN654459)、JL580(KR706343);RT-PCR所用模板来源毒株及GenBanK登录号:BJ-4(AF331831)和HN07由本实验保存。
1.1.2 主要试剂 病毒基因组提取试剂盒Viral RNA/DNA Extraction Kit、逆转录酶M-MLV(RNase H-)、6聚体随机引物Hexadeoxyribonucleotide mixture- pd(N)6、Oligo (dT)15 Primer、DL2 000 DNA Marker、Mighty TA-cloning Kit购自宝生物工程(大连)有限公司(TaKaRa);TaqPlus Master Mix购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 引物设计与合成 本研究所使用的引物序列信息见表1。序列比对使用DNA Man软件进行分析,引物由生工生物(上海)股份有限公司合成。
1.2.2 RNA提取及cDNA的合成 按Viral RNA/DNA Extraction Kit使用说明书从细胞培养物(BJ-4和HN-07)、组织样品(HNzm1、HNam2、HNhx)中提取总RNA;按照M-MLV(RNase H-)说明书进行反转录,具体条件为:Hexadeoxyribonucleotide mixture- pd(N)6(100 μmol/L)和Oligo (dT)15 Primer(50 μmol/L)各0.5 μL。反转录程序:30℃ 10 min,42℃ 60 min,70℃ 15 min,4℃ 10 min。将反转录获得的cDNA置于-20℃保存备用。
1.2.3 PCR扩增 PCR反应体系(25 μL)如下:2 xTaqPlus MasterMix 12.5 μL,cDNA模板2 μL,上下游引物各0.5 μL,ddH2O 9.5 μL。反应参数如下:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,共30个循环;72℃ 5 min。PCR产物采用15 g/L琼脂糖凝胶进行电泳分析。
1.2.4 基因克隆与测序 采用10 g/L琼脂糖凝胶电泳分离PCR产物,利用凝胶回收试剂盒回收目的片段,连接pMD19-T载体后转化DH5α感受态细胞,涂氨苄青霉素抗性的LB平板,37℃培养箱过夜。菌落PCR筛选阳性克隆,PCR反应体系和条件同1.5,最后将阳性克隆送生工生物工程(上海)股份有限公司进行测序。
1.2.5 序列分析 利用生物学软件MEGA6.0对扩增的ORF5基因和参考毒株的ORF5基因进行序列同源性分析,绘制系统进化树[13]。利用DNA Star MegAlign(Clustal V method)进行比对分析,将测序获得的Nsp2序列与参考毒株进行多序列比对分析,确定Nsp2编码区的序列缺失模式。
1.2.6 特异性和敏感性分析 分别选择猪瘟病毒(CSFV)、日本脑炎病毒(JEV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、伪狂犬病病毒(PRV)、猪圆环病毒(PCV)、猪细小病毒(PPV)的临床阳性病料,用获得的cDNA或者DNA作为模板,进行ORF5和Nsp2引物的特异性检验。用纯化的含有目的基因片段的pMD20-T质粒作为标准定量质粒,用于ORF5和Nsp2引物的敏感性检测,基因片段拷贝数计算公式如下:
Y(拷贝数/μL)=[质粒DNA的浓度(g/μL)/(质粒DNA长度bp×660)]×60.2×1023
2 结果
2.1 引物设计
利用DNA Man和DNA Star MegAlign(Clustal V method)生物学软件,针对CH-1a、BJ-4、HuN4、JXA1、NADC30、JL580等代表性毒株,进行序列比对分析,分别设计了针对ORF5基因的通用引物和针对Nsp2基因的鉴别引物,详细序列信息见表1。
2.2 ORF5基因RT-PCR扩增结果
利用设计的ORF5通用引物,检测本实验室保存的标准毒株BJ-4、HN07以及临床送检代表性样本,均可以获得特异性的扩增条带,目的条带大小约851 bp(图1),提示该引物可以用于田间流行PRRSV毒株的检测。
2.3 基于ORF5基因的分子进化树分析
将获得的阳性样品进行序列测定,进一步通过分子进化树分析,显示HN07、HNzm1和HNzm2属于高致病性毒株,HNhx属于类NADC30毒株(图2),同时也进一步提示针对ORF5基因的引物对当前流行毒株具有很好的通用性。
2.4 Nsp2部分片段扩增结果
利用上述cDNA模板和扩增Nsp2特定区域的特异性引物,获得了不同大小的扩增产物其中以经典毒株BJ-4为模板的扩增产物大小约1 040 bp,以高致病性毒株HN07、HNzm1、HNzm2为模板的扩增产物大小约950 bp,以NADC30-like毒株HNhx为模板的扩增产物大小约647 bp(图3)。

表1 引物序列及信息
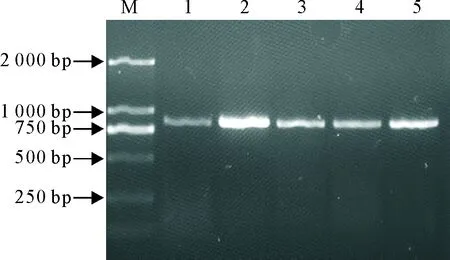
1~5.样品BJ-4、HN07、HNzm1、HNzm2、HNhx 1-5.Samples BJ-4,HN07,HNzm1,HNzm2,HNhx

图2 基于ORF5基因的分子进化树分析
2.5 Nsp2部分片段序列分析
将扩增产物进行序列测定分析显示,与经典毒株CH-1a相比,HNzm1和HNzm2具有高致病性毒株(JXA1)特征性的氨基酸缺失模式-481为和533-561位不连续30个氨基酸的缺失;HNhx具有NADC30毒株特征性的缺失模式-323-433位、482位和504-522位不连续的131个氨基酸的缺失(图4)。证明本研究所设计的引物可以特异性扩增不同毒株的Nsp2序列,且可以用于区分3种主要田间流行毒株。
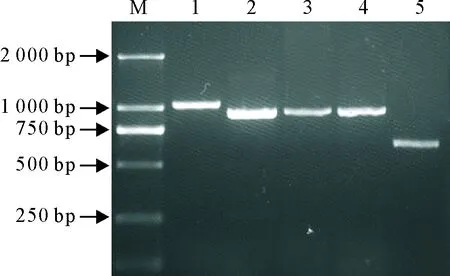
1.BJ-4毒株;2~4.分别为HN07、HNzm1、HNzm2毒株;5.HNhx毒株
1. BJ-4 strain;2-4. HN07、HNzm1、HNzm2 strains;5. HNhx strain
图3 不同毒株Nsp2基因序列检测结果
Fig.3 RT-PCR results of Nsp2 gene for different PRRSV strains
2.6 特异性分析
选取了临床常见的病原来检验所设计的引物是否存在非特异扩增。针对猪瘟病毒(CSFV)、日本脑炎病毒(JEV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、伪狂犬病病毒(PRV)、猪圆环病毒(PCV)、猪细小病毒(PPV)临床阳性病料的RT-PCR/PCR扩增结果显示,用作阳性对照的引物均扩增出特定大小的产物,而针对ORF5和Nsp2的引物均未出现非特异的扩增(图5)。
2.7 敏感性分析
将含有病毒目的基因的pMD20-T载体提取纯化,定量后做10倍系列稀释。PCR结果显示,针对ORF5基因的扩增在稀释至10-7时依然可以看到特异性条带,对应目的基因拷贝数为2.34×102(图6 A);针对Nsp2的扩增在稀释至10-6时可以获得清晰的特异性条带,对应的基因拷贝数为1.52×103(图6 B)。提示所建立的检测方法具有很高的敏感性,适于用于临床样本的检测。

HNzm1、HNzm2具有和JXA1一致的氨基酸缺失模式;HNhx和NADC30具有一致的氨基酸缺失模式 The amino acid deletion pattern of HNzm1 and HNzm2 is consistent with that of JXA1.The HNhx and NADC30 are consistent
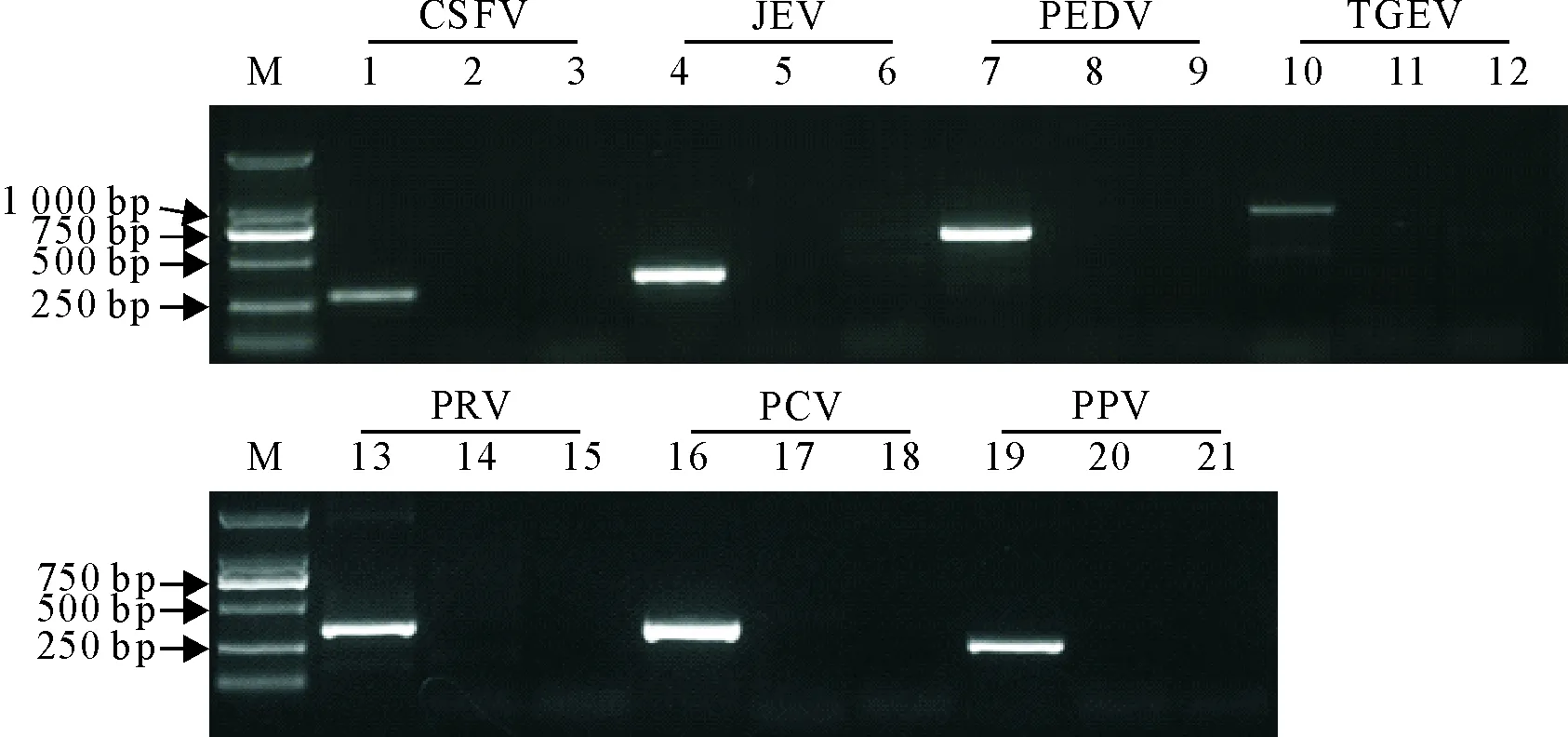
1、4、7、10、13、16、19.分别为阳性对照;2、5、8、11、14、17、20.为针对ORF5的引物扩增结果;3、6、9、12、15、18、21.为针对Nsp2引物扩增结果
1,4,7,10,13,16 and 19. Positive control,respectively;2,5,8,11,14,17,20.The ORF5 primer;3,6,9,12,15,18,21. Nsp2 primer
图5 针对ORF5和Nsp2基因扩增引物的特异性分析
Fig.5 The specificity assay of ORF5 primer and Nsp2 primer

图6 针对ORF5(A)和×(B)基因扩增引物的敏感性分析
3 讨论
猪繁殖与呼吸综合征是危害养猪业的重要疫病,病毒基因组的高变异性、不同毒株间血清学交叉保护反应差是PRRSV的显著特点。我国自1996年首次分离到PRRSV以来,至今PRRSV在全国范围内流行已有20年,期间PRRSV病毒基因组发生了较大的变异,毒力和增殖特性也发生了相应的变化[6,7,9]。如2006年HP-PRRSV在猪群中暴发给养猪业造成了沉重打击。之后虽然开发出了一系列疫苗,但在实际生产中防控效果不太理想,HP-PRRSV在我国猪场还在流行[1,16-18]。2013年-2014年,一种类NADC30毒株在我国多个地区(黑龙江、吉林、天津、北京、河南、浙江、福建)流行[10]。NADC30-like毒株是从北美输入的毒株,且和HP-PRRSV发生了基因重组,现有PRRS的防控措施对该毒株控制效果较差。
PRRSV在我国经过20年的流行变异,对本病的防控构成了严重的挑战。虽然现有的商品疫苗在特定的历史阶段发挥了重要的作用,但也正是在疫苗大范围、高强度使用之后,我国的PRRSV毒株变异速率进一步加快、多样性进一步加大。免疫压力下对病毒变异的影响、弱毒疫苗潜在的毒力返强风险、疫苗毒株和田间流行毒株发生重组的风险等,都是当前需要进一步反思的问题。
鉴于当前我国田间主要流行3类PRRSSV毒株,我们通过不同毒株的多序列比对分析,设计了针对ORF5基因的特异性通用引物,该引物可以用于检测不同PRRSV毒株;根据目前主要流行毒株Nsp2基因特征性的序列缺失模式,设计了一对特异性的鉴别引物,根据扩增片段大小的差异,该引物可以用于区分经典的PRRSV毒株、HP-PRRSV毒株和NADC30-like毒株。本研究建立的检测分析与临床常见病毒无非特异性反应,利用含有目的基因的标准质粒,本方法在目的基因片段低至2.34×102(ORF5)拷贝数和1.52×103(Nsp2)拷贝数时依然可以检出目的片段,说明该方法具有很好的特异性和敏感性,可以用于临床PRRSV的快速诊断和毒株的初步确定,同时也便于进行进一步的序列测定和分子进化树分析。本研究对于PRRSV的防控和分子流行病学监控具有重要的参考价值。
[1] 张显浩,陈瑞爱,李 冰,等.2012年-2014年我国东南地区HP-PRRSV GP5基因的遗传进化与变异分析[J].中国预防兽医学报,2015(1):71-74.
[2] Corzo C A,Mondaca E,Wayne S,et al.Control and elimination of porcine reproductive and respiratory syndrome virus[J].Virus Res,2010,154(1-2):185-192.
[3] Lunney J K,Fang Y,Ladinig A,et al.Porcine reproductive and respiratory syndrome virus (PRRSV):Pathogenesis and interaction with the immune system[J].Annu Rev Anim Biosci,2016,4:129-154.
[4] Zhou Z,Liu Q,Hu D,et al.Complete genomic characterization and genetic diversity of four European genotype porcine reproductive and respiratory syndrome virus isolates from China in 2011[J].Virus Genes.2015,51(3):375-384.
[5] Yin G,Gao L,Shu X,et al.Genetic diversity of the ORF5 gene of porcine reproductive and respiratory syndrome virus isolates in southwest China from 2007 to 2009[J].PLoS One,2012,7(3):e33756.
[6] 郭宝清,陈章水,刘文兴.从疑似PRRS流产胎儿分离PRRSV的研究[J].1996,87(2):1-5.
[7] Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[8] Li Y,Ji G,Wang J,et al.Complete genome sequence of an NADC30-like porcine reproductive and respiratory syndrome virus characterized by recombination with other strains[J].Genome Announc,2016,4(3).doi:10.1186/s40064-016-3336-5.
[9] Zhao K,Ye C,Chang X,et al.Importation and recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J].J Virol,2015,89(20):10712-10716.
[10] Zhou L,Wang Z,Ding Y,et al.NADC30-like strain of porcine reproductive and respiratory syndrome virus,China[J].Emerg Infect Dis,2015,21(12):2256-2257.
[11] 孙英峰,李 志,路 超,等.2014年-2015年天津地区PRRSV分子流行病学调查及流行毒株的分离鉴定[J].动物医学进展,2016,37(10):11-15.
[12] 温青娜,周玲玲,申 红,等.多重实时荧光PCR鉴别欧洲型、美洲型和高致病性PRRSV方法的建立[J].动物医学进展,2015,36(6):1-8.
[13] Tamura K,Stecher G,Peterson D,et al.MEGA6:Molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol,2013,30(12):2725-2729.
[14] 崔奕杰,杨润德,刘晓慧,等.猪日本脑炎病毒RT-PCR检测方法的建立[J].动物医学进展.2006(7):59-62.
[15] Xu X,Chen G,Huang Y,et al.Development of multiplex PCR for simultaneous detection of six swine DNA and RNA viruses[J].J Virol Meth,2012,183(1):69-74.
[16] Leng X,Li Z,Xia M,et al.Mutations in the genome of the highly pathogenic porcine reproductive and respiratory syndrome virus potentially related to attenuation[J].Vet Microbiol,2012,157(1-2):50-60.
[17] Tian Z,An T,Zhou Y,et al.An attenuated live vaccine based on highly pathogenic porcine reproductive and respiratory syndrome virus (HP-PRRSV) protects piglets against HP-PRRS[J].Vet Microbiol,2009,138(1-2):34-40.
[18] 陈红玲,黎作华,万春燕,等.高致病性猪繁殖与呼吸障碍综合征弱毒疫苗在规模化猪场中的临床应用与分析[J].中国猪业,2015(8):41-44.
Development of a RT-PCR Assay for Detection of Primarily Epidemic Porcine Reproductive and Respiratory Syndrome Virus
GUO Zhen-hua1,CHEN Xin-xin1,GUO Jun-qing1,QIAO Song-lin1
(1.HenanKeyLaboratoryofAnimalImmunology,HenanAcademyofAgriculturalSciences,Zhengzhou,Henan,450002,China)
To detect and distinguish the primarily epidemic porcine reproductive and respiratory syndrome virus(PRRSV) strains,we developed a RT-PCR assay method.According to the multiple sequence alignment,we designed two pairs of primers based on ORF5 gene and partial Nsp2 gene sequences respectively.The result of RT-PCR suggested that both of the primers could produce specific objective fragments by cDNA templates from different PRRSV strains.Further,the specificity and sensitivity of this RT-PCR assay were good.It’s very useful and convenient for the quick diagnosis and epidemiological surveillance.
PRRSV; ORF5 gene; Nsp2 gene; RT-PCR
2016-09-29
国家重点研发计划(2016YFD0500709);河南省生猪产业技术体系创新团队项目(S2012-06)
郭振华(1984-),男,执业兽医师,农学博士,主要从事猪疫病诊断与防控工作。*通讯作者
S852.65
A
1007-5038(2017)06-0001-05
