RNA干扰Nodal基因对胃癌细胞凋亡及血管生成的影响
2017-06-26余洁丽邱宇安刘利艳陈文学靳文剑陈火国
余洁丽 邱宇安 刘利艳 陈文学 靳文剑 陈火国 钟 宁
RNA干扰Nodal基因对胃癌细胞凋亡及血管生成的影响
余洁丽 邱宇安 刘利艳 陈文学 靳文剑 陈火国 钟 宁
目的 构建并鉴定Nodal基因的RNA慢病毒表达载体,探讨Nodal基因对胃癌及血管生成的作用。方法 针对Nodal mRNA设计siRNA,构建慢病毒质粒,测序鉴定质粒构建成功。将构建的慢病毒质粒及包装质粒共转染293T细胞,鉴定慢病毒包装成功,并测定其滴度。将慢病毒转染人胃腺癌细胞株MKN-45,通过qPCR检测Nodal基因表达。流式细胞仪检测细胞凋亡。Cellomics仪观察人脐静脉内皮细胞(HUVECs)血管生成。结果 通过测序显示,插入Nodal基因RNAi序列正确。包装后测定病毒滴度达(5.0×108)TU/ml,qPCR检测提示RNA干扰病毒转染MKN-45细胞株后,Nodal基因表达水平显著下降。干扰后胃癌细胞凋亡率明显上升(P<0.05),干扰Nodal基因对血管生成无显著影响(P>0.05)。结论 成功构建了人Nodal基因的RNAi慢病毒表达系统。干扰Nodal基因显著增加胃癌细胞凋亡。
Nodal;RNA干扰;慢病毒载体;胃肿瘤;血管生成
(ThePracticalJournalofCancer,2017,32:401~404)
胃癌是仅次于肺癌的第二大致死性肿瘤。本课题组前期研究提示在人胃低分化腺癌组织中,Nodal蛋白呈高表达。体外培养的胃癌细胞株Nodal基因亦明显表达。我们进一步构建了Nodal基因RNA干扰重组慢病毒载体,并进行了相关功能学研究。
1 材料与方法
1.1 主要试剂
限制性内切酶(NEB公司),Taq Plus DNA polymerase(Vazyme公司),T4 DNA ligase(Thermo Scientific 公司),EndoFree midi Plasmid Kit(TIANGEN 公司),NormalRunTM 250 bp-II DNA Ladder(GeneRay 公司),Puromycin(clontech公司),dNTPs(promega 公司),oligo dT(上海生工公司),Bulge-LoopTM miRNA qPCR Primer Set(广州锐博公司 ),Primer(上海吉凯公司),凋亡试剂盒(eBioscience公司),Matrigel(Corning公司),Calcein AM(上海翊圣生物科技有限公司)。
1.2 主要仪器
Cellomics仪(Thermo公司),流式细胞仪(Millipore公司),生物安全柜(上海振样创空气净化设备公司),CO2培养箱(日本三洋公司),稳压电泳仪(上海天能公司),超细匀浆机(FLUKO公司公司),Real time PCR 仪器(Roche公司),分光光度计(Thermo公司),荧光显微镜(奥林巴斯)。
1.3 质粒及细胞株
人胃腺癌细胞株MKN-45;慢病毒系统包括骨架质粒GV248(元件顺序hU6-MCS-Ubiquitin-EGFP-IRES-puromycin AgeI / EcoRI 酶切)、包装质粒pHelper 1.0、pHelper 2.0;包装细胞293T(均购自上海吉凯基因化学技术有限公司)。
1.4 Nodal基因的RNAi慢病毒载体构建及鉴定
设计合成针对Nodal的3条siRNA:①NODAL-RNAi(44787-1):5’-AGACCAAGCCGCTGAGCAT-3’②NODAL-RNAi(44788-1):5’-CGACATCACTTGCCAGACA-3’③NODAL-RNAi(44789-1):5’-CAACAAGAGGATCTGGCAT-3’。阴性对照5’-TTCTCCGAACGTGTCACGT-3’。将引物退火形成双链DNA,通过T4 DNA ligase将双酶切线性化的载体(GV248)和退火双链DNA连接,连接产物转化大肠杆菌,感受态细胞中培养扩增。对阳性克隆转化子进行测序验证其正确性。对测序正确的菌液进行质粒抽提。将3种质粒载体(重组质粒及pHelper 1.0、pHelper 2.0)共转染293T细胞,进行慢病毒浓缩纯化及病毒滴度测定。
1.5 筛靶实验
取处于对数生长期的MKN-45细胞,胰酶进行消化成细胞悬液,接种于12孔板。感染条件Eni.S(enhance infection solution)+polybrene,待细胞融合度达到30%,在感染复数(MOI)为20的情况下进行慢病毒感染。感染72h后,进行荧光拍照。Real-time qPCR检测Nodal RNAi慢病毒感染后,MKN-45细胞Nodal基因的表达。
1.6 细胞凋亡实验
细胞感染后,培养至贴壁生长。胰酶消化,重悬成细胞悬液,收集于5 mL离心管中,每组设三个复孔。1 300 rmp 离心5 min,弃上清,4 ℃预冷的D-Hanks(pH=7.2~7.4)洗涤细胞沉淀。1×binding buffer 洗涤细胞沉淀一次,1300 rmp、3 min离心,收集细胞。200 μL 1×binding buffer 重悬细胞沉淀。加入10 μL Annexin V-APC 染色,室温避光10~15 min。上机检测。
1.7 血管生成实验
细胞感染后,铺2×105个细胞于6孔板中,待贴壁后,D-Hanks洗涤2遍,换无血清培养基培养24 h,收集上清。提前1天将Matrigel从-20 ℃中取出,4 ℃放置过夜融化,并将实验用孔板及枪头-20 ℃预冷。待Matrigel融化充分后,于预冷的96孔板中铺Matrigel,每孔70 μL,37 ℃凝固30 min,备用。消化HUVEC细胞,用无血清培养基洗细胞2~3次,尽量将血清去除干净,用预先收集的目的细胞培养上清重悬为2×104细胞/100 μL,铺96孔板。37 ℃培养预设时间(4~6 h)后,每孔加入2 μM Calcein AM,室温孵育10~20 min。置于Cellomics仪中扫板,获得图片及数据。
1.8 统计学分析
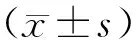
2 结果
2.1 重组慢病毒载体的测序
对构建的3个重组质粒进行DNA测序,结果见图1。测序结果显示,测定序列与目的序列一致。提示插入Nodal基因RNAi序列正确。

图1 慢病毒重组质粒测序结果
2.2 重组慢病毒载体的包装及鉴定
将3种质粒载体转染293T细胞后96 h,荧光显微镜观察细胞,见细胞生长良好,荧光强烈。测定病毒滴度为5×108TU/ml。
2.3 qPCR检测RNA干扰后Nodal基因的表达
RNAi慢病毒感染后,MKN-45细胞Nodal基因的表达水平显著下调。LV-NODAL-RNAi(44787-1)感染、LV-NODAL-RNAi(44789-1)感染分别下调了80.3%和84.9%。
2.4 RNA干扰Nodal基因对MKN-45细胞凋亡的影响
shRNA慢病毒感染MKN-45细胞,培养5天后,干扰组凋亡率与对照组比较明显升高。见表1。
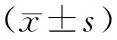
表1 RNAi后MKN-45细胞凋亡率的变化
注:a为与NC组比较,P<0.05;b为与MOCK组比较,P<0.05。
2.5 对体外HUVEC细胞血管生成的影响
96孔板中铺Matrigel,用收集的目的细胞培养上清液重悬HUVEC细胞,铺96孔板。培养后加入Calcein AM,室温孵育。扫板得结果见图2。根据图片及数据分析结果可见,与对照组比较,KD组血管生成主要相关参数中,血管面积、平均血管长度、平均血管宽度、血管节点数无显著性差异(P>0.05),见表2~5。

表2 血管面积
注:a为与NC组比较,P=0.014;b为与KD组比较,P=0.047;c为与KD组比较,P=0.577。

图2 血管生成情况图片

组别平均血管长度/μmMOCK组90.20±7.62abNC组73.78±13.31cKD组67.30±6.70
注:a为与NC组比较,P=0.137;b为与KD组比较,P=0.017;c为与KD组比较,P=0.493。

表4 平均血管宽度
注:a为与NC组比较,P=0.033;b为与KD组比较,P=0.283;c为与KD组比较,P=0.840。

表5 血管节点数
注:a为与NC组比较,P=0.095;b为与KD组比较,P=0.006;c为与KD组比较,P=0.300。
3 讨论
Nodal是早期胚胎发育的关键信号分子[1]。同时,Nodal有助于维持人类胚胎干细胞多潜能干性[2]。阻断或干扰Nodal信号通路将影响胚胎细胞的分化[3]。
有研究显示,Nodal在脑胶质瘤、恶性黑色素瘤、乳腺癌等多种恶性肿瘤中均能高水平表达,且表达水平与肿瘤浸润转移等生物学行为紧密相关[4-6]。Hardy等认为Nodal的激活控制着恶性黑色素瘤的侵袭性行为[7]。Hendrix等认为侵袭性肿瘤细胞类似胚胎祖细胞,也表现出可塑性;胚胎微环境Nodal表达下调可逆转侵袭性黑色素瘤细胞恶性表型,使肿瘤细胞可塑性丧失[8]。提示Nodal在维持肿瘤细胞恶性表型方面有重要作用。
胃癌的临床特征和易转移复发的生物学特性,暗示Nodal信号同样也有可能在胃癌的发生发展中扮演重要角色。
基于此设想,本研究通过RNA干扰胃癌细胞株中Nodal基因的表达,进行相关功能学研究。以揭示Nodal与胃癌的发生发展的联系。结果发现,干扰后的胃癌细胞凋亡率明显增加。可以推测Nodal信号是胃癌的促生长因素,其表达的强弱与胃癌的发生发展之间存在一定的联系。实验还显示,胃癌细胞株中Nodal基因的表达强弱对HUVEC细胞血管生成无显著影响。对于Nodal基因促胃癌细胞凋亡的具体分子机制仍需进一步深入研究。
[1] Shen MM.Nodal signaling:developmental roles and regulation〔J〕.Development,2007,134(6):1023-1034.
[2] James D,Levine AJ,Besser D,et al.TGFbeta/activin/nodal signaling is necessary for the maintenance of pluripotency in human embryonic stem cells〔J〕.Development,2005,132(6):1273-1282.
[3] Schier AF,Shen MM.Nodal signalling in vertebrate development〔J〕.Nature,2000,403 (6768):385-389.
[4] Vartanian AA,stepanova EV,Gutorov SL,et al.Prognostic significance of periodic acid-Schiff-positive patterns in clear cell renal cell carcinoma〔J〕.Can J Urol,2009,16(4):4726-4732.
[5] Baeten CI,Hillen F,Pauwels P,et al.Prognostic role of vasculogenic mimicry in colorectal cancer〔J〕.Dis Colon Rectum,2009,52(12):2028-2035.
[6] Sharma N,Seftor RE,Seftor EA,et a1.Prostatic tumor cell plasticity involves cooperative interactions of distinct phenotypic subpopulations:role in vasculogenic mimicry〔J〕.Prostate,2002,50(3):189-201.
[7] Hardy KM,Kirschmann DA,Seftor EA,et al.Regulation of the embryonic morphogen Nodal by Notch4 facilitates manifestation of the aggressive melanoma phenotype〔J〕.Cancer Res,2010,70(24):10340-10350.
[8] Hendrix MJ,Seftor EA,Seftor RE,et al.Reprogramming metastatic tumour cells with embryonic microenvironments〔J〕.Nat Rev Cancer,2007,7(4):246-255.
(编辑:吴小红)
Effect of RNA Interference Targeting Nodal Gene on Apoptosis in Gastric Carcinoma Cell and Angiogenesis
YU Jieli,QIU Yu’an,LIU Liyan,et al.
Jiangxi Cancer Hospital,Nanchang,330029
Objective To construct and identify lentiviral vector harboring RNAi based on Nodal gene,and to investigate the role of Nodal gene in gastric carcinoma and angiogenesis.Methods siRNA sequences targeting Nodal mRNA were designed.The sequences was connected with lentiviral vector.Gene sequencing was used to identify that recombinant lentivira l vector was constructed successfully.The plasmids were transfected into 293Tcells.Indentification by fluorescent microscopy confirm lentiviral transfection and packaging successfully.The titer of the virus was also tested.The lentivirus was transfected to human MKN-45gastric adenocarcinoma cells.The expression of Nodal gene was analyzed by qPCR.Flow cytometry was used to measure the apoptosis ratio.Angiogenesis of HUVECs was assayed by Cellomicsmetry.Results DNA sequencing suggested that the RNAi sequence targeting the human Nodal gene was correct,The titer of the virus was 5.0×108TU/ml.The expression of Nodal gene was knockdown after the lentivirus transfected to MKN-45cells.Apoptosis ratio of gastric carcinoma cell significantly increased after RNAi targeting Nodal gene(P<0.05).There are no significant altering on angiogenesis(P>0.05).Conclusion The Nodal gene RNAi recombinant lentiviral expression system is constructed successfully.The recombinant lentiviruses show significant inducing effects on apoptosis in gastric carcinoma cell.
Nodal;RNA interference;Lentiviral vector;Gastric carcinoma;Angiogenesis
江西省青年科学基金资助项目(编号:20132BAB215018)
330029江西省肿瘤医院
邱宇安
10.3969/j.issn.1001-5930.2017.03.016
R735.2
A
1001-5930(2017)03-0401-04
2016-11-04
2016-11-22)
