脑胶质瘤患者血清UBE2C、HIF-1α的水平变化及其意义
2017-06-26徐艳祥刘志广
谢 艳 夏 琳 徐艳祥 刘志广
脑胶质瘤患者血清UBE2C、HIF-1α的水平变化及其意义
谢 艳 夏 琳 徐艳祥 刘志广
目的 探讨胶质瘤患者血清UBE2C和HIF-1α水平与脑胶质瘤的临床因素间的相关性。方法 收集脑胶质瘤患者80例,同期选择体检健康者55例为对照组。比较2组血清UBE2C和HIF-1α水平。分析血清UBE2C和HIF-1α水平与胶质瘤患者的年龄、性别、肿瘤部位、肿瘤大小、KPS评分及临床分级等临床因素间的相关性。比较1年随访期间死亡病例和存活病例血清UBE2C和HIF-1α水平。结果 胶质瘤患者血清UBE2C和HIF-1α均明显高于对照组(P<0.01)。胶质瘤患者血清UBE2C和HIF-1α水平与年龄、性别、瘤灶直径、肿瘤部位无显著相关性(P>0.05),与临床分级和KPS评分有明显相关(P<0.01)。死亡组患者入院血清UBE2C和HIF-1α水平显著高于存活组(P<0.01)。结论 胶质瘤患者血清UBE2C和HIF-1α水平显著升高,与胶质瘤的恶性程度联系密切,可能成为临床评价该病患者预后的有效指标之一。
胶质瘤;泛素偶联酶2C;缺氧诱导因子1α;相关性
(ThePracticalJournalofCancer,2017,32:364~366)
胶质瘤是颅内常见恶性肿瘤之一,约占颅内原发性肿瘤的40%[1],胶质瘤多呈侵袭性生长,目前临床措施主要有手术及术后辅以化疗,但是以上疗法很难对肿瘤彻底根除,最终效果欠佳[2]。早诊断早干预是提高胶质瘤患者临床生存率的重要步骤[3]。
UBE2C(ubiquitin-conjugating enzymc 2C)是脑胶质瘤中差异性表达高且与肿瘤发生发展密切相关的基因之一,在脑胶质瘤细胞的侵袭中发挥重要作用[4]。缺氧诱导因子1α(HIF-1α)是存在于肿瘤组织中缺氧条件下的转录因子,在脑胶质瘤的浸润中起到调节作用[5]。然而,有关脑胶质瘤中血清UBE2C和HIF-1α水平变化及与该病的临床因素间的相关性尚未见报道。在本研究中,我们选择近年我院收治的胶质瘤患者80例,分析了患者血清UBE2C和HIF-1α水平及与脑胶质瘤临床因素间的相关性以及对患者预后的影响,现将结果总结报告如下。
1 材料与方法
1.1 一般资料
收集我院2013年7月至2015年2月期间收治脑胶质瘤患者80例,其中男性51例,女性29例;年龄46~61岁,平均(51.26±6.93)岁;临床分级:Ⅰ~Ⅱ级34例,Ⅲ~Ⅳ级46例。同期选择在我院体检健康者55例为对照组,其中男性35例,女性20例;年龄43~65岁,平均(50.43±7.01)岁。2组之间基本资料差异无统计学意义(P>0.05)。胶质瘤诊断依据《中国中枢神经系统胶质瘤诊断和治疗指南》[6]相关标准制定,且经头颅CT及病理查诊。病理分级依据WHO有关神经系统肿瘤分级标准[7]制定。卡氏(KPS)评分以《卡氏评分标准》[8]相关标准制定。纳入标准:①符合以上相关诊断标准;②年龄20~65岁;③研究前患者未采取化疗及临床干预措施者;④患者知情,且签署协议。排除标准:①精神病者;②合并其他类型脑病者;③合并其他系统严重功能障碍者;④不配合随访者。本研究经我院医学伦理委员会批准。
1.2 指标检测
晨起收集患者的空腹静脉血,血样在室温下静置30 min,再离心取血清,于-20 ℃保存备用。采取酶联免疫吸附法测定UBE2C和HIF-1α水平。测定患者肿瘤灶的最大直径。
1.3 分析指标
比较2组血清UBE2C和HIF-1α水平。分析血清UBE2C和HIF-1α水平与胶质瘤患者的年龄、性别、肿瘤部位、肿瘤大小、KPS评分及临床分级等临床因素间的相关性。给予患者1年期随访,记录死亡病例数。
1.4 统计学方法
计量资料运用均数±标准差的形式表示,组间比较用t检验分析;计数资料以χ2检验处理。以上数据运用SPSS 19.0软件包处理,以P<0.05为差异有统计学意义。
2 结果
2.1 2组血清UBE2C和HIF-1α水平比较
胶质瘤患者血清UBE2C和HIF-1α均明显高于对照组,差异有统计学意义(P<0.01),见表1。
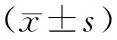
表1 2组血清UBE2C和HIF-1α水平比较
2.2 血清UBE2C和HIF-1α水平与胶质瘤临床病理因素间的相关性
胶质瘤患者血清UBE2C和HIF-1α水平与年龄、性别、瘤灶直径、肿瘤部位无显著相关性(P>0.05),与临床分级和KPS评分有明显相关(P<0.01),见表2。
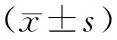
表2 血清UBE2C和HIF-1α水平与胶质瘤临床病理因素的相关性
2.3 存活组和死亡组患者血清UBE2C和HIF-1α水平比较
1年随访结果:34例死亡,46例存活;死亡组患者入院血清UBE2C和HIF-1α水平显著高于存活组,比较有统计学差异(P<0.01),见表3。
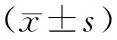
表3 存活组和死亡组患者血清UBE2C和HIF-1α水平比较
3 讨论
由于脑胶质瘤的早期临床表现和病理症状不典型,所以临床诊断脑胶质瘤仍存在较大困难。资料显示即使应用最新技术MRI也不能对脑胶质瘤进行确诊,故如何提高脑胶质瘤的早期诊断有效率是当前临床面临的重要难题。鉴于血清学生物学标志物的便捷、低廉及高效等优点,近年其在临床中已获得广泛使用。已知验证的脑胶质瘤相关血清学标志物,如表皮生长因子受体[9]、胶质纤维酸性蛋白[10]、维生素D[11]及microRNA-205[12]等,也可能是其他肿瘤等疾病的生物学标志物,故探寻其他更多有效标志物,以便进一步提高脑胶质瘤的诊断率。
UBE2C是一种泛素结合酶家族成员,在细胞有丝分裂中期向后期转变中起到重要调节作用。研究表明,生理状态下UBE2C常处于低表达水平,提高机体的UBE2C水平对肿瘤细胞的增殖、侵袭及减少细胞凋亡起到促进作用[13]。免疫组织化学结果显示,在脑胶质组织中UBE2C蛋白呈现高表达状态[14]。本次结果显示,胶质瘤患者血清UBE2C水平显著高于对照组(P<0.01);胶质瘤患者血清UBE2C水平与患者的年龄、性别、瘤灶大小以及肿瘤部位无显著相关性(P>0.05),与临床分级及KPS评分呈明显相关(P<0.01)。1年期随访死亡患者在入院时的血清UBE2C水平显著高于存活组,差异有统计学意义(P<0.01)。以上结果提示了血清UBE2C的高水平可能在脑胶质瘤的病程(浸润、远处转移)中起到重要作用,也有望成为胶质瘤不良预后评估的有效指标。
HIF-1α是缺氧应答调控因子,也是肿瘤细胞适应低氧的转录激活调节因子,能够结合缺氧反应元件从而诱导多基因的表达,在肿瘤的浸润及转移中发挥了重要作用[15]。资料显示,HIF-1α与胃癌、子宫内膜癌、乳腺癌等肿瘤的恶性程度及预后联系密切[16]。免疫组织化学和分子生物学等方法均证实HIF-1α在脑胶质瘤组织中高表达,通过促进新生血管形成在肿瘤的侵袭中发挥调节作用[17]。本次结果显示,脑胶质瘤患者血清HIF-1α水平显著高于对照组(P<0.01)。脑胶质瘤患者血清HIF-1α水平与年龄、性别、瘤灶大小、肿瘤部位无显著相关性(P>0.05),与临床分级及KPS评分明显相关(P<0.01)。1年期随访死亡患者在入院时的血清HIF-1α水平显著高于存活组,差异有统计学意义(P<0.01)。以上结果提示了血清HIF-1α水平升高可能在脑胶质瘤的发展中发挥重要作用,也有望成为胶质瘤不良预后评价的有效指标。
综上所述,脑胶质瘤患者血清UBE2C和HIF-1α水平显著提高,与脑胶质瘤的病程进展联系密切,有望成为评价该病患者不良预后的可靠指标之一。
[1] 夏海成,朱正权,刘 亮,等.脑膜胶质瘤基因MGMT在胶质瘤组织中表达的临床研究〔J〕.中华实验和临床病毒学杂志,2011,25(4):265-267.
[2] 吴海涛,占益平,曲彦明,等.叶酸受体仪在人脑胶质瘤组织中表达及其临床意义〔J〕.中华外科杂志,2014,52(3):202-207.
[3] Galldiks N,Stoffels G,Filss C,et al.The use of dynamic O-(2-18F-fluoroethyl)-l-tyrosine PET in the diagnosis of patients with progressive and recurrent glioma〔J〕.Neuro Oncol,2015,17(9):1293-1300.
[4] 王少冰,王 芳.泛素结合酶E2C 与肿瘤的关系研究进展〔J〕.医学研究生学报,2015,28(5):543-548.
[5] 黄江梅,陈艳昕,王艳梅,等.HIF-1α及MMPs对胶质瘤生物学行为的影响〔J〕.西部医学,2014,26(7):827-830.
[6] 中国中枢神经系统胶质瘤诊断和治疗指南编写组.中国中枢神经系统胶质瘤诊断和治疗指南(2012)〔J〕.中华医学杂志,2013,93(31):2418-2449.
[7] Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumors of the central nervous system〔J〕.Acta Neuropathol,2007,114(2):97-109.
[8] 贾英杰.中西医结合肿瘤学〔M〕.武汉:华中科技出版社,2009:附篇.
[9] Späth F,Andersson U,Dahlin AM,et al.Pre-diagnostic serum levels of EGFR and ErbB2 and genetic glioma risk variants:a nested case-control study〔J〕.Tumour Biol,2016,37(8):11065-11072.
[10] 覃 川,杨秀江,晏 怡,等.脑胶质瘤患者血清胶质纤维酸性蛋白浓度及临床价值〔J〕.第三军医大学学报,2012,34(21):2214-2215.
[11] Zigmont V,Garrett A,Peng J,et al.Association between prediagnostic serum 25-hydroxyvitamin D concentration and glioma〔J〕.Nutr Cancer,2015,67(7):1120-1130.
[12] Yue X,Lan F,Hu M,et al.Downregulation of serum microRNA-205 as a potential diagnostic and prognostic biomarker for human glioma〔J〕.J Neurosurg,2016,124(1):122-128.
[13] Zhang Z,Liu P,Wang J,et al.Ubiquitin-conjugating enzyme E2C regulates apoptosis-dependent tumor progression of non-small cell lung cancer via ERK pathway〔J〕.Med Oncol,2015,32(5):149.
[14] Ma R,Kang X,Zhang G,et al.High expression of UBE2C is associated with the aggressive progression and poor outcome of malignant glioma〔J〕.Oncol Lett,2016,11(3):2300-2304.
[15] Valsecchi R,Coltella N,Belloni D,et al.HIF-1α regulates the interaction of chronic lymphocytic leukemia cells with the tumor microenvironment〔J〕.Blood,2016,127(16):1987-1997.
[16] Chen TC,Wu CT,Wang CP,et al.Associations among pretreatment tumor necrosis and the expression of HIF-1α and PD-L1 in advanced oral squamous cell carcinoma and the prognostic impact thereof〔J〕.Oral Oncol,2015,51(11):1004-1010.
[17] 范阳华,叶敏华,吴 雷,等.人脑胶质瘤中RSUME的SUMO化与HIF-1α/VEGF通路的相关性〔J〕.西安交通大学学报(医学版),2015,36(4):472-478.
(编辑:甘 艳)
Change of Serum Levels of UBE2C and HIF-1α of Glioma Patients and Its Significance
XIE Yan,XIA Lin,XU Yanxiang,et al.
Xiantao First People's Hospital,Xiantao,433000
Objective To analyze serum levels of UBE2C and HIF-1α of glioma patient and their correlation with clinicopathological factors of glioma.Methods 80 cases of glioma patients were selected.At the same time,55 healthy patients received physical examines were the control group.Serum levels of UBE2C and HIF-1α of the 2 groups were detected and compared.Correlation between UBE2C and HIF-1αlevels and age,gender,tumor site,tumor size,KPS socre and clinical staging of glioma was analyzed.Serum levels of UBE2C and HIF-1α between death patients and survival patients during 1-year follow up were compared.Results Serum levels of UBE2C and HIF-1αin glioma were evidently higher than those of the control group(P<0.01).Serum levels of UBE2C and HIF-1αwere not correlated with age,gender,tumor size,and tumor site of glioma (P>0.05),and were remarkably correlated with clinical staging and KPS score(P<0.01).Serum levels of UBE2C and HIF-1αof death patients were obviously higher than survival patients (P<0.01).Conclusion Serum levels of UBE2C and HIF-1αof glioma are evidently elevated,and are related to grade malignancy of glioma,and it can be an effective indicators of clinical prognosis.
Glioma;UBE2C;HIF-1α;Correlation
徐州市科技项目(编号:KC14SH029)
433000 湖北省仙桃市第一人民医院(谢 艳,夏 琳,徐艳祥);221009 江苏省徐州市中心医院(刘志广)
刘志广
10.3969/j.issn.1001-5930.2017.03.005
R739.41
A
1001-5930(2017)03-0364-03
2016-06-07
2016-11-04)
