宫颈癌组织中KLF4表达与外周血KLF4水平的相关性分析
2017-06-26张玉虹孙喜斌
张玉虹 孙喜斌 刘 博
宫颈癌组织中KLF4表达与外周血KLF4水平的相关性分析
张玉虹 孙喜斌 刘 博
目的 探讨宫颈癌组织中和外周血KLF4水平的表达及其相关性。方法 选择120例宫颈癌患者和健康成年女性30例,采用免疫组化SP法检测宫颈组织中KLF4的表达,并采用半定量PCR检测外周血KLF4的表达水平。结果 正常宫颈组织中KLF4表达阳性率最高(100.00%),随着宫颈癌临床分期的增加,KLF4表达阳性率呈下降趋势,Ⅳ期宫颈癌其阳性率仅为14.29%(P<0.05)。外周血中KLF4的表达水平对照组最高(0.78±0.35),其表达水平随着宫颈癌临床分期的增加而逐渐下降,Ⅳ期宫颈癌降至最低(0.06±0.02)(P<0.01)。癌组织中KLF4表达与外周血KLF4水平呈正相关关系,γ=0.75(P<0.01)。两者均与肿瘤临床分期呈负相关性,γ分别为-0.64、-0.92(P<0.01)。结论 KLF4在宫颈癌的发生发展中起抑癌作用,有望成为预测宫颈癌发生及预后评估的参考指标。
宫颈癌;KLF4;免疫组织化学;外周血
(ThePracticalJournalofCancer,2017,32:354~357)
宫颈癌是女性常见的恶性生殖系统肿瘤,死亡率占发展中国家女性恶性肿瘤之首,且其发病在近年呈现年轻化趋势[1]。宫颈癌的病因比较明确,其发生发展与人乳头瘤状病毒(HPV)持续性感染密切相关[2],与生殖道黏膜感染有关的HPV有超过30种,HPV在女性中的感染率高达80%[3]。宫颈癌在早期发现并及时治疗的情况下治愈率可以达到90%[4],因此进行宫颈癌筛查对于防治宫颈癌有非常重要的临床意义。Kruppel样因子-4(kruppel-like factor 4,KLF4) 是1种具有特定结合位点的真核锌指转录因子,它的表达与肿瘤相关,对于不同的靶基因具有抑制或激活的双重作用[5]。包括宫颈癌在内的恶性肿瘤的重要生物学特征之一是凋亡抑制和失控性增殖,KLF4在细胞分化、增殖与凋亡中发挥重要作用,是1种癌基因或抑癌基因。本研究通过分析宫颈癌患者的宫颈组织和外周血中KLF4的表达水平及其相关关系,为探讨宫颈癌的早期诊断和预后评价提供科学依据。
1 材料与方法
1.1 研究对象
选择本院2015年1月至2016年3月收治的120例宫颈癌病例为研究对象(研究组),所有患者均经术后病理检查确诊。患者年龄26~76岁,平均(47.93±7.52) 岁。组织病理学分型:鳞癌98例(81.67%) 、腺癌22例(18.33%) 。按WHO细胞分化标准:高分化23例(19.17%)、中分化68例(56.67%)、低分化29例(24.16%) 。根据国际妇产科联盟(FIGO)的临床分期标准:Ⅰ期29例(24.17%) 、Ⅱ期41例(34.17%) 、Ⅲ期36例(30.00%),Ⅳ期14例(11.66%)。有淋巴结转移49例(40.83%)、无淋巴结转移71例(59.17%)。入组前均未接受过化学治疗或放射治疗。另选择未患宫颈癌的健康成年女性30例作为对照,对照组年龄为28~65岁,平均(45.86±6.94)岁,研究组和对照组年龄差异无统计学意义(P>0.05)。研究在知情同意下进行,所有研究对象均签署知情同意书。
1.2 主要试剂
兔抗人KLF4多克隆抗体购自美国Santa Cruz 公司,SP 染色试剂盒购自武汉博士德生物工程公司,二氨基联苯胺(DBA)显色剂购自北京中山生物技术开发有限公司,细胞总RNA 提取试剂盒购自上海生工生物工程有限公司,RevertAid First Strand cDNA Synthesis Kit购自美国Therom公司。
1.3 研究方法
1.3.1 宫颈组织中KLF4表达检测 对活检获得的宫颈组织标本使用10%福尔马林液固定,挑选有代表性的肿瘤组织的区域,石蜡包埋,制成切片。采用SP 法染色,严格按照试剂盒说明操作。抗体工作浓度为1∶200。以PBS代替一抗作为阴性对照,以已知KLF4 阳性染色切片作为阳性对照。对照组使用正常兔血清作为替代试验,结果均为阴性。呈阳性染色的KLF4一般为分布在细胞核内的棕黄色颗粒。采用盲法,由两名病理科医师按照染色强度与肿瘤细胞显色的比例,对KLF4的表达情况进行半定量判定。根据显色程度评分:1分为弱染色;2分为中等染色;3分为强染色。根据阳性细胞率评分:2分为阳性细胞数在11%~50%;3分为阳性细胞数在51%~80%;4分为为阳性细胞数>80 %。最终评级根据上述两种评分之和分级:不考虑显色强度,阳性细胞率≤10 %即为阴性(-);3~5分为弱阳性(+);6~7分则为强阳性(++)。
1.3.2 外周血KLF4检测 抽取外周血5 ml,以3 000转/min离心15 min,分离血浆。参照细胞总RNA 提取试剂盒说明提取细胞总RNA,以总RNA 中的mRNA 作为模板,严格按照RevertAidFirst Strand cDNA Synthesis Kit 说明书,将mRNA 反转录成cDNA。采用半定量RT-PCR 方法检测KLF4 mRNA 的表达。KLF4 上游引物为5’-ATGGGCAAGTTCGTGCTGAAGGC-3’,下游引物为5’-GCATCTGATCGGGCAGGAAGGAT-3’,PCR 扩增时设内参照基因。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火45 s,延伸72 ℃ 60 s,共40个循环。以2%琼脂糖凝胶进行电泳分离,对PCR 产物条使用Quantity One软件进行灰度值分析,以目标基因的PCR产物灰度值除以内参基因值,所得的结果即为KLF4蛋白的相对表达水平。
1.4 统计学处理
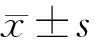
2 结果
2.1 基本情况
120例宫颈癌患者的年龄、病理学分型、细胞分化程度和淋巴结转移等基本情况比较,差异均无统计学意义(P>0.05),见表1。
2.2 KLF4在宫颈癌和正常宫颈组织中的表达情况
正常宫颈组织中KLF4蛋白表达的阳性率为100.00%,Ⅰ期宫颈癌组织中KLF4阳性率为89.64%,Ⅱ期宫颈癌组织中KLF4阳性率为65.85%,Ⅲ期宫颈癌组织中KLF4阳性率为47.22%,而Ⅳ期宫颈癌组织中KLF4阳性率最低,仅为14.29%。随着宫颈癌临床分期的增加,KLF4阳性率呈逐渐下降趋势,各组之间差异有统计学意义(χ2=48.68,P<0.01),见表2。
2.3 外周血KLF4半定量RT-PCR检测结果
RT-PCR检测结果显示:KLF4mRNA表达水平在正常对照组中最高,为(0.78±0.35),随着宫颈癌临床分期的增加,其mRNA表达水平逐步下降,至Ⅳ期宫颈癌下降至最低,仅为(0.06±0.02),各组间的差异有统计学意义(P<0.01)。高分化宫颈癌组织中KLF4mRNA表达水平最高,为(0.51±0.29),随着细胞分化水平的下降,其mRNA表达水平逐步下降,低分化下降至最低,仅为(0.09±0.03),相互间比较差异有统计学意义(P<0.01),见表3。
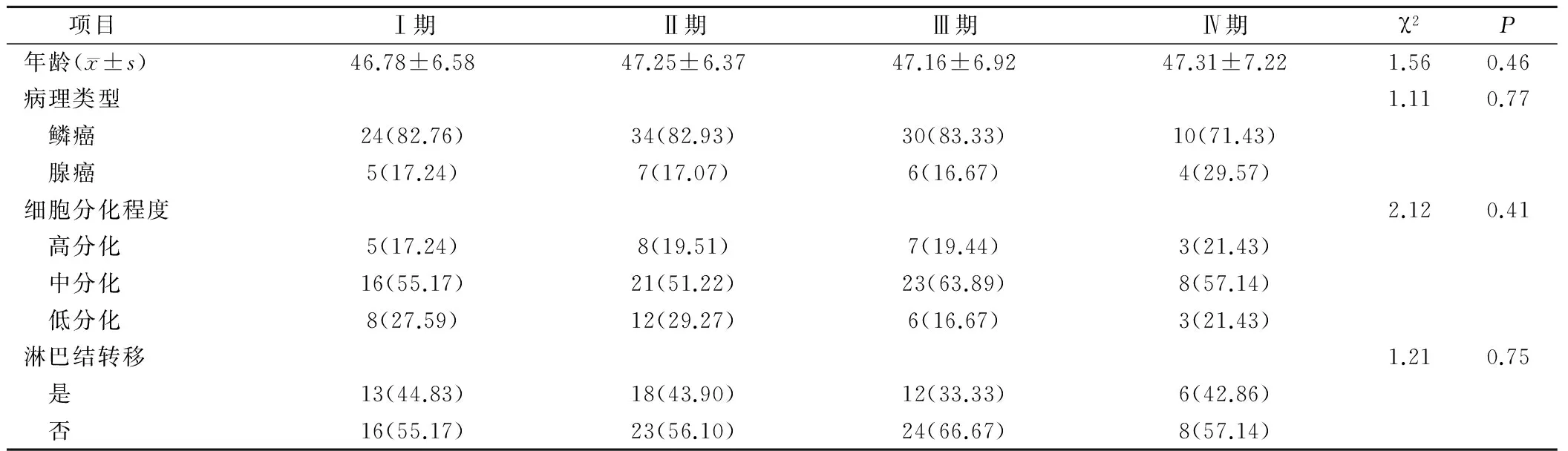
表1 宫颈癌患者的基本情况(例,%)
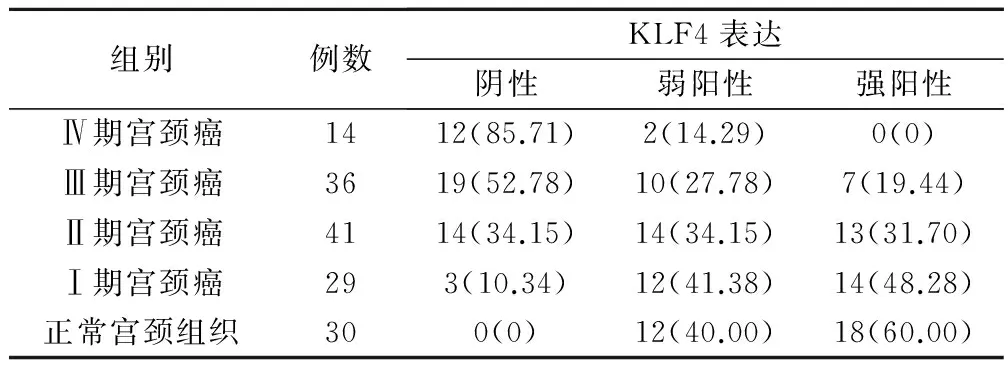
表2 KLF4在不同临床分期宫颈癌组织和正常宫颈组织中表达情况(例,%)
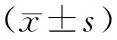
表3 宫颈癌患者外周血中KLF4表达水平与其临床病理指标的关系
2.4 宫颈癌组织中KLF4表达与外周血中KLF4表达的相关性
Spearman相关分析显示:宫颈癌组织中KLF4水平和外周血KLF4水平均随着宫颈癌临床分期的增加而下降,两者均与临床分期呈负相关关系,相关系数γ分别为-0.64(P<0.01)和-0.92(P<0.01)。而癌组织中KLF4水平与外周血KLF4水平呈正相关关系,相关系数γ为0.75(P<0.01)。
3 讨论
KLF4是真核生物中1种基础转录因子,包含3个结构域:高度可变的N端转录调节结构域及核定位序列,高度保守的C端DNA结合结构域,能结合靶基因富含Gc的启动子序列,促进或抑制靶基因的表达[6]。KLF4在口腔、食管上皮、内皮细胞和消化道等处表达丰富,在细胞增殖、分化、凋亡和维持正常组织稳态中发挥发挥不同的生物学功能[7]。KLF4是具有转录调控作用的双重功能转录因子,根据靶基因的不同,KLF4可对下游靶基因起到激活作用或抑制作用,已逐渐成为肿瘤研究中的热点。研究显示,KLF4在不同肿瘤中可分别发挥抑癌基因或癌基因的作用。KLF4在胃癌、结直肠癌、卵巢癌中呈低表达,表现抑癌基因功能,能抑制肿瘤细胞生长,阻滞肿瘤细胞的细胞周期,抑制肿瘤的侵袭和迁移[8-9];而在乳腺癌和口腔癌中则呈高表达,表现癌基因的特点,促进肿瘤的发展、浸润与转移[10]。
宫颈癌的发生与人类乳头状瘤病毒密切相关。在病毒感染和相关的环境影响下,往往经历了从慢性宫颈炎、宫颈上皮内瘤变到宫颈癌的多阶段的进展恶化过程。KLF4 的表达下调可能与宫颈癌的发生、发展过程相关。杨文婷等[11]研究了30例正常宫颈、28 例宫颈原位癌和39 例宫颈鳞癌组织中KLF4 蛋白的表达关系,结果显示KLF4 蛋白在正常宫颈组织与宫颈原位癌中的表达均为阳性,而在宫颈鳞癌组织中表达明显下降下调(P<0.05),提示KLF4 可能作为1个抑癌基因影响着宫颈癌的发生。本研究通过对不同临床分期的宫颈癌和正常宫颈组织的KLF4表达情况进行分析,结果与类似研究比较一致[11-12]。KLF4阳性率在正常宫颈组织的阳性率达到100%,而随着宫颈癌临床分期的增加,KLF4阳性率呈下降趋势,至Ⅳ期宫颈癌阳性率最低,仅为14.29%,各组的KLF4阳性率差异有统计学意义(P<0.01)。KLF4发挥抑癌作用的机制可能是通过上调p27Kip1蛋白表达,从而使细胞周期停滞在G1/S期而抑制宫颈癌细胞的增殖[13]。本研究分析了不同临床分期的宫颈癌病例和正常对照组外周血KLF4的表达水平,结果显示与宫颈组织一致,外周血KLF4在正常对照组中最高,随着临床分期的增加,其表达水平逐步下降,至Ⅳ期宫颈癌下降至最低,各组间的差异有统计学意义(P<0.01)。 Yang的研究显示[13],低分化细胞宫颈癌的宫颈组织KLF4 阳性率低于高、中分化宫颈癌。本研究则表明高分化组外周血中KLF4水平最高,随细胞分化水平下降,其表达水平逐步下降,至低分化组降至最低(P<0.01),这也提示了KLF4在宫颈癌的细胞分化过程中可能起着重要作用。而且本研究相关分析显示,癌组织KLF4水平与外周血KLF4水平为同向变化,呈正相关关系(P<0.01),而两者与临床分期均呈负相关关系(P<0.01)。
综上所述,本研究提示KLF4在宫颈癌的发生发展中可能通过抑制细胞增殖和迁移而发挥抑癌作用,其在宫颈组织或外周血中的表达缺失可能促进了癌组织的进展。宫颈组织或外周血中KLF4的检测可能成为宫颈癌的预测和预后评估的新的参考指标,对宫颈癌的早期诊断及良好预后可能有积极的作用。
[1] 陈 萍,邓守恒.EGCG 对宫颈癌HeLa细胞增殖、侵袭及VEGF蛋白表达的影响〔J〕.实用癌症杂志,2015,30(7):961-963.
[2] 陈艳君,黎勇夫.老年宫颈癌患者组织及血清VEGF-C的表达水平及其相关性研究〔J〕.实用癌症杂志,2015,30(6):812-814.
[3] 刘 微,孙立涛,刘娜娜,等.三维能量多普勒超声对宫颈癌的诊断价值〔J〕.中华超声影像学杂志,2013,22(12):1056-1059.
[4] 季 冰,何浪驰,郭芝亮,等.HC2-HPV-DNA 检测在宫颈癌病变中的临床分析〔J〕.实用癌症杂志,2015,30(6):843-845.
[5] 田 川,李 琦.消化系统肿瘤中Klf4功能研究进展〔J〕.临床肿瘤学杂志,2015,20(7):662-665.
[6] 周 红,徐庆雷,马小波,等.呼吸道合胞病毒毛细支气管炎婴幼儿外周血单个核细胞microRNA206表达水平的变化〔J〕.中华实用儿科临床杂志,2015,30(22):1709-1712.
[7] Jia Y,Zhang W,Liu H,et al.Inhibition of glutathione synthesis reverses Kruppel-like factor 4-mediated cisplatin resistance〔J〕.Cancer Chemother Pharmacol,2012,69(2):377-385.
[8] Zhang N,Zhang J,Shuai L,et al.Kruppel-like factor 4 negatively regulates beta-catenin expression and inhibits the proliferation,invasion and metastasis of gastric cancer〔J〕.Int J Oncol,2012,40(6):2038-2048.
[9] Li Q,Gao Y,Jia Z,et al.Dysregulated Kruppel-like factor 4 and vitamin D receptor signaling contribute to progression of hepatocellular carcinoma〔J〕.Gastroenterology,2012,143(3):799-810.
[10] Nagata T,Shimada Y,Sekine S,et al.Prognostic significance of NANOG and KLF4 for breast cancer〔J〕.Breast Cancer,2014,21(1):96-101.
[11] 杨文婷,刘树艳,郑鹏生.转录因子KLF4 在宫颈癌中的表达及意义〔J〕.西安交通大学学报(医学版),2010,31(1):22-25.
[12] 宋 晖,魏 莉,李 佳,等.KLF4 在宫颈癌中的表达与临床意义〔J〕.现代肿瘤医学,2015,23(1):109-111.
[13] Yang WT,Zheng PS.Kruppel-like factor 4 function as a tumor suppressor in cervical carcinoma〔J〕.Cancer,2012,118 (15):3691-3702.
(编辑:吴小红)
Correlation Analysis of Expression of KLF4 in Cervical Carcinoma Tissue with KLF4 in Peripheral Blood
ZHANG Yuhong,SUN Xibin,LIU Bo.
The First Affiliated Hospital of Hebei North University,Zhangjiakou,075000
Objective To probe the expression of KLF4 in cervical carcinoma tissue and KLF4 level in peripheral blood and their correlation.Methods A total of 120 patients with cervical carcinoma and 30 healthy women were chosen.The expression of KLF4 in cervical tissues was examined by SP immunohistochemicalstaining and levels of KLF4 in peripheral blood were measured by semi-quantitative RT-PCR.Results The positive expression rate of KLF4 in normal cervical tissues was the highest(100.00%),and the positive espression rate decreased gradually with the increasing of clinical classification of cervical cancer.The positive rate of patients with IV phase cervical cancer was only 14.29%(P<0.05).KLF4 level in peripheral blood was the highest in normal controls (0.78±0.35),and its level decreased with the increasing of clinical classification of cervical cancer.The level of patients with IV phase cervical cancer was the lowest(0.06±0.02)(P<0.01).There was strong positive correlation between KLF4 in cervical tissue and KLF4 in peripheral blood(γ=0.75,P<0.01),and both of them were negatively correlated with cervical carcinoma clinical classification,r was -0.64 and -0.92 respectively (P<0.01).Conclusion KLF4 plays the role of tumor suppressing in the development of cervical cancer,which is expected to be a new reference indicator to predict the occurrence of cervical cancer and the prognosis of patients.
Cervical carcinoma;KLF4;Immunohistochemistry;Peripheral blood
2016年度河北省医学科学研究重点课题计划(编号:20160376)
075000 河北北方学院附属第一医院
10.3969/j.issn.1001-5930.2017.03.002
R737.33
A
1001-5930(2017)03-0354-04
2016-06-07
2017-01-12)
