非小细胞肺癌中磷酸化FRK蛋白的表达及预后分析
2017-06-24寇玉玲孙兴旺
李 丽,寇玉玲,陈 菲,孙兴旺
非小细胞肺癌中磷酸化FRK蛋白的表达及预后分析
李 丽1,2,寇玉玲1,陈 菲2,孙兴旺1
目的 探讨非小细胞肺癌(non-small cell lung cancer, NSCLC)中磷酸化FRK(phospho-FRK, p-FRK)蛋白的表达及其预后分析。方法 应用免疫组化EnVision两步法检测162例NSCLC组织及其远端对照组织中p-FRK蛋白的表达水平,并分析p-FRK蛋白表达与NSCLC患者临床病理特征的相关性,评价p-FRK在NSCLC患者预后中的价值。结果 p-FRK蛋白在NSCLC中的阳性率明显高于远端对照组织(51.9%vs11.7%,P=0.001)。p-FRK蛋白阳性水平与NSCLC病理组织类型、淋巴结转移、pTNM分期均显著相关(P<0.05)。Kaplan-Meier生存分析显示p-FRK表达水平与患者术后总生存率呈负相关(χ2=17.849,P<0.001)。多因素生存分析显示p-FRK蛋白是NSCLC患者术后不良预后的独立预测因素(HR=0.496,95%CI:0.295~0.836,P<0.05)。结论 p-FRK阳性患者预后较差,有望成为NSCLC患者预后判断的新型标志物。
肺肿瘤;非小细胞肺癌;Src激酶家族;p-FRK;预后
肺癌发病率与病死率在我国恶性肿瘤中均居首位,在男性及女性中的病死率分别为29.5%和22.5%[1]。肺癌分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC),其中80%~85%肺癌为NSCLC,NSCLC进一步分为3个病理组织学亚型:腺癌(30%~40%)、鳞癌(20%~25%)和大细胞癌(15%~20%)[2]。尽管肺癌的诊断及治疗水平不断发展,但其5年生存率仅为17%[3],所以寻找肺癌发生、发展及对治疗有价值的蛋白尤为重要。近年研究发现,Src激酶家族可通过影响肿瘤细胞的增殖、分化、迁移、黏附和凋亡,从而在肿瘤的发生、发展、转移中起重要作用[4-9]。随着研究的不断深入,发现Src激酶家族中FRK(fyn-related kinase)在不同类型肿瘤中发挥促进或抑制肿瘤生长的作用[10-13]。但磷酸化FRK(phospho-FRK, p-FRK)蛋白在NSCLC肿瘤组织中的表达尚未见报道。本文收集162例肺癌标本及其远端对照组织,采用免疫组EnVision两步法检测两组中p-FRK表达强度差异,并分析其与NSCLC临床病理特征及预后的相关性。
1 材料与方法
1.1 材料 收集华西医院2007年1月~2007年12月病理科确诊为NSCLC且患者术前均未行放、化疗及免疫治疗的石蜡标本162例。其中男性116例,女性46例,最小年龄34岁,最大年龄81岁,中位年龄60岁。按照第7版国际抗癌组织联盟(UICC)的NSCLC分期标准:61例Ⅰ期、38例Ⅱ期、53例Ⅲ期、10例Ⅳ期,其中91例腺癌、71例鳞癌。本组标本均通过华西医院伦理委员会批准,且患者签署书面知情同意书。162例NSCLC组织及其远端对照组织均行石蜡切片HE染色,并由两位病理医师分别确认病理组织学类型。
1.2 试剂 一抗为兔抗人p-FRK抗体,购自BeacomBio公司(BIO100431),工作液稀释比例1 ∶100;抗体稀释液(S2022,DAKO,丹麦);二抗为山羊抗兔/鼠IgG/HRP(K500711,DAKO,丹麦);50x抗原修复液(EGTA组织抗原修复液,MVS-0080,福州迈新公司);Super PAP Pen超级免疫组化油笔(PEN-0002,福州迈新公司);Harris苏木精(7211,Thermo,美国)。
1.3 免疫组化 免疫组化染色采用EnVision两步法。石蜡标本连续4 μm厚切片,60 ℃烤箱烤片2 h,37 ℃烤箱烤片过夜,二甲苯脱蜡、梯度乙醇脱二甲苯至流水冲洗切片,EGTA(pH 9.0)抗原修复液98 ℃水浴修复30 min,3%H2O2溶液阻断内源性过氧化物酶室温15 min,滴加100~200 μL的p-FRK(1 ∶100),4 ℃孵育过夜,室温复温30 min,滴加100~200 μL K500711试剂盒内的多聚物酶标二抗(即用型),37 ℃孵育45 min,孵育完毕,DAB在显微镜下控制显色,Harris苏木精复染3 min,流水冲洗返蓝,梯度乙醇脱水、二甲苯透明2次,Clearvue封片机完成封固,Olympus BX51显微镜下观察。每一批次免疫组化实验均设置阴性对照,阴性对照用PBS代替一抗。
1.4 结果判定 p-FRK蛋白阳性定位于细胞胞质,免疫组化结果由两位病理医师独立阅片进行判断。根据细胞着色程度和阳性细胞占所观察细胞百分比的评分乘积进行半定量,随机选择200倍视野下10个无交叉重复的视野,且每个视野下计数100个肿瘤细胞,按细胞着色程度评分:无阳性着色为0分,浅黄色为1分,棕黄色为2分,棕褐色计为3分。按阳性细胞所占观察细胞百分比评分:无阳性细胞为0分,≤20%为1分,21%~49%为2分,≥50%为3分。将每一张切片的两项分值相乘:0为阴性(-),1~3为弱阳性(+),4~6为中度阳性(),>6为强阳性()。统计分析时将(-)定义为蛋白阴性,(+~)定义为蛋白阳性[14-15]。
1.5 随访 对162例NSCLC患者进行电话或定期门诊、复诊随访。随访从手术之日开始,失访、死于其他疾病或在随访时仍存活视为截尾数据。总生存期定义为从第一次确诊开始至死亡或随访终点时间。
1.6 统计学方法 所有数据应用SPSS 22.0软件进行统计学处理,采用χ2检验及Fisher精确检验进行率的比较分析;生存率采用Kaplan-Meier法分析统计;采用Log-rank检验分析各变量与预后的关系;采用Cox回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC及远端组织中p-FRK的表达 NSCLC肿瘤组织中p-FRK阳性定位于细胞质,呈棕黄色弥漫性或颗粒状着色;远端组织中肺泡上皮细胞、终末细支气管上皮细胞均无明显p-FRK阳性着色,仅少量细胞间质着色,阳性着色程度及阳性细胞百分比明显低于肿瘤组织。NSCLC肿瘤组织中p-FRK蛋白阳性率明显高于远端组织(51.9%vs11.7%,χ2=10.556,P=0.001),两组间差异有统计学意义。在162例NSCLC中,p-FRK在腺癌中阳性率高于鳞癌(59.3%vs42.3%,χ2=4.664,P=0.031),差异有统计学意义(图1)。
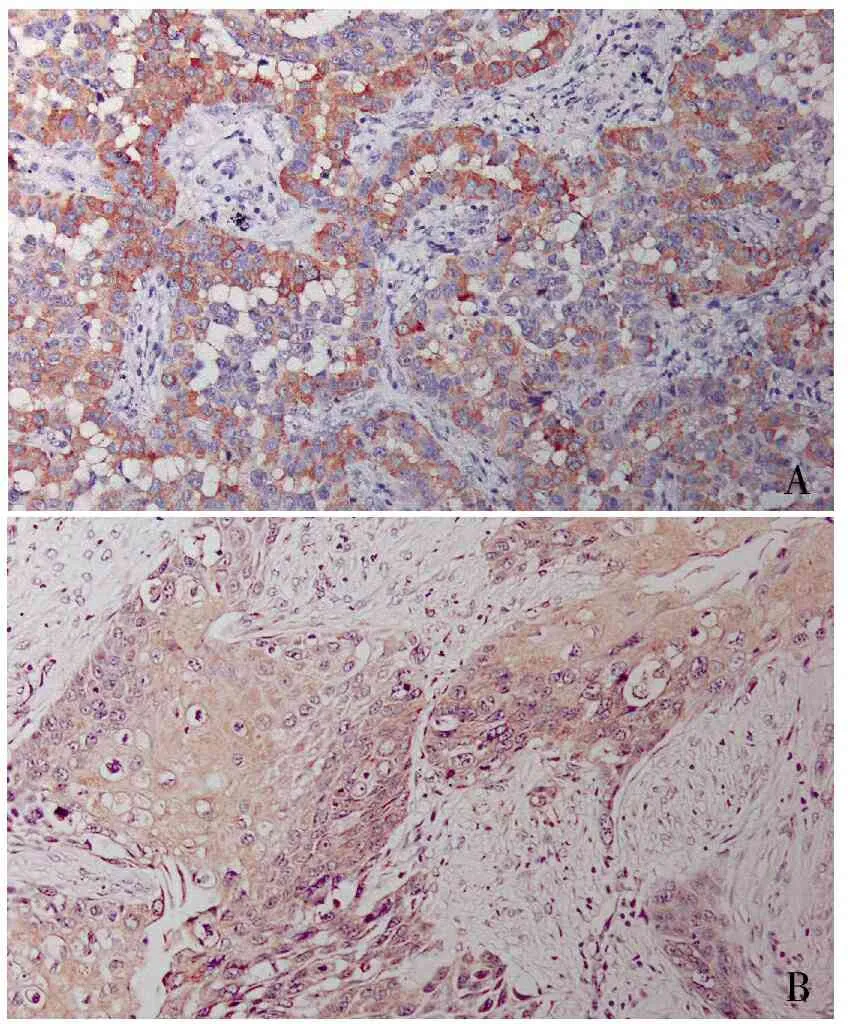
AB
图1 A.肺腺癌中p-FRK呈阳性,EnVision两步法;B.肺鳞癌中p-FRK呈阳性,EnVision两步法
2.2 p-FRK表达与NSCLC临床病理特征的相关性 162例NSCLC中,p-FRK表达与肿瘤大小有关,T2+T3+T4组p-FRK的阳性率明显高于T1组,组间比较差异有统计学意义(P<0.05);p-FRK蛋白表达水平在淋巴结转移组明显高于无淋巴结转移组(P<0.05);临床分期Ⅲ+Ⅳ期组p-FRK蛋白表达水平明显高于Ⅰ+Ⅱ期患者(P<0.05)。p-FRK表达与患者性别、年龄均无相关性(P>0.05,表1)。
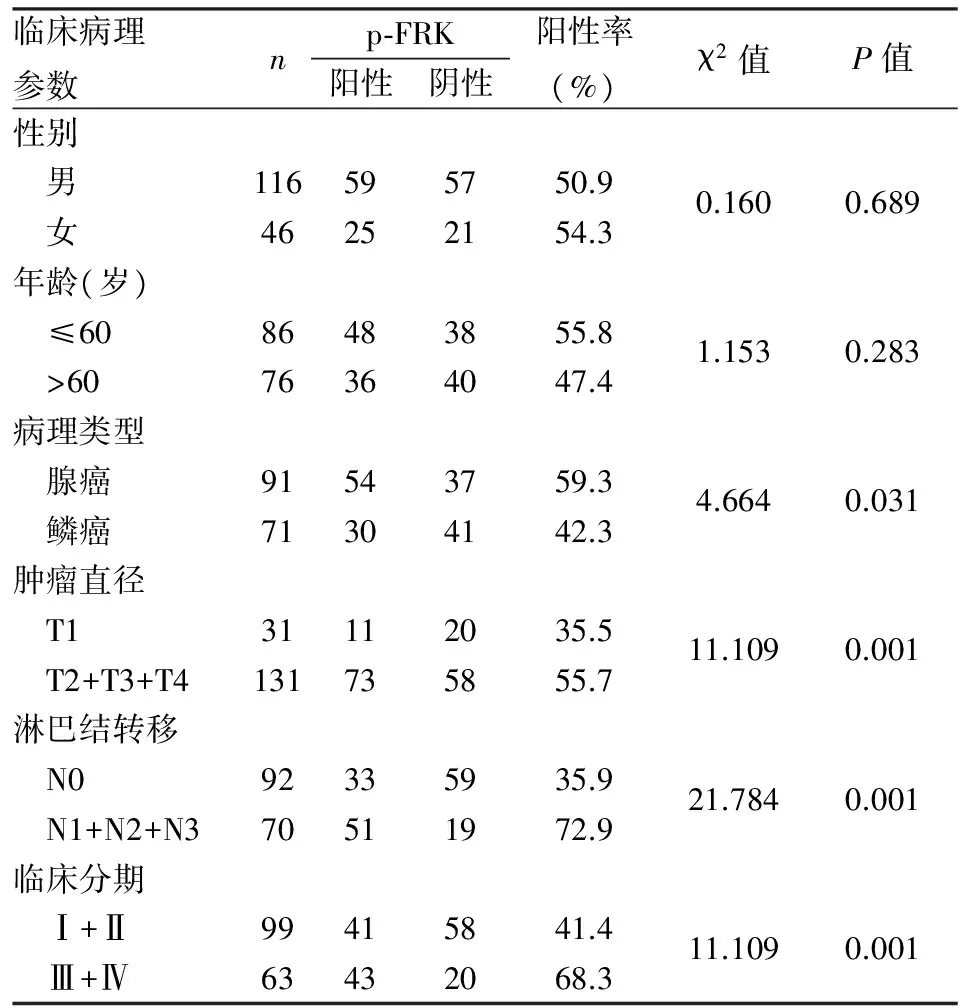
表1 p-FRK表达与NSCLC临床病理特征的相关性
2.3 p-FRK表达与NSCLC患者生存时间的关系 应用Kaplan-Meier法对162例NSCLC患者进行生存分析,结果显示:患者总生存期为1~63个月,中位生存期为12个月;患者1~5年生存率分别为85.7%、57.1%、35.4%、19.4%、2.3%(图2)。p-FRK阳性组与p-FRK阴性组间生存率差异有统计学意义( χ2=17.849,P<0.001,图3)。采用Cox风险比例模型,将患者性别、年龄、病理类型、肿瘤大小、淋巴结转移、p-TNM分期、p-FRK表达均纳入分析。单因素分析结果发现:p-FRK表达、p-TNM分期、淋巴结转移与NSCLC患者术后生存率有显著相关性(P<0.001,表2)。将单因素分析中对患者生存率有显著影响的p-FRK表达、p-TNM分期、淋巴结转移因素纳入Cox回归模型,进行多因素分析结果发现:p-FRK表达是肺癌患者预后的独立影响因素(P<0.01,表3)。

图2 NSCLC的总生存期曲线
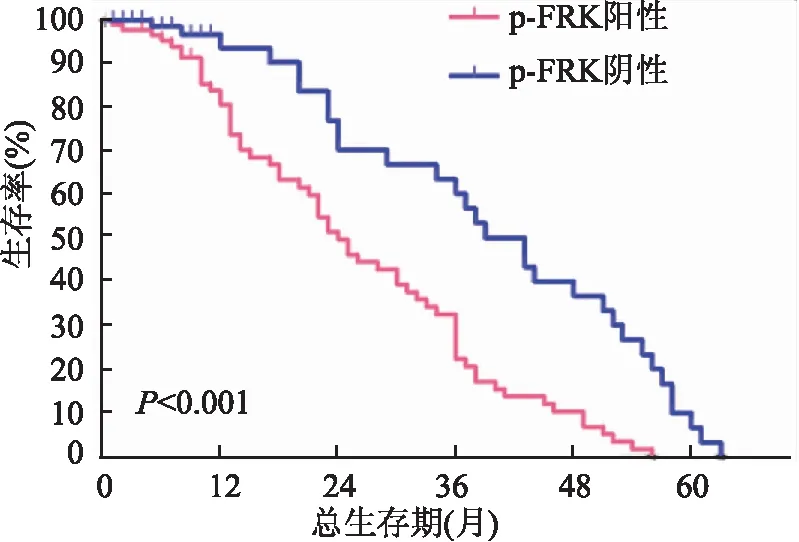
图3 p-FRK阴性组与阳性组的总生存期曲线
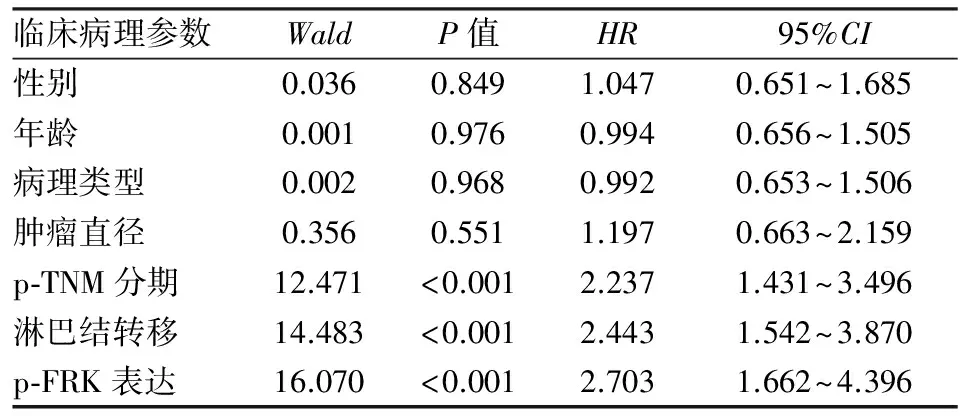
临床病理参数WaldP值HR95%CI性别0.0360.8491.0470.651~1.685年龄0.0010.9760.9940.656~1.505病理类型0.0020.9680.9920.653~1.506肿瘤直径0.3560.5511.1970.663~2.159p⁃TNM分期12.471<0.0012.2371.431~3.496淋巴结转移14.483<0.0012.4431.542~3.870p⁃FRK表达16.070<0.0012.7031.662~4.396
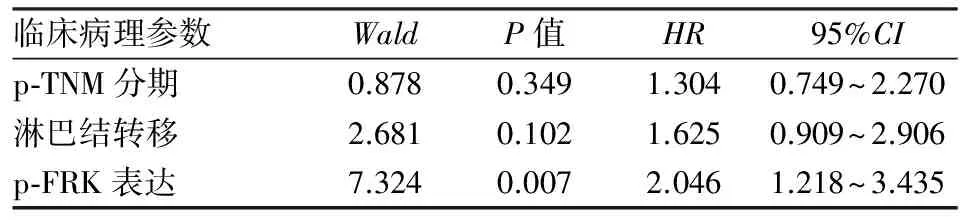
表3 多因素Cox比例风险模型分析NSCLC患者总生存期及预后风险因素
3 讨论
非受体酪氨酸激酶Src激酶家族有13种,在人基因组中由Blk、Brk、Fgr、FRK、Fyn、Hck、Lck、Lyn、Src、Srm和Yes共11个成员组成[5]。近年多项研究表明Src激酶家族在多种信号转导通路中有关键性作用,参与肿瘤细胞的增殖、分化、迁移、黏附和凋亡,与肿瘤的发生、发展、转移及预后密切相关[6-9]。近年研究发现FRK在不同的肿瘤中扮演不同角色,在肝癌和胰腺癌中FRK高表达可促进癌细胞侵袭[10-11],在脑胶质瘤中FRK抑制肿瘤的生长[12-13]。本组发现FRK中的p-FRK在NSCLC中高表达,推测其在肺癌发生、发展中有重要作用。
随着对肿瘤研究的不断深入,许多与肿瘤预后相关的Src激酶家族也相继被发现。Roseweir等[16]报道Lyn核表达的肾透明细胞癌患者预后不良,且Lyn可作为肾透明细胞癌患者预后评估的预测因子。Windischhofer等[17]发现Src蛋白参与G(a1)/Src/p42/44/MAPK信号通路可诱导早期生长反应因子-1(Egr-1)表达,促进骨肉瘤MG-63细胞株的发生、发展。于涓翰等[18]等实验结果显示Brk与Ki-67的协同表达是促进NSCLC进展的重要因素。目前,已发现的Src家族成员多数是癌基因,促进肿瘤发生、发展。
FRK是Src家族激酶中的一员,Zhou等[12]发现FRK在人胶质瘤组织中的表达水平与其恶性程度呈负相关,过表达FRK可以抑制胶质瘤细胞的迁移与侵袭能力。Yim等[5]报道FRK有抑制乳腺癌细胞生长的作用;但Chen等[10]发现FRK是肝癌细胞侵袭的正调控因子,促进肿瘤生长;提示在不同肿瘤中FRK所起的作用也不相同。目前,p-FRK与NSCLC的关系国内外尚无相关报道。本组结果显示,p-FRK表达定位于NSCLC肿瘤细胞细胞质而非细胞核,p-FRK在远端对照组织中的表达水平远低于其在NSCLC组织中表达水平,p-FRK在肺腺癌中的阳性率高于肺鳞癌。
淋巴结转移是肺癌患者重要的转移方式之一,通常与患者的不良预后密切相关。本组结果发现,淋巴结转移者p-FRK蛋白表达水平明显高于无淋巴结转移者;本实验结果还发现,NSCLC患者p-FRK表达水平与患者p-TNM分期呈明显的正相关(P<0.05),提示p-FRK阳性程度可能与NSCLC患者的不良预后相关。
本组中p-FRK阳性程度与NSCLC患者生存周期明显相关。p-FRK阴性组的中位生存期及5年生存率均高于阳性组,推测在NSCLC发生、发展中p-FRK可能起重要作用,但其机制尚需进一步分析。Cox回归单因素分析发现,p-FRK表达、淋巴结转移、p-TNM分期均对NSCLC患者术后生存率影响显著,提示p-FRK表达可能作为NSCLC患者预后的影响因素。将淋巴结转移、p-TNM分期、p-FRK表达水平均纳入Cox回归模型进行多因素统计分析,结果发现p-FRK表达(P<0.01)是NSCLC患者预后的独立影响因素,提示p-FRK可能成为判断NSCLC患者不良预后的标志物之一。
综上所述,p-FRK在NSCLC中的表达水平明显升高,且阳性程度与淋巴结转移及生存周期有明显的相关性,表明p-FRK可作为NSCLC患者不良预后的独立预测因子,且有望成为肺癌病理诊断中新的分子标志物。但是NSCLC的发生、发展是多种因素共同产生的结果,p-FRK在NSCLC的发生及转移中的生物学机制仍需进一步探讨。
[1] 陈万青,郑荣寿,张思维,等. 2012年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2016,25(1):1-8.
[2] Travis W D, Brambilla E, Riely G J . New pathologic classification of lung cancer: relevance for clinical practice and clinical trials[J]. J Clin Oncol, 2013,31(8):992-1001
[3] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2013,63(1):11-30.
[4] Senda Y, Murata-Kamiya N, Hatakeyama M. C-terminal Src kinase-mediated EPIYA phosphorylation of pragmin creates a feed-forward C-terminal Srckinase activation loop that promotes cell motility[J]. Cancer Sci, 2016,107(7):972-980.
[5] Yim E K, Peng G, Dai H,etal. Rak functions as a tumor suppressor by regulating PTEN protein stability and function[J]. Cancer Cell, 2009,15(4):304-314.
[6] Wang R, Li H, Guo X,etal. IGF-I induces epithelial-to-mesenchymal transition via the IGF-IR-Src-MicroRNA-30a-E-Cadherin pathway in nasopharyngeal carcinoma cells[J]. Oncol Res, 2016,24(4):225-231.
[7] Meng Y, Shukla D, Pande V S,etal. Transition path theory analysis of c-Src kinase activation[J]. Proc Natl Acad Sci U S A, 2016,113(33):9193-9198.
[8] Wang Y D, Bao X Q, Xu S,etal. A novel parkinson’s disease drug candidate with potent anti-neuroinflammatory effects through the Src signaling pathway[J]. J Med Chem, 2016, 59(19):9062-9079.
[9] Mila D, Calderon A, Baldwin A T,etal. Asymmetric Wnt pathway signaling facilitates stem cell-like divisions via the nonreceptor tyrosine kinase FRK-1 in caenorhabditis elegans[J]. Genetics, 2015,201(3):1047-1060.
[10] Chen J S, Hung W S, Chan H H,etal. In silico identification of oncogenic potential of fyn-related kinase in hepatocellular carcinoma[J]. Bioinformatics, 2013,29(4):420-427.
[11] Je D W, O Y M, Ji Y G,etal. The inhibition of SRC family kinase suppresses pancreatic cancer cell proliferation, migration, and invasion [J]. Pancreas, 2014,43(5):768-776.
[12] Zhou X, Hua L, Zhang W,etal. FRK controls migration and invasion of human glioma cells by regulating JNK/c-Junsignaling[J]. J Neurooncol, 2012,110(1):9-19.
[13] Shi Q, Song X, Wang J,etal. FRK inhibits migration and invasion of human glioma cells by promoting N-cadherin/β-catenin complex formation[J]. J Mol Neurosci, 2015,55(1):32-41.
[14] Chen B, Zhang W, Gao J,etal. Downregulation of ribosomal protein S6 inhibits the growth of non-small cell lung cancer by inducing cellcycle arrest, rather than apoptosis[J]. Cancer Lett, 2014,354(2):378-389.
[15] 王志维,雷珍牛,林 辉,等. 119例非小细胞肺癌中CCR9的表达及其预后分析[J]. 临床与实验病理学杂志, 2015,31(7):764-768.
[16] Roseweir A K, Qayyum T, Lim Z,etal. Nuclear expression of Lyn, a Src family kinase member, is associated with poor prognosis in renal cancerpatients[J]. BMC Cancer, 2016,16:229.
[17] Windischhofer W, Huber E, Rossmann C,etal. LPA-induced suppression of periostin in human osteosarcoma cells is mediated by the LPA(1)/Egr-1 axis [J]. BMC Cancer, 2012, 94(9):1997-2005.
[18] 于涓翰,张 勇,刘 洋,等. Brk在非小细胞肺癌中的表达及Ki67表达的关系[J]. 解剖科学进展, 2013,19 (1):9-12.
Expression of p-FRK and its prognostic analysis in non-small cell lung cancer patients
LI Li1,2, KOU Yu-ling1, CHEN Fei2, SUN Xing-wang1
(1DepartmentofPathology,AffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China;2LaboratoryofPathology,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
Purpose To investigate the expression of p-FRK protein in non-small cell lung cancer (NSCLC) patients and to explore its prognostic value. Methods The expression of p-FRK protein in tumor tissues and corresponding adjacentnormal pulmonary tissues from 162 NSCLC patients was detected by immunohistochemistry of EnVision two-step. The correlation among p-FRK expression, age, gender, clinicopathologic features, pTNM stage and metastasis of NSCLC patients was also analyzed. whether p-FRK could be used as an independent predictor of prognosis for patients with NSCLC was further determined. Results The positive expression rate of p-FRK in NSCLC tissues (51.9%) was significantly higher than that of adjacent normal lung tissues (11.7%) (P=0.001). The expression of p-FRK in NSCLC was significantly correlated with histopathologic type, lymph node status and pTNM stage (P<0.05). Kaplan-Meier survival analysis showed that there was a negative correlation between p-FRK positive rate and postoperative overall survival (χ2=17.849,P<0.001). Multivariate analysis showed that p-FRK expression was an independent prognostic factor for overall survival of NSCLC patients (HR= 0.496, 95%CI:0.295-0.836,P<0.05). Conclusion As a novel NSCLC biomarker, the expression of p-FRK may predict a poor prognosis in the patients with NSCLC.
lung neoplasm; non-small cell lung cancer; Src kinase family; p-FRK; prognosis
1西南医科大学附属医院病理科,泸州 6460002四川大学华西医院病理研究室,成都 610041
李 丽,女,硕士研究生。Tel: (028) 85164170,E-mail: lilymc@163.com 孙兴旺,男,教授,通讯作者。E-mail: lysunxw@163.com
时间:2017-5-17 23:53 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.012.html
R 734.2
A
1001-7399(2017)05-0525-05
10.13315/j.cnki.cjcep.2017.05.012
接受日期:2017-03-22
