一株乳酸乳球菌的分离鉴定及其发酵豆汁工艺优化
2017-06-23张莉力刘黎莹许云贺
张莉力,韩 梅,刘黎莹,于 洋,张 振,许云贺
(1.锦州医科大学食品科学与工程学院,辽宁锦州 121001;2.锦州医科大学畜牧兽医学院,辽宁锦州 121001)
一株乳酸乳球菌的分离鉴定及其发酵豆汁工艺优化
张莉力1,韩 梅1,刘黎莹1,于 洋1,张 振1,许云贺2,*
(1.锦州医科大学食品科学与工程学院,辽宁锦州 121001;2.锦州医科大学畜牧兽医学院,辽宁锦州 121001)
本研究从自然发酵北京豆汁中筛选到一株既可以加速豆汁与淀粉分离又具有优良豆汁发酵性能的乳酸乳球菌乳酸亚种,将其命名为Lactococcuslactissubsp.lactisLLY003。然后以绿豆淀粉的副产物——淀粉上清液为原料,将Lactococcuslactissubsp.lactisLLY003应用于豆汁发酵,通过单因素和正交实验,确定了发酵豆汁的最佳发酵工艺:在发酵时间为6 h,温度为39 ℃,6%蔗糖添加量和8%接种量的条件发酵,豆汁的感官评分达到94分,乳酸菌活菌数可以达到3.22×1011CFU/mL。通过保质期实验,确定发酵豆汁在4 ℃冷藏条件下,保质期至少可达20 d,在保质期内每毫升发酵豆汁的乳酸菌活菌数在一千亿以上。
豆汁,绿豆,乳酸菌,发酵
老北京豆汁是一种历史悠久的传统发酵食品,以其独特的风味和丰富的营养深受北京人的喜爱。豆汁是以绿豆为原料,经浸泡、研磨、沉淀、粉浆分离和熬制等工艺得到的一种以酸味为主、掺杂着些许臭味的液体发酵食品[1-3]。在加工过程中,绿豆淀粉的分离与发酵产酸是豆汁加工的关键工序,已有研究表明豆汁中的乳酸菌是加速淀粉沉降与发酵产酸的主要微生物[4-5],但是目前仍未有适用于豆汁工业发酵的菌种,所以豆汁生产仍处于初级加工阶段,产品质量受自然条件和操作技术等影响大[6-8]。为此本实验以自然发酵生豆汁为样品,分别以絮凝率、pH和豆汁发酵风味为指标,筛选出豆汁中具有絮凝淀粉活性的乳酸菌,将其作为豆汁发酵菌株应用于豆汁纯种发酵,并优化发酵工艺,提高发酵豆汁的食用安全性和产品质量的稳定性,口味更容易被大多数消费者接受,也为实现发酵豆汁的工业化生产提供技术参考。
1 材料与方法
1.1 材料与仪器
豆汁 北京东直门豆汁店、隆福寺小吃店、老磁器口豆汁店,于4 ℃手提冰箱中运输至实验室,采样当天进行微生物分离;绿豆 市售食用级;蔗糖、葡萄糖、乳糖、酵母膏、磷酸氢二钾、乙酸钠 分析纯;绿豆上清液 将绿豆浸泡8~12 h,以豆水比(g/mL)1∶15的比例打浆30 s,过100目筛子,混匀后静置使淀粉沉淀完全,该上清液即为绿豆淀粉上清液;绿豆汁种子培养基 酵母膏5 g、K2HPO42 g、葡萄糖20 g、蔗糖2 g、乙酸钠5 g、绿豆上清液1000 mL,调pH至6.8,121 ℃灭菌20 min;绿豆糖水培养液 蔗糖20 g、绿豆上清液1000 mL。
SW-CJ-2FD型双人单面净化工作台 上海苏净实业有限公司;LRH-350F生化培养箱 上海捷呈实验仪器有限公司;HZQ-F200型振荡培养箱 上海华邻实业有限公司;DNA快速提取试剂盒 天根生化科技(北京)有限公司;TG16K-II台式高速离心机 济南福的机械有限公司;PHS-3B精密pH计 上海雷磁仪器厂;UV754PC紫外分光光度计 上海佑科仪表有限公司;JYL-Y99料理机 九阳股份有限公司;OLYMPUS BX53显微镜 奥林巴斯(中国)有限公司。
1.2 实验方法
1.2.1 豆汁中产酸菌的分离纯化 采用10梯度稀释法将老北京豆汁稀释至10-7,取10-6、10-7的稀释液各0.1 mL分别注入无菌培养皿中,每个稀释度做两个重复。以无菌操作按20~30 g/L的量将灭菌的CaCO3加入熔化了的绿豆汁种子培养基中,使样品稀释液和CaCO3均匀分布于培养基中,于30 ℃培养48 h。挑取周围产生CaCO3的溶解圈的典型单菌落分别接种于绿豆汁种子培养液中,置于30 ℃温箱中培养24 h。取试管液体培养物1环,进行涂片、革兰氏染色,油镜观察个体形态和纯度,同时挑取1环培养液与载玻片上的3% H2O2混匀,视产气泡情况[9]。将革兰氏阳性细菌且过氧化氢酶阴性菌株初步鉴定为乳酸菌,分别接种于绿豆汁种子培养基斜面上,30 ℃温箱中培养48 h后于4 ℃冰箱保存,待下一步筛选。
1.2.2 具有絮凝淀粉活性产酸菌的筛选 从分离到的菌株斜面挑取2环乳酸菌,接种到3 mL绿豆汁种子培养液中,置于30 ℃培养24 h,再将该培养液按5%接种量扩培至绿豆汁种子培养液中,置于30 ℃培养24 h,测定发酵液的絮凝率。
1.2.3 淀粉絮凝率检测方法 取2.5 mL未接种绿豆汁培养基,加入装有25 mL绿豆淀粉乳的25 mL刻度试管中,塞上塞子后上下混匀10次,沉淀3 min,在刻度试管的18 cm处取样测定其540 nm处吸光度值(浊度),取值设为空白值A;同样方法取2.5 mL菌株发酵液加入装有25 mL绿豆淀粉乳的25 mL刻度试管中,混匀后在刻度试管的18 cm处取样测定其540 nm处吸光度值(浊度),取值设为B[10-11]。
绿豆淀粉乳:取浸泡8~12 h的绿豆,按1∶15的比例加水打浆,过120目筛子所得滤液即为绿豆淀粉乳。
式中:A为空白培养基上清的吸光度(浊度);B为样品上清液的吸光度(浊度)。
1.2.4 豆汁发酵菌筛选 从具有絮凝活性的菌株斜面挑取3环菌,接种到2 mL绿豆糖水培养液中,30 ℃培养24 h,再按5%接种量接入到绿豆糖水培养液中发酵豆汁,30 ℃培养24 h,测定发酵液的pH,并进行发酵豆汁风味评定。
1.2.5 菌种鉴定
1.2.5.1 菌株形态学观察 将筛选到的菌株接种于绿豆汁种子培养基上,30 ℃培养48 h,观察菌落形态,并进行革兰氏染色,荚膜染色,于光学显微镜下观察菌体形态及分裂后菌体间排布方式。
1.2.5.2 菌株的生理生化鉴定 按照《伯杰细菌鉴定手册》进行菌株的生理生化特性鉴定。
1.2.5.3 菌株16S rDNA序列的测定与分析 DNA的提取:取菌液2 mL,12000 r/min离心2 min,去上清液收集菌体,用天根DNA试剂盒提取DNA。提取后的基因组DNA作为扩增16S rDNA的模板。
16S rDNA 系列扩增:两个PCR引物分别是:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R:(5′- GGTTACCTTGTTACGACTT-3′),引物由上海生工(Sangon)合成。
PCR扩增体系:总体积为50 μL,其中27F引物1 μL,1492R引物1 μL,deNTP 1 μL,Pfu Buffer 5 μL,Pfu酶0.25 μL,加水至50 μL。98 ℃预变性5 min,95 ℃变性35 s,55 ℃退火35 s,72 ℃延伸1 min,35个循环后延伸4 min。PCR产物0.8%琼脂糖凝胶电泳,EB染色20 min,紫外分析仪检测。PCR产物纯化、16S rDNA序列测定均由上海生工完成。
16S rDNA序列同源性分析:将测定的16S rDNA序列在NCBI核酸数据库进行BLAST搜索,与数据库中已有的16S rDNA序列进行相似性比较分析。根据比对结果,找出与数据库同源性最高的已知菌种,推测待鉴定菌株的可能的属或种。
1.2.6 豆汁发酵剂的制备 用接种环挑取三环斜面保藏的发酵菌株于5 mL绿豆糖水培养液中,30 ℃下发酵24 h后,将这5 mL发酵液扩大培养,继续接入50 mL绿豆糖水培养液中30 ℃下发酵24 h,获得豆汁的发酵剂。
1.2.7 豆汁发酵工艺流程 100 g绿豆→清洗→浸泡(豆水比(g/mL)1∶10,8 h)→冲洗→加水2000 mL打浆30 s(豆水比(g/mL)1∶20)→过滤(100目筛子)→混匀→静置40 min,按2∶1的比例取上清液和第二层,混匀→加入6%的蔗糖,微加热使其溶解→灭菌(100 ℃,30 min)→晾凉至20~30 ℃→接入10%的发酵剂→发酵(39 ℃,6 h)→冷藏(4 ℃)。
1.2.8 发酵工艺条件的优化
1.2.8.1 单因素实验 分别进行接种量(3%、5%、8%、10%、12%、15%)、蔗糖(0%、2%、4%、6%、8%、10%)、培养时间(2、4、6、8、10、12 h)、培养温度(31、33、35、37、39、41 ℃)的单因素发酵实验,其他条件同1.2.7,以感官评分为指标,分析各因素对发酵的影响。
1.2.8.2 正交实验 选取时间、温度和蔗糖添加量三个因素,以感官评分为指标,作L9(33)正交实验确定最佳发酵工艺条件(表1)。
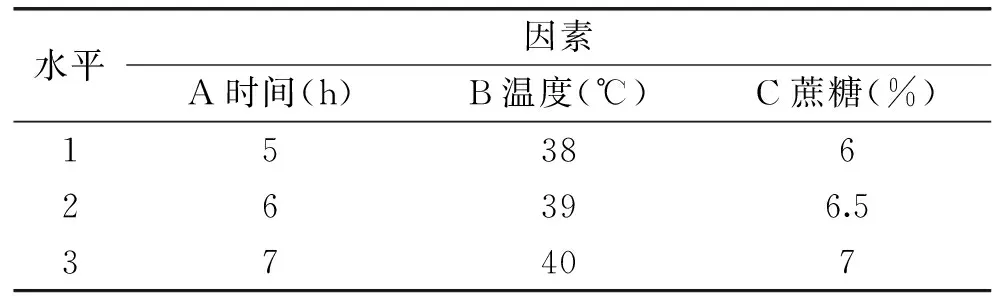
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiment
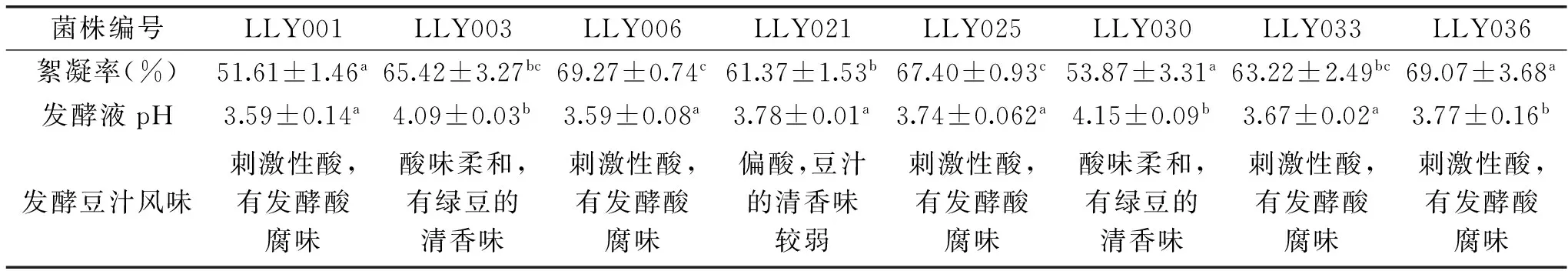
表3 乳酸菌发酵液絮凝率、pH及发酵风味Table 3 Flocculating rate,pH and flavor of the fermentation by lactic acid bacteria
注:同行数据之间肩标字母不同表示差异显著(p<0.05)。

表4 乳酸菌个体形态特征Table 4 Individual morphology of lactic acid bacteria
1.2.8.3 感官评定 感官评定在锦州医科大学食品微生物实验室完成,邀请10人组成评定小组,明确本实验的目的和意义以及感官评定的指标和注意事项。本实验采用随机双盲法进行检验(即对样品进行编号,检验样品也随机化),旨在减少如个人嗜好与偏爱、经验等因素对检验结果的影响。评定分数采用 3 个分制,分别对不同的情况进行打分。每名成员单独进行评分,不互相交流,评定下一个样品之前要用清水漱口。取10名成员的平均分作为最后的结果。发酵豆汁感官评分标准详见表2。
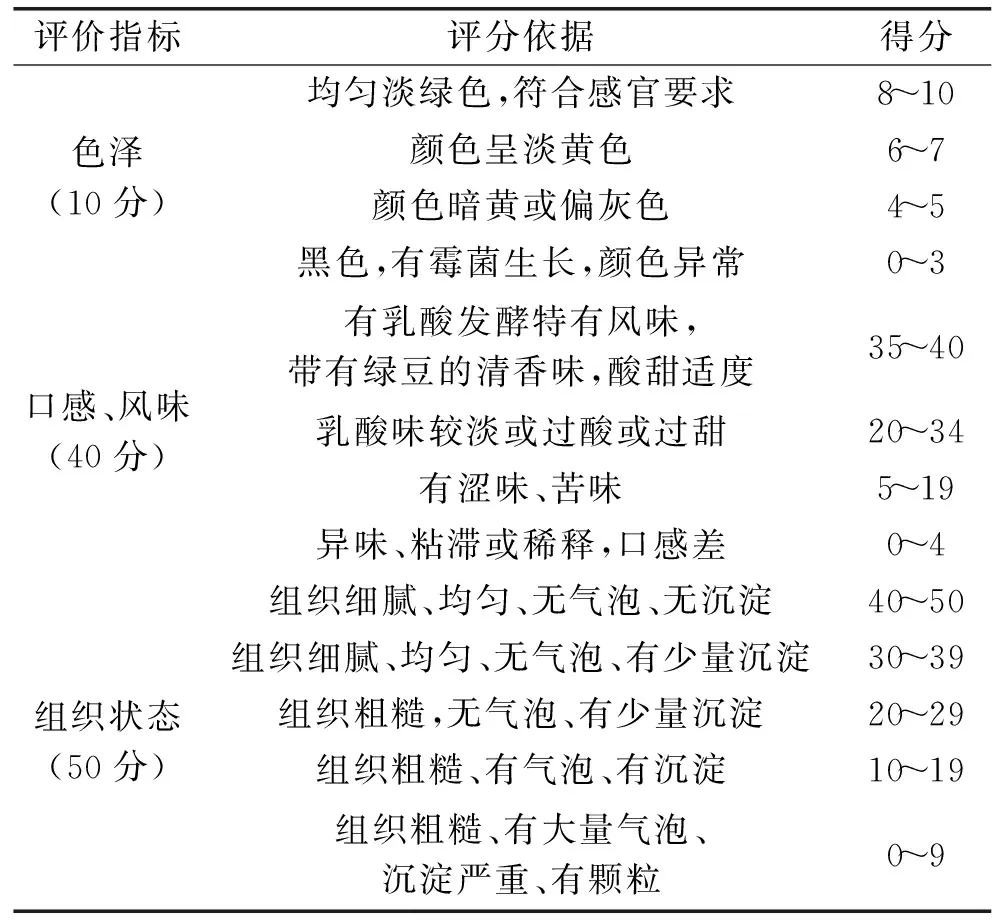
表2 发酵豆汁感官评分标准Table 2 Sensory evaluation standards of fermented beverage of mung bean
1.2.9 数据处理 原始数据采用Excel 2007整理,采用SPSS 19.0 进行ANOVA单因素方差分析及LSD多重检验(p<0.05),数值以均值±标准差表示。
2 结果与分析
2.1 豆汁发酵菌株筛选
淀粉的分离与发酵产酸是加工豆汁的关键工序,因此本研究以检测淀粉沉降分离速度的絮凝率、发酵产酸的pH和豆汁发酵风味为指标筛选豆汁发酵菌株。分别从三个不同来源的老北京豆汁样品中共选取56株有碳酸钙溶解圈的产酸菌株,其中革兰氏染色阳性、过氧化氢酶阴性的菌株有16株,初步鉴定为乳酸菌;然后分别测定这16株菌发酵液的絮凝率,有8株菌的絮凝率高于50%,结果见表3,其中3株为球状乳酸菌、5株为杆状乳酸菌,而且不论是杆状产酸菌还是球状产酸菌菌体分裂后的排布方式均为链状(表4)。
将上述具有絮凝活性的乳酸菌接入到绿豆糖水培养液中发酵豆汁,30 ℃培养24 h,发酵液的pH及豆汁风味见表3。5株杆状的乳酸菌发酵后的豆汁pH都低于4,且发酵豆汁普遍具有发酵酸腐味,而3株球菌发酵后的酸味较柔和,在3株球状乳酸菌中以LLY003菌株絮凝率最高,即加速淀粉沉降分离速度最快,因此选择LLY003菌株作为豆汁发酵菌种,并对其进行菌种鉴定。
2.2 LLY003菌株的鉴定
2.2.1 LLY003菌株的个体形态与菌落形态 LLY003菌株在绿豆汁种子培养基培养,30 ℃培养48 h的菌落图片及菌落特征见图1和表5。

表5 LLY003菌株的形态特征Table 5 Individual morphological characters of strain LLY 003

表6 LLY003菌株的菌落形态特征Table 6 Colonial morphology characters of strain LLY 003

图1 绿豆汁种子培养基中菌株LLY003菌落形态Fig.1 Colonial morphology of strain LLY003 on green bean juice seed solid medium
LLY003菌株在豆汁种子培养基中,30 ℃下培养48 h,观察菌落大小、形态和颜色,结果见图2和表6。
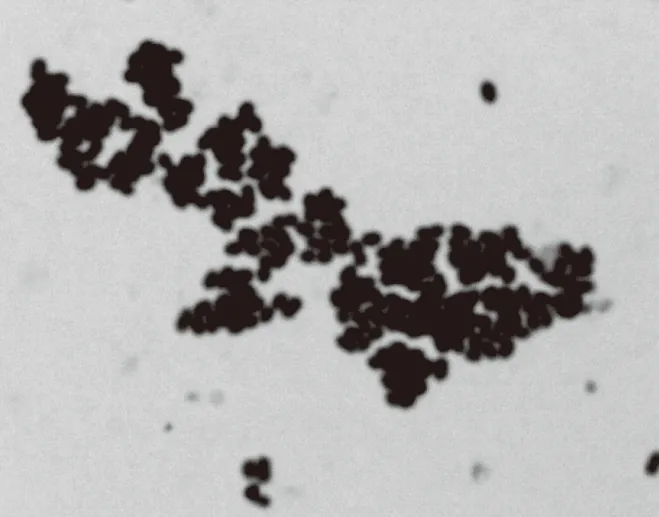
图2 菌株LLY003的个体形态(×1000)Fig.2 Individual morphology of strain LLY003(×1000)
2.2.2 LLY003的生理生化特征 根据常规生理生化鉴定,结果见表7,参照《伯杰细菌鉴定手册》,初步判断菌株LLY003为乳球菌属。
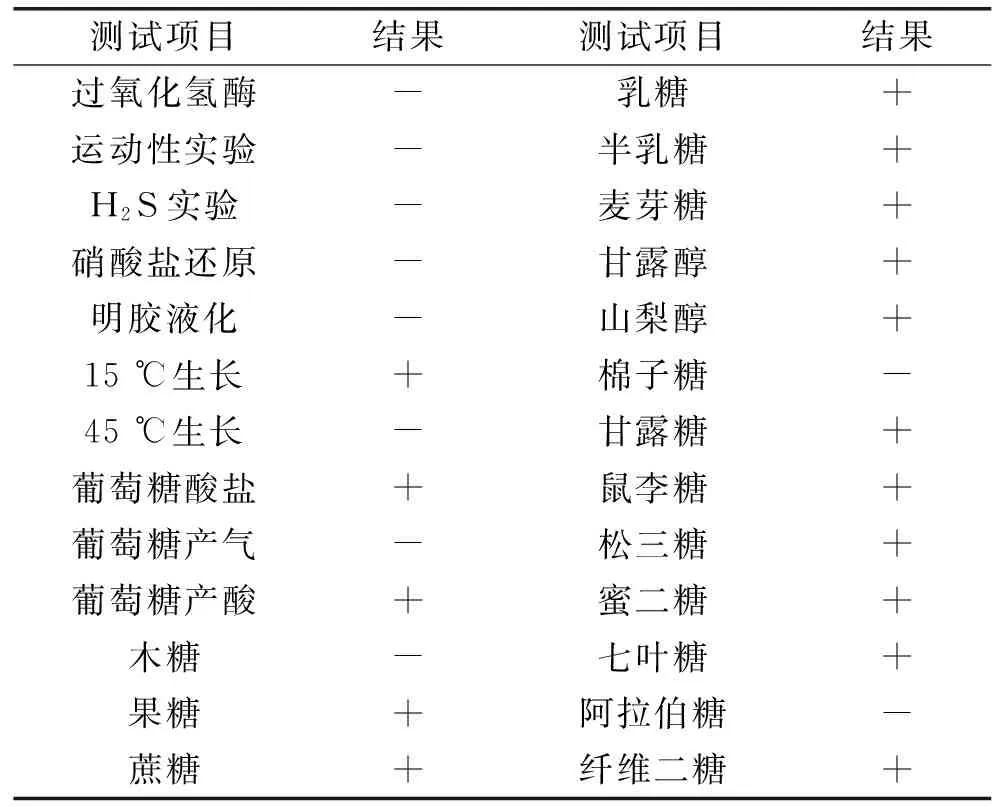
表7 LLY003菌株生理生化特性Table 7 Physiology biochemistry characteristics of strain LLY003
注:+表示阳性,-表示阴性。
2.2.3 乳酸菌LHY03的16S rDNA序列分析结果 该菌株的16S rDNA 序列全长共1466 bp,经Genbank比对相似性达到99.8%;通过菌体的群体形态观察、个体形态观察、生理生化实验结果及菌株的16S rDNA序列比对,确定该菌株为乳酸乳球菌乳酸亚种,命名为Lactobacilluslactissubsp.lactisLLY003,已于2016年7月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No. 12795。
2.3 单因素实验优化发酵工艺实验
2.3.1 不同接种量对豆汁发酵工艺的影响 适当提高接种量可以缩短微生物生长的延滞期,减缓菌株发酵产酸的速度,由图3可知,感官评分随接种量的增多而不断增大,当接种量达到8%时,感官评分达到最高值92分,之后随接种量的增加,豆汁感官质量差异不显著,考虑增加接种量会提高豆汁生产成本,因此选择8%的接种量。
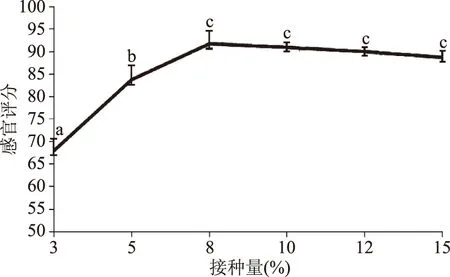
图3 接种量对豆汁发酵的影响Fig.3 Effect of inoculation amount on the fermentation of mung bean beverage注:小写字母不同表示差异显著(p<0.05),图4~图6同。
2.3.2 不同蔗糖添加量对豆汁发酵工艺的影响 蔗糖作为碳源,在一定浓度范围,菌体的生长及发酵产酸速度随着蔗糖含量的增加而加快,由图4可知,蔗糖的添加量在6%~8%时,豆汁发酵风味的感官评分较高,因为蔗糖含量过高会增大培养液的渗透压,抑制菌体生长,另外甜度过高对人体健康不利,因此选择6%的蔗糖添加量。
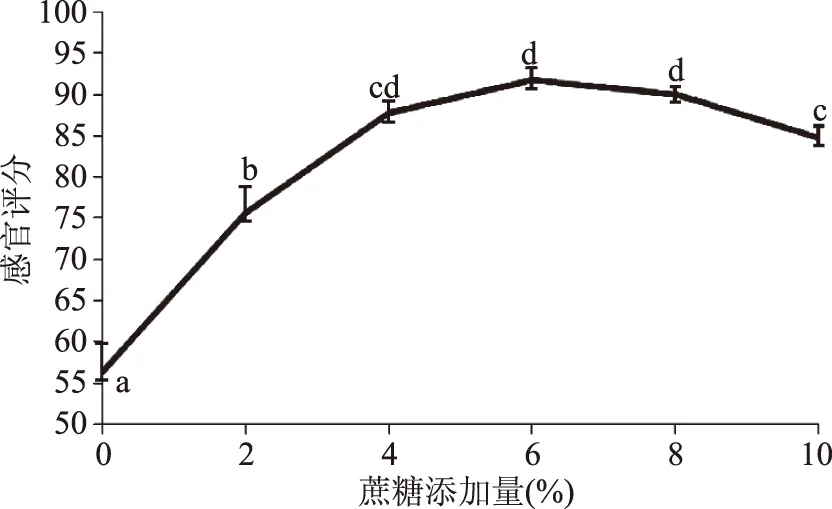
图4 蔗糖添加量对豆汁发酵的影响Fig.4 Effect of sucrose on the fermentation of mung bean beverage
2.3.3 发酵时间对豆汁发酵工艺的影响 由图5可知,发酵时间的长短对豆汁风味的影响较大,在6 h之前,感官评分随时间增多而增大,培养时间过短,菌体生长不充分,乳酸菌发酵蔗糖产酸量不足,发酵豆汁偏甜、酸爽感不足。在培养6 h时,感官评分达到最高分90分。之后,随着发酵时间的延长、乳酸菌产酸量增大,酸度增加,影响口感,豆汁感官评分减小,因此发酵时间选择6 h。
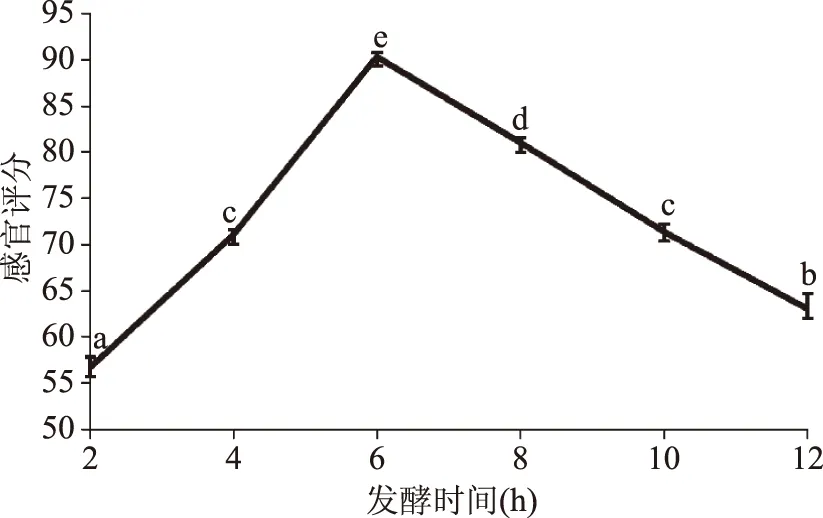
图5 培养时间对豆汁发酵的影响Fig.5 Effect of culture time on the fermentation of mung bean beverage
2.3.4 不同培养温度对豆汁发酵工艺的影响 由图6可知,培养温度低于35 ℃时,随着温度的提高,豆汁感官评分增加,这可能是由于温度较低时,微生物生长速率低及发酵产酸少,风味口感欠佳。在35~39 ℃之间,感官评分缓慢增长,39 ℃时达到最高分数93分,之后评分下降,因此选择39 ℃作为豆汁的最佳发酵温度。
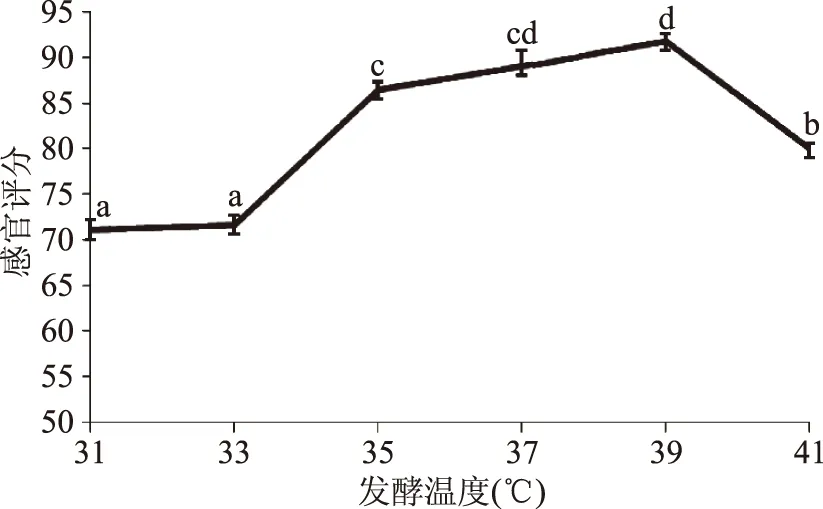
图6 培养温度对发酵工艺的影响Fig.6 Effect of culture temperature on the fermentation of mung bean beverage
2.4 正交实验
通过正交实验表可以看出,对发酵影响最大的因素是发酵时间,其次是发酵温度和蔗糖添加量。根据结果表明,最佳培养条件组合为A2B3C2。在发酵时间为6 h,温度为39 ℃,蔗糖添加量为6%的条件下进行验证实验,感官评分达到94分,乳酸菌活菌数可以达到3.22×1011CFU/mL。
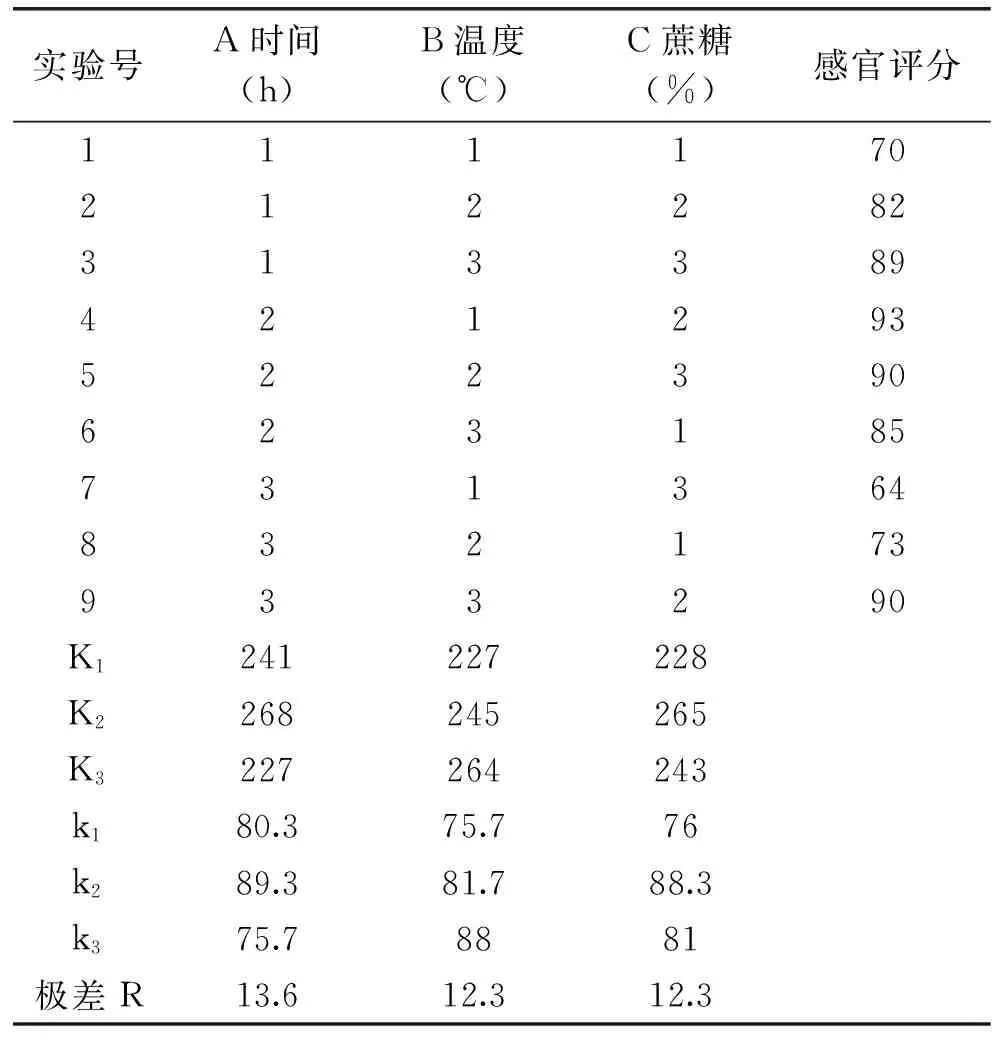
表8 正交实验结果Table 8 Results of orthogonal experiment
2.5 保质期实验
如表9所示,发酵豆汁的保质期实验以其pH、乳酸菌活菌数及感官评分为检测指标,在实验期间,豆汁在4 ℃低温下保藏20 d活菌数几乎没有下降,pH略有降低,感官质量也没有显著降低,因此,确定发酵豆汁在4 ℃低温下,保质期至少可以达到20 d,且在保质期内发酵豆汁的乳酸菌活菌数在1011CFU/mL以上,其活菌数量高于市场上同类产品活菌数的100倍以上[12-15]。

表9 保质期实验结果Table 9 Results of shelf life
注:同列数据之间肩标字母不同表示差异显著(p<0.05)。
3 讨论
一般发酵饮料发酵剂的接入量为3%~8%[12-13],结合实验结果,本实验最适接种量取8%。适当的添加蔗糖对发酵饮料的口感给予保证,也为菌种的生长提供碳源,糖浓度过低会使口感过酸,也可使生长中的菌种由于缺少碳源而生长不充分;而糖浓度过高会使口感过甜,渗透压过大反而抑制菌种生长[14],本实验中蔗糖添加量为6%时达到最高感官得分93分,因此6%为最适蔗糖添加量;培养时间过短,使菌种生长不充分,发酵饮料口感不佳。培养时间过长,可能会带来其他杂菌的生长,使口感过酸或对人体健康不利。因此由实验得知6 h为最适培养时间;实验得知,培养温度过高或过低都不利于该菌种的生长,39 ℃为最适培养温度。对发酵时间、发酵温度和蔗糖添加量进行正交实验,得出最佳发酵条件为发酵时间为6 h,温度为39 ℃,蔗糖添加量为6%。并在此条件下进行验证实验,感官评分达到94分,乳酸菌活菌数达到3.22×1011CFU/mL。
对发酵的产品进行保质期实验,在实验的20 d期间,样品在4 ℃低温下保藏20 d活菌数几乎没有下降,pH略有降低,感官品质没有下降,因此,确定发酵豆汁在4 ℃低温下,保质期至少可以达到20 d,在保质期内发酵豆汁的乳酸菌活菌数在1011CFU/mL以上。其活菌数量高于市场上同类产品活菌数的100倍以上[15]。本开发的发酵豆汁中除了蔗糖外,未添加任何食品添加剂,保证豆汁的营养价值和原有的风味,且生产成本低;纯种发酵的豆汁营养性、安全性和稳定性都较高,口感也更容易被大众所接受,本研究对豆汁的产业化开发具有指导意义。
4 结论
本文以自然发酵老北京豆汁为样品,从中筛选到一株既可以加速豆汁与淀粉分离又具有优良豆汁发酵风味的乳酸乳球菌乳酸亚种,将其命名为Lactobacilluslactissubsp.lactisLLY003。将该菌株应用于豆汁发酵,通过单因素和正交实验,确定了豆汁的最佳发酵工艺,在发酵时间为6 h,温度为39 ℃,6%蔗糖添加量和8%接种量的条件发酵,豆汁的感官评分达到94分,乳酸菌活菌数可以达到3.22×1011CFU/mL。发酵豆汁在4 ℃下冷藏,在20 d保质期实验期间,样品的pH和感官评分变化不大,且发酵豆汁的乳酸菌活菌数仍在1011CFU/mL以上,发酵豆汁的保质期至少可以达到20 d,本研究将为豆汁的工业化生产提供技术参考。
[1]卢晓丹,张敏. 豆汁的加工工艺研究[J]. 食品工业科技,2014,35(3):266-270.
[2]丁玉振,张绍英,梁尽祎,等. 北京传统小吃“豆汁”制作工艺研究[J]. 食品科学,2010,31(2):280-283.
[3]陈宇翔,陈历俊,姜铁民. 北京豆汁优势菌群的探究及其发酵性能测试[J]. 食品科技,2013(8):67-70.
[4]Ding Y Z,Zhang S Y,Liu P,et al. Microbiological and biochemical changes during processing of the traditional chinese food douzhi[J]. Food Control,2009,20(12):1086-1091.
[5]李新华,赵晓阳,张荔力. 副干酪乳杆菌对甘薯浆液中淀粉絮凝机理研究[J]. 食品科学,2010,31(19):273-276.
[6]北京粉丝厂北大生物系酸浆研究小组. 酸浆为什么能沉淀淀粉?[J]. 北京大学学报:自然科学版,1974(S1):60-69.
[7]徐浩,陈晓冬,李悦,等. 一株乳酸菌细胞壁上的凝集淀粉因子——Ⅰ.电子显微镜观察[J]. 微生物学报,1980(3):54-57,123-124.
[8]张莉力,许云贺,李新华. 甘薯酸浆中微生物絮凝性研究[J]. 食品工业科技,2010,31(6):172-175.
[9]Ryan S M,Fitzgerald G F,Sinderen D V. Screening for and identification of starch-,amylopectin-,and pullulan-degrading activities in bifidobacterial strains.[J]. Applied & Environmental Microbiology,2006,72(8):5289.
[10]Aljuboori A H R,Uemura Y,Thanh N T. Flocculation and mechanism of self-flocculating lipid producer microalga Scenedesmus quadricauda,for biomass harvesting[J]. Biomass & Bioenergy,2016,93:38-42.
[11]Bhattacharya A,Mathur M,Kumar P,et al. A rapid method for fungal assisted algal flocculation:Critical parameters & mechanism insights[J]. Algal Research,2017,21:42-51.
[13]Abdolmaleki F,Mazaheri Assadi M,Akbarirad H. Assessment of beverages made from milk,soya milk and whey using Iranian kefir starter culture[J]. International Journal of Dairy Technology,2015,68(3):441-447.
[14]Gabrielyan D S. Development of technology of enriched fermented drink with the use of protein-carbohydrate raw materials[J]. Herald of the N.i.vavilov Saratov State Agrarian Univ,2014.
[15]Gupta,S. & Abu-Ghannam,N. Probiotic fermentation of plant based products:possibilities and opportunities. Critical Reviews in Food Science and Nutrition. 52,183-99(2012).
Isolation and identification ofLactococcuslactisand process optimization in fermented beverage of mung bean
ZHANG Li-li1,HAN Mei1,LIU Li-ying1,YU Yang1,ZHANG Zhen1,XU Yun-he2,*
(1.College of Food Science and Engineering,Jinzhou Medical University,Jinzhou 121001,China; 2.College of Animal Husbandry & Veterinary Medicine,Jinzhou Medical University,Jinzhou 121001,China)
A strain ofLactococcuslactissubsp.lactiswith accelerating the separation of starch and good fermentation properties was isolated from Beijing Douzhi by natural fermentation. This strain was namedLactococcuslactissubsp.lactisLLY003 and applied to fermentation beverage and the supernatant of mung bean starch as substrate. Then the single factor experiment and orthogonal experiment were designed for optimizing the technology parameters. The optimal fermentation condition was inoculated amount 8% at 39 ℃ for 6 hours with 6% aucrose,under these conditions,the values of sensory reached 94 scores and the viable cells reached 3.22×1011CFU/mL. The storage shelf life could reach up to 20 days at 4 ℃ and the viable cells above one hundred billion.
beverage of mung bean;mung bean;lactic acid bacteria;fermentation
2017-01-13
张莉力(1977-),女,博士,副教授,主要从事食品微生物研究,E-mail:13634967549@163.com。
*通讯作者:许云贺(1978-),男,博士,副教授,主要从事畜牧微生物应用研究,E-mail:sn_97@126.com。
国家自然科学基金项目(31301499);辽宁省自然科学基金项目(2014022052)。
TS201.3
A
1002-0306(2017)11-0134-06
10.13386/j.issn1002-0306.2017.11.017
