二维电泳技术对脉冲电场处理哈密瓜汁中酿酒酵母的蛋白质组学研究
2017-06-23田一雄陈晓婵杨瑞金
田一雄,赵 伟,*,陈晓婵,杨瑞金
(江南大学食品学院,江苏无锡 214122)
二维电泳技术对脉冲电场处理哈密瓜汁中酿酒酵母的蛋白质组学研究
田一雄1,赵 伟1,*,陈晓婵2,杨瑞金2
(江南大学食品学院,江苏无锡 214122)
采用二维电泳(2-dimensional gel electrophoresis,2-DE)技术对脉冲电场(pulsed electric field,PEF)处理前后哈密瓜汁中酿酒酵母蛋白质进行检测分析,探究处理过程对酿酒酵母蛋白表达的影响。实验结果得知,所有检测出的酵母蛋白等电点均介于4.00与6.87之间,分子量分布在14.58~109.83 kDa之间;PEF处理后的酿酒酵母为免受环境变化带来的氧化损伤,细胞中硫氧还蛋白过氧化物酶、延长因子2表达上调;并且因场强影响到了细胞的遗传物质,核染色质蛋白和DNA修复蛋白表达上调;此外,细胞中Cu-Zn辅基超氧化物歧化酶和与糖原合成与代谢密切相关的磷酸丙酮酸水合酶的表达下调,反映细胞的活力下降或死亡;与细胞生存和增殖相关蛋白的表达也发生了明显的变化,如胱硫醚β-合酶、腺苷5-单磷酰胺酶、非典型蛋白Ynr034w-A亚基等。PEF处理影响到细胞代谢的相关酶类和遗传物质,可为研究PEF强化杀菌方法提供理论依据。
高压脉冲电场技术(PEF),非热加工技术,二维电泳技术,酿酒酵母蛋白
脉冲电场(Pulsed electric field,PEF)技术作为一种新型的食品非热加工技术,具有能耗低、处理温度低、食品品质保存效果好、设备稳定性好及连续性处理等优点,近年来受到国内外政府及企业的高度重视[1]。脉冲电场对液态食品的灭菌效果不仅取决于微生物本身,同时还受电导率、离子强度、pH、水分活度、黏度、气泡等因素的影响[2]。有研究表明,在较高场强(30 kV/cm,400 μs),处理温度45 ℃时对啤酒中的酿酒酵母有较好的灭菌效果[3]。
哈密瓜汁为热敏性果汁,热处理会产生令消费者无法接受的风味,然而哈密瓜汁具有低电导率特点,通过脉冲电场处理可实现较好的灭菌效果[4]。本文选择以低电导率的哈密瓜汁为介质,用PEF处理果汁中的酿酒酵母,从蛋白质组学的角度解释PEF处理对酿酒酵母蛋白质表达的影响。
1 材料与方法
1.1 材料与仪器
酿酒酵母BY4742 Open Biosystem;新疆西州蜜哈密瓜 无锡华润万家超市;IPG胶条、CHAPS、矿物油、电极纸片、尿素 美国Bio-Rad公司;N,N-亚甲双丙烯酰胺、丙烯酰胺、过硫酸铵、TEMED、SDS、β-巯基乙醇 美国Sigma公司;实验室常用试剂 国药集团化学试剂有限公司。
OSU-4L型PEF连续处理设备 美国俄亥俄州立大学;DRP-9082型电热恒温培养箱 上海森信实验仪器有限公司;LDZX-50KB立式压力蒸汽灭菌器 上海申安医疗器械厂;QYC2102-C型恒温培养摇床 上海新苗医疗器械有限公司;冷冻离心机 艾本德中国有限公司;IPGhor等电聚焦仪 GE Healthcare公司;DALT-SIX SDS-PAGE电泳仪、ImageScanner 扫描仪 GE Healthcare公司;PDquest 分析软件 Bio-Rad公司;ABI 5800 MALDI-TOF/TOF串联质谱仪 美国 AB SCIEX 公司;酸度计 梅特勒-托利多(上海)仪器有限公司;UV-1100型紫外分光光度计 上海美谱达仪器有限公司;DD-11C型电导率仪 上海精密科学仪器有限公司;其他仪器设备 均为实验室常用仪器。
1.2 实验方法
1.2.1 哈密瓜汁的制备 市售的新鲜哈密瓜进行削皮、去籽后用组织捣碎机捣碎,果浆用离心机离心(9000 r/min,10 min)取上清液。将离心好的上清液进行抽滤,滤液用去离子水调节电导率到2000 μs/cm。
1.2.2 微生物的活化培养 从酵母浸出粉胨葡萄糖(YPD)琼脂斜面培养基中取酿酒酵母接种于YPD液体培养基中在30 ℃、200 r/min 条件下摇床培养14 h至酵母细胞生长稳定期[5]。取菌液进行离心(9500 r/min,10 min),将离心好的菌体用无菌水清洗并再次离心(9500 r/min,10 min),将离心好的菌体收集备用。
1.2.3 微生物的接种 按照上述哈密瓜汁制备方法制备哈密瓜汁,将离心好的酿酒酵母加入到适量的哈密瓜汁中,使菌体最终浓度为106~107CFU/mL。
1.2.4 哈密瓜汁的PEF处理 实验采用实验室规模的OSU-4L型连续处理设备处理(20 kV/cm,200 μs,脉冲频率200 Hz,脉宽2 μs),管路依次用4% NaOH、10%的市售84消毒液和无菌水依次清洗使管路保持无菌状态。物料从进料口泵入,依次通过3对处理腔(电极间距为0.29 cm),处理后流经10 ℃的恒温水浴锅冷却,并读数。
1.3 测定方法
1.3.1 酿酒酵母蛋白的提取与定量 根据1.2.1方法将处理好的液体样品离心取离心好的酿酒酵母用无菌水清洗并离心两次,离心好的菌体取出并加入液氮,充分研磨;在研磨好的样品中加入蛋白裂解液在30 ℃下溶解1 h,使蛋白充分溶解;将溶解后的蛋白液离心(9500 r/min,15 min),取上清液,重复两次。采用Bradford法[6]测定上清液中蛋白浓度,并储存于-80 ℃冰箱中备用。
1.3.2 第一向固相pH梯度等电聚焦 取200 μg蛋白样品,与一定量的样品水化液(9 mol/L尿素+4% CHAPS+1% IPG buffer(GE Healthcare)+1% DTT+痕量溴酚蓝)混合,使得总体积为450 μL。从冰箱中取出低温保存的IPG胶条(GE Healthcare,24 cm,pH=4~7),在室温下放置10 min。在聚焦槽中缓慢加入蛋白样品,将胶条下面缓慢覆盖在蛋白样品上。在每根胶条的支持膜面缓慢加上2 mL矿物油,准备完毕后开始等电聚焦程序。等电聚焦参数:温度 20 ℃、最大电流为50 μA/胶条。水化在50 V低电压下进行12 h,然后经过500 V下1 h、1000 V下1 h,而后1 h内梯度升高到10000 V,并保持10 h。
1.3.3 第二向垂直板SDS-PAGE电泳 将聚焦好的IPG胶条取下,在平衡缓冲液1(6 mol/L尿素+50 mmol/L Tris-HCl(pH8.8)+30%甘油+2% SDS+1% DTT+痕量溴酚蓝)和平衡缓冲液2(6 mol/L尿素+50 mmol/L Tris-HCl(pH8.8)+30%甘油+2% SDS+2.5%碘乙酰胺+痕量溴酚蓝)中各平衡15 min。将胶条放到第二向SDS-PAGE凝胶的上表面,使胶条与SDS-PAGE凝胶的胶面充分接触,用琼脂固定,进行电泳:水浴循环仪设定温度为15 ℃;电泳设置为100 V、45 min;至溴酚蓝前沿刚好跑出凝胶。电泳结束后取出凝胶进行染色。
1.3.4 双向凝胶电泳EMBL银染方法(质谱兼容) 参考Shevchenko等[6]的银染方法对凝胶进行染色。基本操作依次是:50%甲醇+5%冰乙酸固定20 min;50%甲醇洗脱10 min;500 mL超纯水水洗10 min;0.02%硫代硫酸钠敏化1 min;500 mL超纯水水洗1 min;0.1%硝酸银4 ℃下进行银染20 min;500 mL超纯水水洗两次各1 min;0.04%甲醛+2% Na2CO3进行显色至斑点清晰;5%冰乙酸终止30 min;用30%乙醇+4.6%甘油保存。
1.3.5 凝胶扫描以及图像分析 用mageScanner扫描仪对染色后的凝胶进行扫描,并采用PDquest 8.0软件对所得的图像分析。将处理组和对照组的双向电泳图片进行比较,选取以变化倍数大于5或小于0.2的蛋白点为差异蛋白,进行质谱分析。
1.3.6 蛋白质质谱分析
1.3.6.1 蛋白质酶解 操作步骤依次为:100 μL去离子水清洗胶点两次;吸出去离子水,每管加入酶解脱色液(15 mmol/L K3Fe9(CN)6+50 mmol/L NaS2O3)50 μL待颜色完全脱去后吸出液体,然后加入200 μL去离子水停止反应;吸出去离子水,并用200 μL去离子水清洗胶点两次;加入25 mmol/L NH4HCO3350 μL吸胀5 min后,吸出液体;加50%乙腈100 μL,5 min后吸出液体;加100 %乙腈100 μL脱水,至胶块完全变白即可,吸出液体;取离心管每管加入2~4 μL酶液(用含10% 乙腈+25 mmol/L NH4HCO3+1 g/L溶于50 mmol/L乙酸中的胰蛋白酶(Promega)溶液配至成终浓度为0.02 μg/μL的酶解工作液),充分吸涨后加20 μL覆盖液(25 mmol/L NH4HCO3+10%乙腈水溶液);37 ℃恒温水浴锅酶解16 h;溶液转移至新离心管中,胶粒采用50 μL萃取液(5%TFA+67%乙腈水溶液)抽提,合并蛋白萃取液和之前的溶液,冷冻干燥,待做质谱。

表1 酿酒酵母蛋白点的等电点与分子量分布Table 1 Isoelectric point and molecular weight distribution of Saccharomyces cerevisiae protein spots
1.3.6.2 质谱鉴定 将干粉重新溶解于5 μL含0.1% TFA的溶液中,然后按照1∶1的比例与含50% ACN和1% TFA的α-氰基-4-羟基肉桂酸饱和溶液混合;取1 μL样品进行质谱点靶鉴定;采用正离子模式和自动获取数据的模式进行数据采集;将一级和二级质谱数据整合并使用GPS 3.6(Applied Biosystems)和Mascot2.3(Matrix Science)软件对质谱数据进行分析和蛋白鉴定;并在NCBInr-Fungi 数据库中检索。
2 结果与分析
2.1 酿酒酵母蛋白质的2-DE分析
图1所示为酿酒酵母处理前后细胞蛋白质的2-DE图谱,水平方向为第一向固相pH梯度等电聚焦(IEF),垂直向为第二向垂直板SDS-PAGE电泳。其中未处理样品中共得到926个蛋白点,PEF处理样品得到851个蛋白点。
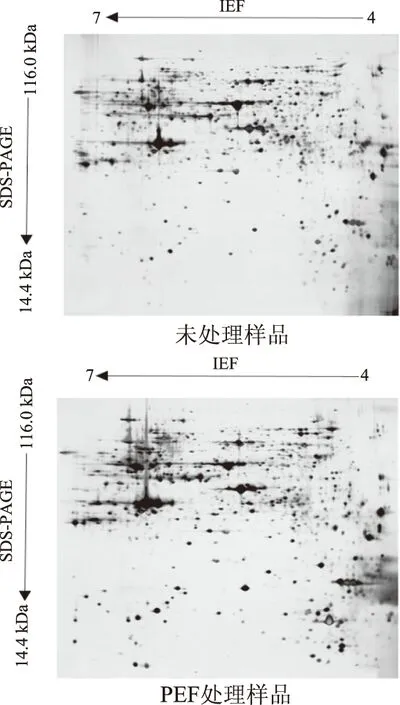
图1 不同条件下酿酒酵母蛋白双向电泳图Fig.1 2-DE of Saccharomyces cerevisiae under different condition
由图1可知,未处理和PEF处理(20 kV/cm、200 μs)样品中酿酒酵母蛋白质的等电点均分布在4.00~6.87之间。从分子量分布上来看,所检测出的酵母蛋白分子量分布在14.58~109.83 kDa之间,分子量分布在处理后不同分子量范围内的样品的蛋白点数比未处理样品均有所减少。具体等电点和分子量分布如表1。
将未处理样品和PEF处理样品的2-DE图进行匹配,寻找差异点,匹配结果如图2所示。
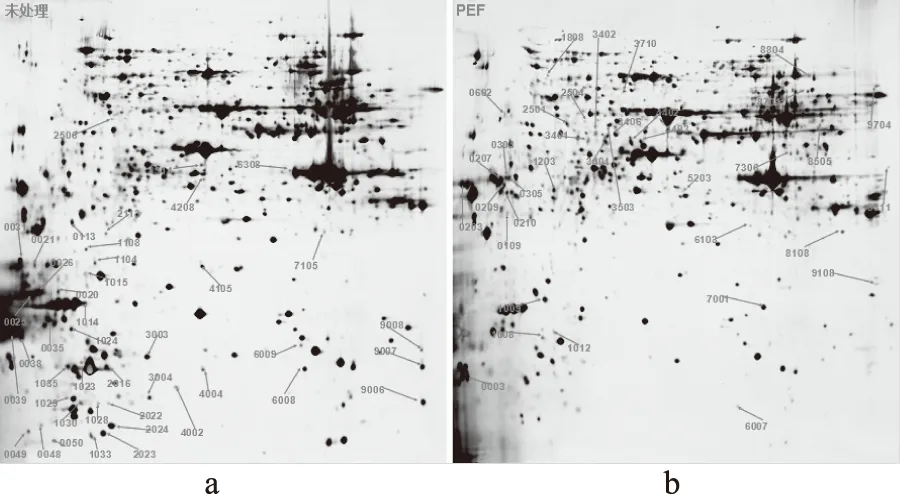
图2 酿酒酵母蛋白点匹配结果Fig.2 Protein spots matching in Saccharomyces cerevisiae
图2a为未处理样品,图2b为处理样品;由于高强度电场处理,酿酒酵母细胞受到不同程度的影响,细胞内蛋白质的表达发生了不同程度的变化。以未处理样品为对照组选取差异倍数大于5(表达明显上调)和小于0.2(表达明显下调)的蛋白点。结果得到明显下调的蛋白点42个,明显上调的蛋白点35个。剩余90.95%的蛋白点未发生明显变化。通过结果可以得出,经过PEF处理,酿酒酵母蛋白的表达变化显著(p<0.05),但蛋白质的等电点和分子量分布没有发生较大变化。
2.2 PEF处理前后酿酒酵母差异蛋白的分析与鉴定
对表达差异显著的酿酒酵母蛋白,利用PDquest分析软件分析,从中选取35个差异蛋白点进行质谱和功能鉴定。用胰蛋白酶酶解选取的35种蛋白点,对水解后的多肽片段进行质谱鉴定,在NCBInr-Fungi数据库中检索,得到35个蛋白点的鉴定信息,如表2所示。

表2 酿酒酵母差异蛋白点鉴定结果Table 2 Identification of differentially expressed proteins in Saccharomyces cerevisiae
在UniProt数据库中搜索上述35个蛋白点功能信息,结果如下:
蛋白点1为原肌球蛋白(Tpm2p),原肌球蛋白在肌肉收缩过程中起着重要作用,影响并调控肌动球蛋白之间相互作用[7]。在酿酒酵母细胞中主要构成细胞形态并与细胞器分布有关[8-9]。
蛋白点2为翻译机制相关蛋白17(Translation machinery-associated protein 17)。是一种ATP酶伴侣,协助RPT6-TPT3 ATP酶对形成。用于维持稳态的蛋白酶体水平并在组装蛋白酶时起到关键作用,如蛋白酶的伸缩和RPN14功能的重叠。
蛋白点3、5为Egd2p。主要存在于细胞质中,参与蛋白质的转运[10]。
蛋白点4为驱动蛋白相关蛋白SMY1(Kinesin-related protein SMY1),此种蛋白质可能与细胞微管运动有关,可代替肌球蛋白2(myo2)[11-14]。
蛋白点6、7、8为硫氧还蛋白过氧化物酶(Tsa1p),该种蛋白质与核糖体结合,维持细胞氧化还原稳态,保持细胞对氧化应激的反应,分子伴侣介导的蛋白质折叠,DNA损伤检验和DNA保护等有关[15-16]。
蛋白点9为Sba1p,能够结合DNA进行调控,与端粒酶对端粒维持的正向调节活动,端粒酶活性调控和蛋白质的折叠有关[17-18]。
蛋白点10、13为热应激蛋白(Hsp12p)。作用可能是对周围环境作出应激反应[19-22]。
蛋白点11、14、25为磷酸丙酮酸水合酶(phosphopyruvate hydratase ENO2),主要和2-磷酸甘油酸磷酸烯醇式丙酮酸与水的缩合反应,参与糖酵解合成D-甘油醛3-磷酸丙酮酸[23]。
蛋白点12为高迁移率族非组蛋白核染色质蛋白(High-mobility group non-histone chromatin protein)。其作用可能与INO80染色质相互作用参与转录调控[24-26]。
蛋白点15、16为Hmf1p,可能与异亮氨酸合成相关[27-28]。
蛋白点17、28、32为磷酸甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase),这种蛋白质是参与糖酵解的关键酶,对甘油醛-3-丙酮酸合成起到关键作用[29]。
蛋白点18为延长因子2(Eft2p),与GTP结合,调节GTP酶活性。
蛋白点19为DNA修复蛋白RAD10(DNA repair protein RAD10),该种蛋白可以切除受紫外线等不良环境下异常的DNA,特异性的降解单链DNA[30-33]。
蛋白点20为热休克蛋白70(Heat shock protein of HSP70 family)。该蛋白可以和与代谢相关的酶类结合,保护自己不受外界高温环境对自身的伤害[34]。
蛋白点21为胱硫醚β-合酶(cystathionine beta-synthase),该酶是细胞内同型半胱氨酸转硫途径代谢的关键酶。
蛋白点22为含Cu-Zn辅基超过氧化物歧化酶A亚基(Chain A,structure solution and molecular dynamics refinement of the yeast Cu,Zn enzyme superoxide dismutase),该酶能够清除细胞内的自由基[35]。
蛋白点23为类浆膜蛋白(Reticulon-like protein 1):该种蛋白主要存在于酿酒酵母内质网中,对内质网的正常运作起到调节稳定作用[36]。
蛋白点24为应激蛋白70(stress-seventy subfamily A protein),该蛋白与ATP结合,维持能量代谢。
蛋白点26为二氢乳清酸脱氢酶(dihydroorotate dehydrogenase),该酶以延胡索酸为电子受体将二氢乳清酸转化为乳清酸盐[37]。
蛋白点27、31、33为未命名蛋白。
蛋白点29、30为腺苷5,-单磷酰胺酶,可以水解腺苷5,-单磷酰胺酯类物质。酿酒酵母在半乳糖培养基上生长,该酶起到重要作用。
蛋白点34为ETF1p,该蛋白作为电子传递的载体,与黄素腺嘌呤二核苷酸结合。
蛋白点35为非典型蛋白Ynr034w-A亚基,该酶参与细胞代谢[38-39]。
经过PEF处理后,酿酒酵母中硫氧还蛋白过氧化物酶表达明显上调,该酶与细胞的自我防御密切相关,说明PEF处理过程中酿酒酵母细胞为免受环境变化造成的损伤而启动代谢调控来防止氧化损伤。延长因子2在蛋白质合成过程中起到重要作用,其表达上调,说明经PEF处理,酿酒酵母细胞需要合成更多的蛋白质以适应外界环境变化,推断可能是一些酶类或膜蛋白等。核染色质蛋白和DNA修复蛋白表达的上调,说明细胞遗传物质在PEF处理过程中也受到了外界电场的影响,推测这有可能会有助于DNA的合成、复制及功能。PEF处理后,细胞Cu-Zn辅基超过氧化物歧化酶表达下调,该酶在生物体内的水平高低是衰老与死亡的直观指标,且与糖原的合成与代谢密切相关的磷酸丙酮酸水合酶表达也发生下调,说明经过PEF处理,酿酒酵母细胞活力下降或死亡。此外,表达发生明显变化的还包括一些与细胞生存和增殖相关蛋白,如胱硫醚β-合酶、腺苷5,-单磷酰胺酶、非典型蛋白Ynr034w-A亚基等。
3 结论
哈密瓜汁中酿酒酵母经过PEF处理,细胞内代谢相关的关键蛋白受到较大影响。细胞需要调控自身蛋白的合成来应对外界恶劣环境的变化,如延长因子2、硫氧还蛋白过氧化物酶、核染色质蛋白和DNA修复蛋白表达上调;与细胞活性相关的蛋白,如Cu-Zn辅基超过氧化物歧化酶和磷酸丙酮酸水合酶表达下调;此外,酿酒酵母细胞蛋白质表达发生明显变化的还包括一些与细胞生存和增殖相关蛋白,如胱硫醚β-合酶、腺苷5,-单磷酰胺酶、非典型蛋白Ynr034w-A亚基等。目前高压脉冲电场强化杀菌方法效果较好的有温和热协同和添加天然抑菌物质的协同[40-41]。此外,我们还可以从这些酵母菌细胞发生显著变化的蛋白质入手,寻求PEF强化杀菌的方法来达到较好的灭菌效果。从而有效延长货架期,在果汁加工行业具有重大潜力。
[1]冯叙桥,王月华,徐方旭. 高压脉冲电场技术在食品质量与安全中的应用进展[J]. 食品与生物技术学报,2013(4):337-346.
[2]曾新安,陈勇.脉冲电场非热灭菌技术[M].北京:中国轻工业出版社,2005:149-165.
[3]刘铮,杨瑞金,赵伟. 高压脉冲电场破壁法提取废啤酒酵母中的蛋白质与核酸[J]. 食品工业科技,2007(3):85-88.
[4]尹琳琳,宋丽军,姜海荣,等. 超高压处理对哈密瓜汁品质的影响[J]. 食品科技,2009(12):56-59.
[5]M M Bradford. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254.
[6]B Drees,C Brown,B G Barrell,et al. Tropomyosin is essential in yeast,yet the TPM1 and TPM2 products perform distinct functions[J]. The Journal of Cell Biology,1995,128(3):383-392.
[7]杨静娴. 原肌球蛋白的分子生物学研究进展[J]. 大连医科大学学报,2004(2):144-147.
[8]Drees B,Brown C,Barrell B G,et al. Tropomyosin is essential in yeast,yet the TPM1 and TPM2 products perform distinct functions[J]. The Journal of Cell Biology,1995,1283:383-392.
[9]Huckaba Thomas M,Lipkin Thomas,Pon Liza A. Roles of type II myosin and a tropomyosin isoform in retrograde actin flow in budding yeast[J]. The Journal of Cell Biology,2006,1756:957-969.
[10]Shi X,Parthun M R,Jaehning J A. The yeast EGD2 gene encodes a homologue of the alpha NAC subunit of the human nascent-polypeptide-associated complex[J]. Gene,1995,1652:199-202.
[11]Lillie S H,Brown S S. Smy1p,a kinesin-related protein that does not require microtubules[J]. The Journal of Cell Biology,1998,1404:873-883.
[12]Lwin Kyaw Myo,Li Donghao,Bretscher Anthony. Kinesin-related Smy1 enhances the Rab-dependent association of myosin-V with secretory cargo[J]. Molecular Biology of The Cell,2016,2715:2450-2462.
[13]Lillie S H,Brown S S. Immunofluorescence localization of the unconventional myosin,Myo2p,and the putative kinesin-related protein,Smy1p,to the same regions of polarized growth in Saccharomyces cerevisiae[J]. The Journal of Cell Biology,1994,1254:825-842.
[14]Lillie S H,Brown S S. Smy1p,a kinesin-related protein that does not require microtubules[J]. The Journal of cell biology,1998,1404:873-883.
[15]Wong Chi-Ming,Zhou Yuan,Ng Raymond W M,et al. Cooperation of yeast peroxiredoxins Tsa1p and Tsa2p in the cellular defense against oxidative and nitrosative stress[J]. Journal of Biological Chemistry,2001,2777:5385-5394.
[16]Lim Jung Chae,Choi Hoon-In,Park Yu Sun,et al. Irreversible oxidation of the active-site cysteine of peroxiredoxin to cysteine sulfonic acid for enhanced molecular chaperone activity[J]. Journal of Biological Chemistry,2008,28343:28873-28880.
[17]Fedor Forafonov,Oyetunji A Toogun,et al. Tp23/Sba1p Protects against Hsp90 inhibitors independently of its intrinsic chaperone activity[J]. Molecular and Cellular Biology,2008,28(10):3446-3456.
[18]Shamrock Vanessa J,Duval Jérme F L,Lindsey George G,et al. The role of the heat shock protein Hsp12p in the dynamic response ofSaccharomycescerevisiaeto the addition of Congo red[J]. FEMS Yeast Research,2009,93:391-399.
[19]MS Fu,SL De,FA Mühlschlegel. Functional characterization of the small heat shock protein Hsp12p from Candida albicans[J]. PLoS One,2012,7(8):e42894.
[20]Karreman Robert J,Dague Etienne,Gaboriaud Fabien,et al. The stress response protein Hsp12p increases the flexibility of the yeast Saccharomyces cerevisiae cell wall[J]. Biochimica et Biophysica Acta,2006,17741:131-137.
[21]Witt I,Witz D. Purification and characterization of phosphopyruvate hydratase in erythrocytes of newborn and adults[J]. Hoppe-Seyler’s Zeitschrift für physiologische Chemie,1970,35110:1232-1240.
[22]Goodwin G H,Shooter K V,Johns E W. Interaction of a non-histone chromatin protein(high-mobility group protein with DNA)[J]. European Journal of Biochemistry,1975,542:427-433.
[23]Limas C J. Enhanced myocardial RNA synthesis in spontaneously hypertensive rats possible role of high-mobility group non-histone proteins[J]. Biochimica et Biophysica Acta,1982,6961:37-43.
[24]Mathew C G,Goodwin G H,Gooderham K,et al. A comparison of the high mobility group non-histone chromatin protein HMG 2 in chicken thymus and erythrocytes[J]. Biochemical and Biophysical Research Communications,1979,874:1243-1251.
[25]Pozdniakovaite Natalija,Popendikyte Violeta. Identification of differentially expressed genes in yeastSaccharomycescerevisiaecells with inactivated Mmf1p and Hmf1p,members of proteins family YERO57c/YJGF[J]. Development,Growth and Differentiation,2004,466:545-554.
[26]Rosita Accardi,Ellinor Oxelmark,Nicolas Jauniaux,et al. High levels of the mitochondrial large ribosomal subunit protein 40 prevent loss of mitochondrial DNA in null mmf1Saccharomycescerevisiaecells[J]. Yeast,2004,217:539-548.
[27]Claude Durrieu,Françoise Bernier-Valentin,Bernard Rousset. Binding of glyceraldehyde 3-phosphate dehydrogenase to microtubules[J]. Molecular and Cellular Biochemistry,1987,741:55-65.
[28]Bardwell L,Cooper A J,Friedberg E C. Stable and specific association between the yeast recombination and DNA repair proteins RAD1 and RAD10invitro[J]. Molecular and Cellular Biology,1992,127:860-862.
[29]Tomkinson A E,Bardwell A J,Bardwell L,et al. Yeast DNA repair and recombination proteins Rad1 and Rad10 constitute a single-stranded-DNA endonuclease[J]. Nature,1993,3626423:860-862.
[30]Bardwell A J,Bardwell L,Johnson D K,et al. Yeast DNA recombination and repair proteins Rad1 and Rad10 constitute a complexinvivomediated by localized hydrophobic domains[J]. Molecular Microbiology,1993,86:1177-1188.
[31]Sung P,Prakash L,Prakash S. Renaturation of DNA catalysed by yeast DNA repair and recombination protein RAD10[J]. Nature,1992,3556362:743-745.
[32]Rafaela M M Paim,Ricardo N Araujo,Miguel Leis,et al. Functional evaluation of Heat Shock Proteins 70(HSP70/HSC70)on Rhodnius prolixus(Hemiptera,Reduviidae)physiological responses associated with feeding and starvation[J]. Insect Biochemistry and Molecular Biology,2016,77:10-20.
[34]Nziengui Hugues,Bouhidel Karim,Pillon David,et al. Reticulon-like proteins in Arabidopsis thaliana:structural organization and ER localization[J]. FEBS Letters,2007,58118:3356-3362.
[35]Williamson R A,Yea C M,Robson P A,et al. Dihydroorotate dehydrogenase is a high affinity binding protein for A77 1726 and mediator of a range of biological effects of the immunomodulatory compound.[J]. The Journal of Biological Chemistry,1995,27038:22467-22472.
[36]Fu-Ping Wen,Yue-Shuai Guo,Yang Hu,et al. Distinct temporal requirements for autophagy and the proteasome in yeast meiosis[J]. Autophagy,2016,124:671-688.
[37]Murphy J Patrick,Stepanova Ekaterina,Everley Robert A,et al. Comprehensive temporal protein dynamics during the diauxicshift in saccharomyces cerevisiae[J]. Molecular & amp Cellular Proteomics,2015,149:2454-2465.
[38]Shen S,M atsubae M,Takao T,et al. A proteomic analysis of leaf sheaths from rice[J]. The Journal of Biochemistry,2002,132(4):613-620.
[39]Tanaka N,Konishi H,Khan M M,et al. Proteome analysis of rice tissues by twodimensional electrophoresis:An approach to the investigation of gibberellin regulated proteins[J]. Mol Gen Genom,2004,270(6):485-496.
[40]赵伟,杨瑞金,张文斌,等. 高压脉冲电场与温和热对液态蛋协同杀菌动力学和工艺研究[J]. 中国农学通报,2010(16):48-52.
[41]崔晓美,杨瑞金,赵伟,等. 高压脉冲电场对石榴汁杀菌的研究[J]. 农业工程学报,2007(3):252-256.
Study on proteomics ofSaccharomycescerevisiaetreated by pulsed electric field in Ha-mi melon juice using two dimensional electrophoresis technology
TIAN Yi-xiong1,ZHAO Wei1,*,CHEN Xiao-chan2,YANG Rui-jin2
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
:2-dimensional gel electrophoresis(2-DE)technology was used to detect and analyze the protein ofSaccharomycescerevisiaein Ha-mi melon juice before and after PEF treatment. On the basis of the experiment results,the isoelectric point of protein spots was between 4.00 and 6.87,the molecular weight of protein spots was 14.58~109.83 kDa. The expression of proteins was up regulated in order to avoid the damage result in environment change,such as thioredoxin peroxidase and elongation factor 2. Additionally,because of field strength,genetic materials were affected,so the expression of nuclear chromatin protein and DNA repair protein was up regulated. The proteins like Cu-Zn cofactor superoxide dismutase and pyruvate phosphatese were down expressed. It revealed that cells viability decreased or cells were dead. The expression of cell survival and proliferation related proteins also changed significantly such as cystathionineβ-synthase,adenosine 5- single phosphate amide,atypical protein Ynr034w-A subunit and so on. The treatment of PEF affected the enzyme relevant to metabolize and genetic material in cells. It can provide the theoretical basis for the study of intensified sterilization of PEF.
pulsed electric field(PEF);non thermal processing technology;2-dimensional gel electrophoresis(2-DE);Saccharomycescerevisiaeprotein
2016-12-02
田一雄(1992-),男,硕士研究生,研究方向:食品加工与配料,E-mail:372767129@qq.com。
*通讯作者:赵伟(1982-),男,博士,教授,研究方向:食品加工与配料,E-mail:zhaow@jiangnan.edu.cn。
国家重点研发计划项目(2016YFD0400300);国家自然基金科学基金项目:(31522044);教育部新世纪优秀人才支持计划(NCET-13-0834);中央高校基本科研业务费专项资金项目(JUSRP51406A)。
TS201.3
A
1002-0306(2017)11-0128-06
10.13386/j.issn1002-0306.2017.11.016
