电刺激对宰后牦牛肉成熟过程中肌钙蛋白-T和肌间线蛋白及嫩度的影响
2017-06-23王玉涛郭丽君张秀英任小娜孙宝忠余群力
王 莉,王玉涛,郭丽君,张秀英,任小娜,张 丽,夏 娜,魏 健,孙宝忠,余群力
(1.喀什大学生命与地理科学学院/叶尔羌绿洲生态与生物资源研究高校重点实验室,新疆喀什 844000;2.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;3.中国农业科学院北京畜牧兽医研究所,北京 100193)
电刺激对宰后牦牛肉成熟过程中肌钙蛋白-T和肌间线蛋白及嫩度的影响
王 莉1,王玉涛1,郭丽君1,张秀英1,任小娜1,张 丽2,*,夏 娜1,魏 健1,孙宝忠3,余群力2
(1.喀什大学生命与地理科学学院/叶尔羌绿洲生态与生物资源研究高校重点实验室,新疆喀什 844000;2.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;3.中国农业科学院北京畜牧兽医研究所,北京 100193)
为研究电刺激对宰后牦牛肉成熟过程中Troponin-T和Desmin降解及嫩度的影响,本实验利用聚丙烯酰胺凝胶电泳(SDS-PAGE)、剪切力法及肌原纤维小片化指数法分别对比测定并动态监测宰后不同处理(电刺激、未电刺激)对牦牛的冈上肌、背阔肌和半腱肌3个部位肉在成熟0,1,2,3,5,7,14 d时Troponin-T、Desmin、剪切力及MFI影响的变化特点。结果表明:电刺激组牦牛三个部位肉Troponin-T和Desmin的降解速度和降解程度均较高,且两个处理组背阔肌Troponin-T 28 kDa、Desmin 38 kDa和36 kDa特征降解产物出现的时间较其他两个部位均早,降解程度也较高;成熟14 d后,电刺激组牦牛冈上肌、背阔肌和半腱肌的剪切力值下降百分率较未电刺激组分别显著高2.93%、9.47%、5.08%(p<0.05),但电刺激对MFI值无显著影响。由此可见,电刺激处理能显著加快宰后牦牛肉肌原纤维骨架蛋白Troponin-T和Desmin的降解程度及剪切力的下降速度,且背阔肌的宰后嫩化较其他两个部位快。
电刺激,牦牛,肌钙蛋白-T,肌间线蛋白,嫩度
牦牛(yak)是中国青藏高原特有的畜种,存栏量居世界第一。牦牛肉肉质鲜美,营养丰富,是天然优质的绿色食品,具有巨大的商业开发潜力[1-2],但是牦牛肉嫩度较差[3]。目前普遍认为宰后成熟能有效改善牛肉的嫩度,而成熟过程中肌原纤维骨架蛋白的降解被认为是嫩度改善的一个很重要的因素。肌钙蛋白-T(Troponin-T)和肌间线(Desmin)是两种重要的肌原纤维骨架蛋白,Troponin-T在肌肉成熟过程中能够降解生成28~30 kDa的特征降解产物,该产物随着成熟时间的延长逐渐增加,且这些降解产物可在一定程度上作为肉嫩度改善的标志因子[4-5]。Desmin连接于Z线之间,在稳定肌纤维的横向结构中起着非常重要的作用。Desmin的降解意味着肌节间横向连接的消失,肌纤维结构松散,改善嫩度[6-8]。但目前还未见有关牦牛宰后成熟过程中肌肉Troponin-T和Desmin降解及嫩度的变化特点的研究,因此,研究宰后牦牛肉成熟过程中Troponin-T和Desmin的降解及嫩度的变化特点,对提高牦牛肉品质及增值具有重要的实际意义。
电刺激可以加快牛肉的死后嫩化过程,减少肉的成熟时间,是一种肉类的快速成熟技术[9],Gursansk等[10]研究发现,电刺激能显著改善牛肉嫩度,且不受牛品种差异的影响。同时有研究报道电刺激可通过加快糖酵解速度和降低pH来防止冷收缩,破坏肌纤维结构,从而改善肉的嫩度[11-14]。White等[15]指出,电刺激不仅可破坏肌肉肌原纤维骨架的结构,而且会溶解Z线,加速了肉类成熟过程。Luo[16]等发现,电刺激提高了肌肉肌原纤维小片化的程度,促进了肌纤维的断裂,加速了肉的嫩化。但目前有关电刺激对宰后牦牛肉成熟过程中Troponin-T和Desmin及嫩度的影响还未见报道。
因此,本实验主要对宰后不同处理(电刺激、未电刺激)对牦牛的冈上肌(Supraspinatus,SU)、背阔肌(Latissimus dorsi,LD)和半腱肌(Semitendinosus,ST)3个部位肉在成熟0,1,2,3,5,7,14 d时Troponin-T和Desmin及其剪切力,肌原纤维小片化指数(myofibrillar fragmentation index,MFI)进行测定分析,比较不同处理组牦牛肉宰后成熟过程中Troponin-T和Desmin及嫩度的差异及变化特点,旨在探索电刺激对宰后牦牛肉嫩度的影响机制,以期为牦牛肉的品质改善提供参考。
1 材料与方法
1.1 材料与仪器
选取甘肃甘南藏族自治州同一牧场的12头健康无病公牦牛,(36±6)月龄,(300±50) kg体重。
KCl 天津光复科技发展有限公司;MgCl2天津市凯通化学试剂有限公司;NaN3天津市凯信化学工业有限公司;K2HPO4、KH2PO4、EDTA、DTT、Na4P2O4、丙烯酰胺、甲叉双丙烯酰胺、Tris-maleate、Tris-HCI、十二烷基磺酸钠(SDS)、丙三醇、β-巯基乙醇、溴酚蓝、TEMED、APS、甘氨酸、考马斯亮蓝R-250、甲醇、宽分子量标准蛋白Marker、冰乙酸,均购自sigma公司,以上试剂均为分析纯。
超低温冰箱 海尔BCD-216SDCM;DM6801A型热电耦测温仪 优利德科技有限公司;TA.XTPlus型质构分析仪 杭州嘉维创新科技有限公司;XHF-D型高速分散器 宁波新芝生物科技股份有限公司;TGL-16M高速台式冷冻离心机 长沙湘仪有限公司;150目滤布 浙江上虞道墟张兴纱筛厂;PHS-3C型pH计 上海仪电科学仪器股份有限公司;XH-B型涡旋混合器 江苏康健医疗用品有限公司;DYY-6C型电泳仪 北京市六一仪器厂;UVP凝胶成像系统 上海苑胜仪器设备有限公司。
1.2 实验设计
12头牦牛分成2组,电刺激组和未电刺激组各6头。每组牦牛屠宰前24 h禁食,12 h禁水。电刺激组牦牛经宰杀、放血后进行电刺激处理(输出电压21 V,额定功率50 W,时间90 s),再去头蹄内脏、剥皮、劈半。未电刺激组牦牛宰杀、放血后未经电刺激处理,直接去头蹄内脏、剥皮、劈半。电刺激组和未电刺激组每头牦牛劈半后,分别在其左、右半胴体现场采集冈上肌、背阔肌和半腱肌3个部位肉。首先从每个部位肉上取0 h的样品,用于测定剪切力的样品用自封袋封装后-20 ℃冷冻保存,用于分析Troponin-T和Desmin降解和肌原纤维小片化指数的样品置于液氮中保存,剩余样品真空包装后置于0~4 ℃、风速0.5 m/s环境下,分别在第1,2,3,5,7、14 d时取样,对成熟过程中的Troponin-T和Desmin及剪切力和肌原纤维小片化指数进行测定分析。
1.3 实验方法
1.3.1 Troponin-T和Desmin的降解 参考Etlinger等[17]的方法,称取约0.5 g去除结缔组织的肉样,剪碎后,按1∶8(m/v)比例加入预冷后的PRB提取液(0.1 mol/L KCl,0.002 mol/L MgCl2,0.002 mol/L EDTA,0.001 mol/L DTT,0.001 mol/L NaN3,0.002 mol/L Na4P2O4,0.01 mol/L Tris-maleate,pH6.8)。使用高速分散器,低温下14000 r/min匀浆30 s,每15 s间隔20 s,匀浆后以1000×g低温离心10 min,取沉淀。然后重复此步骤6次,前4次PRB缓冲液用低盐缓冲液(LSB:除不含Na4P2O4外,其余和PRB相同)代替。后2次用Tris缓冲液(0.005 mol/L Tris-HCI,pH8.0)代替,用涡旋器分散沉淀。最后得到的沉淀采用双缩尿法测定蛋白浓度。然后蛋白样品与样品处理液(3 mmol/L EDTA,3% SDS,20% 甘油,8%β-疏基乙醇,0.04% 溴酚蓝,0.03 mol/L Tris-HC1,pH8.0)按1∶1(v/v)比例混合,使蛋白浓度最终为3.5 mg/mL。混匀后,在100 ℃水锅中加热5 min。变性聚丙烯酰胺凝胶电泳采用12%的分离胶(丙烯酰胺∶甲叉双丙烯酰胺=37.5∶1(w/w),0.5 mol/L Tris-HCl pH8.8,0.05%的TEMED(w/v),0.05%的APS(w/v),0.1%的SDS(w/v)),4% 浓缩胶(丙烯酰胺∶甲叉双丙烯酞胺=37.5∶1(w/w),0.125 mol/L Tris-HCl pH6.8,0.05% 的TEMED(w/v),0.05% APS(w/v),0.1%的SDS(w/v))。电极缓冲液含有0.025 mol/L Tris,0.192 mol/L甘氨酸和0.1% SDS(w/v)。上样量为:30 μL。电泳结束后,使用Blue-silver染色方法进行染色,然后用脱色液进行脱色。
1.3.2 剪切力 参考罗欣[18]等的方法,取6 cm×3 cm×3 cm肉样,剔除表面的筋、腱、膜及脂肪,放入80 ℃恒温水浴锅中加热,用热电耦测温仪测定肉样中心温度,待肉样中心温度达到70 ℃时,取出冷却至中心温度为0~4 ℃。沿肌纤维方向用直径为1.27 cm的空心取样器取肉柱(避开筋键),用质构分析仪测定肉柱的剪切力值,重复12次,取平均值。
1.3.3 肌原纤维小片化指数 参考Karumendu[19]等的方法,称取4.0 g充分剪切后除去脂肪及结缔组织的肉样,加40 mL预冷(2 ℃)的MFI缓冲液(0.1 mol/L KCl,0.01 mol/L K2HPO4,0.008 mol/L KH2PO4,0.001 mol/L EGTA,0.001 mol/L MgCl2,0.001 mol/L NaN3)高速匀浆3次,每次20s,间隔l min;匀浆后冷冻离心(1000×g,15 min,2 ℃),弃上清,将沉淀用40 mL预冷后的MFI缓冲液悬浮,再离心(1000×g,15 min,2 ℃),弃上清,用10 mL预冷后的MFI缓冲液将沉淀充分悬浮,将悬浮液用150 目滤布过滤除去结缔组织,再用10 mL MFI缓冲液洗离心管,并进行过滤,将过滤后的悬浮液用双缩脲法测蛋白浓度,然后用MFI缓冲液调整悬浮液蛋白浓度为0.5 mg/mL,在540 nm测吸光度,将所得结果乘200后便得到MFI值。
1.4 数据分析
用Excel 2007绘制各指标的折线图,用SPSS 19.0统计分析软件在显著水平为0.05的条件下对各指标进行显著性分析。
2 结果与分析
2.1 电刺激对宰后牦牛肉成熟过程中Troponin-T和Desmin降解的影响
Troponin-T是一种分子量约35 kDa的重要调节蛋白,该蛋白降解成分子量为28~30 kDa小分子,大量实验表明这种降解产物和肉的嫩度高度相关[4]。Desmin是一种重要的细胞骨架蛋白,其亚基的分子量约53 kDa,在稳定肌纤维的横向结构中起着非常重要的作用,可降解产生45、38、36 kDa的特征降解产物,该蛋白的降解对于嫩度的改善具有重要的意义[7]。电刺激组和未电刺激组Troponin-T和Desmin SDS-PAGE结果分别如图1和图2所示。

图1 电刺激组牦牛肉熟过程中Troponin-T和Desmin的变化Fig.1 Changes of Troponin-T and Desmin of Electrical stimulation group during yak meat ageing注:“A、B、C”分别表示电刺激组牦牛冈上肌、背阔肌和半腱肌。

图2 未电刺激组牦牛肉成熟过程中Troponin-T和Desmin的变化Fig.2 Changes of Troponin-T and Desmin of No Electrical stimulation group during yak meat ageing注:“a、b、c”分别表示未电刺激组牦牛冈上肌、背阔肌和半腱肌。
由图1可看出,电刺激组三个部位肉在宰后0 h时,Troponin-T和Desmin均以单条带出现,没有降解产物。在成熟1 d时,背阔肌不仅出现了Troponin-T的30 kDa的特征降解产物,同时也有微弱的28 kDa降解产物出现,而冈上肌和半腱肌仅出了Troponin-T的30 kDa的特征降解产物,没能检测到28 kDa降解产物;此时三个部位的Desmin均有微弱的降解,出现了45 kDa的降解产物。成熟3 d时,三个部位肉中均产生Troponin-T 30 kDa和28 kDa的降解产物,但冈上肌的降解度远低于背阔肌和半腱肌;同时三个部位的Desmin随成熟时间的延长,进一步降解,降解产物除45 kDa之外,又生成了分子量分别为38 kDa和36 kDa的降解产物,但背阔肌的特征产物的降解度远高于冈上肌和半腱肌。成熟5 d及其以后,三个部位肉中Troponin-T 30 kDa和28 kDa的条带降解逐步增加,但冈上肌中的降解度仍远小于其他两个部位;Desmin 45、38、6 kDa的降解程度也逐渐增加,但背阔肌的条带降解程度仍远高于其他两个部位。
由图2可知,未电刺激组三个部位肉在宰后0 h时,Troponin-T和Desmin均以单条带出现,没有降解产物。背阔肌和半腱肌在成熟2 d时,出现了Troponin-T的30 kDa的特征降解产物,而冈上肌直到第3 d才出现微弱的30 kDa的特征降解产物;背阔肌在宰后第2 d时产生了45 kDa的Desmin特征降解产物,而冈上肌和和半腱肌在第3 d出现微弱的45 kDa的特征降解产物。成熟3 d时,背阔肌和半腱肌均产生Troponin-T 30 kDa和28 kDa的降解产物,冈上肌在成熟5 d时才产生Troponin-T 30 kDa和28 kDa的降解产物;背阔肌在成熟3 d时,Desmin降解产物除45 kDa之外,又生成了38 kDa和36 kDa的降解产物,冈上肌和半腱肌在宰后5 d才产生38 kDa和36 kDa的降解产物,且条带的降解程度随成熟时间的延长逐渐增加。
2.2 电刺激对宰后牦牛肉成熟过程中剪切力的影响
剪切力是判断肉嫩度好坏的重要参考依据。电刺激组和未电刺激组剪切力值测定结果分别如图3~图5所示。

图3 冈上肌成熟过程中剪切力值变化Fig.3 Changes of shear force values during supraspinatus ageing注:大写字母表示电刺激组成熟过程中的差异显著性(p<0.05),小写字母表示未电刺激组成熟过程中的差异显著性(p<0.05);“*”表示组间差异显著(p<0.05),“**”表示组间差异极显著(p<0.01),图4~图8同。
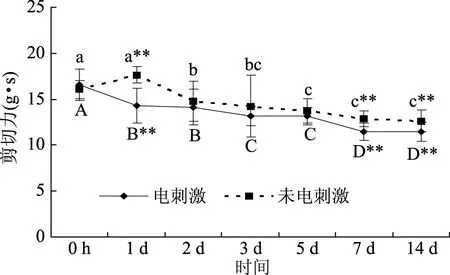
图4 背阔肌成熟过程中剪切力值变化Fig.4 Changes of shear force values during latissimus dorsi ageing

图5 半腱肌成熟过程中剪切力值变化Fig.5 Changes of shear force values during semitendinosus ageing
由图3可知,随着成熟时间的延长,电刺激组和未电刺激组牦牛冈上肌剪切力值均呈现逐渐下降趋势,相比0 h,电刺激组冈上肌成熟14 d的剪切力值显著下降了28.81%(p<0.05),未电刺激组显著下降了25.88%(p<0.05)。除第2 d外,电刺激组冈上肌的剪切力值均显著(p<0.05)或极显著(p<0.01)低于未电刺激组。电刺激组冈上肌除第1 d和2 d、5 d和7 d差异不显著外(p>0.05),其余时间点均存在显著差异(p<0.05)。成熟1 d时,未电刺激组冈上肌的剪切力值最大,为20.13 g.s,第2~5 d、第5和7 d剪切力值差异不显著(p>0.05)。
由图4可看出,电刺激组和未电刺激组牦牛背阔肌剪切力值变化同冈上肌,电刺激组和未电刺激组成熟14 d的剪切力值较0 h分别显著降低了30.92%,21.45%(p<0.05)。电刺激组第1 d、7 d和14 d的剪切力值均极显著低于未电刺激组(p<0.05)。电刺激组第1 d和2 d、3 d和5 d、第7 d和14 d剪切力值差异不显著(p>0.05),未电刺激组第3~14 d的剪切力值无显著差异(p>0.05),在0~14 d成熟过程中剪切力值下降3.45 g.s。
由图5可知,电刺激组和未电刺激组牦牛半腱肌剪切力值变化同前两个部位肉,电刺激组和未电刺激组在0~14 d的成熟过程中剪切力值分别显著下降了29.63%,24.55%(p<0.05),除0 h和14 d外,电刺激组半腱肌剪切力值均极显著低于未电刺激组(p<0.01)。第2~5 d、3~7 d,电刺激组剪切力值差异不显著(p>0.05)。未电刺激组除第2 d和3 d、3 d和5 d差异不显著外(p>0.05),其余时间点间均有显著差异(p<0.05)。
电刺激组牦牛冈上肌、背阔肌和半腱肌的剪切力值下降的百分率较未电刺激组分别高2.93%、9.47%、5.08%。
2.3 电刺激对宰后牦牛肉成熟过程中MFI的影响
MFI值是反映肌细胞内肌原纤维及其骨架蛋白完整程度的指标,MFI值和肉的嫩度显著相关,可作为预测牛肉嫩度的一个重要指标[16],电刺激组和未电刺激组MFI值测定结果分别如图6~图8所示。

图6 冈上肌成熟过程中MFI值变化Fig.6 Changes of MFI values during supraspinatus ageing

图7 背阔肌成熟过程中MFI值变化Fig.7 Changes of MFI values during latissimus dorsi ageing

图8 半腱肌成熟过程中MFI值变化Fig.8 Changes of MFI values during semitendinosus ageing
由图6可看出,随成熟时间的延长,电刺激组和未电刺激组牦牛冈上肌MFI值均逐渐上升,且电刺激组的MFI值均高于未电刺激组,且在整个成熟过程中,电刺激组牦牛冈上肌MFI值显著增加了64.89%,而未电刺激组著增加了64.16%,但电刺激组和未电刺激组牦牛冈上肌在成熟过程中MFI值差异均不显著(p>0.05),说明电刺激对牦牛冈上肌MFI值没有显著影响。
由图7可知,电刺激组和未电刺激组牦牛背阔肌MFI值变化趋势同冈上肌,电刺激组成熟14 d的MFI值较未电刺激组显著增加了26.00%(p<0.05),成熟第3 d和第14 d时,电刺激组背阔肌的MFI值显著(p<0.05)或极显著(p<0.01)高于未电刺激组,其他时间点均无显著差异(p>0.05)。电刺激组背阔肌MFI值除第3 d和5 d差异不显著外(p>0.05),其他时间点均存在显著差异(p<0.05)。未电刺激组第0 h和1 d、第3 d和5 d、第7 d和14 d均无显著差异(p>0.05)。
由图8可看出,电刺激组和未电刺激组牦牛半腱肌MFI值变化趋势同前两个部位肉。电刺激组除第2 d的MFI值极显著高于未电刺激组外(p<0.01),其余时间点均无显著差异(p>0.05)。电刺激组半腱肌除第1 d和2 d、第5 d和7 d差异不显著外(p>0.05),其他时间点均显著差异(p<0.05)。未电刺激组第1 d和2 d、第7 d和14 d差异不显著(p>0.05)。
3 讨论
本研究发现,在成熟过程中,电刺激组牦牛冈上肌、背阔肌和半腱肌Troponin-T和Desmin的降解速度和降解程度均高于未电刺激组,且两组背阔肌Troponin-T 28 kDa、Desmin 38 kDa和36 kDa特征降解产物出现的时间较冈上肌和半腱肌均早1 d,降解程度也较冈上肌和半腱肌高。Ho等[20]使用SDS-PAGE分析表明,电刺激增加了Troponin-T的降解速度,Uytterhaegen等[21]研究认为,电刺激样品中Troponin-T的降解速率较快,且Troponin-T 30 kDa的特征降解产物在电刺激样品中出现较早。Kim等[22]发现,电刺激处理改变了牛背最长肌中pH和温度的关系,进而增加了calpain的活性,促进了Desmin的降解,Li等[23]研究表明,电刺激可明显增加牛肉中Desmin的降解速度和程度,加速Desmin 38 kDa和36 kDa特征降解产物出现的时间。Hwang等[24]发现,电刺激不仅能直接对肌肉细胞膜结构进行物理性的破坏,而且还能使糖原含量在短时间内被大量消耗,导致pH迅速降低,加快Ca2+的释放,将肌肉暴露在高含量的Ca2+状态下,增加u-calpain活性。Chen等[25]研究表明,Troponin-T和Desmin是u-calpain良好的作用底物,这可能是导致电刺激加速Troponin-T和Desmin降解的原因。毛衍伟[26]研究指出,电刺激作用明显加快了Desmin、Troponin-T的降解,且加快了Troponin-T和Desmin的降解产物出现的时间,这亦与本实验的结果相似,本实验中可能是由于电刺激使宰后牦牛肉的糖原含量快速消耗,导致pH迅速降低,加快Ca2+的释放,将肌肉暴露在高含量的Ca2+状态下,增加u-calpain活性,而Troponin-T和Desmin恰好是u-calpain的良好底物,所以电刺激组Troponin-T和Desmin的降解速度和降解程度均高于未电刺激组。本课题组在研究牦肌肉组织学特性时发现,牦牛冈上肌、背阔肌和半腱肌的肌肉组织学特性有显著差异[27],这可能是造成三个部位肉之间Troponin-T和Desmin的降解程度不一的原因之一。
本研究发现,电刺激可明显加速宰后牦牛肉成熟过程中剪切力值的下降,加速牦牛肉的嫩化过程。Gursansk等[28]发现,电刺激对牛肉嫩化有明显的效果。Devine[29]指出,对未电刺激的肉,高温僵直不能使样品在成熟一定时间后达到其潜在嫩度,而电刺激后就不存在此问题,电刺激对牛肉嫩度的改善,一方面是因为电刺激处理诱导局部肌浆网Ca2+的过量释放,从而导致肌肉强烈收缩,形成挛缩带,破坏了肌纤维的物理结构,使肌原纤维的完整性丧失;另一方面,电刺激后的高温、低pH环境提高了肌肉嫩化内源酶的活性,加快了蛋白质的降解速度,从而改善了肉的嫩度,这一观点和Hwang等[24]的相似。本研究还发现在成熟过程中,电刺激组牦牛背阔肌的剪切力值较初始值下降30.92%,半腱肌下降29.63%,冈上肌下降28.81%,而未电刺激组牦牛在整个成熟过程中剪切力值下降程度则与电刺激组相反。Kukowski[30-31]发现中部胴体分割肉的初始嫩度通常有较好的嫩度适口性,更容易让消费者接受,但是电刺激组牦牛冈上肌、背阔肌和半腱肌剪切力值下降程度与未电刺激组相反,这可能是由于电刺激改变了肌肉内部能量水平和能量代谢酶活等因素造成的,具体原因需后期实验进一步研究。
本研究还发现,随着成熟时间的延长,电刺激组和未电刺激组牦牛冈上肌、背阔肌和半腱肌MFI值均逐渐增加,这意味着肌原纤维的完整性越来越差,但电刺激对成熟过程中牦牛肉的MFI值影响不显著。Savell等[32]研究指出,电刺激处理可改变肌肉的肌节长度,使肌节的拉伸和收缩发生变化。Geesink等[33]指出,电刺激虽然显著降低了牛背最长肌的剪切力值,但并没有显著增加MFI值。毛衍伟[26]也发现,电刺激对牛背最长肌的MFI值影响并不显著,且与剪切力无显著相关性,这与本研究的结果相似,但Bjarnadóttir和Luo等[16,34]研究发现,经电刺激处理的牛肉会使其中的不溶性蛋白发生改变,其长链蛋白减少,而小分子蛋白增加,会加速MFI值的上升。本实验中可能是由于电刺激处理宰后牦牛肉时紧对长链蛋白起一定的作用,而对小分子蛋白的破坏有限,作用不明显。
4 结论
两个处理组牦牛三个部位肉Troponin-T和Desmin特征产物的降解程度随成熟时间的延长均逐渐增加,电刺激组Troponin-T和Desmin的降解速度和降解程度均高于未电刺激组,且背阔肌Troponin-T 28 kDa、Desmin 38 kDa和36 kDa特征降解产物出现的时间较其他两个部位均早,降解程度也较高。
两个处理组牦牛三个部位肉的剪切力值随成熟时间延长均逐渐降低,且电刺激组每个成熟时间点的剪切力值均低于未电刺激组,宰后14 d,电刺激组牦牛冈上肌、背阔肌和半腱肌的剪切力值下降速度较未电刺激组分别显著高2.93%、9.47%、5.08%。
两个处理组牦牛三个部位肉的MFI值随成熟时间的变化趋势均与剪切力值相反,但电刺激对成熟过程中牦牛肉的MFI值几乎无显著影响。
[1]Wang Q,Zhao X,Ren Y,et al. Effects of high pressure treatment and temperature on lipid oxidation and fatty acid composition of yak(Poephagusgrunniens)body fat[J]. Meat Science,2013,94(4):489-494.
[2]Yin R H,Bai W L,Wang J M,et al. Development of an assay for rapid identification of meat from yak and cattle using polymerase chain reaction technique[J]. Meat science,2009,83(1):38-44.
[3]张丽,师希雄,余群力. 甘南耗牛肉质构特性的研究[J]. 中国食品工业,2013,(12):70-72.
[4]陈琳. caspase-3 在鸡肉成熟过程中的作用以及与 calpain 的交互关系研究[D]. 南京:南京农业大学,2011.
[5]黄峰. 细胞凋亡效应酶在牛肉成熟过程中的作用机制研究[D]. 南京:南京农业大学,2012.
[6]Muroya S,Ertbjerg P,Pomponio L,et al. Desmin and troponin T are degraded faster in type IIb muscle fibers than in type I fibers during postmortem aging of porcine muscle[J]. Meat Science,2010,86(3):764-769.
[7]Lindahl G,Lagerstedt A,Ertbjerg P,et al. Ageing of large cuts of beef loin in vacuum or high oxygen modified atmosphere-Effect on shear force,calpain activity,desmin degradation and protein oxidation[J]. Meat Science,2010,85(1):160-166.
[8]Balan P,Kim Y H B,Blijenburg R. Small heat shock protein degradation could be an indicator of the extent of myofibrillar protein degradation[J]. Meat Science,2014,97(2):220-222.
[9]Swatland H J. Cellular heterogeneity in the response of beef to electrical stimulation[J]. Meat Science,1981,5(6):451-455.
[10]Gursansky B,O’Halloran J M,Egan A,et al. Tenderness enhancement of beef from Bos indicus and Bos taurus cattle following electrical stimulation[J]. Meat Science,2010,86(3):635-641.
[11]Hwang I H,Devine C E,Hopkins D L. The biochemical and physical effects of electrical stimulation on beef and sheep meat tenderness[J]. Meat Science,2003,65(2):677-691.
[12]Zhu Lixian,Gao Shujuan,Luo Xin.. Rapid chilling has no detrimental effect on the tenderness of low-voltage electrically stimulated M. longissimus in Chinese bulls[J]. Meat Science,2011,88(3):597-601.
[13]Kim Y H B,Lonergan S M,Grubbs J K,et al. Effect of low voltage electrical stimulation on protein and quality changes in bovine muscles during postmortem aging[J]. Meat Science,2013,94(3):289-296.
[14]Smith M A,Bush R D,van de Ven R J,et al. Effect of electrical stimulation and ageing period on alpaca(Vicugna pacos)meat and eating quality[J]. Meat Science,2016,111:38-46.
[15]White A,O’Sullivan A,Troy D J,et al. Effects of electrical stimulation,chilling temperature and hot-boning on the tenderness of bovine muscles[J]. Meat Science,2006,73(2):196-203.
[16]Luo Xin,Zhu Yan,Zhou Guanghong. Electron microscopy of contractile bands in low voltage electrical stimulation beef[J]. Meat Science,2008,80(3):948-951.
[17]Etlinger J D,Zak R,Fischman D A. Compositional studies of myofibrils from rabbit striated muscle[J]. The Journal of Cell Biology,1976,68(1):123-141.
[18]罗欣,周光宏. 电刺激和延迟冷却对牛肉食用品质的影响[J]. 中国农业科学,2008,41(1):188-194.
[19]Karumendu L U,van de Ven R,Kerr M J,et al. Particle size analysis of lamb meat:Effect of homogenization speed,comparison with myofibrillar fragmentation index and its relationship withshear force[J]. Meat Science,2009,82(4):425-431.
[20]Ho C Y,Stromer M H,Robson R M. Effect of electrical stimulation on postmortem titin,nebulin,desmin,and troponin-T degradation and ultrastructural changes in bovine longissimus muscle[J]. Journal of Animal Science,1996,74(7):1563-1575.
[21]Uytterhaegen L,Claeys E,Demeyer D. The effect of electrical stimulation on beef tenderness,protease activity and myofibrillar protein fragmentation[J]. Biochimie,1992,74(3):275-281.
[22]Kim Y H B,Stuart A,Nygaard G,et al. High pre rigor temperature limits the ageing potential of beef that is not completely overcome by electrical stimulation and muscle restraining[J]. Meat Science,2012,91(1):62-68.
[23]Li C,Zhou G,Xu X,et al. Phosphoproteome analysis of sarcoplasmic and myofibrillar proteins in bovine longissimus muscle in response to postmortem electrical stimulation[J]. Food chemistry,2015,175:197-202.
[24]Hwang I H,Park B Y,Cho S H,et al. Effects of muscle shortening and proteolysis on Warner-Bratzler shear force in beef longissimus and semitendinosus[J]. Meat Science,2004,68(3):497-505.
[25]Chen Q,Huang J,Huang F,et al. Influence of oxidation on the susceptibility of purified desmin to degradation by μ-calpain,caspase-3 and -6[J]. Food Chemistry,2014,150(1):220-226.
[26]毛衍伟. 快速冷却和电刺激对牛肉品质的影响及其机理研究[D]. 泰安:山东农业大学,2011.
[27]王莉,孙宝忠,保善科,等. 补饲和放养牦牛肉品质及肌肉微观结构差异[J]. 肉类研究,2015(6):5-10.
[28]Gursansky B,O’Halloran J M,Egan A,et al. Tenderness enhancement of beef from Bos indicus and Bos taurus cattle following electrical stimulation[J]. Meat Science,2010,86(3):635-641.
[29]Devine C. Advantages of electrical stimulation[J]. Meat Science,2009,83(3):584-585.
[30]Kukowski A C,Maddock R J,Wulf D M. Evaluating consumer acceptability of various muscles from the beef chuck and rib[J]. Journal of Animal Science,2004,82(2):521-525.
[31]Kukowski A C,Maddock R J,Wulf D M,et al. Evaluating consumer acceptability and willingness to pay for various beef chuck muscles[J]. Journal of Animal Science,2005,83(11):2605-2610.
[32]Savell J W,Dutson T R,Smith G C,et al. Structural changes in electrically stimulated beef muscle[J]. Journal of Food Science,1978,43(5):1606-1607.
[33]Geesink G H,Smulders F J,Van Laack H L,et al. Effects on meat quality of the use of clenbuterol in veal calves[J]. Journal of Animal Science,1993,71(5):1161-1170.
[34]Bjarnadóttir S G,Hollung K,Høy M,et al. Proteome changes in the insoluble protein fraction of bovine Longissimus dorsi muscle as a result of low-voltage electrical stimulation[J]. Meat Science,2011,89(2):143-149.
Effect of electrical stimulation on Troponin-T and Desmin and tenderness of yak meat during postmortem aging
WANG Li1,WANG Yu-tao1,GUO Li-jun1,ZHANG Xiu-ying1,REN Xiao-na1, ZHANG Li2,*,XIA Na1,WEI Jian1,SUN Bao-zhong3,YU Qun-li2
(1.College of Life and Geographic Sciences,Key Laboratory of Ecology and Biological Resources in Yarkand Oasis at Colleges & Universities under the Department of Education of Uygur Autonomous Region, Kashgar University,Kashgar Xinjiang 844000,China; 2.College of Food Science and Engineering,Gansu Agriculture University,Lanzhou 730070,China; 3.Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing 100193,China)
To study the effect of electrical stimulation on Troponin-T,Desmin degradation and the tenderness of the meat of yak during postmortem aging,the experiment used SDS-PAGE,shear force and myofibrillar fragmentation index method to compare and dynamic monitor the effect of different treatment(electrical stimulation,no electrical stimulation)on the change of characteristics of Troponin-T,Desmin,shear force and MFI of SU,LD and ST of the meat of yak during postmortem 0,1,2,3,5,7 and 14 d. The results showed that the Troponin-T and Desmin degradation rate and degradation degree of three parts meat of electrical stimulation group were higher,and the degradation products existed earlier than the other two parts,and degradation degree was higher than the other two parts of LD of two treatment groups. After 14 days of postmortem,the rate of decrease of the shear force of SU,LD and ST in the electrical stimulation group were increased by 2.93%,9.47% and 5.08% in comparison with no electrical stimulation group(p<0.05),but the electrical stimulation had no significant effect on MFI. This showed that electrical stimulation can significantly accelerate the degradation of yak’s Troponin-T and Desmin and the rate of descent of shear force during postmortem aging,and tenderization speed is faster than the other two parts meat of LD during postmortem aging.
electrical stimulation;yak;Troponin-T;Desmin;tenderness
2016-12-27
王莉(1988-),女,硕士,助教,研究方向:畜产加工与质量安全控制,E-mail:15294195001@163.com。
*通讯作者:张丽(1979-),女,博士,副教授,研究方向:动物性食品营养与工程,E-mail:zhangl@gsau.edu.cn。
国家自然基金地区基金肌原纤维蛋白氧化羰基化诱发的蛋白交联对牦牛肉质构特性的影响机制(31660469);国家肉牛牦牛产业技术体系(nycytx-38);青藏高原特色有机畜产品生产技术与产业模式(201203009)。
TS251.5+2
A
1002-0306(2017)11-0065-07
10.13386/j.issn1002-0306.2017.11.004
