C-myc和cyclin D1在子宫内膜异位症中免疫反应性增强
2017-06-23李金姑石淑卿林元
李金姑,石淑卿,林元
(1福建省泉州市妇幼保健院·儿童医院生殖中心,泉州 362000;2福建省妇幼保健院妇产科,福州 350000)
C-myc和cyclin D1在子宫内膜异位症中免疫反应性增强
李金姑1,石淑卿1,林元2*
(1福建省泉州市妇幼保健院·儿童医院生殖中心,泉州 362000;2福建省妇幼保健院妇产科,福州 350000)
通过观察子宫内膜异位症(endometriosis,EMS)患者雌激素靶基因C-myc和cyclin D1的表达,探讨它们之间是否存在相关性,并分析c-myc与cyclin D1的表达与患者分期、血清CA125水平之间的关系。方法选取开腹或腹腔镜手术治疗的EMS患者30例(病例组)和同期因其它良性疾病行手术治疗的患者30例(对照组),采用免疫组织化学技术和荧光定量PCR检测病例组的子宫内膜和腹膜异位病灶,及对照组的子宫内膜和正常腹膜中c-myc和cyclin D1的表达;化学发光免疫法检测病例组及对照组的血清CA125水平。结果免疫组织化学和荧光定量PCR检测显示:与对照组相比,病例组在位子宫内膜和腹膜异位病灶组c-myc和cyclin D1表达增强;不同分期的子宫内膜异位症患者的在位子宫内膜和腹膜异位病灶组织的c-myc和cyclin D1的表达无统计学差异;病例组c-myc与cyclin D1的表达呈正相关,但与患者血清CA125水平无相关性。结论本研究结果提示,子宫内膜异位症的发生可能与雌激素靶基因c-myc和cyclin D1的共同表达增加有关,与不同分期、CA125水平无关。
子宫内膜异位症;雌激素;c-myc;cyclin D1
子宫内膜异位症(endometriosis, EMS)是指具有活性的子宫内膜组织(腺体和间质)出现在子宫腔被覆粘膜以外的身体其他部位,简称内异症[1]。EMS已成为妇女痛经、慢性盆腔痛和不孕的主要病因,在育龄期妇女中发病率达到10%~15%[2],近年来更呈上升趋势。EMS性质为良性,但其表现具有类似恶性的生物学行为,目前发病机制尚未完全阐明。早期主要提出3种发病学说:体胚上皮化生学说、种植学说和良性转移学说;近年来又有在位内膜决定论学说、分子生物学基础的发生学说、免疫学说、内分泌机制学说等新的学说,其中内分泌机制学说引起越来越多的关注。
C-myc或cyclin D1与EMS的关系在国内外已有相关报道,c-myc和cyclin D1均参与细胞周期调控,在EMS异位内膜中均有过度表达,可引起细胞G1/S期调控检测点失调,促使细胞增殖。最近,国外学者Pellegrino[3]首次提出了雌激素靶基因c-myc和cyclin D1在EMS的发病机制中可能起着共同作用的观点,但相关研究在国内尚未见报道。
本研究采用免疫组织化学技术和RT-PCR检测病例组的在位子宫内膜和腹膜异位病灶组织及对照组的子宫内膜和正常腹膜组织的c-myc和cyclin D1的表达情况,分析两者之间是否与EMS发病存在共同作用、病例组中c-myc与cyclin D1的表达与患者的分期及血清CA125是否存在相关性。
材料与方法
1 研究对象
选择从2012年7月至2013年12月泉州市妇幼保健院开腹或腹腔镜手术治疗的EMS患者30例为病例组;同期因其它良性疾病行手术治疗的患者30例为对照组。EMS参照谢幸《妇产科学》第八版版诊断标准,分期参照ASRM修正子宫内膜异位症分期法(1997年)。病例组年龄为20~40岁(平均年龄29.12±4.047岁);对照组 年龄为21~38岁(平均年龄28.59±4.573岁),两组平均年龄比较差异无统计学意义。
2 主要试剂
人c-myc抗体工作液(工作浓度1∶100,镇江厚普生物);人cyclin D1抗体工作液(工作浓度1∶100,镇江厚普生物);二甲苯、PBS液体、苏木素( 镇江厚普生物 );直接化学发光法糖抗原125(CA125)测定试剂盒(德国西门子)。
3 免疫组织化学染色和结果判定
(1)开设专业英语课程的愿望。有1 611人(84.9%)认为本科阶段有必要开设专业英语课程,286人(15.1%)认为没有必要开设,且不同院系、性别、专业课平均成绩的学生开设课程愿望的差异有显著性(P=8.698×10-9,P=4.236×10-8,P=3.626×10-4),而不同年级和不同任职情况的学生之间差异无显著性(P=0.263,P=0.227)。
病例组和对照组的手术组织尽可能新鲜,0.01mol/L磷酸盐缓冲液(PBS, pH7.4)冲洗,取小于0.5cm×0.5cm×0.1cm组织块固定、脱水、石蜡包埋、切片(厚5μm)。切片粘贴于经多聚赖氨酸的载玻片上 ,60℃过夜。脱蜡、入水后按以下过程进行免疫组织化学染色:1%甲醇双氧水室温10min, 蒸馏水洗1次,PBS洗3次×5min;入抗原修复液中加热至 97℃,保持15min后自然冷却,PBS洗3次×5min;滴加正常山羊血清封闭液,室温20min;甩去多余液体,不洗;滴加第一抗体,4℃过夜,PBS洗3次×5min;滴加生物素化第二抗体(IgG),37℃20min,PBS洗3次×5min;滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37℃20min, PBS洗3次×5min;DAB显色;苏木素复染细胞核1min,充分水洗、1%盐酸酒精分化、1%氨水反蓝、充分水洗、70%乙醇5min、80%乙醇5min、90%乙醇5min两次、95%乙醇5min两次、100%乙醇5min两次脱水、二甲苯透明5min两次、中性树脂封片;显微镜观察:选择实验组和对照组的阳性和阴性组织切片,显微照相。
C-myc和cyclin D1在光镜下进行分析,每张染色切片随机观察10个高倍视野,标本按阳性细胞百分率和染色程度进行评分,计分方法为:阳性细胞百分率显色细胞数占76%以上为:4分,显色细胞数占51%~75%为:3分,显色细胞数占26%~50%为:2分,显色细胞数占6%~25%为:1分,显色细胞数占5%为:0分;细胞染色呈黄棕或棕褐色为:3分,细胞染色呈黄色为:2分,细胞染色呈淡黄色为:1分,染色程度无着色为:0分;每例标本染色积分为乘积如大于6分为:强阳性(+++),4-6分为:阳性(++),2-3分为:弱阳性(+),1分为:阴性(-),方便计算,规定低表达为0~3分,高表达为大于4分。
4 荧光定量PCR
总RNA提取:腹腔镜手术取子宫内膜异位症患者子宫内膜和异位腹膜病灶及子宫肌瘤患者子宫内膜和腹膜各30例,立即放入保存液,手术后送到病理科放入液氮,待完全冷冻后充分碾磨,取50~80mg粉末加入1ml Trizol,剧烈振荡,然后加入0.2ml 氯仿;剧烈振荡15s,室温放置5min;室温下,12,000r/m离心10min;转移不多于80% 上层水相至新的离心管中,加入等体积的异丙醇,上下充分混匀,冰上放置10min,4℃,12,000r/m离心15min,弃去上清;加入1ml预冷的75 %乙醇,上下混匀,4℃,12,000r/m离心5min,弃去上清,空气干燥;加入30~50ul 无RNase双蒸水,充分溶解后,加入DNaseI进行消化,去除基因组DNA污染,分光光度计测定含量和纯度;逆转录:反应条件30℃,10min;42℃,30min;70℃,15min;
荧光定量PCR引物设计和合成:采用Primer Premier 6.0和Beacon designer 7.8软件进行定量PCR引物设计,引物序列见表1。PCR扩增体系和反应条件:95℃,1min;40个循环:95℃,10sec;62℃, 25sec ;熔点曲线分55℃ 至 95℃。

Names of genes Primer Sequences (5' to 3') Human c-myc CCTACGTTGCGGTCACACCCTT CAGCAGCTCGGTCACCATCTC GCAGACCTTCGTTGCCCTCTGT GTTGTTGGGGCTCCTCAGGTTCA Human 18S GACTCAACACGGGAAACCTCAC CCAGACAAATCGCTCCACCAAC Human cyclin D1
5 血清 CA125化学发光免疫分析
采集EMS手术患者空腹静脉血,离心(3000r/ min, 10min)分离血清置-20℃保存。在标本中加入生物素化的抗CA125单克隆抗体和RU32+标记的抗CA125单克隆抗体混匀,形成双抗体夹心抗原抗体复合物,添加链霉亲和素包被的微粒进行孵育,应用全自动化学免疫分析仪(Siemens ADVIA Centaur XP,德国)进行直接化学发光技术的双位点夹心免疫测定法测定血清 CA125[4]:加50µl样品到比色杯内;加100µl标记试剂37ºC孵育7.5min;加 250µl固相试剂37ºC孵育20min;在比色杯磁场中,被固相试剂标记的有效成分吸附在比色杯中,同时向比色杯加入去离子水清洗,并吸除比色杯中的无关物质;加入酸性试剂和碱性试剂各 300µl,酸碱度的变化使标记试剂中的吖啶酯发生化学发光反应而发光,通过光电倍增管测得光亮值,样品中CA125含量和系统检测的光量值存在正比例关系,在定标工作曲线上找出光亮值对应的浓度值(U/ml)。
6 统计分析方法
免疫组织化学资料采用SPSS19.0统计软件包进行数据资料整理和统计分析处理。计数资料采用χ2检验方法,等级相关应用Spearman等级相关分析;计量资料,所有的数据均以均数±标准差的形式表示,两组间均数比较用t检验,多组均数的比较用单因素方差分析,进一步用LSD t检验作组间比较。以P<0.05认为差异有统计学意义,以P<0.01认为差异有显著统计学意义。
荧光定量PCR统计分析方法:Ct值是每个反应管内的荧光信号达到设定阈值时所经历的循环数。每对引物在每个模板做3次重复实验,得到平均Ct值;每个目的基因的平均Ct值都减去相应模板内参基因的平均Ct值,得到ΔΔCt,所以每个目的基因的平均相对含量为2-ΔCt,最后根据公式ΔΔCt=(Ct目的基因-Ct内参基因)×实验组-(Ct目的基因-Ct内参基因)×对照组,算出2-ΔΔCt,用单样本t检验方法进行统计学分析。
结 果
1 子宫内膜异位症在位内膜和腹膜中c-myc和cyclin D1免疫反应性增强
免疫组织化学检测显示,c-myc 和cyclin D1阳性免疫反应产物定位于细胞核,呈棕黄色或棕褐色颗粒状(图1和图2)。EMS在位内膜和腹膜异位病灶组织c-myc与cyclin D1免疫反应性较对照组子宫内膜和腹膜c-myc和cyclin D1免疫反应性明显增强(图1和图2)。
对不同分期的子宫内膜异位症患者的在位子宫内膜和腹膜异位病灶组织的c-myc和cyclin D1免疫组织化学表达水平比较显示, III、IV期与I、II期的子宫内膜异位症患者在位内膜和腹膜异位病灶的c-myc和cyclin D1免疫反应性无明显差异(表1)
2 子宫内膜异位症子宫内膜和腹膜内c-myc 与cyclin D1 mRNA水平升高
荧光定量PCR法检测显示:与对照组在位内膜和腹膜比较,EMS在位内膜和腹膜 的c-myc和cyclin D1 mRNA水平均明显上升(图3和图4)。
3 子宫内膜异位症在位内膜与腹膜异位病灶内cmyc和cyclin D1mRNA表达呈正相关
对EMS在位内膜和腹膜异位病灶内c-myc和 cyclin D1 mRNA表达水平进行荧光定量PCR法检测显示,二者在位内膜和腹膜异位病灶内的表达水平均呈正相关,Spearman等级相关分析检测其中在位内膜内c-myc和cyclin D1 mRNA间r=0.769,P=0.000(图5A),腹膜异位病灶内c-myc和cyclin D1 mRNA间r=0.913,P=0.000(图5B)。

图1 子宫内膜异位症在位内膜及腹膜c-myc免疫组织化学表达增强。A,EMS在位内膜; B,对照组子宫内膜;C,EMS组腹膜异位病灶;D,对照组腹膜;比例尺, 50µmFig. 1 Enhanced immunohistochemical expression of c-myc in the eutopic and ectopic endometrium in EMS. A, eutopic endometrium in the EMS group; B, endometrium in the control group; C, ectopic endometrium in the EMS group; D, peritoneum in the control group; scar bar, 50µm
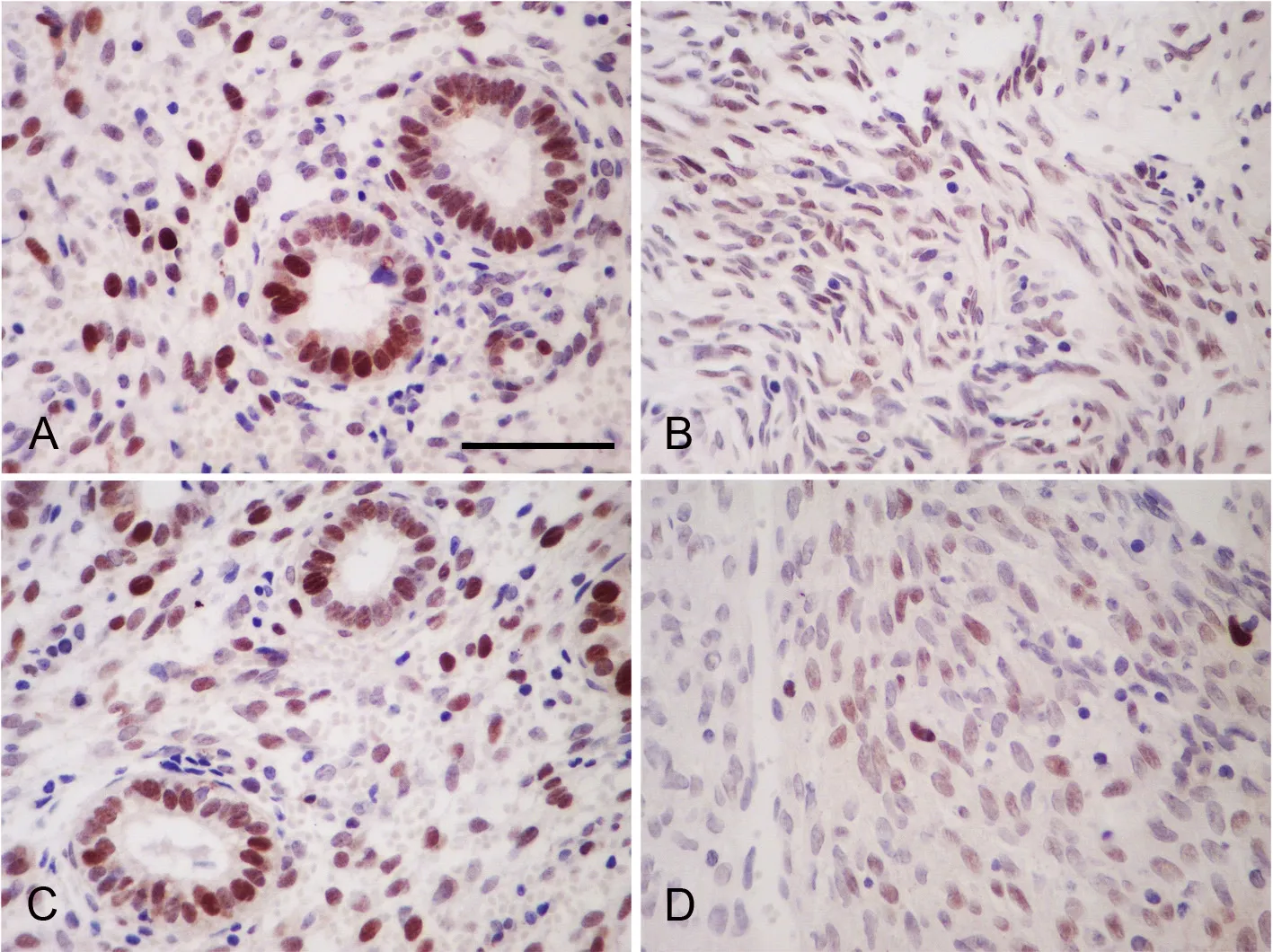
图2 子宫内膜异位症子宫内膜及腹膜异位病灶内cyclin D1免疫组织化学表达增强。A,EMS在位内膜; B,对照组子宫内膜;C,EMS腹膜异位病灶; D,对照组腹膜;比例尺, 50µmFig. 2 Enhanced immunohistochemical expression of cyclin D1 in the eutopic and ectopic endometrium in EMS. A, eutopic endometrium in the EMS group; B, endometrium in the control group; C, ectopic endometrium in the EMS group; D, peritoneum in the control group; scale bar, 50µm
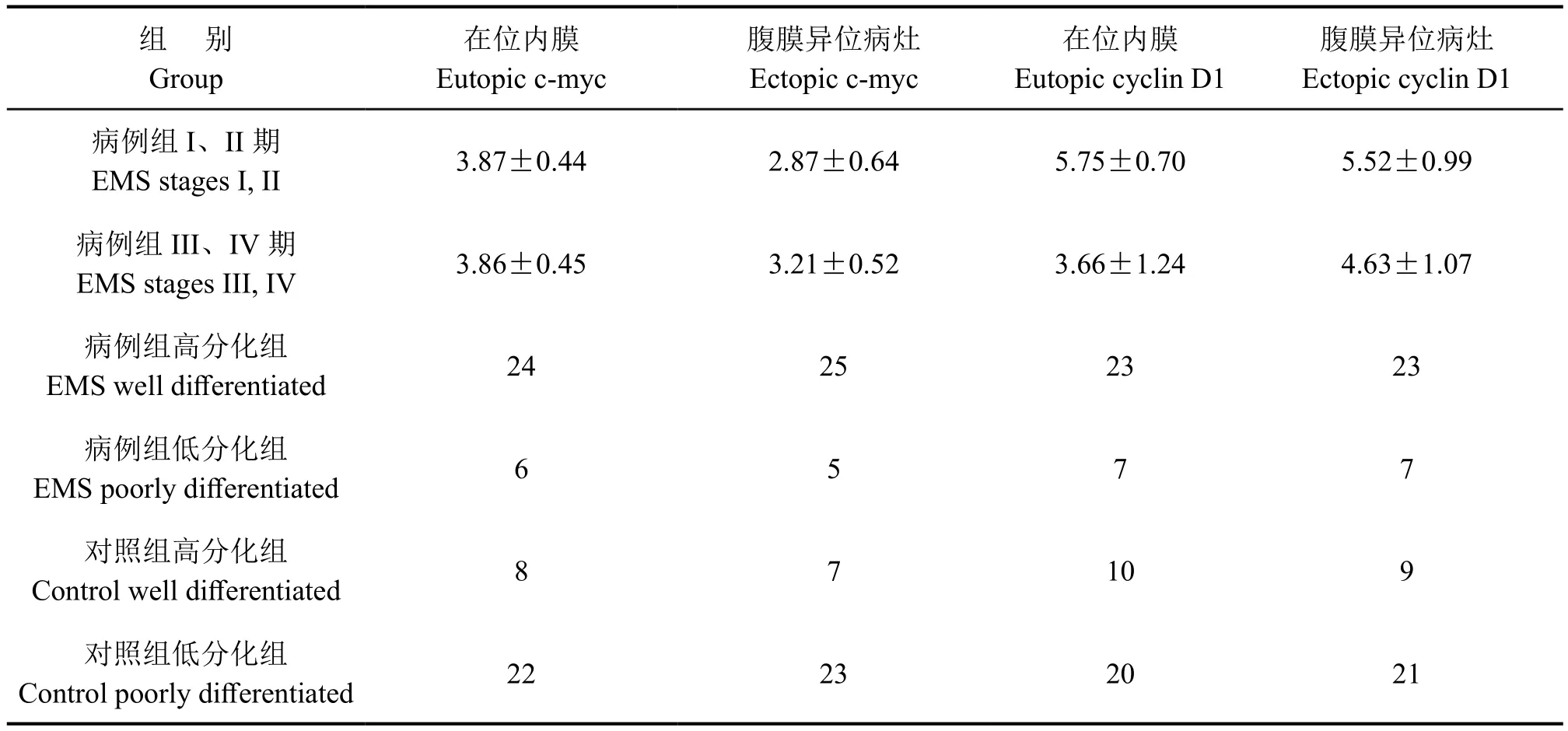
表1 不同期EMS在位子宫内膜和腹膜异位病灶组织内c-myc和cyclin D1免疫组织化学表达水平比较Tab. 1 Comparison of c-myc and cyclin D1 immunohistochemical expression in ectopic endometrium and eutopic endometrium of different stage EMS

图3 子宫内膜异位症在位内膜和腹膜异位病灶内c-myc mRNA表达升高。*,P<0.01Fig. 3 C-myc mRNA level increased in eutopic and ectopic endometrium in EMS. *, P<0.01
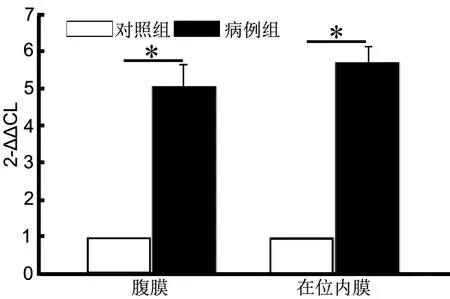
图4 子宫内膜异位症在位内膜和腹膜异位病灶内cyclin D1 mRNA表达升高。*,P<0.01Fig. 4 Cyclin D1 mRNA level increased in eutopic and ectopic endometrium in EMS. *, P<0.01

图5 子宫内膜异位症在位内膜(A)与腹膜(B)内c-myc和cyclin D1 mRNA表达间的关系。Fig. 5 The relationship between the levels of c-myc and cyclin D1 mRNA in eutopic (A) and ectopic (B) endometrium in EMS.
4 子宫内膜异位症在位内膜与腹膜异位病灶c-myc和cyclin D1mRNA 表达与血清CA125水平无相关性
对EMS在位内膜和腹膜 的c-myc和cyclin D1 mRNA表达水平与血清CA125水平进行Spearman等级相关分析检测显示,在位内膜和异位腹膜内cmyc和cyclin D1 mRNA 与血清CA125水平之间均无相关性,其中在位内膜c-myc mRNA与CA125间r=0.115、 P>0.05( 图6A),cyclin D1 mRNA与CA125间r=0.0056、 P>0.05(图6B);异位腹膜c-myc mRNA与CA125间 r=0.097、 P>0.05(图7A),cyclin D1 mRNA与 CA125间 r=0.049、P>0.05(图7B)。
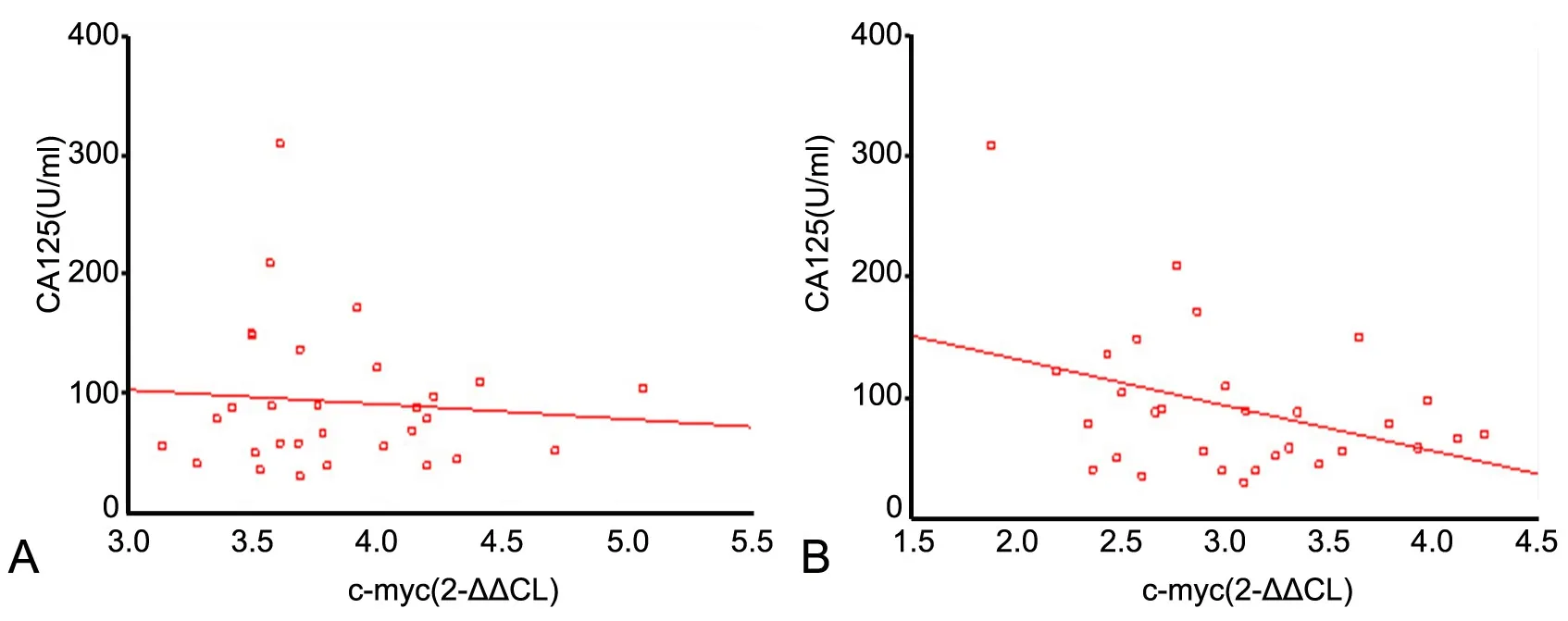
图6 子宫内膜异位症在位内膜(A)/腹膜异位病灶(B)内c-myc mRNA表达与血清CA125水平的关系Fig. 6 The relationship between the level of c-myc mRNA in eutopic (A) and ectopic (B) endometrium and the level of serum CA125 in EMS.

图7 子宫内膜异位症在位内膜(A)/腹膜异位病灶(B)内clclin D1 mRNA表达与血清CA125水平的关系Fig. 7 The relationship between the level of cyclin D1 mRNA in eutopic (A) and ectopic (B) endometrium and the level of serum CA125 in EMS.
讨 论
子宫内膜异位症的发病机制尚未完全阐明。随着内分泌机制学说研究的深入,多数人认为子宫内膜异位症是一种雌激素依赖性疾病。内膜异位症和雌激素发生有着密切关系,雌激素受体与配体结合,形成的复合物通过其他转录因子间接作用于靶基因调节靶基因(如c-myc和cyclin D1等)的转录而产生生物学效应。
雌激素通过靶基因c-myc和cyclin D1共同致EMS的研究是进一步阐明内分泌发病机制的突破点,因此本实验通过研究c-myc和cyclin D1在子宫内膜异位症的在位子宫内膜和腹膜异位病灶组织及对照组的子宫内膜和正常腹膜组织的表达情况,探讨两者之间与EMS发病是否存在共同作用。
C-myc蛋白是一种转录因子,通常与细胞内其他蛋白质结合,最主要与Max结合。c-myc和Max形成复合物后再和DNA核心序列结合调控DNA转录,通过调节目的基因的表达,结合细胞所处的内外环境来影响细胞的生物学行为,c-myc基因表达失调有利于凋亡形成[5]。雌激素和雌激素受体(estrogen receptor,ER)组成复合物诱导c-myc,使细胞由静息状态进入增殖状态,并在连续增殖细胞的整个周期中保持高表达水平。使用c-myc多肽和人雌激素受体的配体连接区域相嵌合技术已证实,c-myc蛋白在其快速早期基因未被诱导时即可使细胞提早进入S期完成DNA合成[6]。Johnson等[6]实验证明子宫内膜异位症病人c-myc,TGF-beta1和Bax基因均有高表达。
Cyclin D1是一种核蛋白,是G1期主要的调控蛋白,其过表达可使细胞G1期缩短,体积变小,降低细胞对促细胞分裂剂的依赖[8]。其机制可能是内异症患者异位内膜高度表达cyclin D1与CDK4结合,使后者激活,活化的CDK4使RB磷酸化,失去抑制E2F启动DNA合成的作用,使细胞由Gl-S期过渡,从而使内异症患者异位内膜细胞增殖能力增强[9]。Wen Chen等[10]认为葛根素通过妨碍E2-BSA诱导,进而降低雌激素靶细胞cyclin D1来抑制子宫内膜异位症的增殖。C-myc或cyclin D1与EMS的关系国内外已有相关报道:2012年李颖等[11]认为cyclin D1在卵巢EMS患者的异位囊肿组织中表达明显增高。C-myc和cyclin D1都是细胞周期的基因。细胞周期是保证细胞进行生命活动的基本过程,通过细胞周期时相的变迁,细胞进入增殖、分化、衰老和死亡等生理状态[11],细胞周期分为G1-S-G2-M四期,细胞周期的调控是通过细胞周期各时相中特异的细胞周期蛋白来实现的,其中细胞周期蛋白(cyclins)、CDK抑制因子(CKIS)、细胞周期蛋白依赖性激酶(CDKS)是参与细胞周期调控的重要因子。细胞周期的调控分为内源性和外源性调控,内源性调控是通过cyclin-CDK的网络调控来完成,外源性调控主要由细胞因子及其他外界刺激引起的。细胞周期主要有三个监测点:G1/S期、G2/M期、纺锤体装配监测点。C-myc通过bHLH Zip结构区与其靶基因(cyclin D1、CDK4)启动子的经典E盒(CACGTG)或其他非经典的E盒相关部位结合,激活cyclin D1,进而激活CDK4,活化的CDK4使Rb磷酸化,磷酸化的Rb蛋白从其所结合的E2F转录因子上解离,从而使cyclin D1代偿性增加,导致更多cyclin D1-CDK复合物,促进G1-S期限制点的调控,调节细胞周期蛋白促进肿瘤细胞的增殖[12];同时cyclin D1激活CDK4和细胞内游离E2F的数量的增加,游离的E2F进入细胞核内结合一系列具有特殊序列的基因启动子区(如c-myc),促进其表达。目前对多种肿瘤研究结果显示:Rb通路是细胞周期的基本通路之一,c-myc和cyclin D1都是Rb通路上的基因,它们对细胞周期的调控,加速G1-S期的进程,对促进肿瘤形成有着重要作用。C-myc和cyclin D1过度表达常同时存在,表明这两种基因异常的共同存在可使肿瘤细胞获得更大的增殖失调。2011年冯晓洁等[13]研究发现c-myc和cyclin D1在恶性多形性腺瘤中的阳性表达率明显高于良性和细胞丰富型多形性腺瘤。
EMS具有雌激素依赖性,雌激素是通过与ER结合发挥作用,作用其靶基因c-myc和cyclin D1,引起二者表达同时上调,两者之间相互作用,引起细胞G1/S期调控检测点失调,可缩短G1期,细胞更快进入S期,促使细胞增殖。雌激素进入细胞后首先与核激素受体相结合,随即受体复合物发生构型变化,在核内与雌激素反应基因的特异性DNA序列相互作用或与启动子内的AP-1或SP-1位点发生相互作用,启动基因表达,使雌激素作用特异性靶组织在肿瘤中表现出生物学效应[14]。在EMS中,雌激素与ER复合物作用于c-myc基因第2,3外显子上游序列,调节c-myc mRNA水平上调[15];Umekita等[16]认为雌激素受体复合物能在细胞周期G1的早至中期增加cyclin D1蛋白质的水平,促进细胞的增殖。同时Rb-Cmyc-Cyclin D1-CDK4途径异常在EMS的发生、发展中起重要作用,c-myc上调时,cyclin D1和CDK4被激活,活化的CDK4使RB磷酸化,磷酸化的RB蛋白从其所结合的E2F转录因子上解离,从而使cyclin D1代偿性增加,导致更多Cyclin D1-CDK复合物;同时细胞内游离E2F的数量的增加,游离的E2F能激活原癌基因c-myc,这表明c-myc和cyclin D1协同促进细胞G1 期更快进入S期。Pellegrino等研究发现EMS患者异位腹膜组织中ERα和ERβ以及其靶基因c-myc、cyclin D1和GREB1mRNA都有高表达。本文发现子宫内膜异位症雌激素靶基因c-myc和cyclin D1在EMS的发病机制起着共同作用,这与Pellegrino等研究发现EMS患者异位腹膜组织中ERα和ERβ以及其靶基因cmyc、cyclin D1和 GREB1mRNA都有高表达一致。
有文献报道EMS患者血清中CA125 水平与与临床分期正相关:CA125是一种血清抗原。80年代中后期发现它与子宫内膜异位症也密切相关。轻度患者与正常人无显著性差异,中、重度患者明显增高[17]。通过血清的检测可检测EMS患者c-myc和cyclin D1的表达与子宫内膜异位症 的CA125的无相关性。也更加说明了EMS患者c-myc和cyclin D1的表达与子宫内膜异位症的分期的无相关性。
[1] 乐杰. 妇产科学(第7版). 北京:人民卫生出版社,2008:325-326.
[2] 郎景和. 子宫内膜异位症的诊断和处理. 现代妇产科进展,2005:5-8.
[3] Chiara Pellegrino, The expression of estrogen receptors as well as GREB1、c-myc and cyclinD1 estrogen-regulated genes implicated in proliferation is increased in peritoneal endometriosis. Fertility, 2012, 98(5)∶ 1200-1208.
[4] Kenemans P, Verstraeten AA, et al. The second generation CA 125 assays. Ann Med, 1995, 27(1)∶ 107-113.
[5] 邓景岳. 影响原癌基因c-myc作用因素的研究进展. 肿瘤学杂志,2009,29(12):1176-1179.
[6] Dedieu J, Gazin C, Rigolet M, etal. Evolutionary conservation of the product human c-myc exon1 expression in a murin cell line. Oneogene ,2012, 12(3)∶ 523-534.
[7] Johnson M, Torres M, Alves A, etal. Cell survival in eutopic endometrium from women with endometriosis∶ expression of c-myc、TGF-beta1 and bax genes. Reprot Biol Endocrinol, 2009, 29(8)∶ 45-53.
[8] 王前,邓晶,蒋永新. cyclin D1 的研究进展. 现代肿瘤医学,2009,17(2):351-354.
[9] 苏琦,敖启林. 胃癌中ER与c-myc的相关性. 中国肿瘤临床,2000,27(10):732- 734.
[10] Wen Chen, Lizao Chen.Puerarin Suppresses proliferation of endometriotic Stromal cells partly via the MAPK signaling pathway by 17ß-estradiol-BSA. Hum pathol, 2012(2)∶ 74-79.
[11] 阿艳妮,李颖.Cyclin Dl和p27在卵巢子宫内膜异位囊肿的表达及其临床意义,中国保健营养,2011,9(8):7-9.
[12] 卢梦玲. Cyclin D1与细胞周期的调控. 生物技术通报,2011,(10):55-60.
[13] 冯晓洁. Cyclin D1、cyclinE、c-myc在涎腺良恶性多形性腺瘤中的表达研究. 口腔医学研究,2011,12(6):1089-1093.
[14] 申景平,刘立仁. 细胞周期调控机制为癌症研究奠定基础.国外科技报,2003,3(2):52-54.
[15] 宋晓辉. PTT、GB、FGF和c-myc在肿瘤发生中的作用机理研究. 青岛大学报,2008,17(11):3845-3849
[16] Umekita Y, bohi Y, Sagara Y, etal. Overexpression of cyclin D1 predicts for poor prognosis in estrogen receptor-negative breast patients. Int J Cancer, 2002, 98(3)∶ 415-418.
[17] Somigliana E , Vigano P , Tirelli AS, et al. Use of the concomitant serum dosage of CA 125 , CA 19-9 and interleukin-6 to detect the presence of endometriosis. Hum Reprod, 2004, 19(8)∶ 1871-1876 .
Enhanced immunoreactivity of c-myc and cyclin D1 in endometriosis
Li Jingu1,Shi Shuqing1,Lin Yuan2*
(1Maternal and Child Health Hospital of Quanzhou, Quanzhou 362000,China;2Maternal and Child Health Hospital of Fuzhou, Fuzhou 350000,China)
To study the expression of estrogenic target genes c-myc and cyclin D1 in patients with endometriosis (EMS), explore the correlation between them, and investigate their relationship with the staging and serum CA125 level of the patients.MethodsSamples were taken from 30 cases of EMS patients who had
laparotomy or laparoscopic surgery (the EMS group) and 30 patients with other benign disease who had received surgery (the control group). The expression of c-myc and cyclin D1 in the endometrium, ectopic peritoneal endometrium or normal peritoneum was detected by immunohistochemistry and fuorescent quantitative PCR (FQ-PCR). The level of CA125 in the serum was detected by chemiluminescent immunoassay.ResultsThe expression of c-myc and cyclin D1 in the eutopic and ectopic endometrium in the EMS group was enhanced compared with that in the endometrium and peritoneum in the control group. Within the EMS group, no signifcant diference in the expression of c-myc and cyclin D1 was detected among patients at diferent EMS stages, nor was a relationship found between the expression of these two genes and the serum CA125 level of the patients, while the expression of c-myc was positively correlated with that of cyclin D1.ConclusionThe results of this study suggest that the occurrence of EMS may involve increase in the expression of estrogenic target genes c-myc and cyclin D1, which is not related to EMS staging or serum CA125 level.
Endometriosis; estrogen; c-myc; cyclin D1
R271.1
A
10.16705/ j. cnki. 1004-1850.2017.02.010
2016-10-14
2017-03-30
泉州市卫计局科研奖
李金姑,女(1978年),汉族,副主任医师*通讯作者(To whom correspondence should be addressed):alice-96@163.com
