天麻多糖结合电针抑制脑缺血大鼠Meynert基底核神经元损伤和上调BDNF、SCF及VEGF表达
2017-06-23王薇缪化春吴锋黄锐赵健
王薇,缪化春,吴锋,黄锐,赵健
(皖南医学院解剖学教研室,芜湖 241002)
天麻多糖结合电针抑制脑缺血大鼠Meynert基底核神经元损伤和上调BDNF、SCF及VEGF表达
王薇,缪化春,吴锋,黄锐,赵健*
(皖南医学院解剖学教研室,芜湖 241002)
目的观察脑缺血后Meynert基底核BDNF、SCF及VEGF等的表达,比较分析天麻多糖(gastrodia elata polysaccharide, GEP))结合电针(electroacupuncture, EA)或单独应用对其干预效果,探讨针药结合对脑缺血的神经血管保护机制。方法将雄性SD大鼠40只随机分成空白对照组、脑缺血模型组、天麻多糖组、电针组及针药结合组,每组8只。采用单侧大脑中动脉线栓法制备局灶性脑缺血大鼠模型。模型制备成功后,天麻多糖组大鼠每日给予天麻多糖100mg/kg灌胃1次,连续2周;电针组大鼠每日电针刺激“百会”、“足三里”穴1次,每次30min,连续2周;针药结合组每日电针刺激“百会”、“足三里”穴1次,每次30min,同时给予天麻多糖100mg/kg灌胃1次,连续2周。尼氏染色法观察各组大鼠Meynert基底核神经细胞形态及存活数,免疫组织化学方法检测各组大鼠Meynert基底核BDNF、SCF及VEGF蛋白的表达情况。结果与正常组比较,模型组大鼠缺血侧Meynert基底核神经细胞存活数显著减少,BDNF、SCF及VEGF免疫染色显著增强;与模型组比较,天麻多糖组、电针组及针药结合组大鼠缺血侧Meynert基底核神经细胞存活数显著增加,BDNF、SCF及VEGF免疫染色显著增强;针药结合组与天麻多糖组、电针组比较,缺血侧Meynert基底核神经细胞存活数显著增加,BDNF、SCF及VEGF免疫染色也增强。结论脑缺血后Meynert基底核神经血管相关因子表达增加,提示Meynert基底核是脑缺血后易损区域之一;天麻多糖结合电针可上调BDNF、SCF及VEGF表达,对Meynert基底核起到神经的保护作用,且作用优于天麻多糖或电针的单独应用。
脑缺血;天麻多糖;电针;Meynert基底核; BDNF;SCF;VEGF
脑缺血病严重威胁到患者的神经功能及生存质量,如何有效地防治脑缺血仍为当今的研究热点[1]。目前,关于脑缺血损伤区域的研究主要集中在大脑皮质、海马、齿状回等部位[2-4],其中大脑皮质是脑缺血的主要易损区之一,而Meynert基底核是与其密切联系的一个重要核团,由该核发出的胆碱能神经纤维主要投射至大脑皮质,参与认知过程[5]。有研究表明,电针(electroacupuncture, EA)治疗可促进脑缺血后神经干细胞(NSCs)的增殖与分化,从而在一定程度上促进脑组织功能的恢复[6]。天麻多糖(gastrodia elata polysaccharide, GEP)是从中药天麻中提取的一种重要的活性成分,具有清除自由基及抗衰老的作用,可改善神经功能缺损[7],但其对脑缺血的治疗机制尚不完全清楚。脑源性神经生长因子(brain derived neurotrophic factor, BDNF)可维持神经元的存活、分化、生长和发育,促进损伤神经元修复和神经突触再生[4,8];在中枢神经系统受损或变性时,干细胞因子(stem cell factor, SCF)表达增加并激活NSCs向损伤区域移位,发挥神经再生作用[9];血管内皮生长因子(vascular endothelial growth factor, VEGF)可特异性诱导血管内皮细胞增殖进而促进脑内新生血管形成和神经发生来发挥神经保护作用[10]。本课题组前期研究显示天麻多糖结合电针可显著促进脑缺血大鼠额叶皮质SCF和巢蛋白的表达[11],但天麻多糖与电针结合对Meynert基底核内的神经、血管相关因子的表达影响,尚未见报道。本实验通过比较分析天麻多糖与电针结合或单独应用对脑缺血大鼠Meynert基底核BDNF、SCF及VEGF表达的影响,进一步探讨针药结合对脑缺血后Meynert基底核的神经保护机制。
材料与方法
1 实验动物与分组
成年健康雄性SD大鼠40只,体重(180~ 220g),由浙江省实验动物中心提供[动物合格证号:SCXK(浙)-2008-0033]。将大鼠随机分为5组:即空白对照(blank control, Con)组、脑缺血模型(cerebral ischemia model, CIM)组、天麻多糖 (GEP)组、电针(EA)组和针药结合(EA+GEP)组,每组8只。
2 主要试剂及仪器
兔抗大鼠BDNF、SCF和VEGF抗体、SABC免疫组织化学试剂盒和HRP-DAB增强型显色液均购自武汉博士德生物工程有限公司;G6805-2型电针仪购自上海医用电子仪器厂理疗分厂;Image-J图像分析软件购自美国。
3 天麻多糖的制备
新鲜天麻洗净经匀浆机制成糊状,分别经蒸馏水浸提和95%乙醇醇沉制得粗天麻多糖,再经DEAE-Cellulose-52柱分离制备天麻多糖。
4 造模方法
参照缪化春等方法[3],采用线栓右侧大脑中动脉法制备局灶性脑缺血模型,以清醒后大鼠出现不能完全伸直左前爪,行走时偏向左侧并向左侧转圈或倾倒等神经体征视为造模成功。大鼠自由摄食进水,将造模成功大鼠用于实验。
5 治疗方法
天麻多糖组和针药结合组大鼠每天按100mg/kg剂量进行天麻多糖灌胃,连续2周。电针组和针药结合组每日用电针治疗仪针刺“百会”和“足三里”穴1次,以局部轻颤为度,每次30min,波宽1ms,电压2V,频率2Hz,连续治疗2周。正常组和模型组则不给予任何治疗,以上各组动物均在相同的环境饲养。
6 组织切片制备及染色反应
所有大鼠均经1%戊巴比妥钠腹腔注射麻醉,开胸暴露心脏和升主动脉,经左心室-升主动脉快速输入100ml生理盐水,然后输入4%多聚甲醛溶液300ml灌注固定。开颅后将大鼠置于大鼠脑立体定位仪上,切取出含有Meynert基底核的节段,经4%多聚甲醛后固定24h,脱水,透明,石蜡包埋,连续切片,片厚5μm,切片分4套收集,按常规方法脱蜡至水。其中1套采用尼氏染色法观察各组大鼠Meynert基底核内神经元形态变化,其余3套按照试剂盒说明书分别进行BDNF、SCF和VEGF的免疫组织化学反应和HRP-DAB显色步骤。阴性对照反应用PBS替代相应的一抗。常规乙醇梯度脱水、二甲苯透明,中性树胶封片,光学显微镜下观察并拍片。
7 结果判定
参照大鼠脑立体定位图谱,在光学显微镜下对每只大鼠选取前囟后1.4mm的相同脑冠状切面各4张作为观察对象,在400倍视野下参照参考文献[12]进行存活神经元的计数以及观察分析测量相同单位面积内的BDNF、SCF和VEGF免疫反应阳性细胞数和平均灰度值。
8 统计分析
结 果
1 天麻多糖结合电针更有效抑制脑缺血大鼠Meynert基底核神经元损伤
尼氏染色结果显示,正常组大鼠Meynert基底核神经元排列紧密,细胞染色清晰,胞核位于中央。模型组Meynert基底核神经元中部分发生细胞皱缩,细胞核固缩,存活神经元数量较正常组显著减少;天麻多糖组、电针组和针药结合组Meynert基底核的神经元形态有明显改善,存活神经元数量较模型组显著增加;与天麻多糖组和电针组比较,针药结合组Meynert基底核的神经元存活数显著增加(图1,表1)。
2 天麻多糖结合电针更明显上调脑缺血大鼠Meynert基底核内BDNF、SCF及VEGF免疫反应性表达
免疫组织化学染色显示,各组大鼠Meynert基底核均有BDNF、SCF及VEGF阳性表达,阳性细胞被DAB染成棕黄色,阳性产物主要定位于细胞膜和细胞质。与正常组比较,模型组大鼠Meynert基底核的BDNF、SCF及VEGF免疫反应阳性细胞数增多,细胞平均灰度值降低;与模型组相比较,天麻多糖组、电针组和针药结合组Meynert基底核的BDNF、SCF及VEGF免疫反应阳性细胞数均明显增多,细胞平均灰度值明显降低;但天麻多糖组与电针组相比较,Meynert基底核BDNF免疫阳性细胞数和平均灰度值无差异;与天麻多糖组和电针组比较,针药结合组Meynert基底核的BDNF、SCF及VEGF免疫反应阳性细胞数明显增多,细胞平均灰度值明显降低(图2,表2)。

图1 脑缺血、天麻多糖与电针对大鼠Meynert基底核神经元存活的影响(尼氏染色)。A,空白对照组;B,脑缺血模型组;C,天麻多糖组;D,电针组;E,针药结合组;比例尺,50μmFig. 1 The efects of cerebral ischemia, GEP and EA on the survival of neurons in the NBM of rats (Nissl staining). A, blank control group; B, cerebral ischemia model group; C, GEP group; D, EA group; E, EA+GEP group; scale bar, 50μm
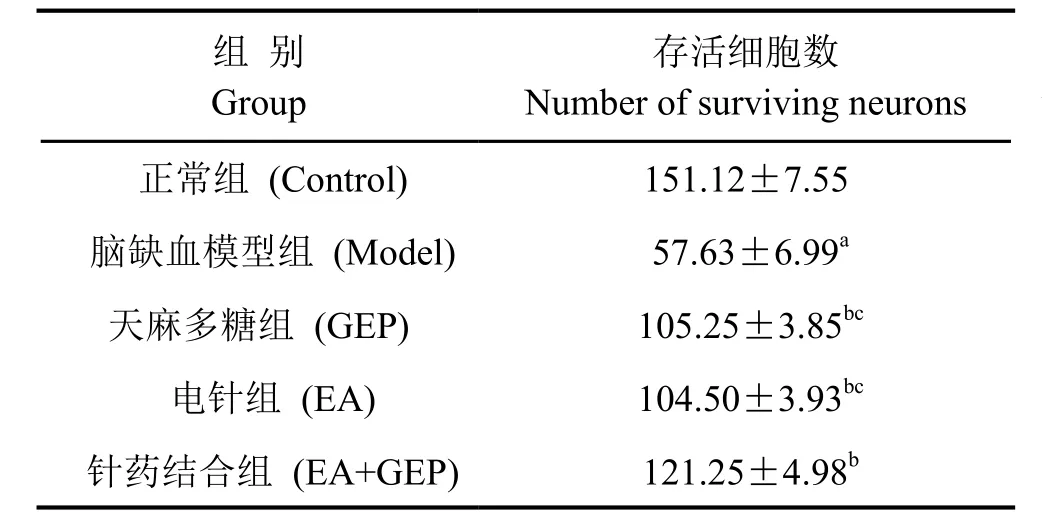
表1 大鼠Meynert基底核存活细胞数比较Tab. 1 Comparison of the number of surviving neurons in the NBM in each group
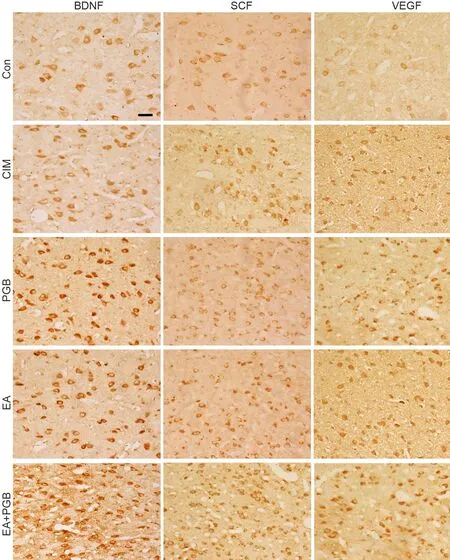
图2 天麻多糖与电针对脑缺血大鼠Meynert基底核内BDNF、SCF与VEGF免疫反应性的影响。比例尺,50μmFig. 2 The efects of cerebral ischemia, GEP and EA on the immunoreactivities of BDNF, SCF and VEGF in the NBM of rats. Scale bar, 50μm

表2 大鼠Meynert基底核内BDNF、SCF及VEGF阳性细胞数和免疫反应强度比较Tab. 2 Comparison of the number of BDNF, SCF and VEGF positive cells and the immunoreactive intensity of these factors in the NBM in each group
讨 论
Meynert基底核属于基底前脑中的大细胞核群,位于豆状核下方,前穿质和大脑脚间窝之间,主要由胆碱能神经元组成,由该神经核发出的胆碱能神经纤维主要投射到大脑新皮质,形成Meynert基底核-皮质通路,参与学习和认知过程[5,13]。本实验观察到脑缺血后Meynert基底核神经元存活数量较正常组显著降低,神经血管相关因子表达较基础水平上升,提示Meynert基底核为脑缺血的受损部位之一。长期脑缺血可能会导致记忆力、定向力、计算力、理解判断力障碍,还可出现情感障碍和行为异常等一系列神经功能障碍的表现[14]。有研究显示,损伤Meynert基底核可引起大脑皮质内神经元密度及乙酰胆碱的释放量同时减少,最终可导致动物的高级认知功能障碍[13]。脑缺血引起的神经功能障碍是否与Meynert基底核受损有关,有待进一步深入研究。
BDNF是由神经细胞产生的一种蛋白质[8],BDNF通过与其受体TrkB的结合激活细胞内信号转导途径,促进中枢神经系统发育过程中特定神经元的存活、分化、生长发育及突触可塑性的调节,抑制神经细胞凋亡,改善神经元的病理状态,发挥神经保护作用[15];在生理情况下,BDNF表达维持较低水平,但受外界因素影响如脑缺血时,BDNF表达上调[3,16]。SCF是一种具有多种功能的细胞生长因子,可与脑内多种神经生长因子及营养因子共同作用,调控细胞的增殖、存活、分化和迁移[17];缺血缺氧等因素可诱导SCF的表达增加并与其酪氨酸激酶受体(tyrosine kinase receptor,KIT)结合,刺激NSCs增殖,并保护神经元,促进神经功能的修复与重建[18]。Zhao LR等对局灶性脑缺血大鼠进行SCF皮下注射,结果显示脑内双侧皮质下区神经元前体细胞数量明显增多,大鼠神经系统功能得到一定的恢复[19]。VEGF是一种特异性表达于内皮细胞的有丝分裂原,它与血管发生有密切的关系,平时呈低水平表达;当发生脑缺血时,缺血性脑损伤诱导VEGF及其受体VEGFR -2表达增加,两者相结合促进缺血部位血管内皮细胞增殖和微血管生成,在一定程度上发挥修复受损神经元和缩小梗死灶面积的作用[20,21]。另外,VEGF表达升高还可以启动IP3K/Akt /NF-κB和MAPK/ERK信号转导通路介导神经营养保护作用,促进神经再生,抑制神经元凋亡和局部炎性反应,促进NSCs增殖、迁移和分化,改善神经功能[22]。本实验免疫组织化学染色观察到脑缺血后Meynert基底核神经血管相关因子BDNF、SCF及VEGF 3种蛋白表达量较基础水平上升,表明脑缺血可刺激神经血管相关因子表达代偿性上调,提示神经血管相关因子参与了脑缺血后神经元的保护作用机制;虽然脑缺血可刺激BDNF、SCF和VEGF的表达上调,但并不足以对抗缺血性脑损伤,可能还需要通过外界因素介入促进其表达进一步升高才可能有利于脑缺血损伤的修复[4,16,20]。
天麻多糖是中药天麻中一种重要的活性成分,其在降血压、延缓衰老、抗菌、抗病毒、抗氧化和提高机体免疫力等方面有显著疗效[7]。有实验证实天麻多糖可促进额叶皮质巢蛋白和干细胞因子表达增加,促进神经元修复,从而保护缺血区脑组织[11]。本实验观察到天麻多糖可减轻Meynert基底核神经元受损,增加BDNF、SCF及VEGF的蛋白表达,这与之前的研究结果一致[3,11],提示应用天麻多糖可促进脑缺血后神经血管相关因子的表达增高,修复受损神经元,发挥神经保护作用,改善神经功能缺损。
脑缺血在中医学属“中风”范畴,根据中医经络理论,其病变在脑,故针刺治疗时首取督脉穴位。而“百会”穴归属督脉,针刺此穴可通经活络、通督醒脑,对神经系统疾病有治疗作用[23]。“足三里”穴属足阳明胃经,针刺此穴具有通经活络、补气养血、健脾胃和促进胃肠活动等作用[24],故本实验选用行经督脉和阳明经穴的“百会”和“足三里”穴进行电针刺激。有研究表明电针可通过活化动物脑内Notch信号通路增加BDNF和VEGF的表达,促使内源性NSCs增殖、分化和迁移,参与神经再生修复,促进脑功能恢复,改善神经功能缺损[16]。本研究应用电针治疗脑缺血后,实验结果显示Meynert基底核神经元存活数量及BDNF、SCF及VEGF的表达均上调,此种表达现象同样存在于大鼠海马CA3区[3],提示电针可能通过上调BDNF和VEGF等神经血管相关因子的表达水平来刺激缺血区内源性NSCs增殖,有利于脑缺血损伤的修复。天麻多糖与电针结合可使Meynert基底核神经细胞存活数及BDNF、SCF及VEGF的蛋白表达显著上调,效果明显优于单用天麻多糖或电针,其原因可能是电针增加了胃肠对天麻多糖的吸收,两者协同共同促进神经血管相关因子的显著表达,进而修复受损神经元,发挥神经保护作用,但具体的作用机制还有待于进一步研究。
[1] 陈怀珍. 《急性缺血性脑血管病中西医诊疗指南》解读.中医药临床杂志,2013,25(11):949-954.
[2] 代恩泽,龙飞,龚标,等. 电针对局灶性脑缺血再灌注大鼠皮质slit-Robo三磷酸鸟苷酶激活蛋白-1和细胞分裂周期蛋白42表达的影响. 针刺研究,2015,40(3):186-191.
[3] 缪化春,吴锋,丁见,等. 电针联合天麻多糖对脑缺血大鼠海马CA3区Nestin、BDNF表达的影响. 中国组织化学与细胞化学杂志,2014,23(1):35-39.
[4] 陈斌,陶静,黄佳,等. 从Notch 通路探讨电针促进局灶性脑缺血再灌注大鼠海马神经干细胞增殖的作用机制. 中国康复医学杂志,2014,29(5):399-404.
[5] 谢祎,肖劲松. Meynert基底核与认知. 国际神经病学神经外科学杂志,2015,42(4): 377-380.
[6] Tao J, Xue XH, Chen LD, et al. Electroacupuncture improves neurological defcits and enhances proliferation and diferentiation of endogenous nerve stem cells in rats with focal cerebral ischemia. Neurol Res, 2010, 32(2)∶ 198-204.
[7] 谢学渊,晁衍明,杜珍,等. 天麻多糖的抗衰老作用.解放军药学学报,2010,26(3): 206-209.
[8] Shu XL, Zhang YS, Xu H, et al. Brain-derived neurotrophic factor inhibits glucose intolerance after cerebral ischemia. Neural Reg Res, 2013, 8(25)∶ 2370-2378.
[9] Hosseini SM, Samimi N, Farahmandnia M, et al. The Preventive Effects of Neural Stem Cells and Mesenchymal Stem Cells Intra-ventricular Injection on Brain Stroke in Rats. N Am J Med Sci, 2015, 7(9)∶ 390-396.
[10] Xie L, Mao XO, Jin KL, et al. Vascular endothelial growth factor-B expression in postischemic rat brain. Vas Cell, 2013, 5(1)∶ 1-5.
[11] 赵健,黄锐,李怀斌,等. 电针及天麻多糖对局灶性脑缺血大鼠缺血灶周围额叶皮质巢蛋白、干细胞因子表达的影响. 针刺研究,2015,40(2):108-112.
[12] 张业贵,龚鑫,侯良芹. 电针预处理对脑缺血再灌注大鼠大脑皮质一氧化氮合酶及胶质纤维纤维酸性蛋白表达的影响. 针刺研究,2015,40(2):113-118.
[13] Kuhn J, Handenacke K, Shubina E, et al. Deep brain stimulation of the nucleus basalis of meynert in early stage of Alzheimer’s dementia. Mol Psy, 2015, 20(3)∶ 353-360.
[14] 王丽晔,林参,赵海苹,等. 大鼠慢性脑缺血认知、情绪及小胶质细胞的变化. 首都医科大学学报,2014,35(6):1-7.
[15] Navanatna D, Guo SZ, Hayakawa K, et al. Decreased cere-brovascular brain-derived neutr- -ophic factor–mediated neuroprotection in the diabetic brain. Diabetes, 2011, 60(6)∶1789 -1796.
[16] Tao J, Chen B, Gao Y, et al. Electroacupuncture enhances hippocampal NSCs proliferation in cerebral ischemia reperfusion injured rats via activation of notch signaling pathway. Int J Neurosci, 2014, 124(3)∶ 204-212.
[17] 罗云,朱文静,徐运. 脑缺血再灌注后干细胞因子和KIT受体的变化及意义. 中国病理生理杂志,2009,25(4):734-737.
[18] 卢桃利,罗勇. SCF/c-Kit 在缺血性脑血管病血管再生中的作用. 中国老年学杂志,2016,36(1):229-230.
[19] Zhao LR, Singhal S. Brain repair by hematopoietic growth factors in a rat model of stroke. Stroke, 2007, 38(9)∶ 2584-2591.
[20] 刘秀萍,邓方. 银杏内酯和白果内酯对大鼠脑缺血再灌注损伤后VEGF的表达的影响. 中风与神经疾病杂志,2015,32(2):108-111.
[21] Shimotake J, Derugin N, Wendland M, et al. Vascular endothelial growth factor receptor-2 inhibition promotes cell death and limits endothelial cell proliferation in a neonatal rodent model of stroke. Stroke, 2010, 41(2)∶ 343-349.
[22] huang F, Cao J, Liu Q, et al. MAPK/ERK signal pathway involved expression of COX-2 and VEGF by IL-1β induced in human endometriosis stromal cells in vitro. Int J Clin Exp Pathol, 2013, 6(10)∶ 2129-2136.
[23] 沈菁,雷晓明,宋洋,等. 电针内关尧百会穴对脑缺血/再灌注大鼠GRP78和Caspase-12 基因表达的影响. 湖南中医药大学学报,2016,36(2):54-57.
[24] 陈姝,雍春燕,陈恒,等.针刺胃扩张模型大鼠内关、足三里等穴位下丘脑室旁核相关神经元的反应. 中国组织工程研究,2014,18(5):675-680.
Combined treatment by gastrodia elata polysaccharide and electroacupuncture protects the nucleus basalis of Meynert of rats from cerebral ischemia and increases the expression of BDNF, SCF and VEGF
Wang Wei, Miao Huachun, Wu Feng, Huang Rui, Zhao Jian*
(Department of Anatomy, Wannan Medical College, Wuhu 241002, China)
ObjectiveTo study the expression of brain derived neurotrophic factor (BDNF), stem cell factor (SCF) and vascular endothelial growth factor (VEGF) in the nucleus basalis of Meynert (NBM) after focal cerebral ischemia, compare and analyze the efects of gastrodia elata polysaccharide (GEP), electroacupuncture (EA) and their combination (EA+GEP) on it, and explore the mechanism underlying the protective efect of EA+GEP on nerves and vessels in cerebral ischemia.MethodsForty male Sprague-Dawley rats were randomized into fve groups of eight rats∶ the blank control group, cerebral ischemia model group, GEP group, EA group, and EA+GEP group. The cerebral ischemia model was established by occlusion of the middle cerebral artery (MCAO), after which the GEP group were given 100mg/kg body weight GEP by gavage once daily for 2 successive weeks; the EA group were given 30-minute-EA in baihui and zusanli acupoints once daily for 2 successive weeks; the EA+GEP group were given 30-minute-EA in baihui and zusanli acupoints as well as 100mg/kg GEP by gavage, both once daily for 2 successive weeks. The number and morphology of surviving neurons in the NBM were observed after Nissl staining, and the expression of BDNF, SCF and VEGF protein in the NBM was detected by immunohistochemistry.ResultsCompared with the blank control group, the number of surviving neurons in the NBM decreased signifcantly in the model group, and the immunoreactivity of BDNF, SCF and VEGF wasremarkably higher. The number of surviving neurons and the expression of BDNF, SCF and VEGF in the NBM were signifcantly higher in the GEP group and the EA group than in the model group, and were even higher in the EA+GEP group. Conclusion The expression of nerve and vascular related factors in the NBM increases after cerebral ischemia, suggesting that the NBM, which is related to cognitive functions, is vulnerable to cerebral ischemia. The combined treatment by GEP and EA increases the expression of these factors and protects the nerves and vessels in the NBM in cerebral ischemia, the efect of which is superior to that of GEP or EA alone.
Cerebral ischemia; gastrodia elata polysaccharide; electroacupuncture; nucleus basalis of Meynert; brain derived neurotrophic factor; stem cell factor; vascular endothelial growth factor
R741
A
10.16705/ j. cnki. 1004-1850.2017.02.005
2016-11-19
2017-03-30
皖南医学院中青年科研基金(WK201612);安徽省自然科学基金(1608085QH223)
王薇,女(1985年),汉族,助教
*通讯作者(To whom correspondence should be addressed):309778721@qq.com
