间伐对黄龙山油松中龄林细根空间分布和形态特征的影响
2017-06-22尤健健张文辉余碧云樊蓉蓉
尤健健,张文辉,邓 磊,余碧云,李 罡,何 婷,樊蓉蓉
西北农林科技大学陕西省林业综合实验室, 杨凌 712100
间伐对黄龙山油松中龄林细根空间分布和形态特征的影响
尤健健,张文辉*,邓 磊,余碧云,李 罡,何 婷,樊蓉蓉
西北农林科技大学陕西省林业综合实验室, 杨凌 712100
为探究油松细根生长与抚育间伐的关系,以黄龙山林区4种不同间伐强度(对照,轻度,中度,强度)下的油松人工中龄林为研究对象,采用根钻法,分3层(0—20,20—40,40—60cm)获取细根样品,研究了间伐强度对油松细根生物量和形态特征的影响。结果表明:油松细根生物量主要分布在0—20 cm土层,不同间伐强度下细根生物量差异显著(P<0.05),随间伐强度的增大,细根生物量先升高后降低,强度间伐下0—20 cm土层细根生物量显著降低(P<0.05),20—40 cm土层和40—60 cm土层细根生物量所占比例随间伐强度的增大而增大。细根根长密度和根表面积密度在不同间伐强度和不同土层间均差异显著(P<0.05),且变化规律与生物量基本一致。细根比根长和比表面积随间伐强度的增加而增大,且强度间伐与其他强度呈显著性差异(P<0.05)。轻度和中度间伐对小径级细根(0—1.0 mm)有显著影响,对较大径级细根(1.0—2.0 mm)的影响则不显著(P<0.05),强度间伐对0—2.0mm的细根均有显著影响(P<0.05)。中度间伐(保留郁闭度0.7)条件下,油松林地细根总生物量达到最大1022.43 g/m2,此条件下细根的根长密度和根表面积密度也达到最大,能充分利用林地的立地资源,最有利于保留木的生长。
间伐强度;油松中龄林;细根;生物量;形态特征
根系是植物与土壤之间进行物质交换和能量流动的重要的功能器官,他不仅为植物吸收生长所需的水分和养分,还能改善土壤结构,并通过自身周转或与微生物的互作影响土壤有机物的含量[1- 3]。细根通常被定义为直径小于2 mm的根系,尽管其生物量只占林分根系的3%—30%[4],但由于其具有很大的吸收面积和生理活性,对森林生态系统的能量流动、物质循环、水土保持以及土壤结构改善等方面有重要意义[5- 6]。林木为了保证地上部分的正常生长所需,会通过自身调控机制而维持一定的细根生物量[7]。细根的形态和空间分布能反映林木对立地的利用状况,与林木的生长发育和生产力紧密相关,能直接影响到林木地上部分的生长和生态效益的发挥[2,8]。
抚育间伐作为森林经营的主要措施,能够直接影响林木的径级结构和林分的光照、水热条件,进而对林地的物种多样性、群落稳定性以及土壤养分含量等产生持续影响,细根生物量以及形态特征也会随之而改变[9- 12]。其中细根生物量的大小与林木地上部分生长和生产力密切相关,而形态特征的变化则影响细根功能的发挥[13- 15]。由于根系不断地从土壤中汲取水分和养分,满足植物生长发育;同时又通过自身的周转或与环境微生物的互作过程参与植物体和土壤间的物质循环和能量流动,所以研究其产量和分布格局随间伐强度的变化规律对揭示林木与环境的关系以及优化人工林经营措施具有重要意义[16- 17]。尤其在黄土高原等生态相对脆弱的地区,研究抚育间伐对人工林林木细根生长规律的影响更加迫切。
本文选择黄土高原南部的黄龙山林区为典型研究区域,采用根钻法取样,对该地区具有代表性的油松人工中龄林在不同间伐强度下各土层细根生物量及形态变化规律进行了研究,并比较了不同径级细根对间伐响应的差异性,旨在深入了解间伐强度对林地细根的影响,探讨油松根系对抚育间伐的响应机制,从而为黄土高原等生态脆弱地区的植被恢复建设中森林经营措施的调整和优化提供参考资料。
1 研究区概况与方法
1.1 研究区概况
试验地位于黄土高原南部的陕西省延安市黄龙山林区[18],地理位置为109°38′—110°12′E,35°28′—36°02′N。该地区是黄土高原沟壑区与丘陵沟壑区交错地带,属大陆性暖温带半湿润气候类型,年平均气温为8.6℃,最低气温-22.5℃最高气温36.7℃,≥10℃的年积温为2953.7℃。全年无霜期126—186d,年均降雨量611.8 mm,多集中在7—9月,土壤以森林褐土为主[18]。森林植被属暖温带落叶阔叶林地带北部的落叶阔叶林亚地带植被[19]。主要建群树种有油松(P.tabulaeformis)、辽东栎(Quercusliaotungensis)、白桦(Betulaplatyphylla)、山杨(Populusdavidiana)等;主要灌木种类有胡枝子(Lespedezabicolor)、虎榛子(Ostryopsisdavidiana)、黄刺玫(Rosahugonis)、绣线菊(Spiraeathunbergii)、陕西荚蒾(Viburnumschensianum)、连翘(Forsythiasuspensa)、卫矛(Euonymusalatus)及灰栒子(Cotoneasteracutifolius)等;草本层常见的有苔草(Carexlanceolata)和披碱草(Elymusdahuricus)。
试验林为1988年营造的油松人工林,造林时采用穴状整地,初植密度为3900株/hm2。1998年进行定株间伐,伐除病虫木和劣质木,2008年进行了轻度间伐(间伐Ⅰ:保留郁闭度0.8)、中度间伐(间伐Ⅱ:保留郁闭度0.7)和强度间伐(间伐Ⅲ:保留郁闭度0.6)3种强度的间伐试验,并按包含对照(CK:郁闭度0.9)在内的4种间伐强度分别设置了3块固定监测样地,此后林地处于自然恢复和保护状态,未经受过较大的外界干扰。经过6 a的自然恢复,2014年8月复查样地的立木基本生长情况(表1)并进行根系取样试验。

表1 样地基本情况
1.2 细根取样及处理方法
黄土丘陵区油松细根主要分布在0—60 cm土层[8]。本研究在每块样地按S形分布选取9个样点,采用内径为9 cm的根钻取样。取样深度为0—60 cm,分0—20,20—40,40—60 cm的3层取出土芯。取样时要清除土表枯落物。将各层取出的土芯编号后小心装入塑封袋,低温保存并带回实验室。在实验室用清水浸泡土芯,反复淘洗后过40目筛网。洗净后的根放入大培养皿,用镊子和游标卡尺等工具小心挑出直径<2.0 mm的油松细根,根据细根的颜色、外形、弹性、根皮与中柱分离的难易程度挑出活根[20]。
将处理好的细根样品放置在盛有清水透明扫描托盘中,待根系完全舒展后用EPSONV7000根系扫描仪扫描,然后通过winRHIZO根系分析系统分析得到根系的长度、直径、表面积等数据。扫描完成后,将细根样品置于80℃烘箱烘干至恒重,用电子天平(精确度0.001g)称量细根干重。计算细根的生物量、根长密度(RLD)、根表面积密度(SAD)、比根长和比表面积,同时计算不同直径(0—0.5、0.5—1.0、1.0—1.5 mm和1.5—2.0 mm)细根的根长密度和根表面积密度:
细根生物量(g/m2)= 细根干重(g)×104/[π(Φ/2)2](Φ=9 cm)
根长密度(m/m2)= 细根长(m) ×104/[π(Φ/2)2]
根表面积密度(m2/m3)= 细根表面积(m2)×106/[π(Φ/2)2]
比根长(m/g)= 细根长m/细根干重g
比表面积(cm2/g)= 细根表面积cm2/细根干重g
1.3 数据处理
用Excel对原始数据进行初步整理和计算,用SPSS 18.0数据分析软件对不同间伐强度下的油松中龄林各土层细根生物量及形态特征指标进行统计分析,采用单因素方差分析(One-way ANOVA)并结合Duncan检验比较参数间差异性(P<0.05),用Origin 8.1软件进行图表绘制。
2 结果与分析
2.1 油松细根生物量随间伐强度的变化
间伐通过改善林木生境条件从而间接影响根系的生长。由表2可以看出不同间伐强度下油松中龄林细根各层总生物量差异显著(P<0.05)。随着间伐强度的增大,0—60 cm的细根总生物量呈现先升高后降低的趋势,间伐强度为Ⅱ时细根总生物量最大,达到1022.43 g/m2。4种间伐强度下林分的细根生物量在不同土层间差异显著(P<0.05),20—40 cm土层和40—60 cm土层的细根生物量随间伐强度的增大而增大,而0—20 cm土层细根生物量在间伐强度达到Ⅲ 时却有显著下降(P<0.05),且低于对照样地水平。

表2 间伐强度对油松细根生物量的影响
不同大写字母表示不同间伐强度间差异显著,不同小写字母表示不同土层间差异显著(P<0.05)
由表2可以看出,各样地细根生物量均主要分布在0—20 cm土层,占0—60 cm土层细根总量的比例依次为78.32%、74.00%、69.18%和56.08%。间伐显著增加了20—40 cm土层和40—60 cm土层的细根生物量比例,4种间伐类型细根在20—40 cm土层的比例由大到小为间伐Ⅲ(27.21%)>间伐Ⅱ(22.54%)>间伐Ⅰ(18.58%)>CK(16.81%),与对照样地相比,3种间伐强度下20—40 cm细根生物量比例分别增加了1.78%、5.74%和10.4%,细根生物量在40—60 cm土层的比例由大到小依次为间伐Ⅲ(16.69%)>间伐Ⅱ(8.32%)>间伐Ⅰ(7.45%)>CK(5.71%)细根生物量比例分别增加了1.74%、2.61%和10.98%。
2.2 油松细根形态的变化
油松细根的根长密度和根表面积密度随土层和间伐强度的变化规律相似(图1,图2)。在同一间伐强度下,不同土层的细根根长密度和根表面积密度均表现为0—20 cm土层>20—40 cm土层>40—60 cm土层。在对照和间伐Ⅰ条件下,0—20 cm土层的根长密度与20—40 cm土层和40—60 cm土层呈现显著性差异(P<0.05)。在间伐Ⅱ和间伐Ⅲ条件下,各土层根长密度均呈现显著性差异(P<0.05)。根表面积密度在不同土层的变化规律与根长密度一致。在同一土层中,不同间伐强度下油松细根的根长密度和根表面积密度也表现出显著性差异(P<0.05),但各土层的变化规律有所不同。在0—20 cm土层,间伐Ⅱ条件下根长密度和根表面积密度开始出现显著性差异(P<0.05),表现为间伐Ⅱ>间伐Ⅰ>对照>间伐Ⅲ;在20—40 cm土层也是从间伐Ⅱ开始出现显著性差异,但表现为间伐Ⅲ>间伐Ⅱ>间伐Ⅰ>对照;在40—60 cm土层,间伐Ⅲ条件下才使得根长密度和根表面积密度与其他间伐强度呈显著差异(P<0.05),其变化规律与20—40 cm土层基本一致。
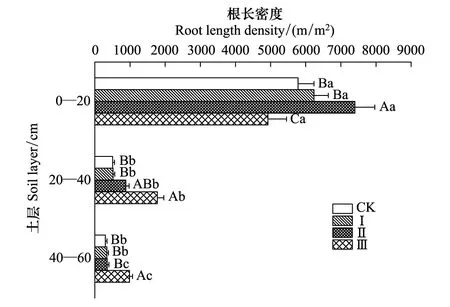
图1 间伐强度对油松细根根长密度的影响 Fig.1 Effects of thinning intensities on root length density of P. tabulaeformis不同大写字母表示不同间伐强度间差异显著,不同小写字母表示不同土层间差异显著(P<0.05)
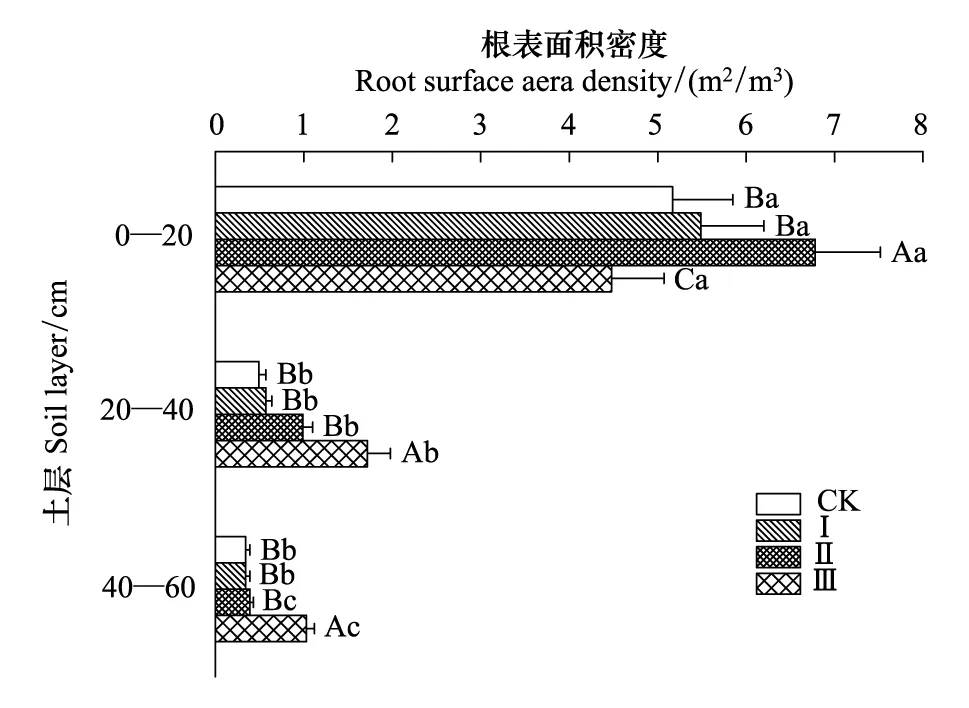
图2 间伐强度对油松细根根表面积密度的影响 Fig.2 Effects of thinning intensities on root surface area density of P. tabulaeformis
由图3和图4可以看出,同一土层中,油松细根的比根长和比表面积随间伐强度变化的规律基本一致,均呈随间伐强度增大而增大的趋势。其中,在0—20 cm土层,比根长和比表面积在不同间伐强度下均没有显著性差异(P<0.05),在20—40土层和40—60 cm土层,只有对照样地的比根长与间伐Ⅱ、间伐Ⅲ呈显著性差异(P<0.05),间伐Ⅰ、间伐Ⅱ和间伐Ⅲ之间差异不显著(P<0.05);比表面积在20—40 cm土层中表现为间伐Ⅲ与对照和间伐Ⅰ间差异显著(P<0.05),在40—60 cm土层则只有CK和间伐Ⅲ差异显著(P<0.05)。同一间伐强度下,0—20 cm土层细根的比根长和比表面积均显著大于其余土层(P<0.05),20—40 cm土层和40—60 cm土层间则无显著性差异(P<0.05)。
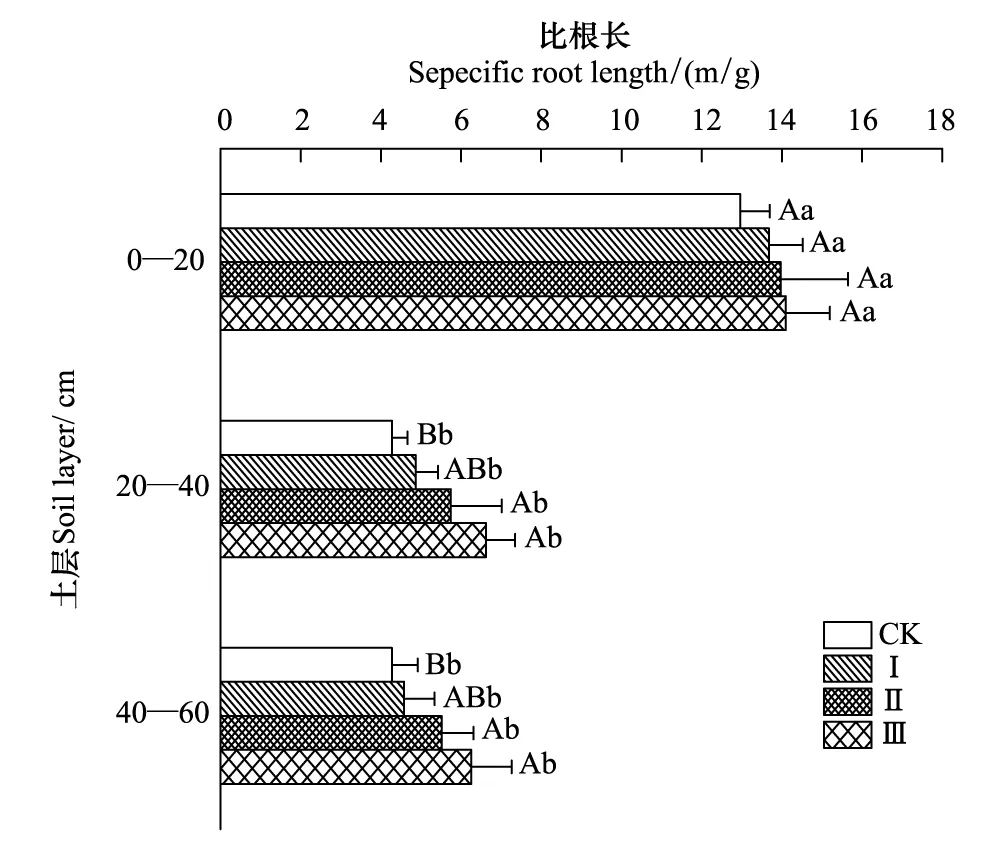
图3 间伐强度对油松细根比根长的影响 Fig.3 Effects of thinning intensities on specific root length of P. tabulaeformis

图4 间伐强度对油松细根比表面积的影响 Fig.4 Effects of thinning intensities on specific root surface area of P. tabulaeformis
2.3 不同径级油松细根的形态变化
同一间伐强度下,各径级细根的根长密度在不同土层间均有显著性差异(P<0.05),且均表现为0—20 cm土层>20—40 cm土层>40—60 cm土层(图5)。0—0.5 mm和0.5—1.0 mm径级的细根的根长密度在0—40 cm土层中的显著性差异(P<0.05)从间伐Ⅱ时开始出现,而在40—60 cm土层中则是从间伐Ⅲ开始呈现显著性差异(P<0.05)。在间伐Ⅲ下小径级细根(0—1.0 mm)在0—20 cm土层的根长密度显著小于其余3种间伐强度,而在20—40 cm土层和40—60 cm土层则显著大于其余3种间伐强度(P<0.05)。不同间伐强度下1.0—1.5 mm径级的细根根长密度在20—40 cm土层有显著性差异(P<0.05),而在0—20 cm土层和40—60 cm土层则无显著性差异(P<0.05)。在同一土层,不同间伐强度下1.5—2.0 mm径级的细根根长密度无显著性差异(P<0.05)。不同径级细根的根表面积密度随间伐强度和土层的变化规律与根长密度基本一致,但在40—60 mm土层中,间伐Ⅲ条件下1.0—2.0 mm径级细根的根表面积密度与其余间伐强度下的根表面积密度呈现出显著性差异(P<0.05)(图6)。

图5 间伐强度对不同径级油松细根根长密度的影响Fig.5 Effects of thinning intensities on root length density of P. tabulaeformis of different diameter classes
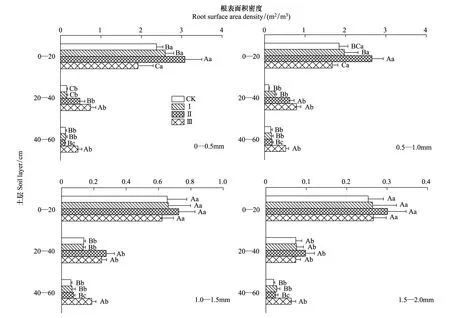
图6 间伐强度对不同径级油松细根根表面积密度的影响Fig.6 Effects of thinning intensities on root surface area density of P. tabulaeformis of different diameter classes
3 讨论与结论
3.1 不同间伐强度对油松中龄林细根生物量的影响
植物细根生物量与其所在气候带、土壤类型、群落结构、树龄及人为干扰程度等有关[14,21-22]。林分被干扰后,在植被的恢复过程中,植物群落组成、林分结构、土壤理化性质和水分养分含量都会发生相应的变化,从而使细根生物量组成和空间分布也随之改变[23]。大量研究表明,采伐干扰会降低细根生物量[24-25],但也有研究表明,采伐干扰会使细根生物量增加[26- 27]。本研究中油松中龄林林分细根生物量随间伐强度的增大呈现先升高后降低的趋势,并在间伐强度为Ⅱ的条件下达到最高的1022.43 g/m2。适度间伐使细根的生物量升高,这可能是由于间伐改善了林地光照条件,增强了林木光合效率,促进了林木地上部分的生长速率,使林木将更多的光合产物分配到地下根系的生长,提高根系吸收水分养分的能力,从而满足地上部分生长的需要。而过度间伐反而使细根的生物量降低,一方面可能是因为过度间伐导致林分密度过小,保留木的细根不能充分利用林地条件,造成了立地资源的浪费。另一方面,可能是过度间伐使林地光照、水分、温度等环境条件的变化较大,进而影响了细根的正常生长[9,22]。随着间伐强度的增大,细根生物量在表层土的分布比例逐渐降低,而20—40 cm土层和40—60 cm土层的细根生物量分布比例则逐渐增大,说明间伐促使油松细根生物量向深土层分配,这与安慧[28]等的研究结果相似。
3.2 不同间伐强度对油松中龄林细根形态的影响
根长密度和根表面积密度是评价植物吸收水分、养分能力的重要指标[29-30]。本研究表明,油松中龄林细根的根长密度和根表面积密度随间伐强度的增加均呈现显著性差异,且在0—20 cm土层的变化规律不同于20—40 cm土层和40—60 cm土层。间伐Ⅰ和间伐Ⅱ可以促进各土层细根根长密度和根表面积密度的增加,而间伐Ⅲ 显著降低了该两项指标在表层土的分布,但显著增加了在20—40 cm土层和40—60 cm土层的分布。可以看出油松林细根根长密度和根表面积密度随间伐强度的变化规律与细根生物量随间伐强度的变化规律是基本一致的,表明细根根长密度和根表面积密度在很大程度上是受单位土体积细根生物量的影响的,这也是细根生物量随间伐强度变化而变化的反映。
植物具有形态可塑性,当外部环境条件发生变化时,它们会通过自身的生长调控机制形成不同的形态和构型,从而提高其对环境的适应能力和竞争能力[31- 32]。本研究的结果表明,油松中龄林各土层细根的比根长和比表面积均随间伐强度增大而增大,这与前人的研究一致[33]。间伐作为重要的森林经营方式,对森林的持续健康发育和高品位木材的生产有重要意义,而随着间伐掉的林木被带出林地,林地的养分也大量流失,土壤养分条件变得相对匮乏。林木通过增加细根的比根长和比表面积从而增加细根吸收养分的能力,从而在土壤养分总量减少的情况下仍能满足地上部分快速生长所需的养分供应,这也是林木对环境变化的适应和调节机制。对不同间伐强度下细根比根长和比表面积变化的方差分析结果表明:间伐强度越大,这种形态变化表现得越明显。
3.3 不同径级油松细根对间伐强度的响应
已有研究[21]表明,植物根系统中只有那些直径细小的或根系末端的小径级根具有较强的吸收功能,在水分和养分吸收中起着主要作用。植物根系的细根可以按照不同直径,划分成若干等级,不同等级的细根对环境变化的敏感性均存在差异[34-35]。本研究中,不同间伐强度下直径小于1.0 mm的细根的根长密度和根表面积密度在各土层都有显著性差异,而直径在1.0—2.0 mm之间的细根的根长密度和根表面积密度在各土层无则基本无显著性差异,只有在中度和强度间伐下才开始出现显著差异。小径级细根的根长密度及根表面积密度随间伐强度的变化规律与总细根的变化规律一致,这说明间伐对细根的影响主要表现在直径小于1.0 mm的小径级细根上,这与前人的研究结果一致[21]。
抚育间伐能显著影响油松细根的空间分布和形态特征。弱度间伐和中度间伐可以促进各土层细根根长密度和根表面积密度的增加,而强度间伐显著降低了该两项指标在表层土的分布,但在20—40 cm土层和40—60 cm土层的分布则显著增加,说明间伐促进了细根向深土层的分布。细根根长密度和根表面积密度在很大程度上是受单位土体积细根生物量的影响的,也是细根生物量随间伐强度变化而变化的反映。各土层油松细根的比根长和比表面积均呈随着间伐强度增大而增大的趋势,且间伐强度越大,这种形态变化表现得越明显。不同径级的细根对间伐响应的敏感程度不同。直径小于1.0 mm的小径级细根对间伐的响应较敏感,在弱度间伐强度下就会有显著变化,而直径相对较大的细根对间伐的响应则较弱,在强度间伐条件下时,较大径级的细根才会有显著的变化。本研究中,油松中龄林林地细根总生物量随间伐强度的增大而增大,并在间伐保留郁闭度为0.7时达到最大,根长密度和根表面积密度也达到最大值,该条件下林地内保留木能充分利用林地的立地资源,最利于保留木的生长,而继续增大间伐强度,则会造成立地资源的浪费。
[1] 王政权, 郭大力. 根系生态学. 植物生态学报, 2008, 32(6): 1213- 1216.
[2] Gill R A, Jackson R B. Global patterns of root turnover for terrestrial ecosystems. New Phytologist, 2000, 147(1): 13- 31.
[3] Vogt K A, Grier C C, Vogt D J. Production, turnover, and nutrient dynamics of above-and belowground detritus of world forests. Advances in Ecological Research, 1986, 15: 303- 377.
[4] Vogt K A, Vogt D J, Palmiotto P A, Boon P, O′Hara J, Asbjornsen H. Review of root dynamics in forest ecosystems grouped by climate, climatic forest type and species. Plant and Soil, 1995, 187(2): 159- 219.
[5] 闫小莉, 戴腾飞, 邢长山, 贾黎明, 张龙宁. 水肥耦合对欧美108杨幼林表土层细根形态及分布的影响. 生态学报, 2015, 35(11): 3692- 3701.
[6] 张小全, 吴可红. 森林细根生产和周转研究. 林业科学, 2001, 37(3): 126- 138.
[7] Shipley B, Meziane D. The balanced-growth hypothesis and the allometry of leaf and root biomass allocation. Functional Ecology, 2002, 16(3): 326- 331.
[8] 黄琳琳, 陈云明, 张升, 王利霞, 张学森. 黄土丘陵区人工油松林地土壤特性及细根特征研究. 水土保持通报, 2011, 31(4): 37- 41.
[9] 谷加存, 王政权, 韩有志, 王向荣, 梅莉, 张秀娟, 程云环. 采伐干扰对帽儿山地区天然次生林土壤表层温度空间异质性的影响. 应用生态学报, 2006, 17(12): 2248- 2254.
[10] 林娜, 刘勇, 李国雷, 吕瑞恒, 王少华, 侯炳柱, 尹凤君. 抚育间伐对人工林凋落物分解的影响. 世界林业研究, 2010, 23(3): 44- 47.
[11] 马履一, 李春义, 王希群, 徐昕. 不同强度间伐对北京山区油松生长及其林下植物多样性的影响. 林业科学, 2007, 43(5): 1- 9.
[12] Yin X, Perry J A, Dixon R K. Fine-root dynamics and biomass distribution in aQuercusecosystem following harvesting. Forest Ecology and Management, 1989, 27(3/4): 159- 177.
[13] 程瑞梅, 王瑞丽, 肖文发, 封晓辉, 刘泽彬, 葛晓改, 王晓荣, 张炜银. 三峡库区马尾松根系生物量的空间分布. 生态学报, 2012, 32(3): 823- 832.
[14] 李瑞霞, 凌宁, 郝俊鹏, 闵建刚, 陈信力, 关庆伟. 林龄对侧柏人工林碳储量以及细根形态和生物量的影响. 南京林业大学学报: 自然科学版, 2013, 37(2): 21- 27.
[15] Pregitzer K S, Laskowski M J, Burton A J, Lessard V C, Zak D R. Variation in sugar maple root respiration with root diameter and soil depth. Tree Physiology, 1998, 18(10): 665- 670.
[16] 邓坤枚, 罗天祥, 张林, 王学云, 李长会. 云南松林的根系生物量及其分布规律的研究. 应用生态学报, 2005, 16(1): 21- 24.
[17] 王迪海, 赵忠, 李剑. 黄土高原不同气候区刺槐细根表面积的差异. 林业科学, 2010, 46(5): 70- 76.
[18] 邓磊, 张文辉, 何景峰. 不同经营措施对黄龙山辽东栎林的影响. 西北植物学报, 2011, 31(1): 159- 166.
[19] 韩文娟, 曹旭平, 张文辉. 地被物对油松幼苗早期更新的影响. 林业科学, 2014, 50(1): 49- 54.
[20] 王韦韦, 熊德成, 黄锦学, 黄超超, 杨智杰, 胡双成, 林成芳, 陈光水. 亚热带不同演替树种米槠和马尾松细根性状对比研究. 生态学报, 2015, 35(17): 5813- 5821.
[21] 陈硕芃, 王韶仲, 王政权, 谷加存. 密度结构对大青川红松人工林细根生物量与根长密度的影响. 森林工程, 2013, 29(4): 1- 7.
[22] 王祖华, 李瑞霞, 关庆伟. 间伐对杉木不同根序细根形态、生物量和氮含量的影响. 应用生态学报, 2013, 24(6): 1487- 1493.
[23] 杨秀云, 韩有志, 张芸香, 武小钢. 采伐干扰对华北落叶松细根生物量空间异质性的影响. 生态学报, 2012, 32(1): 64- 73.
[24] 李瑞霞, 彭婷婷, 刘娜, 王东, 闵建刚, 关庆伟. 间伐对侧柏人工林碳储量以及细根生物量和形态的影响. 东北林业大学学报, 2013, 41(5): 34- 38.
[25] Sword M A. Seasonal development of loblolly pine lateral roots in response to stand density and fertilization. Plant and Soil, 1998, 200(1): 21- 25.
[26] Vargas R, Allen E B, Allen M F. Effects of vegetation thinning on above-and belowground carbon in a seasonally dry tropical forest in Mexico. Biotropica, 2009, 41(3): 302- 311.
[27] Tian D L, Peng Y Y, Yan W D, Fang X, Kang W X, Wang G J, Chen X Y. Effects of thinning and litter fall removal on fine root production and soil organic carbon content in Masson pine plantations. Pedosphere, 2010, 20(4): 486- 493.
[28] 安慧, 韦兰英, 刘勇, 上官周平. 黄土丘陵区油松人工林和白桦天然林细根垂直分布及其与土壤养分的关系. 植物营养与肥料学报, 2007, 13(4): 611- 619.
[29] 王韦韦, 黄锦学, 陈锋, 熊德成, 卢正立, 黄超超, 杨智杰, 陈光水. 树种多样性对亚热带米槠林细根生物量和形态特征的影响. 应用生态学报, 2014, 25(2): 318- 324.
[30] 王祖华, 李瑞霞, 郝俊鹏, 关庆伟. 间伐对杉木人工林不同根序细根形态的影响. 东北林业大学学报, 2011, 39(6): 13- 15, 19- 19.
[31] 武高林, 杜国祯. 植物形态生长对策研究进展. 世界科技研究与发展, 2007, 29(4): 47- 51.
[32] 李俊清, 臧润国, 蒋有绪. 欧洲水青冈(FagussylvaticalL.)构筑型与形态多样性研究. 生态学报, 2001, 21(1): 151- 155.
[33] 陈信力, 刁娇娇, 闵建刚, 关庆伟, 李瑞霞, 王东. 间伐强度和次数对侧柏人工林细根形态及生物量的影响. 西南林业大学学报, 2013, 33(4): 5- 11, 16- 16.
[34] 吴敏, 张文辉, 周建云, 马闯, 韩文娟. 干旱胁迫对栓皮栎幼苗细根的生长与生理生化指标的影响. 生态学报, 2014, 34(15): 4223- 4233.
[35] Iorio A D, Montagnoli A, Scippa G S, Chiatante D. Fine root growth ofQuercuspubescensseedlings after drought stress and fire disturbance. Environmental and Experimental Botany, 2011, 74: 272- 279.
Effects of thinning intensity on fine root biomass and morphological characteristics of middle-agedPinustabulaeformisplantations in the Huanglong Mountains
YOU Jianjian, ZHANG Wenhui*, DENG Lei, YU Biyun, LI Gang, HE Ting, FAN Rongrong
KeyComprehensiveLaboratoryofForestryinShaanxiProvince,NorthwestAgriculutreandForestryUniversity,Yangling712100,China
Pinustabulaeformisplantations play an important role in local water and soil conservation and ecological protection in the Loess Plateau. Because of the large surface area, short life span, and rapid turnover, fine root systems were considered an important part in material cycling, energy transportation, and soil and water conservation of the forest ecosystem. This study was conducted in a middle-agedP.tabulaeformisplantation, located in the Huanglong Mountains, south of Loess Plateau, China. Thinning was performed on three occasions in 2008 following afforestation: light thinning, medium thinning, and heavy thinning. Three replicates of thinned and un-thinned treatments (20 m×30 m) were selected in our research. Basic data of fine root biomass and morphological characteristics were collected from three soil depths (0—20 cm, 20—40 cm, and 40—60 cm) via root drilling methods. The results showed that fine root biomass increased with increasing thinning intensity up to the medium thinning treatment and then decreased in the heavy thinning treatment. Fine root biomass in the 0—20cm soil layer decreased significantly (P<0.05) under heavy thinning intensity compare with other treatments. The proportions of fine root biomass in the 20—40-cm and 40—60-cm soil layers increased with increasing thinning intensity. The differences in root length density and root surface area density between different thinning intensities and different soil layers were significant (P< 0.05), and exhibited a similar trend as the fine root biomass. With increased thinning intensity, specific root length and specific surface area of fine roots increased, and the differences were significant under heavy thinning (P<0.05). Light and medium thinning had a significant effect on finest diameter fine roots (0—1.0 mm), but no significant effect on fine roots (1.0—2.0 mm) (P<0.05), whereas heavy thinning had a significant effect on all roots (0—20 cm) (P<0.05). Fine roots may be distributed in the deep soil layer after thinning. Compared with fine roots, the finest ones were more sensitive to different thinning intensities. In this study, fine root biomass (1022.43 g/m2), along with the root length density and root surface area, peaked at the medium thinning intensity, which could be the appropriate silviculture practice for tree growth.
thinning intensity; middle-agedP.tabulaeformisplantation; fine root; biomass; morphological characteristics
国家林业局全国森林经营基础研究项目(1692016-03);黄土高原松栎林多功能近自然经营作业法及其效益监测研究
2016- 01- 15; 网络出版日期:2016- 12- 19
10.5846/stxb201601150100
*通讯作者Corresponding author.E-mail: zwhckh@163.com
尤健健,张文辉,邓磊,余碧云,李罡,何婷,樊蓉蓉.间伐对黄龙山油松中龄林细根空间分布和形态特征的影响.生态学报,2017,37(9):3065- 3073.
You J J, Zhang W H, Deng L, Yu B Y, Li G, He T, Fan R R.Effects of thinning intensity on fine root biomass and morphological characteristics of middle-agedPinustabulaeformisplantations in the Huanglong Mountains.Acta Ecologica Sinica,2017,37(9):3065- 3073.
