核磁共振代谢组学技术鉴别天然奶油与人造奶油
2017-06-22贾婧怡周瑞泽
李 玮,贾婧怡,李 龙,周瑞泽,周 雅
(北京市食品安全监控和风险评估中心,北京 100041)
核磁共振代谢组学技术鉴别天然奶油与人造奶油
李 玮,贾婧怡,李 龙,周瑞泽,周 雅
(北京市食品安全监控和风险评估中心,北京 100041)
采用核磁共振(nuclear magnetic resonance,NMR)代谢组学技术对天然奶油和人造 奶油的氘代氯仿(CDCl3)提取物进行了鉴别研究。结果表明:与麦淇淋相比,黄油中甾醇、丁酸、1-戊烯、共轭亚油酸含量较高,而总不饱和脂肪酸、亚油酸的含量较低;与植脂奶油相比,稀奶油中甾醇、丁酸、亚麻酸、亚油酸、1-戊烯、共轭亚油酸、总不饱和脂肪酸含量较高,而总饱和脂肪酸含量较低,并且都具有显著性差异(P<0.05)。其中脂肪酸的代谢组学分析结果与气相色谱法所得结果一致。建立的基于NMR代谢组学技术对天然奶油与人造奶油快速、简便的鉴别方法,可以鉴定不同种类奶油的差异化学成分,为奶油制品的品质鉴别和质量控制研究提供分析方法。
核磁共振;代谢组学;黄油;麦淇淋;稀奶油;植脂奶油
天然奶油是从牛奶、羊奶等动物乳中提取的黄色或白色脂肪性半固体食品,根据含脂量的不同可分为稀奶油和黄油(又称奶油),现行国标[1]中规定:脂肪含量在10.0%~80.0%的产品为稀奶油,脂肪含量不小于80.0%产品为黄油。由于天然奶油来源于动物乳,所以产能有限,为满足市场消费在1869年出现了人造奶油[2]。目前,国标[3]中定义:人造奶油(又称人造黄油)系指精制食用油添加水及其他辅料,经乳化急冷捏合成具有天然奶油特色的可塑性制品,也就是平时常说的麦淇淋。在20世纪40年代,美国人罗伯特·维益发明了植脂奶油,这种奶油是以食用氢化油、糖和/或甜味剂、增稠剂等为主要原料,经过乳化、杀菌、均质、冷却、灌装、冷冻等工艺制成的可打发制品[4]。植脂奶油无论是配方还是工艺,都和麦淇淋存在很大不同,但由于这两种奶油都不是来源于动物乳,所以相对于天然奶油来说,在广义上都应被称作人造奶油。在本研究中,为避免混淆,分别用黄油、稀奶油、麦淇淋和植脂奶油这4 个名称代表上述4 种奶油,其中黄油和稀奶油属于天然奶油,而麦淇淋和植脂奶油属于人造奶油。由于天然奶油产能有限,所以导致其价格居高不下,而人造奶油来源稳定,原料成本低廉,价格远低于天然奶油。但在实际应用和商品流通中,由于黄油与麦淇淋在外观、特性与用途上较为相近,而稀奶油与植脂奶油较为相似,不法商家为了追求利益,并不在商品上注明所用奶油的种类,混淆人们对天然和人造奶油的区别,妄图以价格低廉的麦淇淋充当黄油,低价的植脂奶油充当稀奶油,损害消费者权益,但目前尚无健全的鉴别二者的方法。
天然奶油成分复杂,因其原料乳组分受牧草生长、饲料来源、奶牛的年龄和泌乳期的影响,天然奶油脂肪酸的组成呈现明显的季节性和区域性变化[5];而人造奶油因制作原料种类、生产工艺及使用添加剂种类和用量的不同,其化学成分亦存在着较大差异。因此,对奶油种类的鉴别单纯依靠传统定量分析方法难以实现,需采用整体研究思路。代谢组学是有机化学、分析化学、化学计量学、信息学和基因组学、表达组学等多学科将结合的交叉学科[6],以组群指标分析为基础,以高通量检测和数据处理为手段,具有整体观的研究思路[7]。核磁共振(nuclear magnetic resonance,NMR)是有机物结构分析的强有力工具,对食品等复杂体系的整体分析具有天然优势[8-11],与气相色谱法等动植物油中脂肪酸组成的测定方法[12-14]相比,具有高通量、重现性好、操作简便、结构信息丰富等优点,已被用于多种植物油及其他脂类成分的分析中[15-19]。由于通过NMR所得到的样品信息具有数据信息复杂、多维数据矩阵内各变量之间具有高度的相关性等特点,常常无法用传统的单变量分析方法进行提取,与多元统计分析手段结合后不仅可以确定样本之间的相似性或均一性,而且可以高分辨、高效率地确定出引起组间差异的化学成分,且能对那些因为化学结构相似而无法通过味道、气味或颜色进行分辨的物质进行有效区分。因此,基于NMR的代谢组学技术特别适合于食品等复杂体系真伪鉴别、质量评价与分析[20-24]。目前,有采用核磁共振氢谱(1H nuclear magnetic resonance,1H-NMR)法测定奶油中主要脂肪酸等成分的报道[25-26],但少见NMR法用于天然奶油、人造奶油鉴别及化学差异成分的研究。
本研究在对奶油中脂类化学成分鉴定研究的基础上,采用1H-NMR法结合多元统计分析的代谢组学方法对市售的天然奶油、人造奶油的氘代氯仿(CDCl3)提取物进行分析。并且根据实际监管需求,分别针对黄油和麦淇淋、稀奶油和植脂奶油建立了辨别模型,研究不同种类奶油的差异性脂类成分,为天然奶油和人造奶油的快速鉴别提供依据。
1 材料与方法
1.1 材料与试剂
市场上采集了40 份不同品牌、产地的奶油样品(表1),其中黄油、稀奶油、麦淇淋和植脂奶油各10 份。黄油、麦淇淋和稀奶油4 ℃存放,植脂奶油-20 ℃存放,使用前常温融化,避免反复冻融。所有样品均在保质期前使用。
氘代氯仿(CDCl3,氘代度:99.8%) 美国CIL公司;Norell5 mm核磁管 美国Norell公司;37 种脂肪酸甲酯混合标准样品 美国AccuStandard公司;共轭亚油酸混合标准品 美国Nu-Chek公司。

表1 用于1H-NMR分析的40 个奶油样品信息Table1 Samples used for analysis by1HH--NNMMRR
1.2 仪器与设备
AVANCE 600MHZ超导傅里叶变换NMR仪(配有BBO探头和topspin3.2处理软件) 瑞士Bruker公司;XS204电子天平 瑞士Mettler Toledo公司;Centrifuge 5424R离心机 德国Eppendorf公司;TissueLyser II均质器 德国Qiagen公司;7890B气相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 样品溶液的制备
称取适量奶油样品(黄油、麦淇淋样品约150 mg,稀奶油、植脂奶油样品约500 mg)于2 mL EP管中,加入1 mL CDCl3,置于均质器中均质40 s(30 Hz)后放入离心机中,4 ℃条件下8 000 r/min离心10 min。移取600 μL离心后得到的清液于5 mm核磁管中,待测。
1.3.2 仪器条件
1H-NMR谱测定条件:NMR仪1H载波频率为600.13 MHz,使用Bruker标准脉冲序列noesyig1d,检测温度为297 K,1H的90°脉冲宽度为10.04 μs,谱宽为6 002.40 Hz,中心频率为2 400.52 Hz,脉冲延迟时间为10 s,混合时间为0.01 s,13C的去耦序列90°脉冲为260 μs,扫描次数为32,空扫次数为4。
一维全相关实验(1D total correlation spectroscopy,1D-TOCSY)谱测定条件:实验使用selcssfdizs.2脉冲序列,混合时间设为0.8 s,扫描次数为128。
1.3.3 谱图处理和数据分析
测得的1H-NMR谱使用Bruker Topspin 3.2软件处理,变换点数为64 536,线宽因子为1.00 Hz,用指数窗函数处理,基线和相位校正均采用手动方式进行,四甲基硅烷为内标信号(δ 0.00)。处理后的图谱用MestReNova(version 6.0.1,Spain)软件,以δ 0.005积分段对化学位移区间δ 0.40~7.00进行分段积分并进行面积归一化处理。将上述所得数据导入SIMCA-p 11.0(Umetrics, umea, Sweden)软件进行主成分分析(principal component analysis,PCA)和偏最小二乘法-判别分析(partial least squares-discriminate analysis,PLS-DA),两种分析均选用帕莱托换算的数据标度换算方式。PLS-DA模型采用交叉验证Q2值、排列检验对判别分析所建立的模型进行评判,对于成立的PLS-DA模型,在对数据进行回溯转换后用Matlab(V7.0.4,Mathworks Inc., U.S.A.)软件进一步绘制针对每个变量的皮尔森相关系数负载图找出组间有显著性差异的化学成分,通过查阅相关系数表,确定相关系数r 大于0.63作为临界值(P<0.05),小于此系数忽略不计。
1.3.4 气相色谱法测定主要脂肪酸
参照GB 5413.27—2010《婴幼儿食品和乳品中脂肪酸的测定》[27]和NY/T 1671—2008《乳及乳制品中共轭亚油酸(CLA)含量测定 气相色谱法》[28]测定4 种奶油中主要脂肪酸的含量。以保留时间定性,在色谱图上去除杂峰,检出所有脂肪酸甲酯,对脂肪酸甲酯的峰面积求和,每个脂肪酸甲酯峰面积占总脂肪酸甲酯峰面积的百分数就是其占总脂肪酸的相对含量。共轭亚油酸采用外标法进行定量。
色谱条件:HP-88毛细管柱(100.0 m×0.25 mm, 0.20 μm);进样口温度:260 ℃;进样量:1.0 μL,分流比30∶1。37 种脂肪酸甲酯测定升温程序:初始温为130 ℃,以6.5 ℃/min升至170 ℃,以2.75 ℃/min升至205 ℃,保持15 min,再以2.75 ℃/min升至215 ℃,保持5 min,再以4 ℃/min升至230 ℃,保持6 min。共轭亚油酸定升温程序:120 ℃,维持10 min,以3.2 ℃/min升温至230 ℃,维持35 min。
2 结果与分析
2.1 采样参数的确定
扫描次数较少会造成数据重复性差,较多会使数据重复性好,提高信噪比,但同时也会延长实验时间。综合考虑实验的经济性及图谱的稳定性,在本研究中选取扫描次数为32 次即能满足分析要求。弛豫过程是NMR现象发生后得以保持的必要条件,其中纵向弛豫时间代表纵向磁化强度向平衡态回复的动态过程常数。在实验中应选取合适的弛豫延迟时间,保证谱峰强度不会被饱和,这样才有利于得到稳定的图谱结果。实验表明,当选取脉冲延迟时间为10.0 s时,即可满足本研究的分析要求。
2.21H-NMR图谱指认
图1为黄油、稀奶油、麦淇淋和植脂奶油的CDCl3提取物的1H-NMR谱图。根据文献[29-30]报道,对这9 组主要信号峰进行了归属,详见表2。
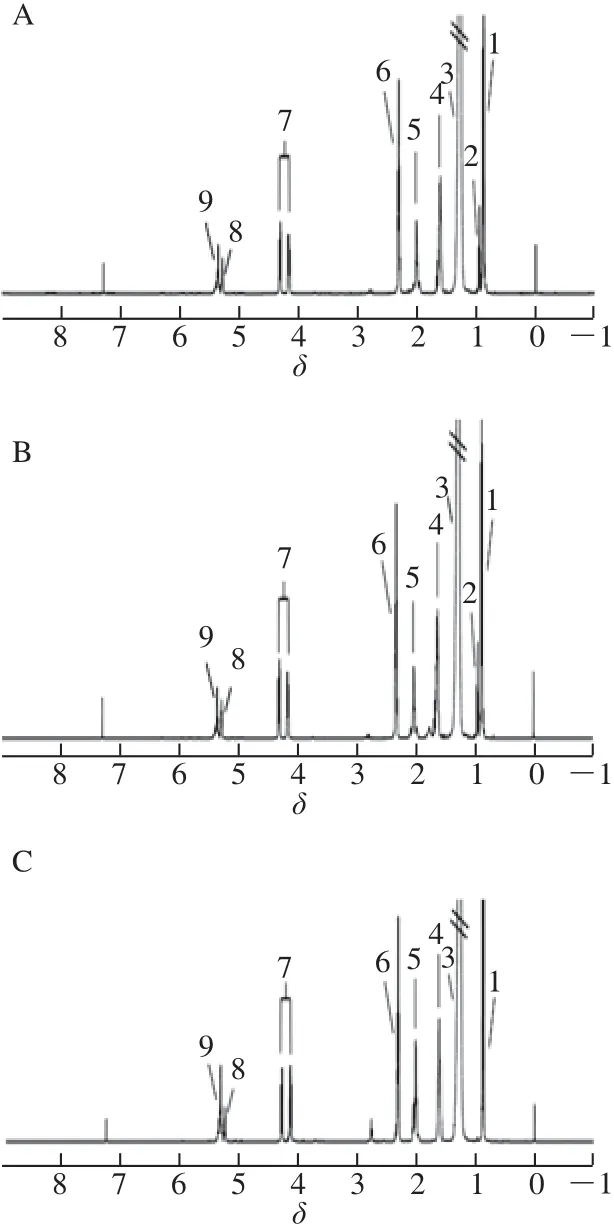

表2 4 种奶油中脂类成分1H-NMR主要化学位移归属Tabllee 221HH--NNMMRR mmaajjoorr cchheemmiiccaall sshhiifftt aassssiiggnnmmeennttss ooff lliippiiddss iinn bbuutttteerr,, ccrreeaamm,, margarine and non-dairy whip topping

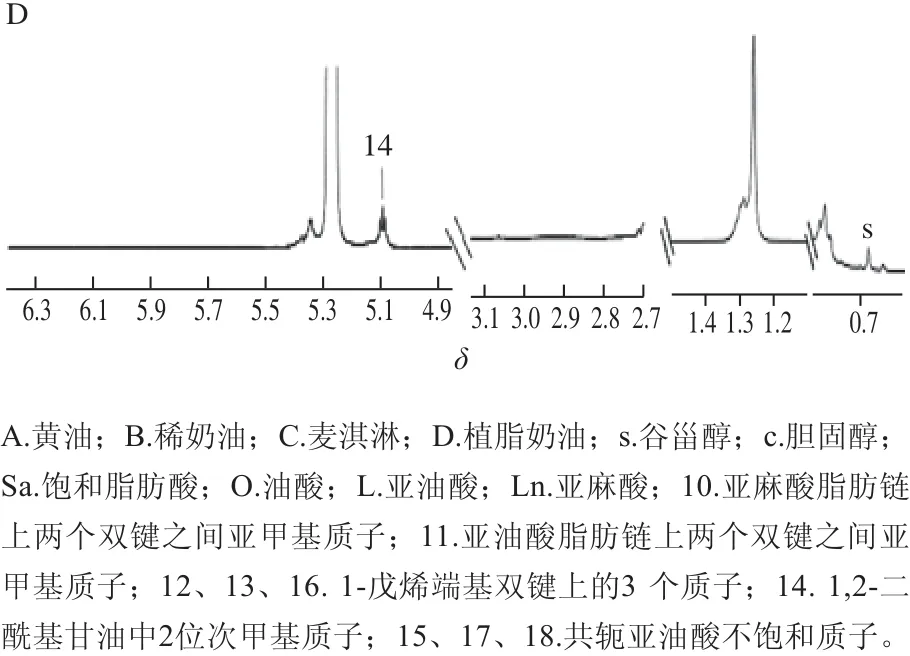
图2 4 种奶油CDCl3提取物的1H-NMR图谱放大图Fig.2 Enlargement of1H-NMR spectra of the lipids of butter, cream, margarine and non-dairy whip topping
图2为黄油、稀奶油、麦淇淋和植脂奶油的CDCl3提取物的1H-NMR谱图的放大图。根据1H-NMR谱中化学位移和信号裂分模式以及1D-TOCSY、1H-1H COSY、J分辨谱等多种NMR图谱所提供的偶合信息,并参考文献和相关脂肪酸标准品实验数据对1H-NMR谱中其他信号峰进行归属。在4 种奶油的1H-NMR谱放大图中,在δ 0.68处都有一个单峰为甾醇类物质13位上角甲基质子信号,黄油和稀奶油图谱中为胆固醇13位上角甲基质子信号,而麦淇淋和植脂奶油为谷甾醇13位上角甲基质子信号;δ 1.11~1.47为长链脂肪酸一般性亚甲基质子信号,通过与标准品的对比分析,得出δ 1.256为饱和脂肪酸链上的一般性亚甲基质子信号,δ 1.286为油酸脂肪酸链上的一般性亚甲基质子信号,δ 1.298为油酸、亚油酸、亚麻酸等不饱和脂肪酸链上的一般性亚甲基质子信号;图2中10、11号峰分别为亚麻酸和亚油酸脂肪链上两个双键之间亚甲基质子信号;12、13、16号峰为1-戊烯端基双键上的三个质子信号;14号峰为1,2-二酰基甘油中2位次甲基质子信号;15、17、18信号为共轭亚油酸不饱和质子信号。
2.3 PCA结果
为观察样品整体的聚类情况以及是否存在离群点,对4 种奶油CDCl3提取物NMR谱图进行PCA,结果见图3。前两个主成分(PC1为67.5%、PC2为16.1%)得分图可以较好地反映不同种类奶油的丛集分布。其中麦淇淋组、植脂奶油组分别和黄油组、稀奶油组在组间有较好的分离趋势,但同属天然奶油的黄油和稀奶油的分离趋势不明显。这是因为黄油和稀奶油的制作原料和工艺较为相似,其甘油三酯中主要脂肪酸的成分也较为相似。同时得分图也显示,植脂奶油组、黄油组和稀奶油组组内样本较为集中,表明这3 组的组内差异较小;而麦淇淋组组内样本分布散开,表明其组内差异较大。
PCA为无监督的模式识别方法,这类方法是从数据本身出发,在没有任何外界指导的情况下,考察数据的整体性质以及内部变量的各种关系[31]。但无监督的模式识别不能忽略组内误差,消除与研究目的无关的随机误差,忽略了数据的整体特征与变化规律,不利于寻找组间差异和差异代谢物[7]。因此为了寻找黄油与麦淇淋,稀奶油与植脂奶油之间的化学差异成分,本研究采用有监督的PLS-DA对数据进行分析。
2.4 PLS-D A结果
PLS-D A是有监督的模式识别方法,在实验数据中,通过这种处理方法可以最大程度地反映分类组别之间的差异,还可以观察NMR数据和与分类模型相关的其他变量之间的相关关系。分别对黄油与麦淇淋,稀奶油与植脂奶油的NMR图谱进行PLS-DA,两个模型前两个主成分的交叉验证Q2分别为0.974和0.963。在此之后,通过排列实验随机多次(n=200)改变分类变量y的排列顺序得到相应不同的随机Q2和R2值对模型有效性做进一步的检验,如图4所示。以模型可预测指标Q2并结合排列实验验证结果共同提示,黄油组与麦淇淋组以及稀奶油组与植脂奶油组所建模型成立,说明组间出现了显著性差异。
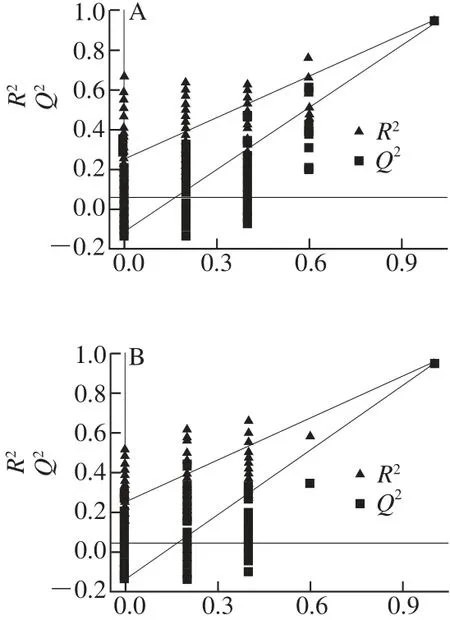
图4 黄油与麦淇淋PLS-DA模型(A)、稀奶油与植脂奶油PLS-DA模型(B)排列实验Fig.4 Permutation test plots for model validation
图5 PLS-DA得分图与相关系数的载荷图Fig.5 PLS-DA score plots and loading plots of correlation coefficients for butter against margarine, and cream against non-dairy whip topping
图5A、C分别为黄油与麦淇淋、稀奶油和植脂奶油的PLS-DA模型得分图,结果显示,在两个模型中黄油与麦淇淋、稀奶油和植脂奶油能够得到很好的区分。通过回溯转换得到表示两个模型中组间差别的相关系数负载图,结果见图5B、D以及表3。图5B显示:黄油组中的甾醇、丁酸、1-戊烯、共轭亚油酸含量显著高于麦淇淋组,而总不饱和脂肪酸、亚油酸的含量显著低于麦淇淋组。同时,黄油组中的甘油三酯中丙三醇的亚甲基(δ 4.10~4.38)和次甲基(δ 5.24~5.29)信号显著高于麦淇淋组,这说明黄油比麦淇淋的甘油三酯中所含有更多的短链脂肪酸。这些均表明黄油与麦淇淋比较具有显著性差异(r >0.63,n=10,P<0.05)。图5D显示:稀奶油组中的甾醇、丁酸、亚麻酸、亚油酸、1-戊烯、共轭亚油酸、总不饱和脂肪酸含量显著高于植脂奶油组,而总饱和脂肪酸的含量显著低于植脂奶油组,表明这两种奶油比较具有显著性差异(r >0.63,n=10,P<0.05)。因此,可以看出甾醇、丁酸、共轭亚油酸、1-戊烯、亚油酸、短链脂肪酸及总不饱和脂肪酸的含量差异,影响着天然奶油与人造奶油核磁代谢组学的分类。
表3 黄油与麦淇淋、稀奶油与植脂奶油PLS-DA组间差异化合物及其相关系数Table3 Compounds with significant contributions to the discrimination between butter and margarine, and between cream and non-dairy whip topping
此外,在对黄油与麦淇淋PLS-DA模型相关系数的载荷图(图5B)进行分析发现,在δ 1.96(a)和δ 2.37(b)两处的相关系数分别为0.80和-0.84,说明这两种物质在两种奶油中的含量具有显著性差异。由于奶油中甘油三酯结构相似,形成混合甘油酯的1H-NMR谱信号严重重叠,难以区分,所以在1H-NMR图谱中,这两个信号峰与周围的信号峰相重叠,难以辨识,无法进行定性分析。但在相关系数的载荷图中,δ 1.96(a)和δ 2.37(b)信号被凸显出来,有了进一步被定性分析的可能。为了进一步对这两个峰进行定性分析,采用化学位移选择性滤波(chemical-shift-selective filter,CSSF)的1D-TOCSY实验方法,分别对黄油样品1H-NMR谱δ 2.37和δ 1.96两个化学位移处进行精确激发,分别得到δ 0.91-1.27~1.35-1.65-2.37和δ 0.90-0.98-1.27~1.37-1.96-5.40两个质子偶合体系,结果见图6。结合2.1节中对1H-NMR图谱指认的相关信息,进一步推断出b为甘油三酯中一饱和脂肪酸,a为单烯烃。
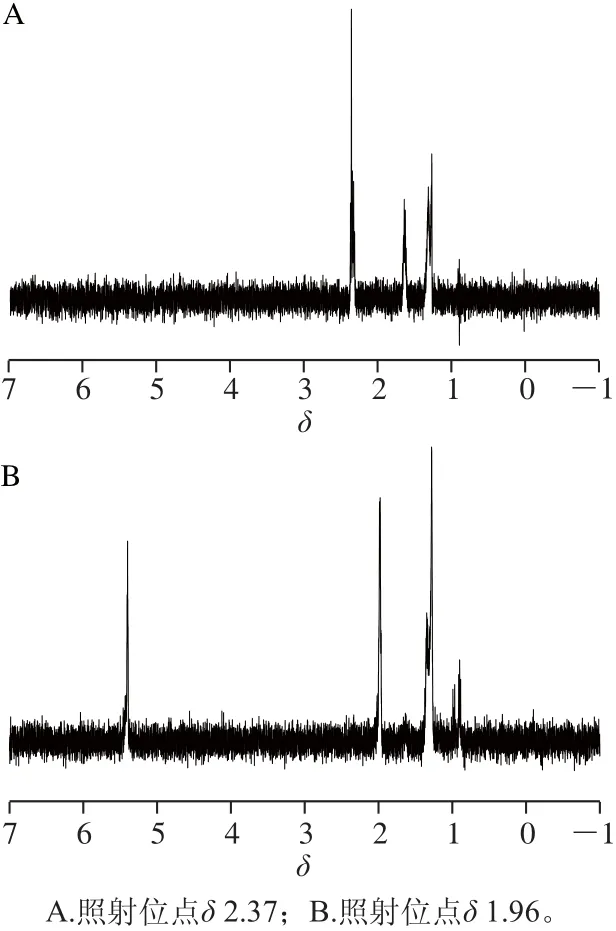
图6 黄油CDCl3提取物选择性照射1H的1D-TOCSY的CSSSSFF图谱Fig.6 1D-TOCSY B (CSSF) spectra of butter extracts obtained with CDCl3with selective excitation of1H
2.5 气相色谱法测定脂肪酸
为了对代谢组学分析的结果进行验证,采用气相色谱法对B-2(黄油)、M-2(麦淇淋)、C-2(稀奶油)、N-2(植脂奶油)4 种不同具有代表性的奶油中主要的脂肪酸进行了含量测定,结果见表4。气相色谱法的测定结果表明,与麦淇淋相比,黄油中丁酸、共轭亚油酸含量高于麦淇淋,而总不饱和脂肪酸、亚油酸的含量则低于麦淇淋,同时黄油中含有的短链脂肪酸也要高于麦淇淋;与植脂奶油相比,稀奶油中丁酸、亚麻酸、亚油酸、共轭亚油酸、总不饱和脂肪酸含量高于植脂奶油,而总饱和脂肪酸含量低于植脂奶油。该定量分析结果与核磁代谢组学分析结果基本一致。

表4 4 种奶油中主要脂肪酸含量Table4 Contents of fatty acids in butter, cream, margarine and non-dairy whip topping %
牛乳中脂肪酸组成主要为短链脂肪酸(C4~C10)和中链脂肪酸(C11~C17),其中含4 个碳的丁酸为牛乳中所特有的脂肪酸,而天然来源的共轭亚油酸也是主要存在于反刍动物的肉及乳中。植物油中脂肪酸组成主要为中链脂肪酸(C11~C17)和长链脂肪酸(大于C18),其中所含的不饱和脂肪酸较多。黄油和稀奶油为天然奶油,均来源于天然乳脂,所以其脂肪酸组成与牛乳类似,含有丁酸、共轭亚油酸及较多的饱和脂肪酸。麦淇淋则是以植物油为主要原料的人造奶油,其脂肪酸组成与植物油的脂肪酸组成相似,不饱和脂肪酸的含量较高。植脂奶油现多以氢化棕榈仁油为原料,所以其中的脂肪酸以饱和脂肪酸为主,并且麦淇淋和植脂奶油中均不含有丁酸及共轭亚油酸。因此,代谢组学的分析结果与奶油制作原料的脂肪酸组成相符。
3 讨 论
由于制作麦淇淋的基料油品种繁多,加上生产工艺的不同,各国生产的麦淇淋的脂肪成分都存在差别,据相关统计,目前全世界生产的麦淇淋品种约有500 余种。本研究中PCA及PLS-DA均显示,与其他3 种奶油相比,麦淇淋的样本分布较为分散,说明其样本的组内差异较大。经过进一步图谱的对比分析,发现差异最大的M-7号样品所含的不饱和脂肪酸明显少于另外9 个麦淇淋样品。因此,在今后的工作中,需增加麦淇淋的样本量,使分类模型更加准确、更具代表性。
奶油中主要的脂类成分为由甘油和脂肪酸形成的甘油三酯,最常见的脂肪酸为棕榈酸、丁酸等饱和脂肪酸和油酸、亚油酸等不饱和脂肪酸。由于这些脂肪酸的结构较为相似,形成混合甘油酯的1H-NMR谱信号严重重叠,难以区分,同时脂肪酸的单纯甘油酯的标准品也较难获得,所以使得甘油三酯中的脂肪酸成分的1H-NMR谱分析更加困难。NMR技术中的1D-TOCSY技术能够得到激发核以及与其在同一个自旋体系的质子的信号,而非该自旋体系的其他质子信号则不出现在谱图中。因此,在用NMR方法研究含有多个脂肪链的甘油三酯等化合物的化学结构时,可将氢谱中谱峰严重重叠的多个脂肪酸逐个分辨出来。与一般的选择性1D-TOCSY实验方法相比,CSSF脉冲序列中有两个180梯度选择可以将J偶合的调制重聚,并且此序列中的零量子压制也在一定程度上会改善图谱的质量,所以对1D-TOCSY来说CSSF的实验效果要优于不含CSSF的序列,更适于食品等复杂基质的定性图谱分析。本研究将相关系数负载图与CSSF 1D-TOCSY技术相结合,对具有显著性差异的非目标成分进行定性分析,为食品安全监控工作中非目标化合物的定性提供有力技术支持。
要从根本上解决食品安全性问题,首先必需要找到一种判别食品质量好坏的方法。目前,红外、色谱、质谱等分析技术结合模式识别的数据分析方法在食品掺伪分析、质量控制等领域中得到应用,但由于这些分析技术都具有偏性,所以难以完成对食品复杂体系的全面分析。与传统分析方法相比,NMR技术的脉冲组合丰富多样,实验方式灵活多变,在解决非目标物的定性分析上更客观、可靠,大大地提高了所能解决的难度和增加了解决问题途径的多样性。1H-NMR的谱峰与样品中各化合物的氢原子一一对应,图谱中信号的相对强弱反映样品中各组分的相对含量,检测没有偏性,结合多种NMR手段,能快速实现对非目标物的定性分析。基于NMR代谢组学技术在建立辨别模型、寻找差异化学成分的同时,还能结合多种NMR技术对非目标成分进行定性分析,充分显示出高场NMR技术在食品等复杂混合物体系中对非目标成分快速定性的优势,为主动发现食品中存在风险积累成功经验。并且随着NMR仪器分辨率的提高、价格的降低和单次测试成本降低,基于NMR代谢组学技术将在食品安全监控工作的实际应用中得到进一步发展。
[1] 卫生部. 稀奶油、奶油和无水奶油: GB 19646—2010[S]. 北京: 中国标准出版社, 2010.
[2] 魏翠平, 王瑛瑶, 栾霞. 人造奶油研究现状及其制备技术[J]. 中国食物与营养, 2011, 17(6): 32-35. DOI:10.3969/j.issn.1006-9577.2011.06.008.
[3] 商业部. 人造奶油(人造黄油): LS/T 3217—1987[S]. 北京: 中国标准出版社, 1987.
[4] 商业部. 植脂奶油: SB/T 10419—2007[S]. 北京: 中国标准出版社, 2007.
[5] 刘志东, 黄洪亮, 沈建, 等. 黄油的研究进展[J]. 农产品加工, 2012(10): 93-97. DOI:10.3969/j.issn.1671-9646(X).2012.10.028.
[6] 漆小泉, 王玉兰, 陈晓亚. 植物代谢组学: 方法学与应用[M]. 北京:化学工业出版社, 2011: 1-2.
[7] 李爱平, 李震宇, 邢婕, 等. 核磁共振代谢组学技术检测食醋化学成分[J]. 食品科学, 2013, 34(12): 247-253. DOI:10.7506/spkx1002-6630-201312051.
[8] 阎政礼, 杨明生, 李添宝, 等. 蜂蜜中葡萄糖、果糖和蔗糖NMR定量分析研究[J]. 食品科学, 2009, 30(14): 253-255. DOI:10.3321/ j.issn:1002-6630.2009.14.055.
[9] MARIA R M, COLNAGO L A, FORATO L A, et al. Fast and simple nuclear magnetic resonance method to measure conjugated linoleic acid in beef[J]. Journal of Agricultural Food Chemistry, 2010, 58(11): 6562-6564. DOI:10.1021/jf100345e.
[10] SOPELANA P, ARIZABALETA I, IBARGOITIA M, et al. Characterisation of the lipidic components of margarines by1H nuclear magnetic resonance[J]. Food Chemistry, 2013, 141: 3357-3364. DOI:10.1016/j.foodchem.2013.06.026.
[11] 姜洁, 李玮, 路勇, 等. 核磁共振脉冲宽度法测定婴幼儿乳粉中乳糖、蔗糖含量[J]. 食品工业科技, 2015, 36(8): 68-71; 77. DOI:10.13386/j.issn1002-0306.2015.08.005.
[12] 国家质量监督检验总局. 动植物油脂脂肪酸甲酯的气相色谱分析:GB/T 17377—2008[S]. 北京: 中国标准出版社, 2008.
[13] ZOU X Q, HUANG J H, JIN Q Z, et al. Lipid composition analysis of milk fats from different mammalian species: potential for use as human milk fat substitutes[J]. Journal of Agricultural Food Chemistry, 2013, 61: 7070-7080. DOI:10.1021/jf401452y.
[14] 潘雨时, 热娜古丽·木沙, 陈悦, 等. GC-MS分析新疆拜城油鸡和南京土鸡鸡皮脂质中脂肪酸组成[J]. 食品科学, 2015, 36(16): 122-126. DOI:10.7506/spkx1002-6630-201516022.
[15] SPYROS A, DAIS P. Application of31P NMR spectroscopy in food analysis. 1. Quantitative determination of mono- and diglyceride composition of olive oils[J]. Journal of Agricultural Food Chemistry, 2000, 48: 802-805. DOI:10.1021/jf9910990.
[16] VIGLI G, PHILIPPIDIS A, SPYROS A, et al, et al. Classification of edible oils by employing31P and1H-NMR spectroscopy in combination with multivariate statistical analysis. A proposal for the detection of seed oil adulteration in virgin olive oils[J]. Journal of Agricultural Food Chemistry, 2003, 51: 5715-5722. DOI:10.1021/jf030100z.
[17] MANNINA L, PATUMI M, PROIETTI N, et al. Geographical characterization of Italian extra virgin olive oils using high-field1H-NMR spectroscopy[J]. Journal of Agricultural Food Chemistry, 2001, 49: 2687-2696. DOI:10.1021/jf001408i.
[18] ELISABETTA S, GABRIELLA P, GIULIO C, et al. Identification of production chain of Asiago d’Allevo cheese by nuclear magnetic resonance spectroscopy and principal component analysis[J]. Journal of Agricultural Food Chemistry, 2008, 56: 7208-7214. DOI:10.1021/ jf801391w.
[19] 李玮, 姜洁, 路勇, 等. NMR氢谱定量测定奶酪中总共轭亚油酸的含量[J]. 食品科学, 2015, 36(10): 134-138. DOI:10.7506/spkx1002-6630-201510027.
[20] 田俊生, 那丽丹, 向欢. 基于核磁代谢组学的驴皮与其伪品的鉴别研究[J]. 中草药, 2015, 46(2): 255-261. DOI:10.7501/ j.issn.0253-2670.2015.02.020.
[21] ANDREOTTI G, TRIVELLONE E, LAMANNA R, et al. Milk identification of different species:13C-NMR spectroscopy of triacylglycerols from cows and buffaloes’ milks[J]. Journal of Dairy Science, 2000, 83(11): 2432-2437. DOI:10.3168/jds.S0022-0302(00)75133-2.
[22] 宋爱华, 沙沂, 徐晓雪, 等. 基于1H-NMR技术的锥叶柴胡与北柴胡鉴别研究[J]. 波谱学杂志, 2014, 31(2): 214-221.
[23] GWENAELLE G, MAX P, IAN C. Discrimination between orange juice and pulp wash by1H nuclear magnetic resonance spectroscopy:identif i cation of marker compounds[J]. Journal of Agricultural Food Chemistry, 2001, 49: 580-588. DOI:10.1021/jf001046e.
[24] EDOARDO C, ARJEN L, SAMUEL H, et al. Wild salmon authenticity can be predicted by1H-NMR spectroscopy[J]. Lipid Technology, 2012, 24(11): 251-253. DOI:10.1002/lite.201200235.
[25] SCHRIPSEMA J. Comprehensive analysis of polar and apolar constituents of butter and margarine by nuclear magnetic resonance, reflecting quality and production processes[J]. Journal of Agricultural Food Chemistry, 2008, 56(8): 2547-2552. DOI:10.1021/jf072274c.
[26] SOPELANA P, ARIZABALETA I, IBARGOITIA M, et al. Characterisation of the lipidic components of margarines by1H nuclear magnetic resonance[J]. Food Chemistry, 2013, 141(4): 3357-3364. DOI:10.1016/j.foodchem.2013.06.026.
[27] 卫生部. 婴幼儿食品和乳品中脂肪酸的测定: GB 5413.27—2010[S].北京: 中国标准出版社, 2010.
[28] 农业部. 乳及乳制品中共轭亚油酸(CLA)含量测定 气相色谱法:NY/T 1671—2008[S]. 北京: 中国标准出版社, 2008.
[29] GUILLEN M, RUIZ A. Rapid simultaneous determination by proton NMR of unsaturation and composition of acyl groups in vegetable oils[J]. European Journal of Lipid Science and Technology, 2003, 105(11): 688-696. DOI:10.1002/ejlt.200300866.
[30] RAFFAELE S, FRANCESCO A, LIVIO P.1H and13C NMR of virgin olive oil. An overview[J]. Magnetic Resonancein Chemistry, 1997, 35(13): 133-145. DOI:10.1002/(SICI)1097.
[31] EBBLES T M D, CAVILL R. Bioinformatic methods in NMR-based metabolic profiling[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 2009, 55(4): 361-374. DOI:10.1016/ j.pnmrs.2009.07.003.
Differentiating Butter (Cream) from Margarine (Non-Dairy Whip Topping) Based on Metabolomics by NMR Spectrometry
LI Wei, JIA Jingyi, LI Long, ZHOU Ruize, ZHOU Ya
(Beijing Municipal Center for Food Safety Monitoring and Risk Assessment, Beijing 100041, China)
Butter and cream are natural food products containing partially saturated animal fat while margarine and non-dairy whip topping contain refine d and preternaturally saturated vegetable oils. Thus, butter and cream are more expensive than margarine and non-dairy whip topping. In the food industry, margarine is widely used as butter while non-dairy whip topping is used as cream. In order to find an analytical tool to differentiate butter (cream) from margarine (non-dairy whip topping), we used1H nuclear magnetic resonance (1H-NMR) to analyze the compositions of extracts (CDCl3) of the four species. We found that the levels of cholesterol, butyrate, 1-penten and conjugated linoleic acid were higher, while total unsaturated fatty acid and linoleic acid were lower in the butter than in the margarine. Cholesterol, butyrate, linoleic acid, linoleic acid, 1-penten, conjugated linoleic acid, and total unsaturated fatty acid were higher while total saturated fatty acid was lower in the cream than in the nondairy whip topping. All these differences were significant (P < 0.05). Partial least squares discriminant analysis (PLS-DA) was used to find the characteristic components in each group, and the results for fatty acids were consistent with those obtained with gas chromatography (GC). Conclusively, an identification method for butter (cream) and margarine (non-dairy whip topping) based on1H-NMR metabolomics has been established for the first time, which can provide an analytical method for the quality identification and control of butter (cream).
1H nuclear magnetic resonance spectroscopy (1H-NMR); metabolomics; butter; margarine; cream; non-dairy whip topping
10.7506/spkx1002-6630-201712043
TS201.2
A
1002-6630(2017)12-0278-08
李玮, 贾婧怡, 李龙, 等. 核磁共振代谢组学技术鉴别天然奶油与人造奶油[J]. 食品科学, 2017, 38(12): 278-285.
10.7506/spkx1002-6630-201712043. http://www.spkx.net.cn
LI Wei, JIA Jingyi, LI Long, et al. Differentiating butter (cream) from margarine (non-dairy whip topping) based on metabolomics by NMR spectrometry[J]. Food Science, 2017, 38(12): 278-285. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712043. http://www.spkx.net.cn
2016-07-18
北京市优秀人才培养资助项目(201400002717G316)
李玮(1984—),女,高级工程师,博士,研究方向为食品营养与安全。E-mail:liwei@bjmu.edu.cn
