实时荧光定量RT-PCR法快速定量检测果蔬中星状病毒
2017-06-22魏海燕徐蕾蕊魏咏新张西萌付溥博赵晓娟
马 丹,魏海燕,徐蕾蕊,魏咏新,汪 琦,张西萌,付溥博,刘 莉,赵晓娟,曾 静*
(北京出入境检验检疫局检验检疫技术中心,北京 100026)
实时荧光定量RT-PCR法快速定量检测果蔬中星状病毒
马 丹,魏海燕,徐蕾蕊,魏咏新,汪 琦,张西萌,付溥博,刘 莉,赵晓娟,曾 静*
(北京出入境检验检疫局检验检疫技术中心,北京 100026)
目的:针对不同果蔬表面建立星状病毒富集与RNA提取方法,结合已报道的实时荧光定量逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)引物和探针,实现果蔬中星状病毒的高灵敏快速定量检测。方法:利用10 倍梯度稀释的星状病毒cRNA分子检测Ct值及其对应的初始浓度,构建标准曲线,为星状病毒的 定量检测提供参考。将ISO/TS 15216-2:2013针对果蔬中诺如病毒和甲肝病毒RNA的提取方法用于星状病毒的检测,利用人工感染的大白菜和草莓样品,分析病毒回收率、灵敏度及检测重复性。最终通过60 份果蔬样品的检测验证该方法的实用性。结果:所建立的实时荧光定量RT-PCR方法扩增效率达95.9%,检测低限为5.6 拷贝/反应。人工感染的大白菜样品中病毒回收率在0.94%~9.63%之间,而人工感染草莓样品中病毒回收率最高达1.03%。对同一感染浓度的样品在不同时间的检测结果变异系数均小于2%。最终检出1 份来自北京农贸市场的草莓样品为星状病毒阳性,检测阳性率达1.67%。结论:建立的果蔬中星状病毒荧光RT-PCR定量检测方法快速、高效、灵敏,在食源性病毒的日常筛查和风险评估工作中具有重要的应用价值。
星状病毒;实时荧光定量RT-PCR;果蔬;定量检测
星状病毒(human astrovirus,HAstV)是引起婴幼儿、老年人及免疫功能低下者急性病毒性肠炎的重要病原之一[1-2],有较强的离体存活力和感染性,一般10~200 个病毒粒子即可引发感染[3],主要通过粪口途径传播[4-5]。20世纪70年代在儿童的腹泻标本中使用电镜发现了星状病毒,随着分子检测技术不断的发展,对该病毒的研究逐渐增多。目前,确认HAstV是导致病毒性腹泻的重要病原体[6-7],在一些国家的调查中发现HAstV的感染已相当普遍,阳性检出率在2%~9%之间[8-9],如肯尼亚为6.3%[10],美国和英国的检出率为4%,我国对1998—2005年来自7 个地区的1 668 份腹泻患儿粪便标本进行检测,HAstV感染平均阳性率为5.5%[11],而据文献报道,2011年南昌市发生一起HAstV暴发流行事件[12]。果蔬等生鲜农产品作为高风险的食品,通常不经烹饪直接生食,且在供应链中的不同环节都容易被污染,如人类粪便污染的灌溉用水、肥料、食物处理用水、食物处理者的不卫生操作、交叉污染等[13],因而也成为HAstV的常见传染源。目前国内对HAstV检测的研究重点主要集中在临床粪便样品和水产品中,缺乏果蔬中HAstV污染的相关报道,因此亟需建立果蔬中HAstV快速定量检测方法,为下步的食品安全风险评估和流行病学调查提供参考依据。
本实验将国际标准ISO/TS 15216-2:2013[14]中提取果蔬表面诺如病毒和甲肝病毒RNA的技术应用到HAstV中,并结合已报道的实时荧光定量逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)引物和探针[15]及通过体外转录构建的HAstV cRNA标准分子,建立起果蔬中HAstV的高灵敏快速定量检测方法。利用人工感染的大白菜和草莓样品,分析了不同果蔬中病毒回收率及检测重复性,最终通过60 份实际样品的检测对该方法的实用性加以进一步验证。
1 材料与方法
1.1 病毒阳性样本
HAstV的阳性样本为本实验室收集的婴幼儿腹泻粪便,并经过透射电镜、实时荧光定量RT-PCR等方法验证含有HAstV。将含有病毒颗粒的粪便样品用磷酸盐缓冲液(phosphate buffer solution,PBS)按1∶10稀释,混匀,10 000 r/min离心2 min,收集上清液备用。
1.2 试剂
一步法实时荧光定量R T-P C R检测试剂盒(SuperScript®Ⅲ Platinum®One-Step qRT-PCR System) 美国Invitrogen公司。
R N A提取试剂:P B S:K H2P O40.2 g、Na2HPO4·12H2O 1.15 g、NaCl8 g、KCl 0.2 g、无RNase超纯水1 000 mL、pH 7.3、高压灭菌;Tris/甘氨酸/牛肉膏缓冲液(Tris/glycine/beef extract buffer,TGBE):Tris基质12 g、甘氨酸 3.8 g、牛肉膏10 g、无RNase超纯水定容至1 000 mL、pH 7.3、高压灭菌;5×PEG/NaCl溶液:聚乙二醇(polyethylene glycol,PEG)8000 500 g、NaCl 87 g、无RNase超纯水定容至1 000 mL、高压灭菌;黑曲霉果胶酶 美国Sigma公司;焦碳酸二乙酯(diethy pyrocarbonate,DEPC) 北京天根生化科技有限公司;TRIzol、Dynabeads®mRNA Purification Kit美国Invitrogen公司;乙醇、异丙醇、氯仿 北京化学试剂公司;反转录试剂盒:Ribo MAXTMLarge Scale RNA Production system-T7 美国Promega公司;RNeasy MiniElute Cleanup kit 德国Qiagen公司。
1.3 仪器与设备
MAHFIA型组织匀浆器 瑞士Consul A.R.公司;Centrifuge 5810R型低温冷冻高速离心机 德国Eppendorf公司;7900HT Fast实时荧光PCR仪 美国ABI公司;ROCHE LightCycler 480实时荧光PCR仪 瑞士罗氏公司。
1.4 方法
1.4.1 引物和探针
选用Grimm等根据HAstV的衣壳蛋白编码基因(ORF2)5’端高度保守基因序列设计的引物和探针[15],序列见表1。

表1 普通RT-PCR和实时荧光定量RT-PCR检测所用引物和探针Table1 Primer and probe sequences for RT-PCR and real-time RT-PCR
1.4.2 实时荧光定量RT-PCR反应体系的构建
利用SuperScript®Ⅲ Platinum®One-Step qRT-PCR试剂盒构建一步法实时荧光定量RT-PCR反应。25 μL的反应体系包括:2×SuperScript®Ⅲ RT/Platinum®Taq Mix 12.5 μL、上游引物和下游引物(10 μmol/L)各1 μL、探针(10 μmol/L)各0.1 μL以及RNA 模板5 μL。于ABI 7900 PCR仪中按以下条件进行反应:50 ℃逆转录15 min,95预变性2 min;95 ℃变性15 s,60 ℃退火1 min,40 个循环。
1.4.3 HAstV cRNA的构建与荧光RT-PCR检测标准曲线的绘制
以粪便样品中提取的HAstV RNA为模板,利用引物AstU1(+)和AstL1(-),扩增出约217 bp的特异性片断,称之为Ast;T-A克隆构建重组质粒pCR2.1-Ast(pCR2.1-T载体购自美国Invitrogen公司),于生工生物工程(上海)股份有限公司进行序列测定,并将测序结果与GenBank中HAstV的基因序列进行同源性分析,保证其同源性达99%以上。提取并纯化质粒D NA,以其为模板,用Ribo MAXTMLarge Scale RNA Production system-T7试剂盒进行体外转录(按试剂盒操作说明书进行),体外转录产物用DNase消化,去除其中的DNA。利用RNeasy MiniElute Cleanup kit进一步纯化cRNA。紫外分光光度计测定cRNA的浓度,并通过以下公式计算模板分子的拷贝数。进而将cRNA进行10 倍梯度稀释至单拷贝,进行荧光RT-PCR检测,分别以cRNA模板的拷贝数对数值和相对应的检测Ct值为横坐标和纵坐标,绘制标准曲线。

1.4.4 人工感染果蔬样品的检测
1.4.4.1 人工感染果蔬样品的制备
取已证实不含HAstV的白菜和草莓,分别作为食物接触硬表面和软表面的样品代表。用PBS将含有HAstV的粪便样品进行10 倍梯度稀释至10-3,分别取各稀释度粪便样品200 μL均匀滴加到待测果蔬表面,白菜样品添加表面积为40 cm2左右,草莓样品添加表面积为20 cm2左右,静置1 h。
1.4.4.2 人工感染果蔬样品前处理
参照ISO/TS 15216-2:2013标准中针对果蔬中诺如病毒和甲肝病毒RNA的提取方法,分别对人工感染的白菜和草莓样品进行如下处理:
白菜样品的硬表面代表:将浸润500 μL PBS的无菌棉用力擦拭硬表面(最大100 cm2)。迅速将无菌棉放入干净的离心管中,按压无菌棉,尽量将液体全部挤出,重复上述操作3~4 次,以确保病毒被最大程度的挤出无菌棉。保留病毒富集液用于提取RNA。
草莓样品的软表面代表:称取样品约25 g,转移至400 mL带滤网的均质袋中,加入40 mL TGBE缓冲液、30 U的黑曲霉果胶酶,在室温、60 r/min振摇孵育20 min。对于酸性样品,在孵育过程中,每10 min检测洗脱液的pH值,如果pH值低于9.0,则用NaOH溶液调节pH值至9.5。每调节一次pH值,则需要延长10 min的孵育时间。透过滤网,将洗脱液倒入离心管中,4 ℃、10 319 r/min离心30 min,将上清液转入干净的离心管中,并用1 mol/L盐酸溶液将pH值调节至7.0。加入0.25倍体积的5×PEG/NaCl溶液(最终为10 g/100 mL PEG,0.3 mol/L NaCl),振荡60 s以混匀,之后在5 ℃、60 r/min孵育60 min。在5 ℃、10 319 r/min离心30 min,弃去上清液,然后在5 ℃、10 319 r/min离心5 min,以压实沉淀物。弃上清液,加入500 μL PBS重悬沉淀。加入500 μL的氯仿-正丁醇,涡旋混合,然后在室温条件下孵育5 min。于5 ℃、10 319 r/min离心15 min,将上层水相小心地转移到一个新的离心管中,保留病毒富集液用于提取RNA。
1.4.4.3 人工感染果蔬样品病毒RNA的提取
将1.4.4.2节的病毒富集液加入5 mL Trizol-reagent,剧烈涡旋混匀1 min,室温放置5 min。将溶液转移至10 mL无RNase的离心管中,加入1.2 mL氯仿,剧烈涡旋混匀1 min,室温放置5 min。4 ℃、10 319 r/min离心5 min,小心吸取上清液至无RNase的10 mL离心管中。加入0.5 倍体积的异丙醇,颠倒混匀后室温放置5 min。4 ℃、10 319 r/ min离心10 min,弃上清液,用预冷的75%乙醇溶液洗涤沉淀。加入100 μL无RNase的水,60 ℃加热5~10 min,使沉淀完全溶解,得到总RNA。继续按照Dynabeads®mRNA Purification Kit使用说明从总RNA中纯化得到病毒RNA。
1.4.4.4 病毒回收率的计算及检测低限分析
按照1.4.4.3节方法直接利用Trizol-reagent提取用于添加的HAstV阳性粪便样本(原液至10-3)RNA,连同提取的人工感染果蔬样品中病毒RNA一起进行实时荧光定量RT-PCR检测,并根据病毒定量检测的标准曲线计算各自所对应的RNA拷贝数,以此分别作为果蔬中添加的病毒基因拷贝数和实际提取到的病毒基因拷贝数。按照式(2)计算病毒回收率,并比较在不同果蔬中HAstV的检测低限。

1.4.5 检测重复性分析
按照1.4.4.1节的方法制备15 份人工感染HAstV的草莓样本,将其分成3 组,分别在3 d内进行检测,计算组内与组间检测结果的变异系数(coefficient of variation,CV),评价该方法的重复性和稳定性。
1.4.6 实际果蔬样品的检测
选取出口冷冻草莓、冷冻树莓,以及购自北京农贸市场和超市的新鲜草莓、苹果、大白菜、油麦菜、生菜、圣女果、黄瓜9 种共计60 份果蔬样品,利用建立的实时荧光定量RT-PCR法进行HAstV的检测,进一步验证该方法的有效性。
2 结果与分析
2.1 HAstV荧光定量RT-PCR标准曲线的绘制
对c R N A进行1 0 倍梯度稀释,使其浓度达5.6×107~5.6 拷贝/μL,经荧光RT-PCR检测,获得扩增曲线如图1所示,可见随cRNA稀释度的增加,其所对应的Ct值逐渐增大,呈一定的梯度关系。分别以cRNA模板的拷贝数对数值和相对应的检测Ct值为横坐标和纵坐标,绘制得到标准曲线,方程为y=-3.424x+39.696,其相关系数R2达0.997,斜率为-3.424,扩增效率达95.9%。因此后续检测中,将待测样本实时荧光定量RT-PCR的检测Ct值代入标准曲线的回归公式,即可计算出其对应的病毒RNA拷贝数,从而为HAstV的定量检测提供参考。

图1 HAstV cRNA进行实时荧光定量RT-PCR检测的扩增图谱Fig.1 Amplification plots of HAstV cRNA
2.2 病毒回收率计算及检测低限分析

表2 粪便及人工感染样本中HAstV实时荧光定量RT-PCR的定量检测结果Table2 Quantitative test results of HAstV in artificially infected samples by real-time fluorescence RT-PCR
对人工感染不同浓度HAstV的大白菜和草莓样品,提取病毒RNA,经实时荧光定量RT-PCR检测,根据测得的Ct值和标准曲线回归公式,可分别计算出添加的和提取到的病毒RNA拷贝数(表2),由此测得人工感染的大白菜样品中病毒回收率在0.94%~9.63%范围内,而人工感染草莓样品中病毒回收率则明显降低,最高达1.03%(图2);此外,两种人工感染样品的病毒回收率均呈现出随添加量降低而下降的趋势,在大白菜样品中,添加粪便的稀释度由10-2降为10-3时,病毒回收率下降了10 倍,而草莓中添加10-3稀释度粪便样本时,已检测不到HAstV RNA的存在(图2)。
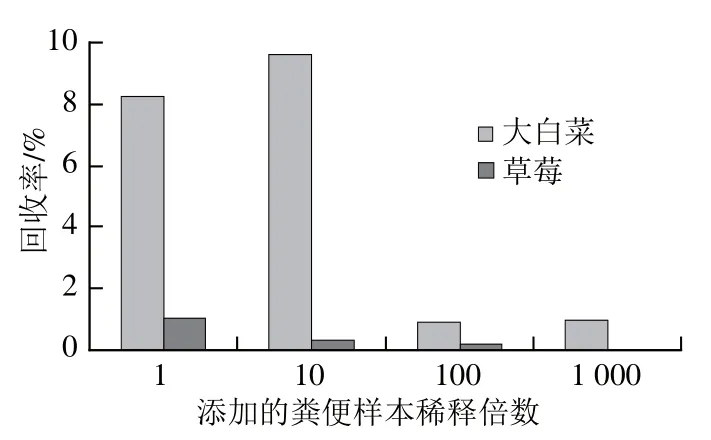
图2 不同添加粪便样本稀释倍数的大白菜和草莓样本中HAstV回收率比较Fig.2 Recovery of HAstV from spiked cabbage and strawberry samples
2.3 人工感染样品检测重复性分析
对人工感染的草莓样品进行检测,结果发现无论是同一天内的5 次重复所得Ct值,还是3 d独立实验所得的平均Ct值都非常接近,经统计学计算同一天内检测结果的CV(组内CV)分别为1.41%、1.67%和1.39%,而3 d间检测结果的CV(组间CV)为1.06%(表3),说明本方法检测果蔬中HAstV的效果非常稳定,具有良好的重复性。
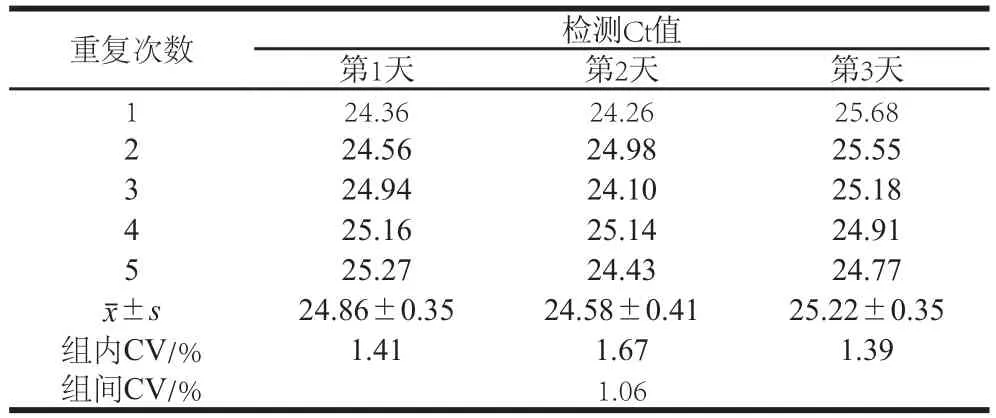
表3 一步法实时荧光定量RT-PCR检测HAstV重复性分析Table3 Repeatability analysis of real-time RT-PCR for detecting HAstV
2.4 实际样品检测结果
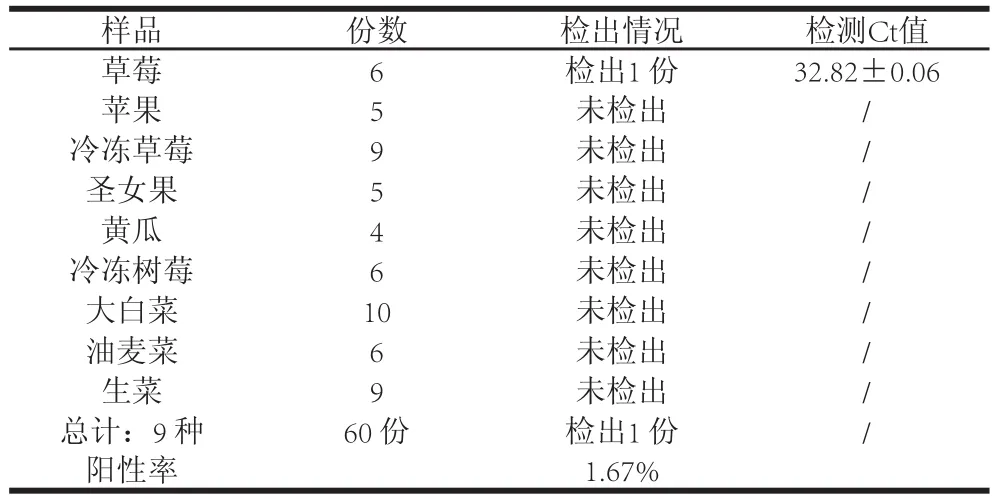
表4 实际样品的检测结果Table4 Results of HAstV detection of actual samples
利用建立的实时荧光定量RT-PCR法对60 份果蔬样品进行HAstV的检测,在购自北京农贸市场的1 份草莓样品中检出HAstV,检测阳性率为1.67%(表4)。
3 讨 论
HAstV的衣壳蛋白编码基因(ORF2)5’端是一个核酸序列高度保守区,多用于引物和探针的设计。Sakon等[16]设计的RT-PCR引物AC230、AC1’以及探针Acom-prob就位于该区,然而这些引物和探针同HAstV的部分血清型核酸序列间不是很匹配,因此也就影响了其检测的特异性。Grimm[15]在Sakon[16]等研究基础上,综合分析了HAstV8 个血清型[17-19]间的序列差异,选取了217 bp的片段作为扩增把序列,设计出一系列引物和探针,保证在一个反应体系中可同时检测到HAstV的8 种血清型,大大提高了检测效率。本实验将该系列引物和探针引入果蔬中HAstV的检测,通过对10 倍梯度稀释的cRNA进行进行实时荧光定量RT-PCR扩增分析,发现该系列引物和探针的扩增效率达95%以上,最低检测限可达5.6 拷贝/反应,且检测Ct值同模板拷贝数的对数值存在良好的线性关系,R2达0.997,从而为实际样品的定量检测提供了技术参考。
虽然病毒是严格的细胞内寄生物,但在果蔬中不能繁殖,果蔬作为病毒的携带者,病毒载量往往较低,再加上其基质成分的复杂性[20-24],使得病毒的有效富集和病毒RNA的高纯度、完整提取成为决定食源性病毒检测成败的关键,也是近年来研究的热点。我国已有针对HAstV的检测标准SN/T 2519—2010《贝类中星状病毒检测方法 普通PCR和实时荧光PCR方法》[25]、SN/T 2518—2010《贝类食品中食源性病毒检测方法 纳米磁珠-基因芯片法》[26]和SN/T 3841—2014《出口贝类中诺如病毒和星状病毒的快速检测 反转录-环介导恒温核酸扩增(RT-LAMP)法》[27]均是针对贝类食品,由于贝类和果蔬基质间的显著差异,其病毒RNA的提取方法并不适用于果蔬类食品。ISO在2013年发布的“食品和动物饲料微生物学——食品中甲肝病毒和诺如病毒的实时荧光定量RT-PCR检测水平方法(ISO/TS 15216-2:2013)”中给出了针对不同果蔬表面的病毒富集、洗脱与RNA的提取方法,但却未涉及HAstV。鉴于HAstV同诺如和甲肝病毒存在相似的结构特点,即均为球形、无包膜病毒颗粒,内含单股正链RNA,并在基因结构3´端含有polyA尾[28-30],因此,本研究将ISO/TS 15216-2:2013中诺如病毒和甲肝病毒的RNA提取技术应用到HAstV中,通过对人工感染的大白菜和草莓样品检测发现HAstV的回收率最高分别可达9.63%和1.03%(图2),满足国际标准ISO/TS 15216-2:2013检测要求。同时,研究结果表明HAstV自食品硬表面(如大白菜)中的回收率普遍高于软表面(如草莓),这可能是由于软表面对病毒的吸附性更强,病毒不易洗脱,操作步骤更加繁杂,增加病毒损失的机率,且草莓中果胶等核酸扩增抑制成分的释放,均会导致病毒回收率的降低。此外,研究还发现果蔬中病毒回收率会随着污染水平的降低而急剧下降,特别是在大白菜样品中这一趋势更加明显,其添加粪便的稀释度由10-2降为10-3时,病毒回收率下降了10 倍(图2),表明低污染水平的样品检测难度更大,需要开发更为高效灵敏的病毒富集提取技术,以期进一步提高病毒的检出率。
实验最终通过15 份人工感染和60 份实际果蔬样品的检测,证明该方法具有良好的重复性和稳定性,病毒检出率达1.67%,其检测时间约3~5 h,无需昂贵的试剂和特大型仪器设备,并可实现定量检测,可作为食品安全检测实验室的常规方法,在食源性病毒筛查与风险评估中具有重要的应用价值。
[1] 王永霞, 段招军, 李宇宁. 人星状病毒研究进展[J]. 病毒学报, 2012, 28(4): 482-485.
[2] 何国芳. 星状病毒感染的研究现状[J]. 安徽医药, 2004, 8(4): 297-298. DOI:10.3969/j.issn.1009-6469.2004.04.040.
[3] 曾军荣, 李榕娇, 陈永强, 等. 常见腹泻病毒多重荧光逆转录聚合酶链反应检测方法的建立及临床应用[J]. 国际检验医学杂志, 2011, 32(13): 1461-1462. DOI:10.3969/j.issn.1673-4130.2011.13.027.
[4] 谭冬梅, 邓丽丽. 人星状病毒的研究进展[J]. 应用预防医学, 2009, 15(4): 251-254. DOI:10.3969/j.issn.1673-758X.2009.04.024.
[5] THORNTON A C, JENNINGS-CONKILN K S, MCCORMICK M I. Noroviruses: agents in outbreaks of acute gastroenteritis[J]. Disaster Manag Response, 2004, 2(l): 4-9. DOI:10.1016/j.dmr.2003.11.001.
[6] DENNEHY P H, NELSON S M, SPANGENBERGER S, et al. A prospective case-control study of the role of astrovirus in acute diarrhea among hospitalized young children[J]. The Journal of Infectious Diseases, 2001, 84(1): 10-15. DOI:10.1086/321007.
[7] 刘春艳, 申昆玲, 王树欣, 等. 北京儿童医院的腹泻患儿星状病毒感染分析[J]. 中华儿科杂志, 2002, 40(7): 402-404.
[8] BON F, FASCIA P, DAUVERGNE M, et al. Prevalence of group A rotavirus, human calicivirus, astrovirus, and adenovirus type 40 and 41 infections among children with acute gastroenteritis in Dijon, France[J]. Journal of Clinical Microbiology, 1999, 37(9): 3055-3058.
[9] MUSTAFA H, PALOMBO E A, BISHOP R F. Epidemiology of astrovirus infection in young children hospitalized with acute gastroenteritis in Melbourne, Australia, over a period of four consecutive years, 1995 to 1998[J]. Journal of Clinical Microbiology, 2000, 38(3):1058-1062.
[10] KIULIA N M, MWENDA J M, NYACHIEO A, et al. Astrovirus infection in young Kenyan children with diarrhoea[J]. Journal of Tropical Pediatrics, 2007, 53(3): 206-209. DOI:10.1093/tropej/fml093.
[11] 方肇寅, 孙亚萍, 叶新华, 等. 中国七个地区1998-2005年急性腹泻住院患儿中星状病毒感染研究[J]. 中国流行病学杂志, 2006, 27(8):673-676. DOI:10.3760/j.issn:0254-6450.2006.08.008.
[12] 夏文, 倪贤生, 吴越, 等. 一起星状病毒引起暴发流行的实验室检测[J].现代预防医学, 2013, 40(4): 744-745.
[13] 谢雅晶, 刘贤金. 食源性诺如病毒在果蔬农产品中的污染及检测研究[J]. 病毒学报, 2015(6): 685-697.
[14] Microbiology of food and animal feed-horizontal method for determination of hepatitis A virus and norovirus in food using realtime RT-PCR-part 2: method for qualitative detection: ISO/TS 15210-2:2013[S].
[15] GRIMM A C, CASHDOLLAR J L, WILLIAMS F P, et al. Developmentof an astrovirus RT-PCR detection assay for use with conventional, real-time, and integrated cell culture/RT-PCR[J]. Canadian Journal of Microbiology, 2004, 50(4): 269-278. DOI:10.1139/w04-012.
[16] SAKON N, YAMAZAKI K, UTAGAWA E, et al. Genomic characterization of human astrovirus type6 Katano virus and the establishment of a rapid and effective reverse transcription-polymerase chain reaction to detect all serotypes of human astrovirus[J]. Journal of Medical Virology, 2000, 61(1): 125-131. DOI:10.1002/(SICI)1096-9071(200005)61:1<125:AID-JMV20>3.0.CO;2-B.
[17] NOEL J S, LEE T W, KURTZ J B, et al. Typing of human astroviruses from clinical isolates by enzyme immunoassay and nucleotide sequencing[J]. Journal of Clinical Microbiology, 1995, 33(4): 797-801.
[18] MENDEZ-TOSS M, ROMERO-GUIDO P, MUNGUIA M E, et al. Molecular analysis of a serotype8 human astrovirus genome[J]. The Journal of General Virology, 2000, 81(Pt 12): 2891-2897. DOI:10.1099/0022-1317-81-12-2891.
[19] VICTORIA M, CARVALHO-COSTA F A, HEINEMANN M B, et al. Genotypes and molecular epidemiology of human astroviruses in hospitalized children with acute gastroenteritis in Rio de Janeiro, Brazil[J]. Journal of Medical Virology, 2007, 79(7): 939-944. DOI:10.1002/ jmv.20814.
[20] SCHWAB K J, NEILL F H, le GUYADER F, et al. Development of a reverse transcription-PCR-DNA enzyme immunoassay for detection of“Norwalk-Like” viruses and hepatitis A virus in stool and shellfish[J]. Applied and Environmental Microbiology, 2001, 67(2): 742-749. DOI:10.1128/AEM.67.2.742-749.2001.
[21] HACKL E, HÖLZL C, KONLECHNER C, et al. Food of plant origin:production methods and microbiological hazards linked to food-borne disease. EFSA Supporting Publications, 2013: EN-402, Reference: CFT/ EFSA/BIOHAZ/2012/01 Lot 1(Food of plant origin with high water content such as fruits, vegetables, juices and herbs)[M]. DOI:10.2903/ sp.efsa.2013.EN-402.
[22] CLIVER D O. Detection and control of food borne viruses[J]. Trends in Food Science and Technology, 1995, 6(11): 353-358.
[23] LE G F, LOISY F, ATMAR R L, et al. Norwalk virus-specific binding to oyster digestive tissues[J]. Emerging Infectious Diseases, 2006, 12(6): 931-936. DOI:10.3201/eid1206.051519.
[24] BERG J M, TYMOCZKO J L, STRYER L. Biochemistry[M]. Newnork:Freeman, 1995: 23-41.
[25] 国家质量监督检验检疫局. 贝类中星状病毒检测方法 普通PCR和实时荧光PCR方法: SN/T 2519—2010[S]. 北京: 中国标准出版社, 2010.
[26] 国家质量监督检验检疫局. 贝类食品中食源性病毒检测方法 纳米磁珠-基因芯片法: SN/T 2518—2010[S]. 北京: 中国标准出版社, 2010.
[27] 国家质量监督检验检疫局. 出口贝类中诺如病毒和星状病毒的快速检测 反转录-环介导恒温核酸扩增(RT-LAMP)法: SN/T 3841—2014[S]. 北京: 中国标准出版社, 2014.
[28] MONROE S S, JIANG B, STINE S E, et al. Subgenomic RNA sequence of human astrovirus supports classification of Astroviridae as a new family of RNA viruses[J]. Journal of Virology, 1993, 67(6): 3611-3614.
[29] IMADA T, YAMAGUCHI S, MASE M, et al. Avian nephritis virus (ANV) as a new member of the family Astroviridae and construction of infectious ANV cDNA[J]. Journal of Virology, 2000, 74(18): 8487-8493. DOI:10.1128/JVI.74.18.8487-8493.2000.
[30] RISCO C, CARRASCOSA J L, PEDREGOSA A M, et al. Ultrastructure of human astrovirus serotype 2[J]. The Journal of General Virology, 1995, 76(Pt 8): 2075-2080. DOI:10.1099/0022-1317-76-8-2075.
Development of a Real-Time Fluorescent RT-PCR Assay for Quantitative Detection of Astrovirus in Fruits and Vegetables
MA Dan, WEI Haiyan, XU Leirui, WEI Yongxin, WANG Qi, ZHANG Ximeng, FU Pubo, LIU Li, ZHAO Xiaojuan, ZENG Jing*
(Inspection and Quarantine Technical Center, Beijing Enter-Exit Inspection and Quarantine Bureau, Beijing 100026, China)
Objective: Different procures for viral concentration and RNA extraction from fruits and vegetables were proposed taking into account the difference in surface structure between both materials and they were used to develop a sensitive and rapid real-time fluorescent reverse transcription-polymerase chain reaction (RT-PCR) for the quantitative detection of astrovirus in fruits and vegetables using the primers and probes designed according to published sequences. Methods: A standard curve for quantitative detection of astrovirus was constructed by plotting the cycle threshold (Ct value) versus the starting concentration of 10-fold serially diluted cRNA. Then the method for norovirus and hepatitis A virus RNA extraction from fruits and vegetables described in the standard ISO/TS 15216-2:2013 was applied to detect astrovirus. The viral recovery rate, sensitivity and reproducibility of the assay were evaluated by using artificially contaminated cabbage and strawberry samples. Finally, 60 fruit and vegetable samples were tested to demonstrate the feasibility of this method. Results: The amplification efficiency of the real-time fluorescent RT-PCR was 95.9%, with a limit of detection (LOD) of 5.6 copies per reaction. The viral recovery rate of artificially contaminated cabbage samples was 0.94%-9.63%, compared to only 1.03% for the strawberries. Analysis of the artificially contaminated samples containing the same viral levels demonstrated high reproducibility with a coefficient of variation (CV) of less than 2%. Additionally, one strawberry sample collected from a retail market in Beijing was shown to be astrovirus-positive, and the detection rate was 1.67%. Conclusion: The developed method is rapid, efficient and sensitive for quantitative detection of astrovirus in fruits and vegetables, and will be a useful tool for routine screening and risk assessment of foodborne viruses.
astrovirus; real-time fluorescent RT-PCR; fruits and vegetables; quantitative detection
10.7506/spkx1002-6630-201712037
R155.5
A
1002-6630(2017)12-0240-06
2016-07-30
公益性行业(质检)科研专项(201410080)
马丹(1987—),女,工程师,硕士,研究方向为食品微生物检测。E-mail:mad@bjciq.gov.cn
*通信作者:曾静(1963—),女,研究员,博士,研究方向为食品安全微生物检测。E-mail:zengj@bjciq.gov.cn马丹, 魏海燕, 徐蕾蕊, 等. 实时荧光定量RT-PCR法快速定量检测果蔬中星状病毒[J]. 食品科学, 2017, 38(12): 240-245. DOI:10.7506/spkx1002-6630-201712037. http://www.spkx.net.cn
MA Dan, WEI Haiyan, XU Leirui, et al. Development of a real-time fluorescent RT-PCR assay for quantitative detection of astrovirus in fruits and vegetables[J]. Food Science, 2017, 38(12): 240-245. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201712037. http://www.spkx.net.cn
