一种基于多重实时荧光聚合酶链式反应熔解曲线分析的肉及肉制品掺假鉴别方法
2017-06-22李家鹏李金春乔晓玲杨君娜
周 彤,李家鹏*,李金春,乔晓玲*,黄 鑫,陈 曦,杨君娜,郭 雅
(中国肉类食品综合研究中心 肉类加工技术北京市重点实验室,北京 100068)
一种基于多重实时荧光聚合酶链式反应熔解曲线分析的肉及肉制品掺假鉴别方法
周 彤,李家鹏*,李金春,乔晓玲*,黄 鑫,陈 曦,杨君娜,郭 雅
(中国肉类食品综合研究中心 肉类加工技术北京市重点实验室,北京 100068)
为实现肉及肉制品掺假快速鉴别,分别以猪、牛线粒体DNA的COXⅠ,绵羊、山羊、狗、狐狸、貉线粒体DNA的16S rRNA及鸡、鸭线粒体DNA的12S rRNA基因为靶位点,设计扩增产物熔解温度(Tm值)具有显著性差异的特异性引物,建立一种用于快速鉴别肉或肉制品中猪、牛、绵羊、山羊、鸡、鸭、狗、狐、貉9 种源性成 分的5重实时荧光聚合酶链式反应熔解曲线分析方法,通过特异性、灵敏度及市售样品的检测,对该方法进行检验和评价。结果表明:方法具有良好的特异性 及灵敏度,单物种DNA检出限为0.001~1 ng,多物种混合DNA检出限均为0.1 ng,通过市售样品检测表明该方法可用于实际样品(包括生鲜样品和熟制样品)掺假的快速鉴别。
肉类掺假;多重实时荧光聚合酶链式反应;熔解曲线分析;SYBR Green染料;动物源性成分
近年来国内外肉类掺假事件频发,巨大的价格差异驱动着一些不法经营者以低价肉替代高价肉而未在标签上注明来降低成本。这不仅严重侵害了消费者利益,而且更严重的是造成恶劣的社会影响,对整个肉类产业也会造成巨大伤害,因此急需开发可靠的真伪鉴别技术,保护消费者权益和肉类产业健康发展。
目前,应用DNA分子序列特异性开发动物源性成分检测技术仍是该领域的研究焦点和主流,也是多数国家检测方法标准中指定的检测方法,基于DNA序列特异性的动物源性检测技术中以聚合酶链式反应(polymerasechain reaction,PCR)技术应用最为广泛[1-9],单重PCR检测物种少、检测效率低、检测成本高,因此多重PCR技术逐渐成为研究热点,多重PCR技术的开发是提高掺假鉴别检测效率与通量、简化检测流程的最有效途径之一。此项技术保留了常规PCR特异性强、灵敏度高的优势,同时又简化了操作步骤、缩短了检测周期、降低了人员和试剂耗材成本[10],满足了当前动物源性成分检测技术快速、简便、低成本的趋势和需求,引起了国内外学者的巨大关注。Matsunaga等[11]首次将常规多重PCR技术应用在物种鉴定上,近些年,国内[12-16,21]及国外学者[17-20,22-23]应用常规多重PCR与电泳结合的技术进行了多种动物源性成分检测的研究,但此方法存在无法定量、流程复杂、污染环境等缺点和局限性。多重实时荧光PCR(real-time fluorescent-PCR,RT-PCR)技术克服了上述问题,在不需要电泳的情况下可实现高灵敏度检测[24-27]。Safdar等[28]应用SYBR Green双重RT-PCR熔解曲线分析方法实现了饲料中牛和禽类源性成分的检测,还应用EvaGreen双重RT-PCR熔解曲线分析方法实现了香肠中牛肉和大豆源性成分的同步快速测定[29]。
由于引物设计方法局限和多重PCR体系间干扰等因素,现有文献报道能同时检测的成分数多为5 个及以下且检出限较高。本实验应用引物的简并性设计,即寻找遗传相近的物种(鸡鸭、狗狐貉、山羊绵羊等)通用而与其他物种特异的DNA序列来设计引物,实现不增加PCR反应重数的前提下,提高可检测物种的种类,开发一种基于5重RT-PCR熔解曲线分析的肉及肉制品中猪、牛、绵羊、山羊、鸡、鸭、狗、狐、貉9 种源性成分的同步鉴别方法,为相关部门提供可靠的技术手段和执法依据,具有巨大的市场需求和广阔的应用前景。
1 材料与方法
1.1 材料与试剂
猪肉 北京资源公司;牛肉 北京御香苑畜牧有限公司;绵羊、山羊肉 内蒙古金戈尔有机畜牧有限公司;鸡肉、鸭肉、狗肉、狐狸肉、貉子肉、鹿肉、驴肉、胖头鱼肉、马肉 市购;猫血、鼠血 北京某宠物医院采集。
DNeasy Blood & Tissue Kit DNA提取试剂盒 凯杰企业管理(上海)有限公司;SYBR Green酶体系预混液、8联排RT-PCR反应管 罗氏诊断产品(上海)有限公司;引物合成由英潍捷基(上海)贸易有限公司完成。
1.2 仪器与设备
Prep多样品均质仪 美国Omni公司;BT224S分析天平 赛多利斯科学仪器(北京)有限公司;S-100涡旋振荡器 大洋科学工业株式会社;5417 C/R型离心机 艾本德中国有限公司;Cascada BIO超纯水系统 美国颇尔公司;GI54DWS全自动高压灭菌器 美国致微(厦门)仪器有限公司;Synergy H4多功能酶标仪 美国伯腾仪器有限公司;LightCycler 480实时荧光PCR仪 罗氏诊断产品(上海)有限公司。
1.3 方法
1.3.1 肉类组织DNA提取
将肉去筋膜、剪碎,按照肉水比1∶4(m/m)准确称取并进行匀浆,均质仪转速13 000 r/min,匀浆时间10 min,吸取100 μL匀浆液于1.5 mL离心管中,采用Qiagen DNeasy Blood & Tissue Kit试剂盒提取DNA,DNA溶解于100 μL TE缓冲液中,4 ℃保存,利用酶标仪测定DNA的纯度及浓度。
1.3.2 适用于多重RT-PCR熔解曲线分析(Tm值显著性差异)的物种特异性引物设计
利用Mega 5.1软件将不同物种线粒体DNA上某一特定基因序列对齐比较,选取物种间序列变异大、种内亚种序列保守的区域应用引物设计软件Oligo 7.0进行物种特异性引物的设计,以猪、牛线粒体DNA的COXⅠ基因,绵羊、山羊、狗、狐狸、貉线粒体DNA的16S rRNA基因及鸡、鸭线粒体DNA的12S rRNA基因为靶位点设计各特异性引物。
由于本方法是基于各物种特异性引物扩增产物的Tm值的显著性差异所建立的,因此选择如表1中所示的5 对引物作为多重RT-PCR引物组合,进行后续研究,其中,羊特异性引物可同时扩增绵羊和山羊源性成分;鸡鸭特异性引物可同时扩增鸡源性和鸭源性成分;狗狐貉特异性引物可同时扩增狗源性、狐狸源性和貉源性成分。

表1 多重RT-PCR反应引物信息Table1 Multiplex RT-PCR primer sequences used in this study
1.3.3 多重RT-PCR反应
多重RT-PCR反应体系(总体积为20 μL)如表2所示。多重RT-PCR扩增反应及熔解曲线制作条件为:95 ℃、5 min预变性;95 ℃、10 s变性;57 ℃、45 s退火+延伸,30 个循环;熔解曲线制作:95 ℃、1 min,70 ℃、1 min,以0.02 ℃/s速率升温至95 ℃,同时连续检测荧光强度;降温:40 ℃、60 s。
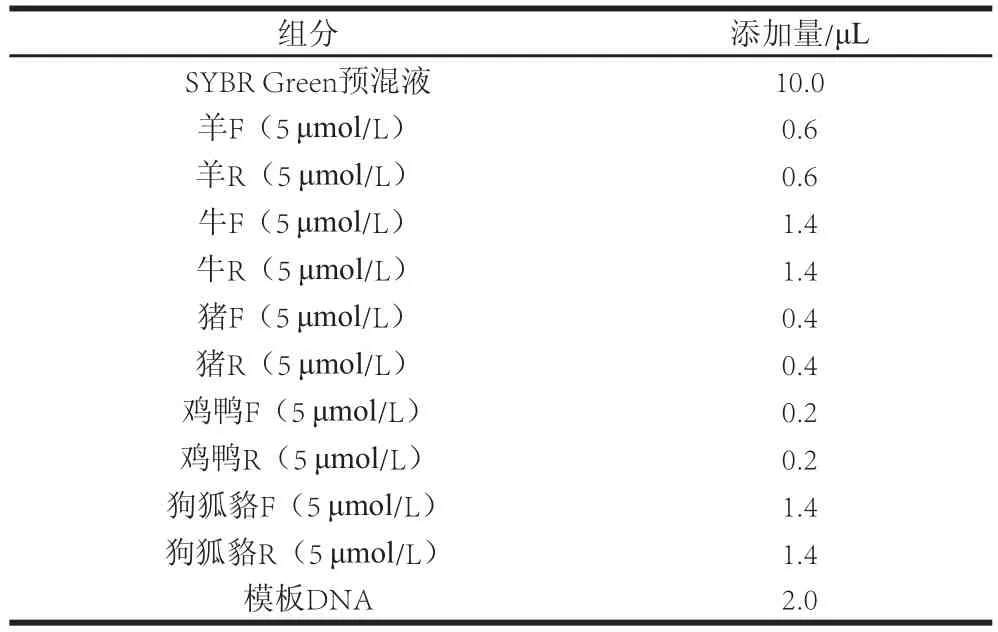
表2 多重RT-PCR反应体系组分及配比(总体积20 μLTable2 Reaction system o f multiplex RT-PCR (total volume 20 μL
以荧光信号对温度的一阶负导数为纵坐标,温度为横坐标,得到熔解峰值图。
1.4 数据处理
2 结果与分析
2.1 引物特异性检验
分别使用猪、牛、羊、鸡鸭、狗狐貉及5 对特异性引物的混合体系对提取好的猪、牛、绵羊、山羊、鸡、鸭、狗、鹿、鱼、狐狸、貉子、马、猫、驴、鼠15 个物种DNA(稀释到相同质量浓度5 ng/μL)进行RT-PCR检测,如表3所示。5 对引物均表现出了良好的特异性,只对测试引物相对应的物种产生阳性特异性扩增,而对其他物种在30 个循环内无典型扩增曲线出现。5 对引物混合后对各物种DNA的多重RT-PCR检测扩增曲线如图1所示,结果与单一引物检测相同,这为开发完整的基于多重RT-PCR熔解曲线分析的掺假检测技术提供理论依据。
目前,国内外学者利用多重PCR方法进行动物源性成分检测的研究中,PCR反应重数多为5重及以下[12-16,21-23,28-29],PCR重数越高,引物对之间相互影响越大,对检测结果影响也越大。在本研究的特异性引物设计中,采用大类特异小类保守的线粒体DNA序列作为扩增靶序列,这使得在不增加引物对数的情况下增加了同步检测物种数量,大幅提 高了检测通量和效率,例如狗狐貉引物对能扩增狗狐貉3 种犬科动物源性成分,而无法扩增其他源性成分。

图1 多重RT-PCR混合引物特异性检测扩增曲线Fig.1 Multiplex RT-PCR amplification curves showing the specificity of mixed primers
按照表4制作不同物种组合的样品(混合样品中各肉种成分比例相同),采用5重RT-PCR体系对各样品进行检测和熔解曲线分析,进一步验证方法体系的特异性,同时确定各物种成分特异性熔解峰的Tm值范围。所有样品出现熔解峰的位置均与样品已知肉种组成相符,未出现非特异性扩增,表明方法具有较好的特异性,多重RT-PCR熔解曲线图谱中各源性成分Tm值的分布范围分别为:绵羊源性成分Tm值(71.8±0.6) ℃,山羊源性成分Tm值(73.3±0.4) ℃,牛源性成分Tm值(74.7±0.7) ℃,狗、狐狸、貉源性成分Tm值(77.2±0.9) ℃,猪源性成分Tm值( 80.8±0.5) ℃,鸡源性成分Tm值(85.1±0.4) ℃,鸭源性成分Tm值(87.4±0.2) ℃。
各源性成分中Tm值跨度范围最小的是鸭源性成分,为0.4 ℃;跨度最大的是狗、狐狸、貉源性成分,为1.8 ℃。表明方法稳定性较好,源性成分Tm值偏移跨度小,并且每种源性成分Tm值范围之间并无重叠,因此,本方法体系可以根据熔解峰值图中峰的个数和位置准确的同步检测食品中猪、牛、绵羊、山羊、鸡、鸭、狗、狐、貉9 种源性成分,不同源性成分Tm值的差异主要是由于扩增产物长度和碱基组成不同造成的。建立5重RT-PCR体系同时鉴别9 种源性成分如图2所示。

表3 多重RT-PCR的引物特异性Table3 Specificity of multiplex RT-PCR primers

表4 不同物种组合中各物种成分特异性熔解峰Tm值Table4 Tm of different species in meat mixtures℃
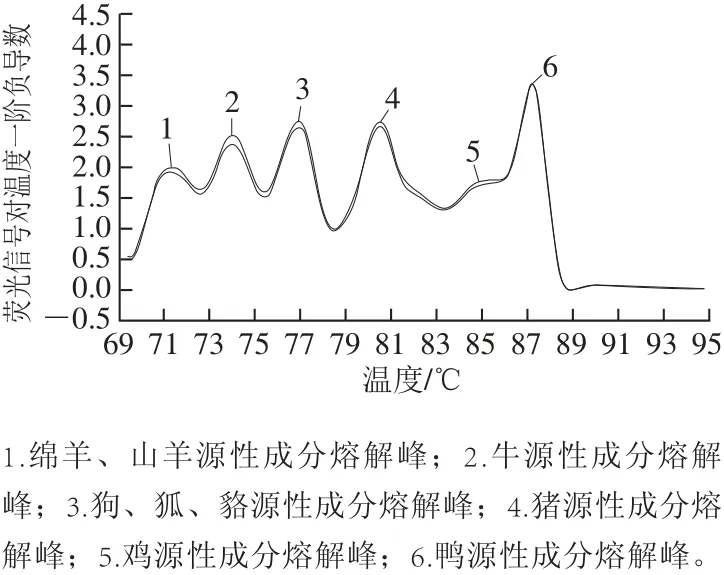
图2 多重RT-PCR鉴别9 种动物源性成分的熔解峰值图Fig.2 Melting curve for identification of nine animal-derived ingredients by multiplex RT-PCR
2.2 方法的灵敏度检验结果
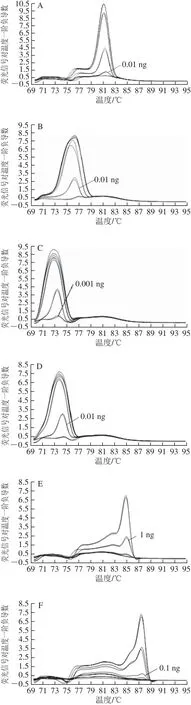
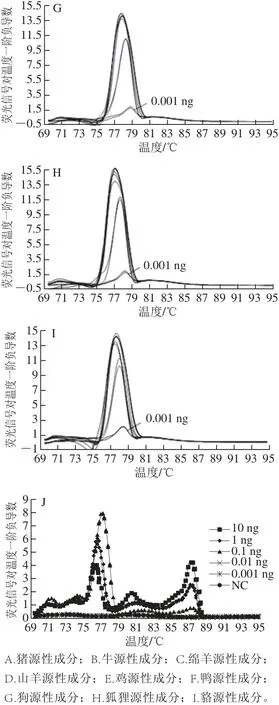
图3 单物种成分(A~I)和多物种混合DNA(J)灵敏度检验Fig.3 Sensitivity o f ingredients from single species (A-I) and mixed species DNA (J)
将10、1、0.1、0.01、0.001 ng猪、牛、绵羊、山羊、鸡、鸭、狗、狐狸、貉子9 个肉种DNA样品及猪、牛、绵羊、鸭、狐狸混合DNA样品,进行5重RT-PCR及熔解曲线分析,检测本方法灵敏度。从图3A~I可以看出,采用本方法多重RT-PCR体系检测单物种DNA,绵羊、狗、狐狸、貉子源性成分的检出限为0.001 ng,猪、牛、山羊源性成分的检出限为0.01 ng,鸭源性成分的检出限为0.1 ng,鸡源性成分的检出限为1 ng。从图3J可以看出,采用本方法体系检测多物种混合DNA,猪、牛、羊、狐狸、鸭5 种源性成分的检出限均为0.1 ng。
Hanapi等[18]开发了可检测猪、反刍动物、鸟、兔4 种成分的多重PCR方法,检出限为0.1 ng。Hou Bo等[21]开发了一种可同时检测肉制品中鸡、鸭、鹅源性成分的多重PCR方法,方法检出限为0.05 ng。Bai Weibin[30]和Hanapi[18]等研究表明0.1 ng DNA的灵敏度对于肉制品掺假检测已经足够。
2.3 市售肉类样品检测
为了进一步考察本方法的准确性和实际应用性,对100 份随机采集的市售肉类样品进行检测,结果表明,Tm值在(71.8±0.6) ℃范围内出现熔解峰(绵羊源性成分)的有18 份样品;Tm值在(73.3±0.4) ℃范围内出现熔解峰(山羊源性成分)的有3 份样品;Tm值在(74.7±0.7) ℃范围内出现熔解峰(牛源性成分)的有50 份样品;Tm值在(80.8±0.5) ℃范围内出现熔解峰(猪源性成分)的有28 份样品;Tm值在(85.1±0.4) ℃范围内出现熔解峰(鸡源性成分)的有10 份样品;Tm值在(87.4±0.2) ℃范围内出现熔解峰(鸭源性成分)的有10 份样品。

表5 市售肉类样品分类及检测结果Table5 Detection of commercial meat products
如表5所示,生肉片肉卷、酱卤肉制品、肉串、干制品、香肠和火腿制品等各类肉制品中均存在掺假情况,掺假率达27.0%,其中肉串类食品掺假最为严重,掺假率高达40.7%,大多采用鸡、鸭等低价肉种替代或掺假。上述结果表明,该方法可以用于实际样品(包括生鲜样品和熟制样品)掺假的快速鉴别。
3 结 论
本研究建立的一种基于5重RT-PCR熔解曲线分析的肉及肉制品掺假鉴别方法,可以准确同时检测肉及肉制品中猪、牛、绵羊、山羊、鸡、鸭、狗、狐、貉9 种源性成分。该方法具有良好的特异性及灵敏度,可用于实际样品(包括生鲜样品和熟制样品)掺假鉴别,大幅降低了检测成本,提高了检测效率和准确率,对加强肉类市场监管、有效抵御肉制品掺假,保护消费者和相关肉制品企业利益是十分重要的,为相关部门提供可靠的技术手段和执法依据,具有巨大市场需求和广阔的应用前景。
参考文献:
[1] MAHAJAN M V, GADEKAR Y P, DIGHE V D, et al. Molecular detection of meat animal species targeting MT 12S rRNA gene[J]. Meat Science, 2011, 88(1): 23-27. DOI:10.1016/j.meatsci.2010.11.026.
[2] 高琳, 徐幸莲, 周光宏. 应用PCR-RFLP法鉴别肉制品中的猪和牛源性成分[J]. 南京农业大学学报, 2001, 24(1): 135-138. DOI:10.7685/ j.issn.1000-2030.2008.02.028.
[3] ROJAS M, GONZALEZ I, PAVON M A, et al. Application of a real-time PCR assay for the detection of ostrich (Struthio camelus) mislabelling in meat products from the retail market[J]. Food Control, 2011, 22(3/4):523-531. DOI:10.1016/j.foodcont.2010.09.039.
[4] SAKARIDIS L, GANOPOULOS L, ARGIRIOU A, et al. A fast and accurate method for controlling the correct labeling of products containing buffalo meat using high resolution melting (HRM) analysis[J]. Meat Science, 2013, 94: 84-88. DOI:10.1016/j.meatsci.2012.12.017.
[5] AMARAL J S, SANTOS C G, MELO V S, et al. Authentication of a traditional game meat sausage (Alheira) by species-specif i c PCR assays to detect hare, rabbit, red deer, pork and cow meats[J]. Food Research International, 2014, 60: 140-145. DOI:10.1016/j.foodres.2013.11.003.
[6] KARABASANAVAR N S, SINGH S P, KUMAR D, et al. Detection of pork adulteration by highly-specif i c PCR assay of mitochondrial D-loop[J]. Food Chemistry, 2014, 145: 530-534. DOI:10.1016/ j.foodchem.2013.08.084.
[7] CAMMÀ C, DOMENICO M D, MONACO F. Development and validation of fast rea l-time PCR Assays for species identif i cation in raw and cooked meat mixtures[J]. Food Control, 2012, 23: 400-404. DOI:10.1016/j.foodcont.2011.08.007.
[8] 陈颖, 钱增敏, 徐宝梁, 等. 保健品中牛羊源性成分的PCR检测[J]. 食品科学, 2004, 25(10): 215-218. DOI:10.3321/ j.issn:1002-6630.2004.10.050.
[9] 周彤, 李家鹏, 田寒友, 等. 一种基于实时荧光聚合酶链式反应的肉及肉制品中猪源性成分含量测定[J]. 肉类研究, 2013, 27(12): 11-15.
[10] TOBE S S, LINACRE A M. A Multiplex assay to identify18 European mammal species from mixtures using the mitochondrial cytochrome b gene[J]. Electrophoresis, 2008, 29(2): 340-347. DOI:10.1002/ elps.200700706.
[1 1] MATSUNAGA T, CHIKUNI K, TANABE R, et al. A quick and simple method for the identification of meat species and meat products by PCR assay[J]. Meat Science, 1999, 51: 143-148. DOI:10.1016/S0309-1740(98)00112-0.
[12] 邵碧英, 陈文炳, 郑腾, 等. 动物产品中牛、羊源性成分多重PCR检测方法的建立[J]. 畜牧与兽医, 200 4, 36(3): 7-9. DOI:10.3969/ j.issn.0529-5130.2004.03.004.
[13] 段庆梓, 尚可, 张玉, 等. 多重PCR法用于鸡、鸭肉源性的鉴定[J]. 食品研究与开发, 2014, 35(5): 90-93. DOI:10.3969/ j.issn.1005-6521.2014.05.026.
[14] 苏葳艺, 李欣南, 于雷, 等. 利用多重PCR方法检测牛肉中的掺假肉[J].食品工业, 2015, 36(2): 277-280.
[15] 张全芳, 马德源, 刘艳艳, 等. 利用多重PCR技术检测羊肉中掺杂狐狸肉的方法研究[J]. 山东农业科学, 2014, 46(12): 4-6; 10.
[16] 刘烜, 郑文杰, 赵卫东, 等. 饲料中六种动物源性成分多重PCR快速检测方法[J]. 食品研究与开发, 2009, 30(3): 141-144. DOI:10.3969/ j.issn.1005-6521.2009.03.044.
[17] GIUSTI A, CASTIGLIEGO L, RUBINO R, et al. A conventional multiplex PCR assay for the detection of toxic gem fish species (Ruvettus pretiosus and Lepidocybium fl avobrunneum): a simple method to combat health frauds[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 960-968. DOI:10.1021/acs.jafc.5b04899.
[18] HANAPI K U, DESA M N M, ISMAIL A, et al. A higher sensitivity and efficiency of common primer multiplex PCR assay in identification of meat origin using NADH dehydrogenase subunit4 gene[J]. Journal of Food Science and Technology, 2015, 52(7): 4166-4175. DOI:10.1007/ s13197-014-1459-7.
[19] DALMASSO A, FONTANELLA E, PIATTI P, et al. A multiplex PCR Assay for the identif i cation of animal species in feedstuffs[J]. Molecular and Cellular Probes, 2004, 18: 81-87. DOI:10.1016/j.mcp.2003.09.006.
[20] SAFDAR M, JUNEJO Y. A multiplex-conventional PCR assay for bovine, ovine, caprine and fish species identif i cation in feedstuffs: highly sensitive and specif i c[J]. Food Control, 2015, 50: 190-194. DOI:10.1016/ j.foodcont.2014.08.048.
[21] HOU B, MENG X R, ZHANG L Y, et al. Development of a sensitive and specif i c multiplex PCR method for the simultaneous detection of chicken, duck and goose DNA in meat products[J]. Meat Science, 2015, 101: 90-94. DOI:10.1016/j.meatsci.2014.11.007.
[22] ALI M E, RAZZAK M A, HAMID S B A, et al. Multiplex PCR assay for the detection of five meat species forbidden in islamic foods[J]. Food Chemistry, 2015, 177: 214-224. DOI:10.1016/j.foodchem.2014.12.098.
[23] LI J M, HONG Y, KIM J H, et al. Multiplex PCR for simultaneous identif i cation of turkey, ostrich, chicken, and duck[J]. Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(6): 887-893. DOI:10.1007/s13765-015-0118-7.
[24] KÖPPEL R, RUF J, RENTSCH J. Multiplex real-time PCR for the detection and quantification of DNA from beef, pork, horse and sheep[J]. European Food Research and Technology, 2011, 232(1): 151-155. DOI:10.1007/s00217-010-1371-y.
[25] SAKAI Y, KOTOURA S, YANO T, et al. Quantification of pork, chicken and beef by using a novel reference molecule[J]. Bioscience Biotechnology and Biochemistry, 2011, 75(9): 1639-1643. DOI:10.1271/ bbb.110024.
[26] 曾少灵, 秦智锋, 阮周曦, 等. 多重实时荧光PCR检测牛、山羊和绵羊源性成分[J]. 生物工程学报, 2009, 25(1): 139-146. DOI:10.13345/ j.cjb.2009.01.018.
[27] 刘艳艳, 霍胜楠, 梁水美, 等. 化妆品中动物源性成分多重实时荧光PCR检测方法的研究[J]. 日用化学工业, 2016, 46(8): 479-484. DOI:10.13218/j.cnki.csdc.2016.08.011.
[28] SAFDAR M, JUNEJO Y. Development and validation of fast duplex real-time PCR assays based on SYBER green florescence for detection of bovine and poultry origins in feedstuffs[J]. Food Chemistry, 2015, 173:660-664. DOI:10.1016/j.foodchem.2014.10.088.
[29] SAFDAR M, ABASIYANIK M F. Dev elopment of fast multiplex realtime PCR assays based on evagreen fluorescence dye for identif i cation of beef and soybean origins in processed sausages[J]. Food Research International, 2013, 54: 1652- 1656. DOI:10.1016/j.fo odres.2013.09.013.
[30] BAI W, XU W, HUANG K, et al. A novel common primer multiplex PCR (CP-M-PCR) method for the simultaneous detection of meat species[J]. Food Control, 2009, 20(4): 366-370. DOI:10.1016/ j.foodcont.2008.05.021.
A Multiplex RT-PCR Melting Curve Analysis Method for Adulteration Identification in Meat and Meat Products
ZHOU Tong, LI Jiapeng*, LI Jinchun, QIAO Xiaoling*, HUANG Xin, CHEN Xi, YANG Junna, GUO Ya
(Beijing Key Laboratory of Meat Processing Technology, China Meat Food Research Center, Beijing 100068, China)
This study was aimed to establish a rapid method for the identification of adulterated meat and meat products. Five pairs of species-specific primers, yielding amplicons having significantly different melting temperatures (Tm), were designed targeting the mitochondrial COXⅠ gene of pig and bovine, the 16S rRNA gene of sheep, goat, dog, fox and raccoon, and the 12S rRNA gene of chicken and duck, respectively. The established multiplex RT-PCR-melting curve analysis method was evaluated in term of specificity and sensitivity and was applied in the detection of commercial meat products. The method showed a good specif i city and sensitivity, and was able to detect 0.001-1 ng of DNA from single species and 0.1 ng of DNA form mixed species. Thus, it can be used to test both raw and processed meat products.
meat adulteration; multiplex real-time PCR; melting curve analysis; SYBR Green dye; animal- derived ingredient
10.7506/spkx1002-6630-201712033
TS207.7
A
1002-6630(2017)12-0217-06
周彤, 李家鹏, 李金春, 等. 一种基于多重实时荧光聚合酶链式反应熔解曲线分析的肉及肉制品掺假鉴别方法[J]. 食品科学, 2017, 38(12): 217-222.
10.7506/spkx1002-6630-201712033. http://www.spkx.net.cn
ZHOU Tong, LI Jiapeng, LI Jinchun, et al. A multiplex RT-PCR melting curve analysis method for adulteration identification in meat and meat products[J]. Food Science, 2017, 38(12): 217-222. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712033. http://www.spkx.net.cn
2016-10-13
国家自然科学基金面上项目(31271877);“十二五”国家科技支撑计划项目(2014BAD04B05)
周彤(1984—),男,高级工程师,硕士,研究方向为食品生物技术。E-mail:zhoubai767@126.com
*通信作者:李家鹏(1979—),男,高级工程师,硕士,研究方向为生物技术。E-mail:ljp7915@126.com乔晓玲(1964—),女,教授级高级工程师,本科,研究方向为肉品科学和加工技术。E-mail:cmrcsen@126.com
