巴氏葡萄球菌TS-82类胡萝卜素裂解酶的分离纯化及其酶学特性
2017-06-22朱明明樊明涛何鸿举马汉军
朱明明,樊明涛,何鸿举,*,马汉军
(1.河南科技学院食品学院,河南 新乡 453003;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
巴氏葡萄球菌TS-82类胡萝卜素裂解酶的分离纯化及其酶学特性
朱明明1,樊明涛2,何鸿举1,*,马汉军1
(1.河南科技学院食品学院,河南 新乡 453003;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
巴氏葡萄球菌TS-82类胡萝卜素裂解酶经强阴离子柱、高效制备液相色谱和多肽分子筛纯化得到液相级纯酶(95.6%)。该酶比活力为125 U/g,纯化倍数为446,回收率为2.39%。纯化后的类胡萝卜素裂解酶经液相色谱-质谱联用测定,得其分子质量为655.093 D。关于酶学特性,研究发现该酶对C40类胡萝卜素底物的最适温度为60 ℃,而作用于β-阿朴-8’-胡萝卜醛的最适温度是50 ℃,该酶的稳定温度为50 ℃以下;该酶对所测定底物的最适pH值为3.0;该酶与5 种底物亲和力排列为:玉米黄质>虾青素>β-胡萝卜素>角黄质>β-阿朴-8’-胡萝卜醛;Al3+和Fe3+是该酶的强效催化剂,Fe2+是该酶的强效抑制剂;H2O2在低浓度范围内(0~16 mmol/L)可促进酶活性;低体积分数乙醇(4%~16%)的添加对酶活性无明显抑制作用。结果表明该酶具有很好的耐酸性和热稳定性,能够适应果酒环境,为其工业化应用提供依据。
巴氏葡萄球菌TS-82;类胡萝卜素裂解酶;类胡萝卜素;分离纯化;酶学特性
类胡萝卜素是一类在自然界广泛存在的呈红色、黄色或橘黄色的色素。众所周知,类胡萝卜素是一类重要的前体物质,可生成多种在生物体中具有重要功能的衍生物,包括类VA、植物激素、色素及芳香类化合物[1]。而类胡萝卜素裂解酶是一类对类胡萝卜素有催化作用,可将底物转为目标产物的生物酶类,广泛存在于动植物及微生物中[2-4],而目前有关葡萄球菌及其所产类胡萝卜素裂解酶的研究甚少。课题组前期研究首次发现巴氏葡萄球菌TS-82可高效降解类胡萝卜素[5-7],为了解其所产类胡萝卜素裂解酶的酶学特性、作用机理及应用方式,对酶进行分离纯化是极其必要的环节。
一直以来,国内外主要致力于类胡萝卜素裂解酶的克隆表达[8-9],关于天然类胡萝卜素裂解酶的分离纯化关注较少。近几年虽也有研究者直接从微生物中提取纯化类胡萝卜素裂解酶,但相关报道不多[10-11]。其中Scheibner等[10]利用Q-Sepharose阴离子交换柱和Superdex 200 HR分子筛柱纯化β-胡萝卜素裂解酶,获得了50%的得率;而Lanfermann等[11]则先通过Phenyl Sepharose疏水层析,接着利用Q-Sepharose阴离子交换层析,最后选用Superdex 75分子筛层析对其进行纯化,获得了9%的得率和261 倍的纯化倍数。由此可见,不同微生物源的类胡萝卜素裂解酶的分离纯化并不完全相同,故对巴氏葡萄球菌TS-82类胡萝卜素裂解酶进行分离纯化的条件,还需进行摸索筛选。
另外,特定的类胡萝卜素裂解酶可专一地催化类胡萝卜素的特定双键[12]断裂。不同来源的类胡萝卜素裂解酶的许多生化性质都存在较大差异,如最适温度、pH值、热稳定性、耐酸性、底物特异性等[1]。基于前期对初步纯化的类胡萝卜素裂解酶酶学性质研究[13],本实验以巴氏葡萄球菌TS-82为材料,采用阴离子交换层析、制备型高效液相色谱(preparative high performance liquid chromatography,PHPLC)和多肽分子筛层析对所产类胡萝卜素裂解酶进行分离纯化,采用液相色谱-电离质谱(liquid chromatography-electrospray ionization mass spectrometry,LC-ESI/MS)确定其分子质量,并利用HPLC法研究类胡萝卜素裂解酶作用于不同底物(β-阿朴-8’-类胡萝卜醛、β-胡萝卜素、玉米黄质、角黄质、虾青素)的酶学性质,探究其热稳定性及耐酸性等,为下一步研究其作用机理及应用方式提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
巴氏葡萄球菌菌株TS-82(GenBank Accession No. KP171185)为西北农林科技大学食品发酵与生物技术实验室分离保存。
1.1.2 试剂
β-阿朴-8’-胡萝卜醛(纯度98%)、β-胡萝卜素(98%)、玉米黄质(95%)、角黄质(95%)、虾青素(95%) 美国Sigma-Aldrich公司;乙腈、甲醇(色谱级) 美国Tedia公司;牛血清白蛋白 美国Amresco公司;甲基叔丁基醚 上海Aladdin公司;色谱级水 杭州娃哈哈集团有限公司;正己烷、丙酮 陇南化学试剂公司;其他分析纯试剂购自天津科密欧公司。
1.2 仪器与设备
AKTA Purifier 100蛋白纯化仪 瑞典Amersham Biosciences公司;CoolSafe冷冻干燥机 丹麦Labogene仪器公司;LC-20A HPLC仪 日本岛津公司;高速冷冻离心机 安徽中科中佳科学仪器有限公司;HH恒温水浴锅 北京科伟永兴仪器有限公司。
1.3 方法
1.3.1 类胡萝卜素裂解酶粗酶液的制备
参照朱明明等[13]的方法制备粗酶液,冷冻干燥浓缩后保存于4 ℃条件下待用。
1.3.2 蛋白质量浓度的测定
以牛血清白蛋白为标品,按照Bradford[14]的方法测定蛋白质量浓度。
1.3.3 酶活力测定
实验中类胡萝卜素底物的浓度为160 μmol/L。由于类胡萝卜素对光和热均特别敏感,所有储备液需现配现用。底物储备液参照虾青素储备液的配制方法[15],置于4 ℃条件下,待用。以β-胡萝卜素为底物测定纯化过程中的酶活力,以所有类胡萝卜素为底物测定其酶学特性的酶活力。取450 μL标品储备液(160 μmol/L),添加1 mL酶液,用pH 5.0的醋酸-醋酸钠缓冲液(20 mmol/L)定容至2 mL。以不加酶液的溶液作对照。类胡萝卜素裂解酶的活性可通过比较酶解反应液和对照在37 ℃条件下反应30 min后460 nm波长处底物峰面积减少和颜色变化而得到。酶活力单位(U)定义为:在上述条件下,每分钟降解1 μmol类胡萝卜素所需的酶量,酶含量用每升反应液的酶活力单位表示,即U/L。
1.3.4 类胡萝卜素裂解酶的分离纯化
阴离子交换柱层析条件:Mono Q 10/100 GL层析柱(10 mm×100 mm,10 μm);A液:20 mmol/L pH 5.0醋酸-醋酸钠缓冲液;B液:A液+1.0 mol/L NaCl溶液。洗脱流速1 mL/min;洗脱程序:0~30 min,A液;30~70 min,0~50% B液;70~80 min,50% B液;80~110 min,100% B液,收集280 nm波长处的吸收峰。检测各个洗脱峰的类胡萝卜素裂解酶活力,收集合并有酶活力的峰,冷冻干燥浓缩,测定酶液体积、质量浓度及酶活力,保存备用。
PHPLC条件:半制备色谱柱C18(250 mm×10 mm,10 μm);流动相A:20 mmol/L醋酸-醋酸钠缓冲液,pH 5.0;流动相B:乙腈;洗脱流速5 mL/min;柱温30 ℃;洗脱程序:0~20 min,12.5%~50% B;20~25 min,50%~60% B;25~35 min,60%~100% B;35~40 min,100%~12.5% B;收集280 nm波长处的吸收峰;检测各个洗脱峰的活性,收集合并有酶活力的峰,冷冻干燥浓缩,测定酶液体积、质量浓度及酶活力,保存备用。
多肽分子筛层析条件:Superdex Peptide 10/300 GL层析柱(10 mm×300~310 mm,13 μm)洗脱流速0.5 mL/min;洗脱时间70 min;收集280 nm波长处的吸收峰。检测各个洗脱峰的活性,收集合并有酶活力的峰,冷冻干燥,测定酶液体积、浓度及酶活力,浓缩液二次上样于多肽分子筛柱,条件同第一次,将二次上样后得到的活性成分进行混合并冷冻干燥浓缩,测定其体积、蛋白质量浓度及酶活力,保存备用。
1.3.5 反相HPLC鉴定纯度
Z O R B A X E c l i p s e P l u s C18色谱柱(4.6 mm×250 mm,5 μm);流动相A:20 mmol/L pH 5.0醋酸-醋酸钠缓冲液,流动相B:乙腈;洗脱流速1 mL/min;柱温30 ℃;洗脱程序:0~10 min,100% B,检测类胡萝卜素裂解酶的纯度。将制备的纯酶组分冷冻干燥成酶粉,保存备用。
1.3.6 分子质量的测定
使用HPLC-MS联用仪对经 上述柱层析分离纯化得到的酶进行相对分子质量的测定。在阳离子操作模式下测定m/z 500~5 000之间的数据,所用源电压为4.50 kV。
1.3.7 纯酶的酶学特性测定
1.3.7.1 最适反应温度及其热稳定性的测定
由于最适温度并不是绝对常数,会受到底物、pH值等因素的影响[16],所以本实验选用β-阿朴-8’-胡萝卜醛、β-胡萝卜素、玉米黄质、角黄质和虾青素5种底物研究温度对类胡萝卜素裂解酶的影响。取450 μL的类胡萝卜素标品储备液,添加4 μg酶粉,用pH 5.0的醋酸-醋酸钠缓冲液定容至2 mL,以不加酶粉的溶液作为对照。将酶解反应液与对照分别放入30~70 ℃的水浴锅反应30 min,根据朱明明等[15]的方法终止反应并按照HPLC条件测定底物含量的变化,计算酶活力,得到酶活力与温度之间的线性关系,由此确定酶的最适反应温度。将实验中得到的最高酶活力定义为100%,其余条件下测得的酶活力换算成相对酶活力。
将4 μg酶粉溶于1 mL的pH 5.0的醋 酸-醋酸钠缓冲液中,以不加酶粉的缓冲液为对照,将其分别放在30~70 ℃的水浴锅中处理1 h,选取450 μL的β-胡萝卜素标品储备液用于验证酶活力损失,最后定容至2 mL,测定酶活力,以未处理酶液的酶活力为100%。
1.3.7.2 最适pH值及其耐酸性的测定
最适pH值会随着很多因素的变化而改变[16-17],故选用上述5 种底物研究pH值对类胡萝卜素裂解酶的影响。取450 μL类胡萝卜素标品储备液,添加4 μg酶粉,用不同pH值的缓冲液(20 mmol/L,pH 2.0~3.5甘氨酸-HCl溶液、pH 4.0~5.5醋酸-醋酸钠溶液、pH 6.0磷酸氢二钠-磷酸二氢钠溶液)定容至2 mL。以不加酶粉、只加类胡萝卜素标品储备液的各相应pH值的溶液为对照,计算酶活力。将实验中得到的最高酶活力定义为100%,其他条件下测得的酶活力换算成相对酶活力。
将24 μg酶粉溶于1 mL各不同pH值缓冲液中,以不加酶粉的缓冲液为对照。将各pH值缓冲液处理的酶液放置4 ℃冰箱处理一周后调pH值为5.0,随后选取450 μL β-胡萝卜素标品储备液用于验证酶活力损失,最后定容至2 mL,研究比较不同pH值缓冲液处理的残余酶活力。以处理前酶液的酶活力为100%。
1.3.7.3 酶动力学常数的测定
用pH 5.0的醋酸-醋酸钠缓冲液配制6~36 μmol/L之间6 种不同的底物浓度2 mL,加入4 μg酶粉,在37 ℃条件下反应10 min后测定酶活力。依据测定结果,采用Lineweaver-Burk法作图,计算米氏常数(Km)及最大反应速率(vmax)。
1.3.7.4 活化能(Ea)的计算
类胡萝卜素裂解酶的Ea通过阿伦尼乌斯方程得到,本实验中以β-胡萝卜素为底物,选择25~50 ℃之间测定的数据来计算活化能。
1.3.7.5 金属离子对酶活力的影响
以β-胡萝卜素为酶反应底物,选用11 种不同的金属离子(Na+、K+、Mg2+、Zn2+、Ca2+、Fe2+、Mn2+、Hg2+、Cu2+、Al3+、Fe3+),向1.3.7.1节反应体系中加入不同浓度(1、5、10、50、100 mmol/L)的金属离子,研究不同金属离子对酶活力的影响。以未加金属离子的酶液的活力作对照,计算剩余酶活力。
1.3.7.6 双氧水对酶活力的影响
以β-胡萝卜素为酶反应底物,向1.3.7.1节反应体系中分别加入不同浓度的H2O2(4、8、12、16、20 μmol/L),测定酶活力变化。
1.3.7.7 乙醇对酶活力的影响
以β-胡萝卜素为酶反应底物,向1.3.7.1节反应体系中分别加入不同体积分数的乙醇溶液(4%、8%、12%和16%),测定酶活力变化。
以上所有反应均重复3 次,结果取平均值。
2 结果与分析
2.1 阴离子交换层析纯化结果
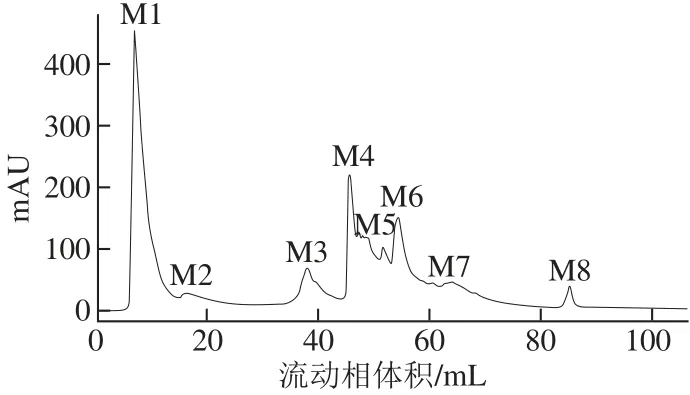
图1 类胡萝卜素裂解酶的Mono Q强阴离子交换层析图谱Fig.1 Elution profile of carotenoid cleavage enzyme by Mono Q 10/100 GL

图2 Mono Q强阴离子交换层析洗脱得到的各组分的酶活力Fig.2 Enzymatic activities of each of the elution fractions obtained by Mono Q 10/100 GL
如图1所示,所得样品中主要有8 个蛋白洗脱峰,对其酶活力进行测定,结果如图2所示,具有催化活性的组分主要集中在峰M6,其活性显著高于其他组分,表明类胡萝卜素裂解酶通过阴离子交互作用基本完全结合在Q柱上。当NaCl浓度在0.25~0.30 mol/L时,目标组分M6被洗脱下来。将组分M6进行收集合并,测得其纯化倍数为
5.5 倍。将收集的酶液进行冷冻干燥浓缩后进行高效制备液相分离纯化。
2.2 PHPLC纯化结果
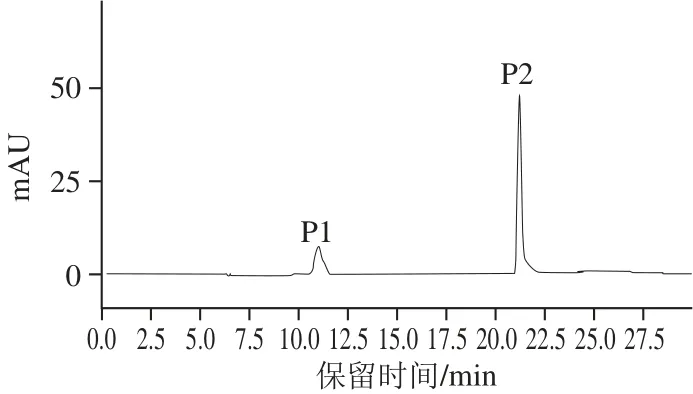
图3 类胡萝卜素裂解酶的PHPLC图谱Fig.3 Elution profile of carotenoid cleavage enzyme by PHPLC
将经过阴离子交换层析后得到的活性组分上样于PHPLC,进一步纯化,结果如图3所示。活性组分M6经过半制备柱C18进一步分离为2 个组分。由图4可知,P1组分具有较高的催化活性,而P2组分的活性很低。将活性组分P1收集,测得其蛋白质量浓度为207 mg/L,与离子交换后的酶液相比纯化了15 倍。
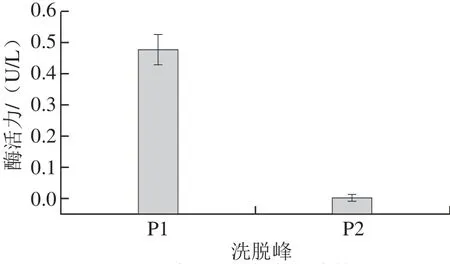
图4 PHPLC洗脱得到的各组分的酶活力Fig.4 Enzymatic activities of each of the elution fractions obtained by PHPLC
2.3 多肽分子筛层析纯化结果

图5 类胡萝卜素裂解酶的第1次Superdex Peptide多肽分子筛层析图谱Fig.5 Elution profile of carotenoid cleavage enzyme by the first Superdex Peptide 10/300 GL chromatography
分子筛层析是根据分子质量大小对活性成分进行分离纯化的技术手段,Superdex Peptide 10/300 GL多肽分子筛可以高分辨率分离肽和分子质量在100~7 000的生物小分子。本实验采用Superdex Peptide 10/300 GL对活性组分P1进行3级纯化,结果如图5所示。所得样品中主要有4 个280 nm波长处的吸收峰。
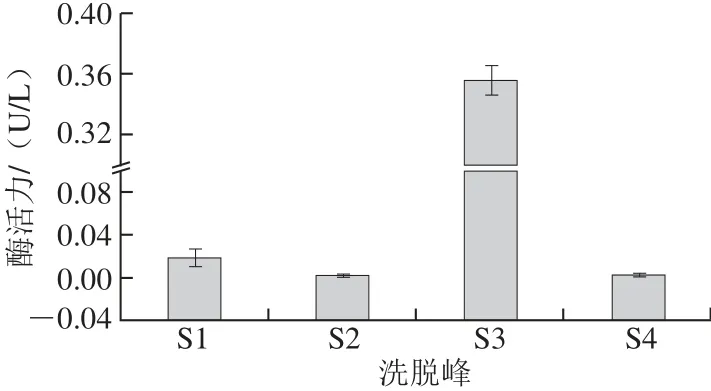
图6 第1次Superdex Peptide多肽分子筛层析洗脱得到的各组分的酶活力Fig.6 Enzymatic activities of each of the elution fractions obtained from the first Superdex Peptide 10/300 GL chromatography
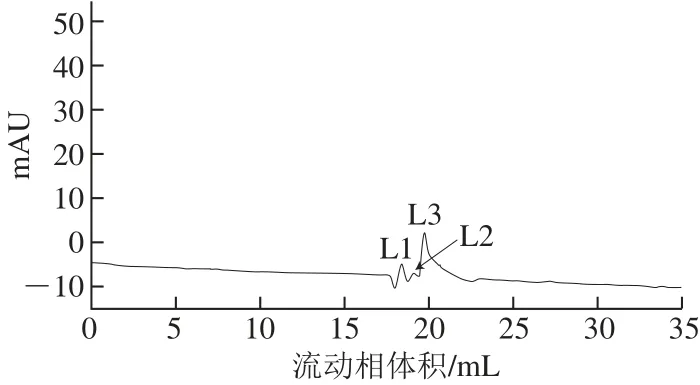
图7 类胡萝卜素裂解酶的第2次Superdex Peptide多肽分子筛层析图谱Fig.7 Elution profile of carotenoid cleavage enzyme by the second Superdex Peptide 10/300 GL chromatography
对其酶活力进行测定,结果如图6所示,其中S3的活性显著高于其他峰,收集组分S3并浓缩后二次上样于多肽分子筛,结果如图7所示。
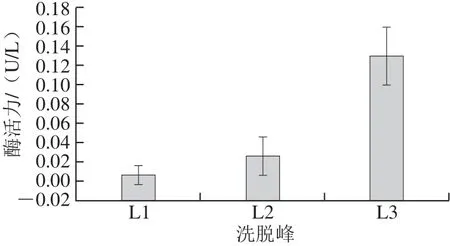
图8 第2次Superdex Peptide多肽分子筛层析洗脱得到的各组分的酶活力Fig.8 Enzymatic activities of each of the elution fractions obtained from the second Superdex Peptide 10/300 GL chromatography
组分酶活力鉴定结果如图8所示。收集合并L3组分,真空冷冻干燥浓缩后,4 ℃条件下贮存备用。
2.4 反相HPLC纯度鉴定
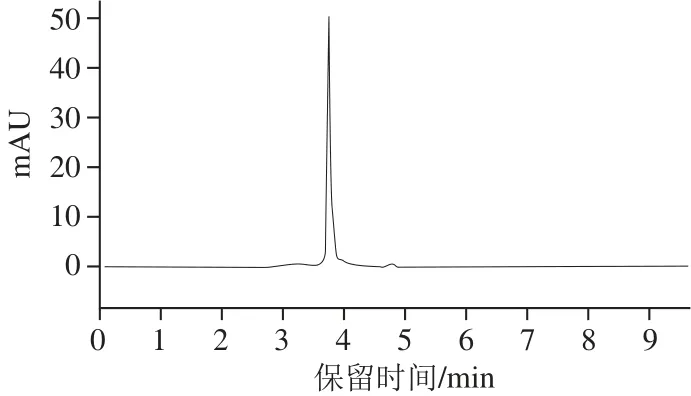
图9 类胡萝卜素裂解酶的HPLC纯度分析Fig.9 Purity analysis of the carotenoid cleavage enzyme by HPLC
由于该酶分子质量很小,难以用聚丙烯酰胺凝胶电泳验证其纯度,故选择HPLC检验物质纯度,其结果显示峰狭窄单一(图9),纯度达到95.6%(以峰面积比例表征物质纯度),由此表明经上述纯化得到的酶液已为纯酶。

表1 巴氏葡萄球菌TS-82中类胡萝卜素裂解酶的分离纯化Table1 Purification procedures of carotenoid cleavage enzyme from S. pasteuri TS-82
巴氏葡萄球菌TS-82发酵液中类胡萝卜素裂解酶的分离纯化结果如表1所示。以β-胡萝卜素为底物测定比活力,纯化后的类胡萝卜素裂解酶的比活力达到125 U/g,纯度提高了446 倍,酶的回收率为2.39%。
2.5 分子质量的测定结果
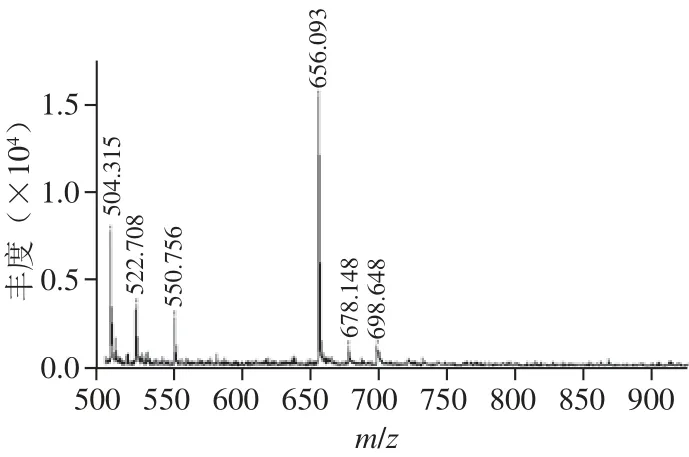
图10 LC-ESI/MS测定巴氏葡萄球菌TS-82类胡萝卜素裂解酶的相对分子质量Fig.10 LC-ESI/MS of purified carotenoid cleavage enzyme from S. pasteuri TS-82
由图10可知,分离纯化得到的纯类胡萝卜素裂解酶分子质量为655.093 D,明显小于报道的该类酶的相对分子质量。据报道,类胡萝卜素裂解酶的分子质量一般在10 kD以上,如Pleurotus sapidus中分离得到的分子质量为38 kD[9],Ganoderma applanatum中的分子质量分别为38.30 kD和38.37 kD[11],而CCD家族的分子质量也在20 kD以上[18-19],表明巴氏葡萄球菌TS-82中分离得到的类胡萝卜素裂解酶明显不同于其他来源的类胡萝卜素裂解酶,其氨基酸序列及结构有待于进一步研究。为排除其为其他有机分子或无机离子的可能性,在实验过程中,分别在高温、强酸和强碱环境下处理该活性物质,测其活性明显降低,随着处理时间的延长,该物质的活性几乎完全丧 失,表明该活性物质并非无机盐离子;在pH 8.0条件下,用胰蛋白酶和蛋白酶K处理该活性物质,再将pH值调至5.0,测其催化活性,发现活性也有明显降低,表明该活性物质被水解,说明该活性物质为多肽或蛋白质类。
2.6 纯酶的酶学特性
2.6.1 最适反应温度及热稳定性

图11 温度对类胡萝卜素裂解酶催化类胡萝卜素底物降解的影响Fig.11 Effect of temperature on the activity of carotenoid cleavage enzyme towards carotenoids substrates
如图11所示,在测定的温度范围内酶活力先随着温度的升高而增加,达到最大值后,随着温度继续升高,酶活力逐步下降。该类胡萝卜素裂解酶作用于C40类胡萝卜素底物的最适反应温度是60 ℃,而作用于β-阿朴-8′-胡萝卜醛的最适温度是50 ℃。酶与双环底物混合物的最适反应温度高于酶与单环底物混合物,表明酶与双环底物的混合物更加稳定,从而保护该酶的结构,使其暂时免受加热的破坏[20]。也有文献报道称具降解类胡萝卜素活性的酶有较高的反应温度,如在茶叶和香兰叶中提取的类胡萝卜素裂解酶最适温度是70 ℃[21],杏鲍菇中得到的该类酶最适温度是65 ℃[8],大部分水果中的该类酶反应温度在45 ℃左右[22-23]。
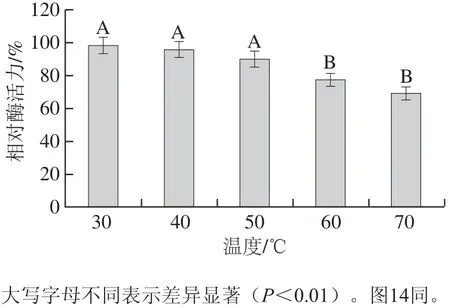
图12 类胡萝卜素裂解酶的耐热性Fig.12 Thermostability of carotenoid cleavage enzyme
在类胡萝卜素裂解酶耐热性研究中,选取β-胡萝卜素标品用于验证酶活力的损失程度,其结果如图12。该酶在50 ℃条件下放置1 h后测定酶活力,发现无显著性地降低,酶活力损失不严重,而当温度继续升高,处理该酶1 h后发现酶活力显著性下降,表明其耐热温度可达到50 ℃,说明该类胡萝卜素裂解酶自身结构较稳定,不易受到温度的破坏。
2.6.2 类胡萝卜素裂解酶的最适反应pH值及其耐酸性

图13 pH值对类胡萝卜素裂解酶催化类胡萝卜素底物降解的影响Fig.13 Effect of pH on the activity of carotenoid cleavage enzyme towards carotenoids substrates
从图13可以看出,所得纯酶催化所有类胡萝卜素底物的最适pH值均为3.0。从pH值分布上看,类胡萝卜素裂解酶在酸性环境下催化活性较高,随着pH值升高,催化能力逐步减弱,在pH 6.0时该酶几乎完全失活,这与报道的其他微生物源的类胡萝卜素裂解酶的最适pH值不同。Sphingopyxis alaskensis RB2256和Plesiocystis pacif i ca SIR-1中的此类酶的最适催化pH值是7.0[1],Pleurotus eryngi中的是5.0[8],表明巴氏葡萄球菌TS-82所产类胡萝卜素裂解酶的耐酸性极好。鉴于沙棘果酒偏酸性,其pH值也在3.0~3.5之间,故该酶的生化特性使其能够适应果酒的工业环境,可用于改善果酒的风味。

图14 类胡萝卜素裂解酶的酸稳定性Fig.14 Acid resistance of carotenoid cleavage enzyme
从图14可看出,所得纯酶在低pH值条件下处理1 周的酶液活性损失显著增加,表明酸性越强,酶结构破坏越严重。在弱酸性环境中(pH 5.0~6.0)放置1 周,酶活力并未发生显著性变化,酶活力仍保有原来的95%以上,说明该酶适合保存在pH 5.0~6.0的缓冲液中,避免结构破坏。该酶在pH 3.5条件下放置1 周后,酶活力显著下降,仅保有原酶活力的45%左右,表明所得纯酶可用于沙棘果酒酿造过程中,在酿造初期可催化部分类胡萝卜素降解,而随着酿造时间增加,该酶活力逐渐降低,可保留一定量的类胡萝卜素以确保沙棘果酒中类胡萝卜素自身的营养价值。
2.6.3 类胡萝卜素裂解酶的Km和vmax

表2 类胡萝卜素裂解酶作用于不同底物的Km和vmaxTabllee 22 Kmaanndd vmmaaxxvvaalluueess ooff ccaarrootteennooiidd cclleeaavvaaggee eennzzyymmee ttoowwaarrddss ddiiffffeerreenntt substraatteess
如表2所示,所得类胡萝卜素裂解酶对底物β-阿朴-8’-胡萝卜醛、β-胡萝卜素、玉米黄质、角黄质和虾青素的Km值分别为15.403、10.99、9.846、11.285 μmol/L和10.952 μmol/L,最大反应速率vmax分别为0.922、0.962、1.406、1.089 μmol/(L·min)和1.044 μmol/(L·min),表明该酶对玉米黄质的Km值最低,故此酶与玉米黄质的结合力最强,亲和力最高;该酶对虾青素、β-胡萝卜素、角黄质和β-阿朴-8’-胡萝卜醛的Km值分别比对玉米黄质的Km值高11.2%、11.6%、14.6%和
56.4 %,表明该酶对虾青素和β-胡萝卜素的亲和力仅次于玉米黄质,其次是角黄质,而β-阿朴-8’-胡萝卜醛与该酶的亲和力最差。
2.6.4 类胡萝卜素裂解酶的Ea
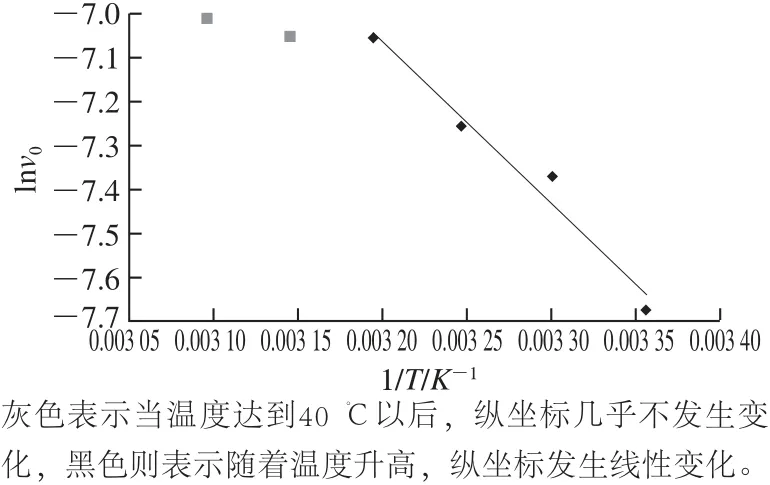
图15 类胡萝卜素裂解酶对β-胡萝卜素的阿伦尼乌斯方程Fig.15 Arrhenius plot of carotenoid cleavage enzyme towards β-carotene
将测定的最适反应温度的数据用来计算Ea。由阿伦尼乌斯曲线方程y=-3 680.1x+4.711 8(图15)的斜率可计算得到Ea为30.617 kJ/mol。而报道的植物源类胡萝卜素裂解酶的Ea是62.2 kJ/mol或者更高[12,23],这表明相较于报道的类胡萝卜裂解酶,所得纯酶更易降解β-胡萝卜素。
2.6.5 金属离子对类胡萝卜素裂解酶的影响
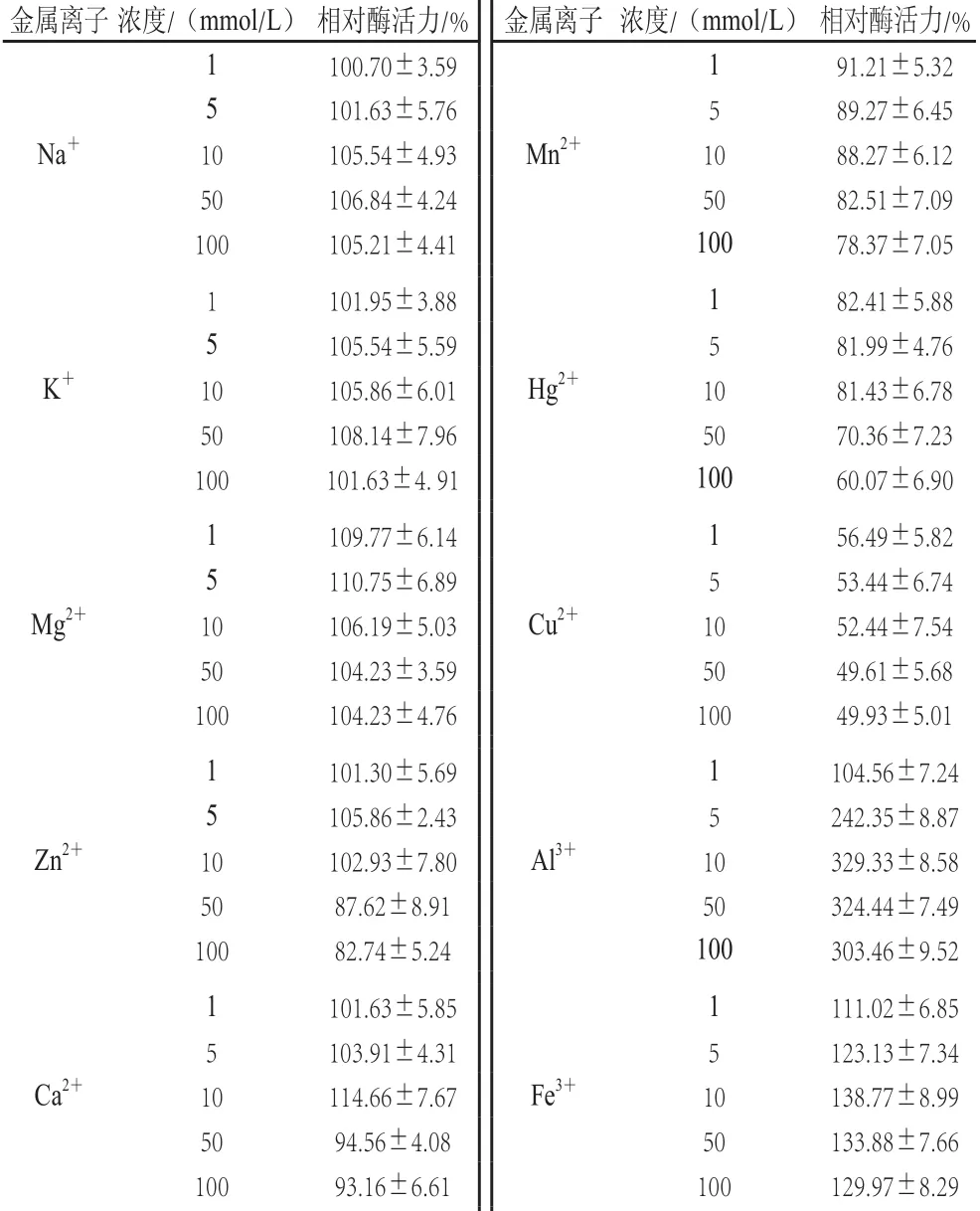
表3 金属离子对酶催化-胡萝卜素活性的影响Table3 Effects of metal ions on the carotenoid cleavage enzyme activity towards -carotene
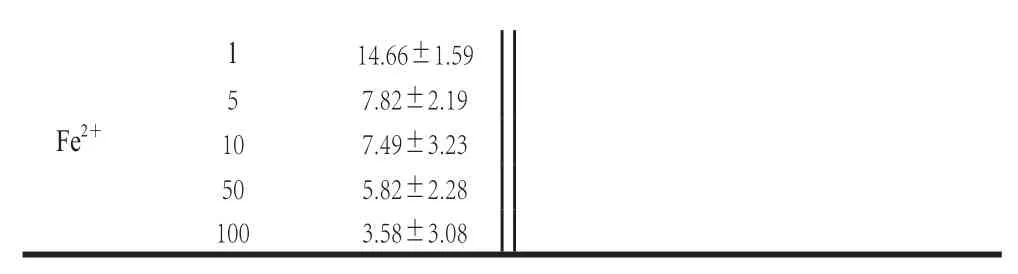
如表3所示,反应体系中,一价阳离子Na+和K+能促进酶活力,但效果不显著。二价阳离子中Mg2+在测试浓度范围内对酶活力有促进作用,但促进作用不明显;Zn2+和Ca2+在低浓度时,对酶活力有轻微的促进作用,在高浓度时,对酶活力有轻微的抑制作用;加入Fe2+、Mn2+、Hg2+、Cu2+后,酶活力随着浓度的增加而降低,其中Mn2+、Hg2+对其抑制作用较轻;而Cu2+对酶活力有较强的抑制作用,在浓度为10 mmol/L时,抑制率达到48%;e2+对酶活力的抑制作用最强,在浓度为1 mmol/L时,抑制率就达到85%,随着浓度升高,在10 mmol/L时,抑制率可达93%,所以Fe2+可作为酶的强效抑制剂。三价阳离子对酶活力都有显著的促进作用,Al3+在10 mmol/L时可使酶活力提高至3 倍多,显著高于其他离子的促进作用,可作为该酶的强效催化剂。
2.6.6 双氧水对类胡萝卜素裂解酶的影响如表4所示,双氧水在低浓度时对该酶无抑制作用,随着H2O2浓度的增加,酶活力先增加后减弱,在12 μmol/L

表4 H2O2对酶催化-胡萝卜素活性的影响Table4 Effects of H2O2on the carotenoid cleavage enzyme activity towards -carotene
时达到最大值,而当浓度过大时,可导致酶失活,这与报道的适当浓度的双氧水可促进类胡萝卜素裂解酶活性的结果一致[8,24],可能是由于高浓度的H2O2导致自发失活抑制作用并形成失活的氧化态而造成的[25]。
2.6.7 乙醇对类胡萝卜素裂解酶的影响

表5 乙醇对酶催化-胡萝卜素活性的影响Table5 Effects of ethyl alcohol on the carotenoid cleavage enzyme activity towards -carotene
如表5所示,乙醇的加入并未对酶活力产生显著的影响,当体积分数达到12%~16%时,活性反而有微弱的提高,表明该酶能够稳定的适应果酒环境,该性质为该酶直接添加于果酒酿造提供了可能性。
3 结 论
巴氏葡萄球菌TS-82所产类胡萝卜素裂解酶经强阴离子柱、高效制备液相和多肽分子筛分离后,可得类胡萝卜素裂解酶纯酶;该酶降解β-胡萝卜素的比活力为125 U/g,纯化倍数为446,回收率为2.39%。经HPLC分析,确定该酶为单一峰,纯度达到95%以上。所得纯酶经HPLC-MS测定,得其分子质量为655.093 D,明显小于报道的该类酶的相对分子质量(≥10 kD),表明巴氏葡萄球菌TS-82中分离得到的类胡萝卜素裂解酶可能是一个新的家族。
关于酶学特性,该酶对C40类胡萝卜素底物的最适温度为60 ℃,而作用于β-阿朴-8’-胡萝卜醛的最适温度是50 ℃,该酶的稳定温度为50 ℃以下;该酶对所考察底物的最适pH值为3.0;根据Lineweaver-Burk法作图求得的Km值和vmax可知,该酶与5 种底物亲和力大小排列为:玉米黄质>虾青素>β-胡萝卜素>角黄质>β-阿朴-8’-胡萝卜醛,底物转化率为:玉米黄质>角黄质>虾青素>β-胡萝卜素>β-阿朴-8’-胡萝卜醛;Al3+和Fe3+是该酶的强效催化剂,Fe2+是该酶的强效抑制剂,在1 mmol/L的情况下就可使该酶几乎完全失活;H2O2在低浓度范围内(0~16 mmol/L)可促进酶活力;低体积分数乙醇(4%~16%)的添加对酶活力影响不大,无抑制作用。上述酶学特性表明该酶能够稳定的适应果酒环境,为其工业化应用提供依据。
[1] HOFFMANN J, BÓNA-LOVÁSZ J, BEUTTLER H, et al. In vivo and in vitro studies on the carotenoid cleavage oxygenases from Sphingopyxis alaskensis RB2256 and Plesiocystis pacifica SIR-1 revealed their substrate specificities and non-retinal-forming cleavage activities[J]. The FEBS Journal, 2012, 279(20): 3911-3924. DOI:10.1111/ j.1742-4658.2012.08751.x.
[2] KLOER D P, SCHULZ G E. Structural and biological aspects of carotenoid cleavage[J]. Cellular and Molecular Life Sciences, 2006, 63(19): 2291-2303. DOI:10.1007/s00018-006-6176-6.
[3] RODRÍGUEZ-B USTAMANTE E, SÁNCHEZ S. Microbial production of C13-norisoprenoids and other aroma compounds via carotenoid cleavage[J]. Critical Reviews in Microbiology, 2007, 33(3): 211-230. DOI:10.1080/10408410701473306.
[4] SUI X W, KISER P D, von LINTING J, et al. Structural basis of carotenoid cleavage: from bacteria to mammals[J]. Archives of Biochemistry and Biophysics, 2013, 539(2): 203-213. DOI:10.1016/j.abb.2013.06.012.
[5] ZHU M M, WANG S L, FAN M T. Isolation and identification of a novel β-carotene degrading microorganism from sea buckthorn juice[J]. Food Biotechnology, 2016, 30(1): 1-17. DOI:10.1080/089054 36.2015.1129501.
[6] 王树林, 朱明明, 李婧, 等. 影响β-胡萝卜素降解菌酶活性因素的研究[J]. 食品科学, 2013, 34(13): 157-161. DOI:10.7506/spkx1002-6630-201313034.
[7] 麻俊侠, 樊明涛, 王树林, 等. β-胡萝卜素降解葡萄球菌化学合成培养基营养素的研究[J]. 食品科学, 2013, 34(5): 137-141.
[8] ZELENA K, HARDEBUSCH B, HÜLSDAU B, et al. Generation of norisoprenoid flavors from carotenoids by fungal peroxidases[J]. Journal of Agricultural and Food Chemistry, 2009, 57(21): 9951-9955. DOI:10.1021/jf901438m.
[9] SCHÜTTMANN I, BOUWS H, SZWEDA R T, et al. Induction, characterization, and heterologous expression of a carotenoid degrading versatile peroxidase from Pleurotus sapidus[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 103: 79-84. DOI:10.1016/ j.molcatb.2013.08.007.
[10] SCHEIBNER M, HÜLSDAU B, ZELENA K, et al. Novel peroxidases of Marasmius scorodonius degrade beta-carotene[J]. Applied Microbiology and Biotechnology, 2008, 77(6): 1241-1250. DOI:10.1007/s00253-007-1261-9.
[11] LANFERMANN I, LINKE D, NIMTZ M, et al. Manganese peroxidases from Ganoderma applanatum degrade β-carotene under alkaline conditions[J]. Applied Biochemistry and Biotechnology, 2015, 175(8):3800-3812. DOI:10.1007/s12010-015-1548-8.
[12] BALDERMANN S, NAIM M, FLEISCHMANN P. Enzymatic carotenoid degradation and aroma formation in nectarines (Prunus persica)[J]. Food Research International, 2005, 38(8): 833-836. DOI:10.1016/j.foodres.2005.02.009.
[13] 朱明明, 王树林, 贺静, 等. 巴氏葡萄球菌类胡萝卜素降解酶的酶学性质研究[J]. 中国食品学报, 2016, 16(2): 18-24. DOI:10.16429/j.1009-7848.2016.02.003.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1006/abio.1976.9999.
[15] 朱明明, 贺静, 樊明涛, 等. 细菌类胡萝卜素裂解酶酶解虾青素工艺优化[J]. 食品科学, 2015, 36(8): 1-5. DOI:10.7506/spkx1002-6630-201508001.
[16] 郭勇. 酶工程研究进展与发展前景[J]. 华南理工大学学报(自然科学版), 2002, 30(11): 130-133. DOI:10.3321/j.issn:1000-565X.2002.11.023. [17] 董梅. 酒类酒球菌31MBR β-D-葡萄糖苷酶的分离纯化及酶学性质研究[D]. 杨凌: 西北农林科技大学, 2014: 36-42.
[18] SCHWARTZ S H, QIN X Q, ZEEVAART J A D. Characterization of a novel carotenoid cleavage dioxygenase from plants[J]. Journal of Biological Chemistry, 2001, 276(27): 2520 8-25211. DOI:10.1074/jbc. M102146200.
[19] WYSS A, WIRTZ G, WOGGON W D, et al. Cloning and expression of β,β-carotene 15,15′-dioxygenase[J]. Biochemical and Biophysical Research Communication, 2000, 271(2): 334-336. DOI:10.1006/ bbrc.2000.2619.
[20] KISHORE D, KAYASTHA A M. A β-galactosidase from chick pea (Cicer arietinum) seeds: its purif i cation, biochemical properties and industrial applications[J]. Food Chemistry, 2012, 134(2): 1113-1122. DOI:10.1016/ j.foodchem.2012.03.032.
[21] NINGR UM A, SCHREINER M. Carotenoid-cleavage activities of crude enzymes from Pandanous amryllifolius[J]. Chemistry and Biodiversity, 2014, 11(11): 1871-1881. DOI:10.1002/cbdv.201400029.
[22] FLEISCHMANN P, STUDER K, WINTERHALTER P. Partial purif i cation and kinetic characterization of a carotenoid cleavage enzyme from quince fruit (Cydonia oblonga)[J]. Journal of Agricultural and Food Chemistry, 2002, 50(6): 1677-1680. DOI:10.1021/jf011184j.
[23] FLEISCHMANN P, WATANABE N, WINTERHALTER P. Enzymatic carotenoid cleavage in s tar fruit (Averrhoa caram bola)[J]. Phytochemistry, 2003, 63(2): 131-137. DOI:10.1016/S0031-9422(02)00657-X.
[24] FRANCESCO G M. Alkene cleavage catalysed by heme and nonheme enzymes: reaction mechanisms and biocatalytic applications[J]. Bioinorganic Chemistry and Applications, 2012(23): 626909. DOI:10.1155/2012/626909.
[25] ARNAO M B, ACOSTA M, del RIO J A, et al. A kinetic study on the suicide inactivation of peroxidase by hy drogen peroxide[J]. Biochimica et Biophysica Acta, 1990, 1041(1): 43-47. DOI:10.1016/0167-4838(90)90120-5.
Isolation, Purification and Characterization of a Novel Carotenoid-Cleaving Enzyme from Staphylococcus pasteuri TS-82
ZHU Mingming1, FAN Mingtao2, HE Hongju1,*, MA Hanjun1
(1. School of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China; 2. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
A carotenoid cleavage enzyme with HPLC grade purity of 95.6% w as obtained from Staphylococcus pasteuri (S. pasteuri) TS-82 by using anion-exchange chromatography, preparative high performance liquid chromatography (PHPLC), and superdex peptide chromatography together. The purified enzyme had a specific activity of 125 U/g with 466-fold purification and 2.39% recovery. Its molecular weight was 655.093 D as identified by liquid chromatographyelectrospray ionization-tandem mass spectrometry (LC-ESI/MS). Enzymatic characterization indicated that the purified enzyme had optimal temperature of 60 ℃ for degrading C40carotenoids and 50 ℃ for degrading β-apo-8’-carotenal, and it maintained stable activity at 50 ℃. The optimum pH value was 3.0 for degrading all investigated substrates. The Kmand vmaxvalues indicated that the enzyme showed the highest affinity towards zeaxanthin, followed by astaxanthin, β-carotene, canthaxanthin, and β-apo-8’-carotenal in a decreasing order. The metal ions Al3+and Fe3+were identif i ed as potent activators for the purif i ed enzyme, whereas Fe2+as a potent inhibitor. H2O2was able to increase the enzyme activity in degrading β-carotene at levels of 0-16 mmol/L. Alcohol at low concentration (4%-16%) did not inhibit the activity of the enzyme. In conclusion, the enzyme showed great acid resistance and thermostability, which makes it stable in wine environment and provides a basis for industrial application.
Staphylococcus p asteuri TS-82; carotenoid cleavage enzyme; carotenoids; purif i cation; characterization
10.7506/spkx1002-6630-201712016
TS20
A
1002-6630(2017)12-0104-08
朱明明, 樊明涛, 何鸿举, 等. 巴氏葡萄球菌TS-82类胡萝卜素裂解酶的分离纯化及其酶学特性[J]. 食品科学, 2017, 38(12): 104-111.
10.7506/spkx1002-6630-201712016. http://www.spkx.net.cn
ZHU Mingming, FAN Mingtao, HE Hongju, et al. Isolation, purification and characterization of a novel carotenoid-cleaving enzyme from Staphylococcus pasteuri TS-82[J]. Food Science, 2017, 38(12): 104-111. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712016. http://www.spkx.net.cn
2016-06-11
河南科技学院高层次人才科研启动项目(2015015;2016020);国家自然科学基金面上项目(31171728);河南省高校科技创新团队支持计划项目(13IRTSTHN006)
朱明明(1989—),女,讲师,博士,主要从事食品分析研究。E-mail:happyzhumingming@126.com
*通信作者:何鸿举(1983—),男,教授,博士,主要从事食品质量分析与快速检测研究。E-mail:hongju_he007@126.com
