高糖胁迫下槲皮素对酿酒酵母胞内损伤的保护作用与机制
2017-06-22徐晓丹柯尊丽周志钦
徐晓丹,潘 宇,柯尊丽,周志钦,2,*
(1.西南大学园艺园林学院,重 庆 400716;2.中国农业科学院柑桔研究所,农业部柑桔产品质量安全风险评估实验室(重庆),重庆 400715)
高糖胁迫下槲皮素对酿酒酵母胞内损伤的保护作用与机制
徐晓丹1,潘 宇1,柯尊丽1,周志钦1,2,*
(1.西南大学园艺园林学院,重 庆 400716;2.中国农业科学院柑桔研究所,农业部柑桔产品质量安全风险评估实验室(重庆),重庆 400715)
以酿酒酵母S288c为模型,分析高糖 胁迫下槲皮素对其胞内损伤的保护作用及机制。结果表明:与对照相比,高糖胁迫不影响酵母胞内活性氧(reactive oxygen species,ROS)水平,但显著降低了胞内酶比活力(P<0.05);槲皮素处理后,与对照组和高糖组相比,酿酒酵母胞内ROS水平、超氧化物歧化酶和过氧化氢酶活力均显著下降(P<0.05),而过氧化物酶(peroxi dase,POD)比活力极显著升高(P<0.01),说明POD比活力对高糖耐受性反应更为灵敏,可作为衡量高糖胁迫应激机制的重要生理指标,槲皮素可通过调节胞内POD比活力来提高机体的抗氧化能力。另外,实时荧光定量聚合酶链式反应结果表明高质量浓度葡萄糖显著抑制了酵母中GPD2和SUC2的表达水平(P<0.05),并极显著提高了HXT1的表达水平(P<0.01),而对GUT1的表 达影响不显著;槲皮素处理后,高糖胁迫下酵母中GPD2、SUC2和HXT1的表达 水平显著提高(P<0.05),而GUT1无显著变化,说明槲皮素可能通过高渗透甘油途径、菊糖水解途径和己糖转运途径等来促进葡萄糖的分 解代谢,从而达到保护机体细胞免受伤害的作用。结果表明槲皮素对高糖诱导的酿酒酵母胞内损伤具有保护作用,其作用机制可能与自身的抗氧化作用以及利用调节机体内高渗透甘油途径与糖的分解和转运途径存在一定的关联性。
酿酒酵母;高糖胁迫;槲皮素;酶比活力;基因表达水平
在发酵与酿造业中,高糖发酵具有节省能源,提高酒精产量,降低成本等优点,而酿酒酵母(Saccharomyces cerevisiae)因其耐高渗特性而被广泛应用[1]。然而,在高糖胁迫下,细胞内也会产生过量的活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)等有害物质,促使线粒体产生超氧化物并激活一氧化氮合酶,形成过氧亚硝基,致使机体进一步被氧化而受损伤[1]。在生物体内,过量的ROS、氮化物等氧化物会对生物体产生不同程度的伤害,造成细胞损伤,甚至凋亡。目前,关于氧化应激反应在酿酒酵母中已有很多相关报道,但普遍认为超氧化物歧化酶(superoxide dismutase,SOD)是重要的ROS清除剂,对维持生物体内ROS的动态平衡起重要作用[2];另外,提高SOD和过氧化氢酶(catalase,CAT)活性可显著提高其对逆境的耐受能力[3]。除此之外,研究认为过氧化物酶(peroxidase,POD)与高糖耐受力也紧密关联[3],但具体的分子作用机制尚不清楚。
槲皮素(3,3′,4′,5,7-五羟基黄酮)是一种抗氧化能力较强的黄酮醇类物质,在蔬菜、水果等食物中普遍存在,具有抗氧化、降脂及减少机体损伤等生物学功能,在清除自由基[4]、抗血小板聚集[5]、抗肥胖和延长寿命[6]、抗炎[7]等方面发挥至关重要作用。此外,在人类系膜细胞模型中,槲皮素能显著抑制高糖胁迫下ROS-NF-κB的信号途径,从而保护机体细胞免受伤害[8];其超强的抗氧化特性也能显著抑制高糖胁迫下细胞的凋亡[9]。但在酿酒酵母模型中,高糖胁迫下槲皮素作为抗氧化剂对细胞保护作用的机理还尚不明确。因此,本研究以酿酒酵母S288c为模型,分析了高葡萄糖胁迫下槲皮素对相关抗氧化酶活性的影响及其葡萄糖代谢途径中关键酶基因表达的差异,从细胞和分子水平上对槲皮素在高糖胁迫处理后胞内抗氧化酶生理特性的变化及分子作用机制进行了初步分析,为今后槲皮素等天然抗氧化黄酮类化合物的开发及其应用提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与培养基
酿酒酵母S288c由广东省微生物菌种保藏中心所提供。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母提取物10 g/L,121 ℃高压灭菌15 min。
YPD固体培养基:YPD液体培养基加入琼脂粉20 g/L。
高糖培养基:以YPD液体培养基为基础,添加葡萄糖至40、80、100 g/L,121 ℃高压灭菌15 min。
1.1.2 试剂
槲皮素(纯度≥98%) 宝鸡浩翔生物技术有限公司;ROS检测试剂盒 碧云天生物技术研究所;反转录试剂盒、RNAiso Plus(Total RNA)提取试剂盒宝生物工程有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;琼脂粉、考马斯亮蓝G-250、葡萄糖、钼酸铵、邻苯三酚(焦性没食子酸)、愈创木酚均为国产分析纯试剂。
300 μmol/L槲皮素:称取0.151 g槲皮素粉末溶解于1 000 μL DMSO中,得500 μmol/L槲皮素,取300 μL的500 μmol/L槲皮素用DMSO定容至500 μL。
1.2 仪器与设备
紫外-可见分光光度计 德国Eppendorf公司;Varioskan Flash全波长扫描式多功能酶标仪 美国Thermo公司;CFX96实时荧光定量聚合酶链反应(quantitative real time-polymerase chain reaction,qRT-PCR)仪 美国Bio-Rad公司。
1.3 方法
1.3.1 酿酒酵母菌株活化与培养处理
将保存的菌种接种于YPD固体培养基于28 ℃培养,挑取单菌落转接到YPD液体培养基,培养至OD600nm为1.0。将酵母细胞按1∶100(V/V)的接种量再接种于事先加入0.1%槲皮素或100 g/L葡萄糖处理的YPD液体培养基中,28 ℃培养,槲皮素作用8 h后的酿酒酵母细胞用于后续实验中各指标的测定。实验分4 个处理组,即对照组、高糖组(培养基葡萄糖质量浓度为100 g/L)、对照组+300 μmol/L槲皮素、高糖组+300 μmol/L槲皮素。
1.3.2 酿酒酵母生长曲线的测定
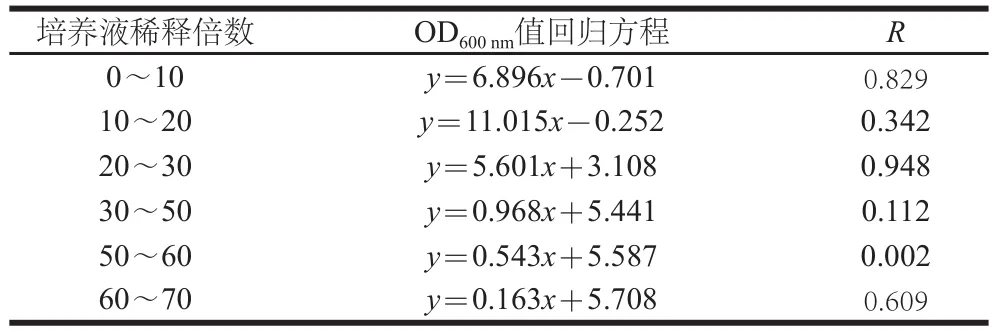
表1 酿酒酵母S288c不同稀释倍数OD600 nm值计算回归方程Table1 Regression equations for OD600of Saccharomyces cerevisiae S288c at different dilution factors
将接入1∶100(V/V)接种量接入YPD培养基开始计为0 h,以未接种的YPD液体培养基将紫外-可见分光光度计校正为零点,在波长600 nm处分别测定培养0、2、4、6、8、12、14、16、18、20、22、24 h的酵母细胞悬液的OD600nm值,每份样品测定3 次计算平均值。当菌悬液菌体浓度过高时,为保证结果可靠性,对其进行稀释,控制OD600nm值介于0.1~0.8之间[10],按照每个稀释梯度对应的回归方程计算获得OD600nm实际值(表1),x为稀释后OD600nm值,y为OD600nm实际值。以各时间点菌悬液的OD600nm值为纵坐标,培养时间为横坐标,绘制酵母细胞生长曲线。
1.3.3 酵母胞内ROS水平测定
酿酒酵母胞内R O S水平采用2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichloro-dihydrofluorescein diacetate,DCFH-DA)法进行测定。用未接种酵母细胞的YPD培养基稀释DCFH-DA终浓度为10 μmol/L,细胞数量控制在1×106个/mL,置于培养箱内37 ℃避光孵育20 min。孵育完成后用800 μL 磷酸缓冲液(50 mmol/L,pH 7.0)洗涤3 次,充分去除附着于细胞表面的DCFH-DA,收集 并重悬细胞,酶标仪在激发波长为488 nm,发射波长为525 nm,检测各组细胞内的荧光强度。
1.3.4 蛋白质量浓度测定
采用Bradford法测定样品中蛋白质量浓度,用595 nm波长条件下校正的牛血清白蛋白为标准样[11]。
1.3.5 酵母细胞内酶比活力测定
取20 mL酵母细胞悬液(OD600nm为0.1)8 000×g离心5 min,收集酵母细胞并破碎,再10 000×g离心20 min,收集上清液即为粗提酶液,分别用于后续相关指标的测定,3 次重复。酶的比活力以每毫克蛋白质所具有的酶活力表示。
SOD活力采用邻苯三酚自氧化法测定,具体步骤参照许雅娟等[12]方法,在波长325 nm处每隔0.5 min测定一次OD值,共测定4 min,计算出OD值变化速率。每分钟反应液中SOD抑制50%反应速率时即为1 个SOD活力单位(U)。
CAT活力测定参照程鲁京等[13]方法,采用钼酸铵比色法测定,在波长410 nm处测定OD值并计算酶活力,以每分钟分解1 μmol过氧化氢为1 个酶活力单位(U)。
POD活力 参照刘艳[14]采用的愈创木酚法进行测定,记录在波长470 nm处每分钟内的OD变化值,以每分钟OD值变化0.01为1 个酶活力单位(U)。
1.3.6 酵母中糖代谢基因的表达量差异分析
采用RNAiso Plus试剂盒提取酵母细胞的总RNA。各取1 μg总RNA,用反转录试剂盒对RNA进行反转录。反转录后的cDNA保存于-20 ℃备用。
采用qRT-PCR方法分别对4 种不同条件处理的酿酒酵母细胞中GPD2、GUT2、SUC2和HXT1基因表达量的变化进行了检测,扩增反应体系含2 μL(约100 ng)模板cDNA,0.5 μL上下游引物(10 μmol/L),5 μL SYBR Green荧光染料,加ddH2O至10 μL。在qRTPCR仪进行扩增反应,条件为95 ℃预变性3 min,40 个循环,95 ℃变性10 s,退火30 s(退火温度根据引物确定,表2),65 ℃延伸5 s。反应结束后,根据内参基因ACT1计算目的基因的相对表达量,采用3 次生物学重复和3 次技术重复,数据通过SPSS13.0软件分析并进行t检验。
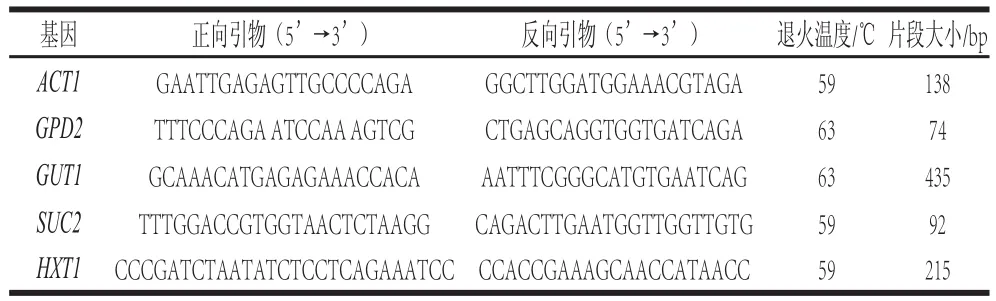
表2 qRT-PCR目的基因及引物序列Table2 Primers for target genes used for qRT-PCR in this study
1.4 统计学分析
2 结果与分析
2.1 高糖胁迫对酿酒酵母生长的影响
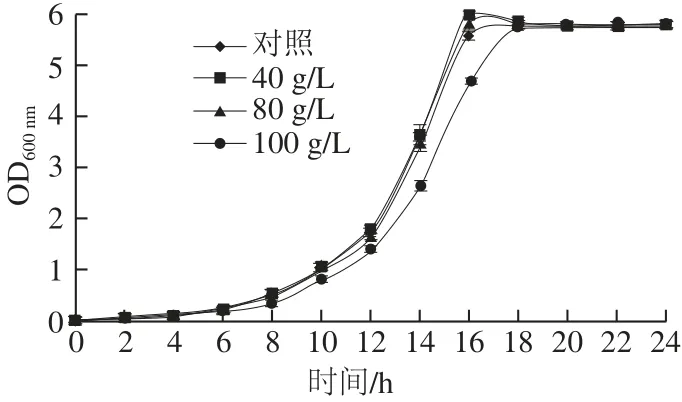
图1 不同葡萄糖质量浓度处理下的酿酒酵母S288c生长曲线Fig.1 Growth curve of S. cerevisiae S288c at different glucose concentrations
微生物生长历程一般分为延滞期、对数期、稳定期和衰亡期4 个时期。图1结果表明,不同质量浓度葡萄糖处理的酿酒酵母主要经历了前3 个生长阶段,0~8 h为延滞期,在低糖质量浓度(20、40、80 g/L)条件下8~16 h为对数期,16 h后趋于稳定,而葡萄糖质量浓度为100 g/L时,8~18 h为对数期,说明葡萄糖质量浓度对酵母生长的延滞期影响较小,当葡萄糖质量浓度为100 g/L时,酵母生 长的对数期延长,即进入稳定期的时间滞后,认为对酵母生长产生了高糖胁迫。因此,本研究以槲皮素作用8 h后的酵母细胞悬液(即酿酒酵母生长的对数期起始期)为不同实验处理起始临界点,高糖胁迫的葡萄糖质量浓度设为100 g/L。
2.2 槲皮素对酿酒酵母胞内ROS水平的影响
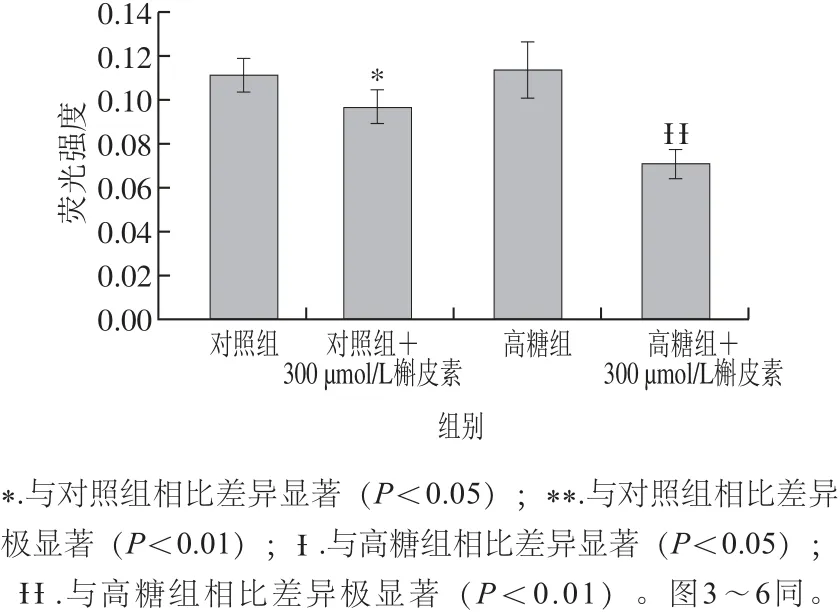
图2 高糖胁迫下槲皮素对酿酒酵母S288c胞内ROS水平的影响Fig.2 Effects of quercetin on intracellular ROS levels of S. cerevisiae S288c under high glucose-induced stress
ROS具有很强的氧化活性,过量积累易造成细胞结构的损伤,影响其正常的生理活性。槲皮素具有较强的抗氧化及自由基清除能力,且浓度为300 μmol/L时对酿酒酵母的保护作用最佳[4]。因此,本研究将在高糖胁迫条件下保护剂的槲皮素浓度设为300 μmol/L。图2结果显示,对照组与高糖组中胞内ROS水平基本保持一致,无显著差异(P>0.05),而槲皮素处理后,对照组中胞内ROS水平下降了12.88%(P<0.05),而在高糖组中下降37.47%(P<0.01),达到差异极显著水平,说明在进入对数期之前,尽管高糖胁迫处理对胞内ROS水平无显著作用,却能显著降低尤其是高糖胁迫下胞内ROS水平。因此,研究结果表明槲皮素具有很好的自由基清除能力,能显著降低胞内ROS水平,从而保护酿酒酵母免受自由基的损伤,维持机体正常生长。
2.3 槲皮素对酿酒酵母胞内抗氧化酶活性的影响

图3 高糖胁迫下槲皮素对酿酒酵母S288c胞内SOD比活力的影响Fig.3 Effects of quercetin on intracellular superoxide dismutase activity of S. cerevisiae S288c under high glucose-induced stress
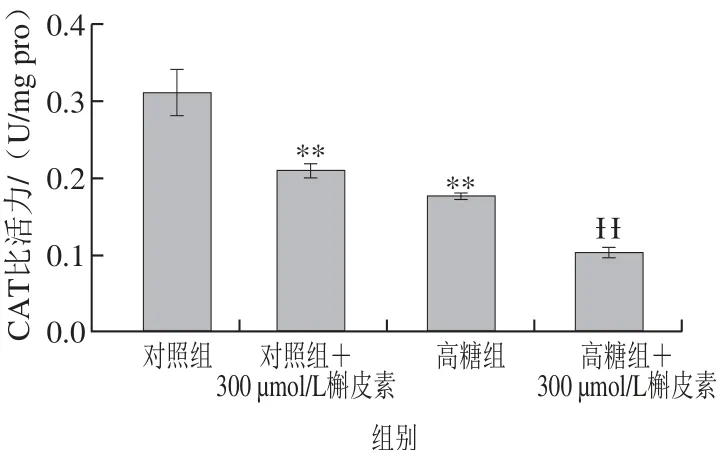
图4 高糖胁迫下槲皮素对酿酒酵母S288c胞内CAT比活力的影响Fig.4 Effects of quercetin on intracellular catalase activity of S. cerevisiae S288c under high glucose-induced stress
在逆境条件下,SOD、CAT和POD通常是细胞抵御ROS伤害的重要保护酶,能及时清除氧自由基、过氧化氢、羟自由基等,从而保护机体免受伤害[15]。在高糖胁迫处理后,酿酒酵母胞内SOD和CAT比活力变化趋势比较一致,均明显低于对照,下降率高达48.59%和43.41%,达到极显著水平(P<0.01)(图3、4)。然而,槲皮素处理后,对照组与高糖组中SOD和CAT比活力仍然表现为明显的下降趋势,在对照组中SOD与CAT比活力下降率分别达到18.11%(P<0.05)和32.43%(P<0.01),在高糖组中,SOD与CAT比活力分别下降了75.89%(P< 0.01)和41.58%(P<0.01),说明在一定浓度范围内的高糖胁迫及槲皮素能显著降低酿酒酵母胞内SOD与CAT比活力。
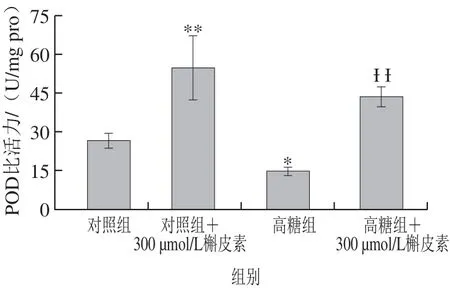
图5 高糖胁迫下槲皮素对酿酒酵母S288c胞内POD比活力的影响Fig.5 Effects of quercetin on intracellular peroxidase activity of S. cerevisiae S288c under high glucose-induced stress
然而与对照相比,高糖胁迫处理后,POD比活力降低了44.82%,达到显著差异水平(P<0.05),但在槲皮素处理后,对照组与高糖组中POD比活力分别上升了106.71%和198.49%,达到极显著差异水平(P<0.01)(图5),说明槲皮素可通过调节POD比活力来响应高糖胁迫的抗 氧化应激反应,进而显著提高机体的抗氧化能力。
2.4 酿酒酵母中GPD2、GUT1、SUC2和HXT1表达量的变化
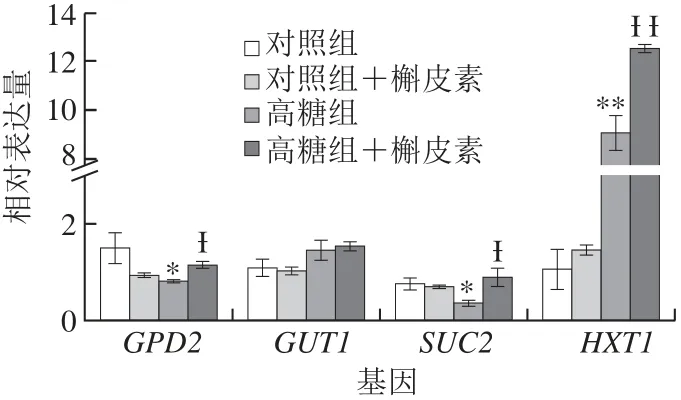
图6 高糖胁迫下槲皮素对酿酒酵母S288c中GPD2 GUT1 SUC2 HXT1基因表达的影响Fig.6 Effects of quercetin on the expression profiles of GPD2, GUT1, SUC2 and HXT1 in S. cerevisiae S288c under high glucose-induced stress
图6结果显示,与对照相比,槲皮素处理后的酵母中GPD2、GUT1、SUC2和HXT1的相对表达量均无显著变化(P>0.05),说明在正常培养条件下,槲皮素对酵母中相关基因的相对表达量影响较小。在高糖胁迫处理后,酿酒酵母S288c中GPD2和SUC2相对表达量显著下调(P<0.05),分别比对照降低了45.30%和51.30%(图6),而HXT1表现为极显著上调表达(P<0.01),相对表达量比对照增加了7.54 倍,GUT1相对表达量却无显著变化(P>0.05);同时在槲皮素处理后,酿酒酵母S288c中GPD2、SUC2和HXT1的相对表达量均显著升高(P<0.05),相对表达量分别比高糖组增加了39.50%、1.40倍和38.30%,但GUT1的相对表达量始终无显著变化(P>0.05)。本研究结果表明高质量浓度葡萄糖能显著抑制GPD2和SUC2的表达,诱导HXT1的表达;同时,槲皮素可显著提高酿酒酵母S288c中GPD2、SUC2和HXT1的表达水平,从而促进酵母体内葡萄糖的转运代谢和分解利用。
3 讨 论
黄酮类化合物是一类重要的天然有机化合物,是植物在长期自然选择过程中产生的一类次生代谢产物,它能清除生物体内的自由基,具有抗氧化作用而被广泛关注[16]。其中,槲皮素被认为是类黄酮物质中最重要的一种天然抗氧化剂,属于多羟基黄酮醇类化合物,广泛存在于各种蔬菜、水果及中草药中,其药理作用主要表现在其抗氧化与自由基清除能力、抗炎、抗病毒等方面[5]。而在生物体中,抗氧化酶系统是有效清除ROS、维持细胞正常生理功能的第一道屏障,包括SOD、CAT和POD等保护酶系统均在清除自由基、过氧化氢和过氧化物及降低自由基的形成等方面发挥至关重要作用[17]。酿酒酵母是与人类关系最广泛的一种酵母,其氧化应激反应的抗胁迫机制与多种代谢途径相关,涉及众多基因的参与调控[18]。当机体受到高渗胁迫时,细胞内的氧化还原平衡系统被破坏,ROS、氮化物等内源性氧化物大量积累从而对细胞形成伤害[3]。酿酒酵母在高盐、高糖、高乙醇和氧化剂等胁迫后,胞内ROS水平、SOD、CAT及POD比活力显著提高[19],说明这些抗氧化物酶活性物质对维持有机体胞内正常渗透压起到关键作用。本研究以酿酒酵母S288c为模型,在葡萄糖质量浓度为100 g/L时,酵母生长曲线的对数期延长,说明对酵母的生长形成了高糖胁迫,且细胞内的SOD、CAT和POD比活力却受到显著抑制,而胞内的ROS水平差异不显著;在槲皮素处理之后,酿酒酵母胞内ROS水平降低,且SOD与CAT比活力受到抑制更加明显,但极显著提高了POD比活力。本研究结果显示高质量浓度(100 g/L)葡萄糖和槲皮素处理仅显著提高了POD比活力,对ROS水平、SOD和CAT比活力起到抑制作用,说明并未激活酿酒酵母胞内所有的抗氧化系统应激机制,酿酒酵母中POD的调节机制与ROS、SOD、CAT可能不同。另外,本研究结果说明过氧化物酶活性对高糖耐受性更为灵敏,可作为衡量筛选及鉴定高糖胁迫应激机制的重要生理指标,而槲皮素主要作用在于通过调节胞内过氧化物酶活性来提高机体的抗氧化能力。
在酿酒酵母中,葡萄糖可作为碳源,来维持其正常生长代谢,主要参与了甘油与乙醇合成的糖代谢过程。研究认为,在酵母中甘油的合成主要受胞内高渗透甘油(high osmolarity glycerol,HOG)信号途径中编码3-磷酸甘油脱氢酶的GPD1、GPD2及甘油分解代谢途径中编码甘油激酶和FAD+-3-磷酸甘油脱氢酶的甘油利用的GUT1和GUT2的调控。GPD2在氧化还原代谢中起着至关重要的作用,GPD2过表达会提高细胞质中NADH的氧化还原[20]。GUT1在发酵碳源(葡萄糖)和非发酵碳源(甘油、乙醇等)表达完全不同,在葡萄糖存在的条件下GUT1会受到抑制作用[21]。与GUT1相类似,一些基因的表达也会受到葡萄糖的影响而被抑制,主要包括GAL、SUC2、MAL和STA等基因[22],其中,SUC2被认为是编码蔗糖转化酶的重要基因,SUC2的过表达可促进菊糖水解途径中菊糖的水解与乙醇的合成,因此被认为是分析葡萄糖抑制机理的一种理想基因分析模型[23]。另外,在糖代谢过程中,葡萄糖主要通过己糖代谢途径被酿酒酵母细胞吸收和利用,而HXT1是该途径中负责葡萄糖转运的重要基因,属于HXT基因家族。目前,已有20多个HXT家族基因被成功克隆并完成功能鉴定[24]。当HXT1表达上调时,酿酒酵母对葡萄糖的摄入利用加快,最终提高乙醇或乳酸的合成[25]。本研究结果表明,在高质量浓度葡萄糖下,GPD2和SUC2的表达受到显著抑制(P<0.05),说明高糖胁迫处理显著影响了酵母细胞内的HOG途径与菊糖水解途径,使甘油和乙醇形成受阻,导致机体内代谢失去平衡;同时,HXT1的表达水平显著提高,说明高糖胁迫可能会诱导己糖代谢途径的发生。在槲皮素处理后,GPD2和SUC2的表达水平显著提高(P<0.05),说明在高糖胁迫下,槲皮素在一定程度上缓解了高葡萄糖对HOG途径的抑制作用,促进了甘油的合成,同时槲皮素显著提高了葡萄糖的转运,使机体内菊糖的分解代谢加快,从而维持细胞正常的生长代谢;另外,槲皮素极显著提高HXT1的表达水平,说明己糖代谢途径可能是酿酒酵母摄取外源葡萄糖的重要代谢途径,槲皮素通过促进机体对葡萄糖的吸收利用,进而维持机体内与外界葡萄糖质量浓度的平衡,保护细胞免受伤害。
因此,本研究以酿酒酵母S288c为分析模型,发现高糖胁迫与槲皮素处理后,酿酒酵母胞内ROS水平、SOD和CAT比活力显著降低,POD比活力显著升高,说明POD比活力对高糖耐受性及槲皮素处理后的反应更为灵敏,可作为衡量高糖胁迫应激机制的重要生理指标;另外,在高糖胁迫后,槲皮素显著提高了GPD2、SUC2和HXT1的表达水平,说明槲皮素可以通过调控酿酒酵母中HOG途径、菊糖水解途径和己糖转运途径来响应高糖胁迫处理,从而保护酿酒酵母免受自由基的损伤、修复抗氧化系统和促进机体内的代谢平衡。本研究结果为槲皮素等天然抗氧化黄酮类化合物的开发及其对酵母体内高渗机理的分子机制研究提供一定的理论依据。
[1] NOTI O, VAUDANO E, PESSIONE E, et al. Short-term response of different Saccharomyces cerevisiae strains to hyperosmotic stress caused by inoculation in grape must: RT-qPCR study and metabolite analysis[J]. Food Microbiology, 2015, 52: 49-58. DOI:10.1016/ j.fm.2015.06.0 11.
[2] 冯宇, 徐滕洋, 蔡瑾, 等. 蛋白酶A敲除对酿酒酵母抗氧化性的影响[J].中国食品学报, 2013, 13(2): 13-18.
[3] 熊雅兰, 晏伟, 张穗生, 等. 酿酒酵母呼吸突变株的高糖胁迫反应研究[J]. 广西科学, 2014, 21(1): 34-41.
[4] VILA A R, MENDES V, MENDES M V, et al. Quercetin protects Saccharomyces cerevisiae against oxidative stress by inducing trehalose biosynthesis and the cell wall integrity pathway[J]. PLoS ONE, 2012, 7(9): e45494. DOI:10.1371/journal.pone.0045494.
[5] 孙涓, 余世春. 槲皮素的研究进展[J]. 现代中药研究与实践, 2011, 25(3): 85-88. DOI:10.3969/j.issn.1004-2407.2006.06.027.
[6] BELINHA I, AMORIM M A, RODRIGUES P, et al. Quercetin increases oxidative stress resistance and longevity in Saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6):2446-2451. DOI:10.1021/jf063302e.
[7] 蔡夏夏, 鲍雷, 丁叶, 等. 槲皮素对葡萄糖胺条件下血管内皮细胞损伤的影响[J]. 食品科学, 2013, 34(13): 224-228. DOI:10.7506/spkx1002-6630-201313047.
[8] CHEN P, SHI Q, XU X, et al. Quercetin suppresses NF-κB and MCP-1 expression in a high glucose-induced human mesangial cell proliferation model[J]. International Journal of Molecular Medicine, 2012, 30(1): 119-125. DOI:10.3892/ijmm.2012.955.
[9] QU L, LIANG X, GU B, et al. Quercetin alleviates high glucose-induced Schwann cell damage by autophagy[J]. Neural Regeneration Research, 2014, 9(12): 1195. DOI:10.4103/1673-5374.135328.
[10] 郭春叶, 龚月生, 刘林丽, 等. 酵母菌生长曲线的测定及其转葡萄芪合酶基因重组菌遗传稳定性的检测[J]. 安徽农业科学, 2007, 35(7):190 9-1910. DOI:10.3969/j.issn.0517-6611.2007.07.014.
[11] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[12] 许雅娟, 赵艳景, 胡虹. 邻苯三酚自氧化法测定超氧化物歧化酶活性的研究[J]. 西南民族大学学报(自然科学版), 2008(6): 1207-1209. DOI:10.3969/j.issn.1003-2843.2006.06.034.
[13] 程鲁京, 孟泽. 钼酸铵显色法测定血清过氧化氢酶[J]. 临床检验杂志, 1994, 12(1): 6-8.
[14] 刘艳. 机械伤害诱导豌豆幼苗防御性反应及其调控机制[D]. 北京:中国农业大学, 2005: 15-16. DOI:10.7666/d.y773580.
[15] LETELIER M E, LEPE A M, FA NDEZ M, et al. Possible mechanisms underlying copper-induced damage in biological membranes leading to cellular toxicity[J]. Chemico-Biological Iinteractions, 2005, 151(2): 71-82. DOI:10.1016/j.cbi.2004.12.004.
[16] 延玺, 刘会青, 邹永青, 等. 黄酮类化合物生理活性及合成研究进展[J]. 有机化学, 2008, 28(9): 1534-1544. DOI:10.3969/ j.issn.1673-1328.2011.20.030.
[17] FRIDOVICH I. Superoxide dismutases[J]. Annual Review of Bio chemistry, 1975, 44(1): 147-159. DOI:10.1146/annurev. bi.44.070175.001051.
[18] P REZ-TORRADO R, BRUNO-BRCENA J M, MATALLANA E. Monitoring stress-r elated genes during the process of biomass propagation of Saccharomyces cerevisiae strains used for wine making[J]. Applied and Environmental Microbiology, 2005, 71(11):6831-6837. DOI:10.1128/AEM.71.11.6831-6837.2005.
[19] 杜春迎, 赵辉, 赵志昌, 等. 发酵工业中酿酒酵母耐性机制的研究进展[J]. 食品工业科技, 2012, 33(13): 378-382.
[20] KNUDSEN J D, CARLQUIST M, GORWAGRAUSLUND M. NADH-dependent biosensor in Saccharomyces cerevisiae: principle and validation at the single cell level[J]. AMB Express, 2014, 4(1): 81. DOI:10.1186/s13568-014-0081-4.
[21] GRAUSLUND M, LOPES J M, RNNOW B. Expression of GUT1, which encodes glycerol kinase in Saccharomyces cerevisiae, is controlled by the positive regulators Adr1p, Ino2p and Ino4p and the negative regulator Opi1p in a carbon source-dependent fashion[J]. Nucleic Acids Research, 1999, 27(22): 4391-4398. DOI:10.1093/nar/27.22.4391.
[22] ZHOU H, WINSTON F. NRG1 is required for glucose repression of the SUC2 and GAL genes of Saccharomyces cerevisiae[J]. BMC Genetics, 2001, 2(1): 5. DOI:10.1186/1471-2156-2-5.
[23] GANCEDO J M, FLORES C L, GANCEDO C. The repressor Rgt1 and the cAMP-dependent protein kinases control the expression of the SUC2 gene in Saccharomyces cerevisiae[J]. Biochimica et Biophysica Acta-General Subjects, 2015, 1850(7): 1362-1367. DOI:10.1016/ j.bbagen.2015.03.006.
[24] ÖZCAN S, JOHNSTON M. Function and regulation of yeast hexose transporters[J]. Microbiology and Molecular Biology Reviews, 1999, 63(3): 554-569.
[25] ROSSI G, SAUER M, PORRO D, et al. Effect of HXT1 and HXT7 hexose transporter overexpression on wild-type and lactic acid producing Saccharomyces cerevisiae cells[J]. Microbial Cell Factories, 2010, 9(1): 1. DOI:10.1186/1475-2859-9-15.
Protective Effect and Mechanism of Quercetin against High Glucose-Induced Intracellular Damage in Saccharomyces cerevisiae
XU Xiaodan1, PAN Yu1, KE Zunli1, ZHOU Zhiqin1,2,*
(1. College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400716, China; 2. Laboratory of Quality & Safety Risk Assessment for Citrus Products (Chongqing), Ministry of Agriculture, Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400715, China)
In this study, the protective effect of quercetin on high glucose-induced damage was investigated in Saccharomyces cerevisiae. Compared with the control group, the activities of superoxide dismutase (SOD), catalase (CAT), and peroxidase (POD) were all significantly decreased under high glucose-induced stress (P < 0.05), but intracellular ROS was no obviously changed. After being treated with quercetin, the ROS levels and SOD and CAT activities were dramatically inhibited (P < 0.05), but the POD activity was significantly enhanced in comparison to the control and high glucose groups (P < 0.01). The results showed that POD activity was more sensitive than other indicators in reflecting the resistance to high glucose-induced stress, and quercetin could effectively enhance the antioxidant capacity by regulating POD activity in S. cerevisiae S288c. In addition, high glucose-induced stress resulted in an significant decrease in the expression levels of glycerol-3-phosphate dehydrogenase2 (GPD2) and sucrose transport protein-encoding genes (SUC2) (P < 0.05), but a significant increase in the expression level of hexose transport-1-encoding gene (HXT1) (P < 0.01), compared with the control. After being treated with quercetin, the expression profiles of GPD2, SUC2, and HXT1 were significantly increased in S. cerevisiae S288c (P < 0.05). However, the expression level of glycerol kinase gene (GUT1) was not changed significantly. These results suggested that quercetin could reduce highglucose-induced damage by regulating the high osmolarity glycerol (HOG) signaling pathway, inulin catabolism pathway and hexose transport pathway to accelerate glucose decomposition. Therefore, we conclude that quercetin plays an important role in protecting S. cerevisiae from damage caused by high glucose-induced stress, and the underlying mechanism may be associated with its antioxidant effect and being involved in the HOG signaling pathway and the glucose decomposition and transport pathways in S. cerevisiae.
Saccharomyces cerevisiae; high glucose-induced stress; quercetin; enzyme activitity; expression levels
10.7506/spkx1002-6630-201712010
TS201.4
A
1002-6630(2017)12-0063-06
2016-09-13
重庆市基础与前沿研究计划项目(cstc2014jcyjA80026);2016食用农产品特征性营养组成识别与验证评估专项项目(GJFP201601501;GJFP201601503);重庆市现代特色效益农业技术体系创新项目(20164-4)
徐晓丹(1990—),女,硕士研究生,研究方向为果品营养与质量安全。E-mail:xuxiaodanxdd@163.com
*通信作者:周志钦(1964—),男,教授,博士,研究方向为果品营养与质量安全。E-mail:zzqswu@yahoo.com
徐晓丹, 潘宇, 柯尊丽, 等. 高糖胁迫下槲皮素对酿酒酵母胞内损伤的保护作用与机制[J]. 食品科学, 2017, 38(12):63-68.
10.7506/spkx1002-6630-201712010. http://www.spkx.net.cn
XU Xiaodan, PAN Yu, KE Zunli, et al. Protective effect and mechanism of quercetin against high glucose-induced intracellular damage in Saccharomyces cerevisiae[J]. Food Science, 2017, 38(12): 63-68. (in Chinese wit h English abstract) DOI:10.7506/ spkx1002-6630-201712010. http://www.spkx.net.cn
