马铃薯糖苷生物碱的水解及其工业应用
2017-06-22靳承煜曾凡逵赵宇慈
靳承煜,曾凡逵,许 丹,赵宇慈,刘 刚,*
(1.中国科学院兰州化学物理研究所,甘肃兰州 730000;2.中国科学院大学,北京 100049)
马铃薯糖苷生物碱的水解及其工业应用
靳承煜1,2,曾凡逵1,许 丹1,2,赵宇慈1,2,刘 刚1,*
(1.中国科学院兰州化学物理研究所,甘肃兰州 730000;2.中国科学院大学,北京 100049)
马铃薯糖苷生物碱是马铃薯中重要的植物次级代谢产物,在马铃薯的自身防御过程中起到了重要的作用,但同时也给马铃薯产品的品质带来很大的负面影响。本文主要从马铃薯块茎中两种主要的糖苷生物碱α-卡茄碱和α-茄碱的毒性、对马铃薯产品的影响,去除糖苷生物碱的方法以及马铃薯糖苷生物碱水解的研究进展及意义等方面进行综述。本文着重阐述了马铃薯糖苷生物碱在高/低酸浓度下的水解机理、影响水解的因素以及糖苷生物碱对马铃薯浓缩蛋白所带来的影响。期望通过对马铃薯糖苷生物碱水解的综述引起人们对其应用更为广泛的关注,并对马铃薯废弃物的再利用起到指导作用。
马铃薯,糖苷生物碱,水解,α-卡茄碱,α-茄碱,马铃薯浓缩蛋白
马铃薯,茄科植物,作为一种主要的廉价的低脂食物来源,可为机体提供能量(淀粉)、高品质蛋白、膳食纤维和维生素等。然而,马铃薯也会产生一些具有生物活性的次级代谢物,这些代谢物在人类膳食与健康方面会产生一些有利和不利的影响[1]。其中非常重要的一类就是糖苷生物碱。
1820年,Defosses发现了第一种糖苷生物碱,将它命名为茄碱[2]。之后,人们就一直用茄碱,即人们常说的“龙葵素”来表示马铃薯中的这种有毒物质。直到一百多年后,才有文章报道,“茄碱”是两种化合物的混合物,即α-茄碱和α-卡茄碱[3]。马铃薯块茎中最主要的两种糖苷生物碱是α-茄碱和α-卡茄碱,两者含量占到块茎中糖苷生物碱总含量的95%以上[4]。这两种糖苷生物碱都具有较强的毒性,这与马铃薯自身的防御机制有着密切的关系[5]。曾凡逵等[6]报道一种HPLC法检测马铃薯糖苷生物碱的方法,只需要通过一针进样就能同时检测α-茄碱和α-卡茄碱的含量。
马铃薯糖苷生物碱有较强的毒性,且在马铃薯浓缩蛋白加工生产过程中,往往会将糖苷生物碱富集,导致马铃薯浓缩蛋白产品质量和应用价值的降低。马铃薯浓缩蛋白具有非常高的营养价值,可作为饲料添加剂或者食品添加剂应用于饲料或食品加工领域,然而由于糖苷生物碱在浓缩蛋白中的富集现象,使得浓缩蛋白的应用受到很大限制。
马铃薯糖苷生物碱的水解产物具有较低的毒性,通过水解的方式可以大大降低糖苷生物碱给马铃薯产品带来的影响。同时,马铃薯糖苷生物碱的水解产物在制药领域具有很广阔的发展前景。因此,研究马铃薯糖苷生物碱的水解是十分有必要的。
1 马铃薯糖苷生物碱的毒性
马铃薯糖苷生物碱是甾族生物碱的一种,由糖苷配基——茄啶和一个三糖的寡糖链组成,具有较强的毒性。较高剂量的马铃薯糖苷生物碱的毒性主要表现在影响中枢神经系统的抗胆碱酯酶活性[7-8],引发肝损伤[9],通过破坏细胞膜来影响消化系统及基本的人体代谢[10],造成系统性毒性,例如会出现发烧、低血压、呼吸过快、神经失调等症状[11];在较低剂量时,糖苷生物碱在人体中的毒性主要造成胃肠的紊乱,例如,呕吐、腹泻、腹痛等。正是由于对糖苷生物碱的毒性的关注,人们不得不对马铃薯新品中的糖苷生物碱建立一种非正式指导性限制,即总糖苷生物碱含量不得超过200 mg/kg(鲜重)[12]。
马铃薯糖苷生物碱广泛存在于许多马铃薯产品中,当含量过高时将严重影响马铃薯产品的质量。因此,如何去除马铃薯产品中过高的糖苷生物碱成为人们广为关注的问题之一。目前,针对这一问题,解决的主要途径有两种:分离和水解。
2 马铃薯糖苷生物碱的分离
分离主要是在不改变糖苷生物碱化学性质的情况下,通过物理方式实现糖苷生物碱和马铃薯其他成分的分离。目前,已经取得了一些这方面的研究进展。Backleh等[13]采用了一种pH梯度吸附泡状分离的方法来去除马铃薯粉碎浆液中的糖苷生物碱,实验结果显示几乎完全除去了浆液中的糖苷生物碱。Zeng等[14]采用扩张床吸附技术从马铃薯淀粉加工分离汁水中回收活性蛋白,发现回收的马铃薯蛋白当中糖苷生物碱含量很低。在工业上,为了避免糖苷生物碱对马铃薯产品的影响,也常常采用酸溶清洗的方法来去除糖苷生物碱,但是这种方法却会产生大量的工业用水。总体来说,分离的方法可实现糖苷生物碱与马铃薯产品的分离,但这很大程度上依靠分离材料的特性,操作过程较为复杂,不确定因素较多。特别是当加工使用的马铃薯品种不同时,所适用的分离条件也不确定。
3 马铃薯糖苷生物碱的水解
马铃薯糖苷生物碱的水解主要是通过一定手段直接或者逐步将糖苷生物碱的糖苷链切除,得到β型、γ型产物以及茄啶的过程。目前,水解的主要途径有两种:一种是通过微生物或者酶水解;另外一种则是通过无机酸水解。
3.1 微生物或酶的水解
在马铃薯的芽、花和块茎中存在一些可以断裂糖苷链的酶,这些酶参与植物自身降解糖苷生物碱的代谢过程以防止植物自身的中毒。采用酶或者微生物来水解糖苷生物碱的方法由来已久。1953年,Petroshenko等[15]的研究表明,马铃薯芽中的一种酶具有裂解糖苷生物碱中糖组分的能力,但是由于当时茄碱是人们知道的糖苷生物碱,所以,人们将这种与糖苷生物碱水解相关的酶称之为茄碱水解酶(solaninase)。Swain等[16]从休眠的马铃薯块茎中获得酶制剂并第一次阐述了卡茄碱不完全水解以及茄碱直接水解成为茄啶的过程。1965年,Huston和Manners[17]研究了马铃薯块茎提取物中的胞外酶糖苷酶的酶活力,1978年,Derek[18]将这种酶的特性表征为等电点为4.7,最适pH为6.5。在30 ℃,pH=6.8的条件下Km值为0.21 mmol/L。2002年,Oda等[19]报道了一种采用filamentous真菌水解卡茄碱来降低马铃薯糖苷生物碱毒性的方法。采用酶水解糖苷生物碱的方法更加简单和环保。但是,这种方法却比普通的无机酸溶液水解的方法要花费更长的时间。
3.2 无机酸的水解
采用无机酸对糖苷生物碱水解,一般要在强酸和高温的条件下进行。1984年,Gelder等[20]采用了一种两相体系对甾族糖苷生物碱进行水解,在强酸体系中水解糖苷生物碱的同时保护了生成的茄啶。1993年,Friedman等[21]采用无机酸水解的方法探究了马铃薯糖苷生物碱水解的动力学机理。无机酸水解是一种高效的水解方式,有研究表明,10%的盐酸在75 ℃下水解2 h就可以达到一个很好的水解效果[22];采用酶水解的方式则需要72~96 h,而且往往得到的也只是部分水解产物[19,23]。无机酸水解马铃薯糖苷生物碱具有高效、简便的特点,其反应条件要求不会像酶水解那样苛刻,成本也比较低,更加适合工业化生产。
3.3 溶剂对水解的影响
1995年,Friedman等[24]对马铃薯中的α-卡茄碱在醇体系中的水解做了研究,结果表明糖苷生物碱在直链醇体系中随着链长的增长其水解速率降低:甲醇>乙醇=1-丁醇>丙醇>戊醇>水。此外,这项研究还通过在醇体系中加入水来探究混合体系中α-卡茄碱的水解。研究表明加水对糖苷生物碱的水解几乎没有作用甚至有负作用。
3.4 糖苷生物碱的水解机理
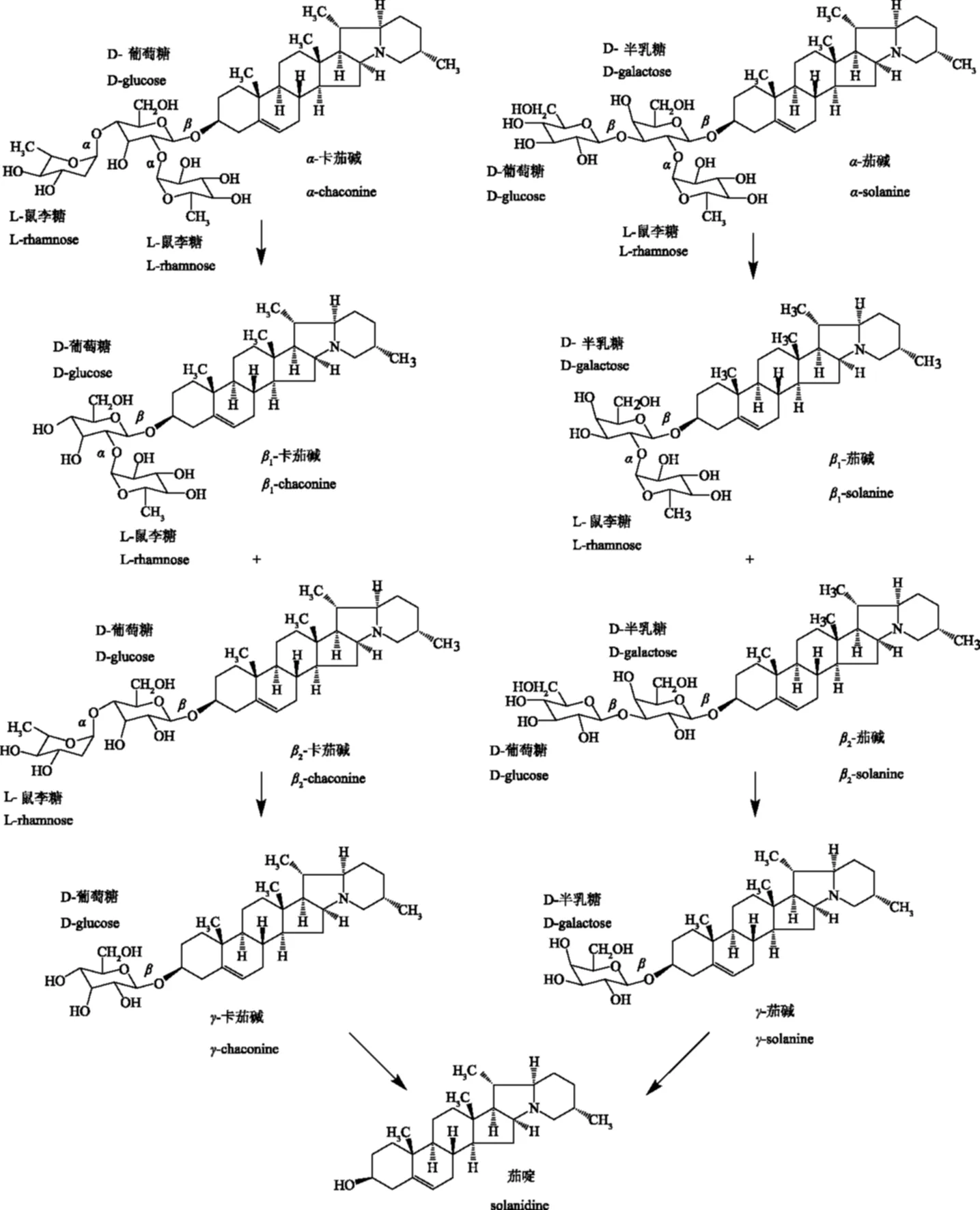
图1 α-卡茄碱和α-茄碱的分步水解过程[6]Fig.1 Stepwise hydrolysis of α-chaconine and α-solanine[6]
通过酶或者微生物参与进行的糖苷生物碱水解,由于涉及到一系列的生化反应等,反应过程较为复杂,但多以一种不完全水解的方式进行[16,19]。一般的无机酸水解都有赖于一定的水解条件,例如温度、无机酸浓度、溶剂和水解时间等。在较为温和的水解条件下,糖苷生物碱的水解仍然会采取一种不完全水解的方式。Friedman等[21]在1993年系统的阐述了茄碱和卡茄碱在不同盐酸浓度下进行分步水解的动力学过程和不同亚型糖苷生物碱的水解敏感性。两种马铃薯糖苷生物碱(α-卡茄碱和α-茄碱)每一种都可以单独形成两种双糖配糖体和一种单糖配糖体,即β1-,β2-和γ-卡茄碱与β1-,β2-和γ-茄碱。两种三糖配糖体混合物的不完全水解体系中应该包含9种化合物,其水解过程及各级产物如图1所示。
当无机酸浓度较高时,糖苷生物碱常常存在另外的一种水解方式。根据BeMiller(1967)和Capon(1969)的报道[25-27],一种可接受的酸催化水解机制是3β-O-糖苷键上的氧原子被快速质子化后产生碳正离子,碳正离子具有非常高的反应活性,进而反应产生了一个三糖和茄啶。这种情况一般是在强酸和高温的情况下发生的。在这种情况下水解反应产生的茄啶又会很快被转化为solanthrene,失去了茄啶原有的价值[22]。因此,多相水解马铃薯糖苷生物碱的方法被引用到水解提取茄啶的过程中,在强酸水解糖苷生物碱的同时,生成的茄啶迅速转移到有机相中而被保护[20]。

图2 在高酸浓度下的糖苷生物碱的水解过程及副反应Fig.2 The hydrolysis of glycoalkaloid and side reaction in high acid concentration
糖苷生物碱的寡糖链在其生理学和毒理学活性方面起到主要作用,通过水解的方法来去除糖苷生物碱的寡糖链可以降低其在马铃薯产品中的毒性。但是,如果要在较短时间内把糖苷生物碱较大幅度的去除掉,通常需要较高的酸浓度或者较高的反应温度,这会造成非常大的能耗和污染。同时,高温强酸的环境也容易在水解的过程中产生一些有害的副产物,例如,在水解植物蛋白的过程中高温酸水解极易产生氯丙醇等致癌物质[28]。然而,在酸浓度和温度较低时,相同的时间内水解效果较差,这一矛盾也是阻碍糖苷生物碱水解广泛应用的主要原因。Grokoré等采用无机酸水解与酶水解结合的方法来水解去除糖苷链取得了很好的效果,有效减少了有害物质的产生同时又提高了水解的效率[29]。
3.5 马铃薯糖苷生物碱水解的意义
马铃薯糖苷生物碱的水解在食品、农业、医药等领域具有非常重要的意义。在许多马铃薯产品中由于糖苷生物碱的含量过高,而严重影响了产品的品质。通过水解的方式可以有效降低糖苷生物碱的毒性,从而降低其对马铃薯产品质量的影响。
2013年,世界马铃薯产量达到3.68亿吨,根据苏黎世联邦理工学院Christian Willersinn博士的一项研究,收获的马铃薯有1/3由于腐烂或变绿可能对消费者健康造成危害而被淘汰,再加之在贮藏运输等过程中的损失,马铃薯浪费数量惊人。而马铃薯糖苷生物碱含量过高是十分重要的原因之一[30]。同时,在马铃薯淀粉生产过程中,通常要进行去皮处理以去除大部分的糖苷生物碱,去除的皮层往往被废弃而造成很大的资源浪费。资源化利用这些被废弃的马铃薯和薯皮可以有效地减少浪费,水解马铃薯糖苷生物碱,可创造巨大的经济价值。
马铃薯糖苷生物碱的水解产物茄啶是激素合成的一种重要前驱体,具有较高的制药价值[6,31]。通过水解提取的方法来得到茄啶是一种非常重要的方法,糖苷生物碱的水解也主要应用在这一方面。研究糖苷生物碱的水解对于食品安全和资源化利用马铃薯产业中的废弃资源具有重要意义。
4 马铃薯糖苷生物碱水解应用前景——马铃薯浓缩蛋白中的糖苷生物碱的去除
4.1 马铃薯浓缩蛋白(Potato protein concentrates,PPC)
PPC一般是指马铃薯淀粉生产过程中产生的一种副产物。在马铃薯淀粉生产废水中含有大量的马铃薯蛋白,通过热絮凝等方法将蛋白沉淀分离出来所得的蛋白浓缩产品即为马铃薯浓缩蛋白。然而,由于糖苷生物碱的存在使马铃薯浓缩蛋白的品质大大降低。
4.2 PPC的营养价值及回收
在马铃薯鲜基中蛋白含量只有2%左右,但是,在干基中的含量就可以达到10%左右,基本与水稻、小麦这些谷物中的蛋白含量持平,且马铃薯蛋白富含赖氨酸、苏氨酸,具有较高的品质,可以有效弥补谷物蛋白的缺陷[32-33]。马铃薯淀粉生产中产生的废水含有大量的可提取利用的马铃薯蛋白,一般在工业化生产中最常用的提取方法是酸热絮凝法[34],这种方法可以沉淀废水中的蛋白降低废水污染,同时,可将分离得到的浓缩蛋白作为动物饲料等加以利用。
中科院兰州化学物理研究所刘刚研究员带领的研究团队,经连续7年技术攻关,成功完成了“马铃薯淀粉工艺水提取蛋白高值化利用与废水达标排放技术装备”开发,该装备分别在宁夏固原和甘肃定西两个国家级贫困地区以及河北张家口察北管理局等成功推广应用,日处理脱蛋白水能力960 m3左右,废水排放达到COD 100 mg/L以下的国家标准。
4.3 PPC中糖苷生物碱的危害
在分离所得的浓缩蛋白中,由于絮凝过程中许多糖苷生物碱与蛋白共同絮凝沉淀出来,造成浓缩蛋白中糖苷生物碱的含量很高。Friedman等研究了一种商品马铃薯浓缩蛋白中的糖苷生物碱,结果显示糖苷生物碱含量高达200 mg/100 g[1],严重超出了食品安全限200 mg/kg[12]。然而,喂食实验表明马铃薯蛋白具有出色的营养价值[35-36]。Kerr等[37]进行了喂食猪马铃薯浓缩蛋白的实验,结果表明含有较低糖苷生物碱的浓缩蛋白(15.6 mg/100 g)的喂食效果等同于鱼肉蛋白。在对鲑鱼喂食含有较多糖苷生物碱的浓缩蛋白时,造成鲑鱼严重的体重下降;但是,含较低糖苷生物碱的浓缩蛋白却具有较高的营养价值,并且没有明显的负作用[38]。对人类的喂食实验也表明,马铃薯蛋白有着超乎其氨基酸组成所显示的营养价值[39]。因此,过高糖苷生物碱的存在严重影响了马铃薯蛋白的品质。研究如何有效降低糖苷生物碱在浓缩蛋白中的毒性是实现马铃薯浓缩蛋白高值化利用必须要解决的问题。水解马铃薯浓缩蛋白中的糖苷生物碱正是一种十分有效的降低糖苷生物碱毒性的方法。
5 结论与展望
马铃薯糖苷生物碱作为马铃薯自身防御机制的重要组成部分发挥了巨大的作用,但同时也给人们的饮食安全带来很多隐患,如何有效地去除糖苷生物碱成为人们十分关注的问题。水解马铃薯糖苷生物碱是降低马铃薯糖苷生物碱毒性的有效方法。目前,通过微生物和酶进行水解的方法花费时间较长,且效率较低。而通过无机酸进行水解的方法需要较高的酸浓度和较高的温度,这将需要很大的能耗并造成污染。因此,如何提高无机酸水解的效率或者筛选一种能够快速水解糖苷生物碱的酶将会变得十分重要。同时,糖苷生物碱在生物医药领域拥有十分巨大的潜力,水解提取马铃薯废弃物中的有效成分将创造出十分可观的经济价值。因此,水解马铃薯糖苷生物碱(主要是α-卡茄碱和α-茄碱)具有十分重要的现实意义,值得人们更多地去关注与探究。
[1]Friedman Mendel. Potato Glycoalkaloids and Metabolites:Roles in the Plant and in the Diet[J]. J Agric Food Chem,2006,54(23):8655-8681.
[2]Defosses M. Extrait d’une letter[J]. J Pharm,1820,6:374-376.
[3]Kuhn R,Löw I. The constitution of solanines[J]. Chem Ber,1955,88:1492-1507.
[4]Langkilde S,Mandimika T,Schroder M,et al. A 28-day repeat dose toxicity study of steroidal glycoalkaloids,alpha-solanine and alpha-chaconine in the Syrian Golden hamster[J]. Food Chem Toxicol,2009,47(6):1099-1108.
[5]赵雪淞,李盛钰,何大俊,等. 马铃薯糖苷生物碱抗真菌活性构效关系研究[J]. 食品工业科技,2013,34(6):159-163.
[6]曾凡逵,周添红,康宪学,等. HPLC法测定马铃薯块茎中糖苷生物碱的含量[J]. 中国马铃薯,2015,29(5):263-268.
[7]Abbott D G,Field K,Johnson E I. Observation on the correlation of anticholinesterase effect with solanine content of potatoes[J]. Analyst,1960,85:375-377.
[8]Heftmann E. Biochemistry of steroidal saponins and glycoalkaloids[J]. Lloydia,1967,30:209-230.
[9]Caldwell K A,Grosjean O K,Henika P R,et al. Hepatic ornithine decarboxylase induction by potato glycoalkaloids in rats[J]. Food and Chemical Toxicology,1991,29:531-535.
[10]Keukens E A,De V T,Van d B C,et al. Molecular basis of glycoalkaloid induced membrane disruption[J]. Biochimica Et Biophysica Acta,1995,1240(2):216-218.
[11]Friedman M,Levin C E. Chapter 7-Glycoalkaloids and Calystegine Alkaloids in Potatoes[M]//Advances in Potato Chemistry and Technology(Second Edition). San Diego:Academic Press,2016:167-194.
[12]Wilson G S. A small outbreak of solanine poisoning[J]. Monthly Bulletin of the Ministry of Health & the Public Health Laboratory Service,1959,18:207-210.
[13]Backleh M,Ekici P G,Coelhan M,et al. Enrichment of the glycoalkaloids alpha-solanine and alpha-chaconine from potato juice by adsorptive bubble separation using a pH gradient[J]. Journal of Separation Science,2004,27(12):1042-1044.
[14]Zeng F K,Liu H,Ma P J,et al. Recovery of native protein from potato root water by expanded bed adsorption with amberlite XAD7HP[J]. Biotechnology and Bioprocess Engineering,2013,18(5):981-988.
[15]Petroshenko E I. Solaninase in potato sprouts[J]. Doklade Akademi nauki SSSR,1953,90:1091-1094.
[16]Ansel P Swain,Thomas J Fitzpatrick,Eugene A Talley. Enzymatic hydrolysis ofα-chaconine andα-solanine[J]. Phytochemistry,1978,17(4):800-801.
[17]Huston D H,D J Manners. Enzymatic activity of exoenzymes[J]. Biochemical Journal,1965,94:783-785.
[18]Killilea,S D,M J Clancy. Properties of potato c~-glucosidase[J]. Phyto Chemistry,1978,17:1429-1431.
[19]Oda Y,Saito K,Ohara-Takada A,et al. Hydrolysis of the potato glycoalkaloidα-chaconine by filamentous fungi[J]. Journal of Bioscience & Bioengineering,2002,94(4):321-325.
[20]Gelder W M J V. A new hydrolysis technique for steroid glycoalkaloids with unstable aglycones from Solanum spp.[J]. Journal of the Science of Food and Agriculture,1984,35(5):487-494.
[21]Friedman Mendel,McDonald G,Haddon W F. Kinetics of acid-catalyzed hydrolysis of carbohydrate groups of potato glycoalkaloids.alpha.-chaconine and.alpha.-solanine[J]. J Agric Food Chem,1993,41(9):1397-1406.
[22]Attoumbré J,Giordanengo P,Baltorarosset S. Solanidine isolation from Solanum tuberosum by centrifugal partition chromatography[J]. Journal of Separation Science,2013,36(14):2379-2385.
[23]Nikolic N C,Stankovic M Z. Hydrolysis of glycoalkaloids from Solanum tuberosum L. haulm by enzymes present in plant material and by enzyme preparation[J]. Potato Research,2005,48(1):25.
[24]Friedman Mendel,McDonald G M. Acid-Catalyzed Partial Hydrolysis of Carbohydrate Groups of the Potato Glycoalkaloid.alpha.-Chaconine in Alcoholic Solutions[J]. J Agric Food Chem,1995,43(6):1501-1506.
[25]BeMiller J N. Acid-catalysed hydrolysis of glycosides[J]. AdV Carbohydr Chem,1967,22:25-108.
[26]Capon B. Mechanism in carbohydrate chemistry[J]. Chem ReV,1969,69:407-498.
[27]Nikolic N C,Stankovic M Z. Solanidine hydrolytic extraction and separation from the potato(SolanumtuberosumL.)vines by using solid-liquid-liquid systems[J]. Journal of Agricultural & Food Chemistry,2003,51(7):1845-1849.
[28]江新业. 酸水解植物蛋白调味液中氯丙醇的危害与控制[J]. 中国食品添加剂,2013(S1):164-171.
[29]Koffi G Y,Remaud-Simeon M,Due A E,et al. Isolation and chemoenzymatic treatment of glycoalkaloids from green,sprouting and rotting Solanum tuberosum potatoes for solanidine recovery[J]. Food Chemistry,2017,220:257-265.
[30]Willersinn C,Mack G,Mouron P,et al. Quantity and quality of food losses along the Swiss potato supply chain:Stepwise investigation and the influence of quality standards on losses[J]. Waste Management,2015,46,120-132.
[31]李会珍,张志军. 马铃薯糖苷生物碱及其影响因素研究进展[J]. 食品研究与开发,2012,33(11):227-230.
[32]Shewry P R. Tuber Storage Proteins[J]. Annals of Botany,2003,91(7):755-769.
[33]Friedman M. Nutritional Value of Proteins from Different Food Sources:A Review[J]. Journal of Agricultural and Food Chemistry,1996,44(1):6-29.
[34]Knorr D,Kohler G O,Betschart A A. Potato protein concentrates:the influence of various methods of recovery upon yield,compositional and functional characteristics[J]. Journal of Food Processing and Preservation,1977,1:235-247.
[35]Nestares T,Lopez-Jurado M,Sanz A,et al. Nutritional assessment of two vegetable protein concentrates in growing rats[J]. J Agric Food Chem,1993,41(8):1282-1286.
[36]Markakis P. The nutritive quality of potato protein[M]//In Protein Nutritional Quality of Foods and Feeds. New York,1975:471-487.
[37]Kerr C A,Goodband R D,Musser R E,et al. Evaluation of potato proteins on the growth performance of early-weaned pigs[J]. Journal of Animal Science,1998,76(12):3024-3033.
[38]Ståle Refstie,Harold A.J Tiekstra. Potato protein concentrate with low content of solanidine glycoalkaloids in diets for Atlantic salmon(Salmo salar)[J]. Aquaculture,2003,216(1):283-298.
[39]Kies C,Fox H M. Effect of amino acid supplementation of dehydrated potato flakes on protein nutritive value for human adults[J]. Journal of Food Science,2006,37(3):378-380.
The hydrolysis of potato glycoalkaloids and its application of industry
JIN Cheng-yu1,2,ZENG Fan-kui1,XU Dan1,2,ZHAO Yu-ci1,2,LIU Gang1,*
(1.Lanzhou Institute of Chemical Physics,Chinese Academy of Sciences,Lanzhou 730000,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China)
Potato glycoalkaloids are impotant secondary plant metabolites in potato which possess an important role in the process of its self-defence and bring many negative impacts on the quality of potato products as well. In this review,the toxicity of two dominant glycoalkaloidsα-chaconine andα-solanine in potato tuber,the influence of glycoalkaloids on potato products,the methods to remove the glycoalkaloids and the research development and significance of potato glycoalkaloid hydrolysis were discussed. The mechanism of potato glycoalkaloids hydrolysis in high and low acid concentration,the factors influencing the hydrolysis and the influence of glycoalkaloids on potato protein concentrate were described in detail. The aim was to draw more attention on the application of hydrolysis by reviewing the potato glycoalkaloid hydrolysis and had guidance on the recycling of potato waste.
potato;glycoalkaloids;hydrolysis;α-chaconine;α-solanine;potato protein concentrate
2016-11-08
靳承煜(1991-),男,硕士研究生,研究方向:马铃薯糖苷生物碱,E-mail:jinchengyu@licp.cas.cn。
*通讯作者:刘刚(1962-),男,博士,研究员,研究方向:马铃薯加工及废水处理,E-mail:gangliu@licp.cas.cn。
国家马铃薯产业技术体系专项(nycytx-15)。
TS255.1
A
1002-0306(2017)10-0368-06
10.13386/j.issn1002-0306.2017.10.063
