枸杞芽茶与叶茶的化学成分和抗氧化活性分析
2017-06-22周志阳曹有龙王艺涵陈帝君李晓莺闫亚美曾晓雄
周志阳,曹有龙,王艺涵,陈帝君,米 佳,李晓莺,闫亚美,,*,曾晓雄,,*
(1.南京农业大学食品科技学院,江苏南京 210095; 2.国家枸杞工程技术研究中心,宁夏银川 750002)
枸杞芽茶与叶茶的化学成分和抗氧化活性分析
周志阳1,曹有龙2,王艺涵1,陈帝君1,米 佳2,李晓莺2,闫亚美1,2,*,曾晓雄1,2,*
(1.南京农业大学食品科技学院,江苏南京 210095; 2.国家枸杞工程技术研究中心,宁夏银川 750002)
以宁夏枸杞芽茶、枸杞叶茶为原料,利用热水浸提(料液比1∶40、温度96 ℃、时间30 min)制备枸杞芽茶与叶茶提取物并对其所含的化学成分含量进行测定,采用HPLC对枸杞芽茶与叶茶提取物中游离氨基酸的组成进行了分析,利用DPPH自由基、ABTS自由基、超氧阴离子自由基清除率、总还原力为指标对枸杞芽茶、叶茶茶汤提取物的抗氧化活性进行分析评价。结果表明,枸杞芽茶、枸杞叶茶提取物中多酚含量分别为6.32%、2.96%。枸杞芽茶与叶茶提取物中天冬氨酸(3230.41、2440.96 μg/g)、天冬酰胺(3754.77、3495.57 μg/g)、组氨酸(5585.26、2825.17 μg/g)以及亮氨酸(4376.09、1051.00 μg/g)含量较为丰富。枸杞芽茶与叶茶提取物相比抗氧化活性较强,二者对DPPH自由基(IC50:147.63、241.23 μg/mL)、ABTS自由基(IC50:109.87、145.32 μg/mL)以及超氧阴离子自由基(IC50:46.58、54.32 μg/mL)均具有良好的清除能力,与叶茶相比,枸杞芽茶具有更好的抗氧化活性。
枸杞芽茶,枸杞叶茶,化学成分,游离氨基酸,抗氧化活性
宁夏枸杞(LyciumbarbarumL.)属茄科落叶灌木,是我国重要的药用植物资源,同时也是宁夏最具特色的药食同源性农产品[1]。枸杞的芽叶部分与枸杞子同样具有重要的药用价值,据《本彩纲目》记载“春采枸杞叶,名天精草”,这里“天精草”所指的就是枸杞新鲜芽叶[2]。制作枸杞芽茶、叶茶所选用的枸杞树品种为无果枸杞树,花蕾少,结果率低,色泽碧绿且无病虫害[3]。大量研究报道,多酚类物质是茶叶中最具代表性的活性成分,传统绿茶由于茶多酚类物质的存在发挥了广泛的生物活性,如抗氧化[4]、降血糖[4]、降血脂[4]、抗肿瘤及诱变剂[5]、保护心血管[6]、抗炎症[7]、调节细胞凋亡[8]、抗辐射[9]等,但目前关于枸杞芽茶、叶茶这一新型茶品,对其所含的多酚等具有重要生物活性的化学成分的相关研究不多。邱虹等[10]在对无果枸杞芽茶醇提取物的抗氧化作用研究中发现无果枸杞芽茶醇提取物可改善小鼠的学习与记忆能力,且作用机制可能与枸杞芽茶醇提取物的抗氧化活性有关;分析无果枸杞芽茶对高血脂患者血脂水平及抗氧化能力的影响,结果显示患者人群在饮用枸杞芽茶4个月后,血清总胆固醇(TC)水平、甘油三酯(TG)水平、MDA水平、低密度脂蛋白(LDL-C)水平下降,SOD活力增高(p<0.05),高密度脂蛋白(HDL-C)水平无明显变化(p>0.05),表明宁夏无果枸杞具有调节血脂、增强机体抗氧化能力的作用。魏智清等[11]在探讨宁夏枸杞芽茶、叶茶水煎剂对糖尿病小鼠的降血糖作用研究中发现一定剂量的宁夏枸杞芽茶、叶茶水煎剂对四氧嘧啶糖尿病小鼠有较明显的降血糖作用。
本研究以宁夏枸杞芽茶、叶茶为原料制备芽茶与叶茶提取物,对包括多酚、儿茶素、黄酮、多糖、蛋白质及氨基酸在内的化学成分含量进行测定,利用高效液相色谱(HPLC)法分析游离氨基酸组成与含量,并通过DPPH自由基、ABTS自由基、超氧阴离子自由基清除率及总还原力等指标对枸杞芽茶、叶茶提取物的抗氧化活性进行评价,以期为枸杞叶茶、芽茶的进一步开发利用提供基础理论数据。
1 材料与方法
1.1 材料与仪器
枸杞芽茶、叶茶 购于银川泰丰生物技术有限公司,新鲜枸杞芽、叶经杀青、揉捻、干燥等工序后密封包装保存于-20 ℃备用;碧螺春绿茶 杭州西湖名茶有限公司;没食子酸、谷氨酸 国药集团化学试剂有限公司;芦丁 上海瑞永生物技术有限公司;牛血清白蛋白 北京索莱宝科技有限公司;葡萄糖、VC(Vitamin C)、DPPH(2,2′-diphenyl-1-picrylhydrazyl)、ABTS[2,2′-azino-bis-(3-ethylbenothiazolin-6-sμLfonate)diammonium salt]、NBT(nitroblue tetrazolium)、PMS(Phenazine methosulfate)、TPTZ[2,4,6-tris(2-pyridyl)-s-trizaine] 美国Sigma公司;邻苯二甲醛(OPA) 上海麦克林生化科技有限公司;其余试剂 均为国产分析纯。
HH-4数显恒温水浴锅 江苏国华电器有限公司;EYELA N-1100真空旋转蒸发仪 日本东京理化公司;Telstar LyoQuest 2G6冷冻干燥机 西班牙Telstar公司;BL-220H分析天平 日本岛津公司;MAPADAV-1200可见分光光度计 上海美谱达仪器有限公司;Agilent 1100高效液相色谱仪(G1311A四元泵、G1379A真空脱气机、G1316A柱温箱、G1315BDAD工作站)、Agilent Zorbax Eclipse XDB-C18色谱柱(4.6 mm×15 cm,5 μm) 美国安捷伦公司;Synergy-2酶标仪 美国Biotek公司。
1.2 实验方法
1.2.1 枸杞芽茶、叶茶提取物的制备 取适量枸杞芽茶、叶茶以去离子水(96 ℃预热、料液比 1∶40)于96 ℃水浴锅中充分浸提30 min,浸提液经纱布过滤、4000 r/min离心20 min后得澄清茶汤,茶渣重复以上操作二次后合并上清液,上清液经浓缩、冷冻干燥后制得枸杞芽茶、叶茶提取物,提取物置于-20 ℃冰箱中保存备用。
1.2.2 多酚、儿茶素、黄酮、可溶性总糖、蛋白质、氨基酸含量测定 多酚含量的测定参照刘丽香[12]等的方法;儿茶素含量的测定参照刘坤等[13]的方法;黄酮含量的测定参照韦秀芝等[14]的方法;可溶性总糖含量的测定参照王黎明[15]、傅博强等[16]的方法蛋白质含量的测定参照邓莉丽等[17]的方法;游离氨基酸含量的测定参照刘美[18]、邵金良等[19]的方法。所有实验重复三次。
1.2.3 枸杞芽茶与叶茶提取物中游离氨基酸的HPLC分析 参照Wang等[20]的方法并做适当修改。准确称取0.25 g枸杞芽茶或叶茶,加入10 mL去离子水于95 ℃浸提20 min,过滤、离心,上清液定容10.0 mL,以0.45 μm水相微孔滤膜过滤。取1.0 mL过膜后的茶汤于活化后的SPE固相萃取柱上,收集洗脱液,随后以10 mL 10%乙醇洗脱萃取柱,合并两次洗脱液、浓缩,用1.0 mL去离子水复溶,过0.22 μm有机相滤膜。准确称取50.0 mg OPA试剂于10 mL离心管中,依次加入0.5 mL甲醇、4.5 mL硼酸(0.4 mol/L,pH9.5)、0.25 mLβ-巯基乙醇,即为OPA衍生化试剂。准确移取复溶后的枸杞芽茶、叶茶茶汤洗脱液或标准氨基酸溶液(每种氨基酸含5个浓度)140 μL与20 μL OPA衍生化试剂于离心管中,混匀于25 ℃反应2 min,立即取样进行HPLC分析,绘制各氨基酸标准曲线,计算枸杞芽茶、叶茶氨基酸含量。
高效液相色谱条件:Agilent Zorbax Eclipse XDB-C18色谱柱;流动相A:乙腈∶甲醇∶水=45∶45∶10,流动相B:40 mmol/L磷酸盐缓冲液(pH7.5),采用梯度洗脱方法;流速:1.0 mL/min;检测波长:338 nm。洗脱程序为:0 min,10% A;10 min,18% A;15 min,24% A;21~21.5 min,41% A;22 min,42.2% A;23 min,42.5% A;25 min,58% A;27 min,59% A;30~35 min,60% A。
1.2.4 枸杞芽茶与叶茶抗氧化活性测定
1.2.4.1 DPPH自由基清除率测定 参照Liu等[21]、Hu等[22]的方法并做适当改动,依次准确移取不同浓度(0.025、0.05、0.1、0.15、0.2、0.25 mg/mL)枸杞芽茶、叶茶提取物水溶液50 μL、DPPH溶液(0.4 mmol/L)25 μL及去离子水100 μL于96孔板中,混匀于30 ℃避光反应30 min,反应结束后用酶标仪测定517 nm处吸光值,计算清除率及半抑制浓度(清除率达到50%对应的样品浓度,IC50值),VC做阳性对照。
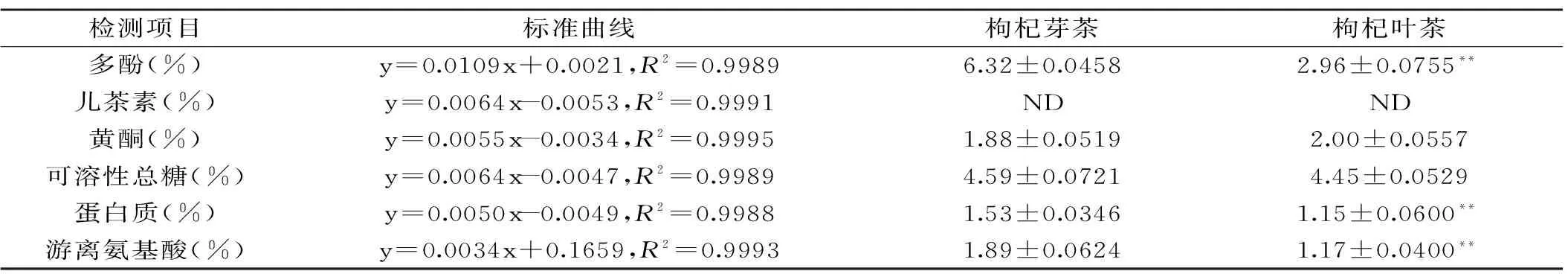
表1 枸杞芽茶、叶茶各项化学成分含量Table 1 Chemical contents of Lycium barbarum bud and leaf teas
注:ND:未检测到,*显著水平0.05,**显著水平0.01,每组实验结果为三次平行实验平均值±标准差。
其中,A0为去离子水代替样品组,A1为正常实验组,A2为无水乙醇代替DPPH试剂空白组。
1.2.4.2ABTS自由基清除率测定 参照Xie等[23]的方法,将ABTS溶液(7mmol/L)与K2S2O8溶液(4.95mmol/L)等体积混合,于暗处放置12h后以PBS溶液(磷酸盐缓冲溶液0.2mol/L,pH7.4)调整混合液734nm处吸光值在0.7±0.02范围制备ABTS工作液。准确移取不同浓度(0.025、0.05、0.1、0.15、0.2、0.25mg/mL)枸杞芽茶、叶茶提取物水溶液20μL及ABTS工作液200μL于96孔板中,摇匀于室温下反应10min,测定反应液在734nm处吸光值,VC做阳性对照。
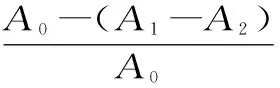
其中,A0为去离子水代替样品组,A1为正常实验组,A2为PBS溶液代替ABTS工作液试剂空白组。
1.2.4.3 超氧阴离子自由基清除率测定 参照Bi等[24]的方法,依次准确移取不同浓度(0.025、0.05、0.1、0.15、0.2、0.25mg/mL)枸杞芽茶与叶茶提取物水溶液、以PBS(磷酸盐缓冲溶液0.1mol/L,pH7.4)配制的NBT溶液(156μmol/L)、NADH溶液(468μmol/L)及PMS溶液(60μmol/L)各50μL到96孔板中,混匀后于室温下反应5min,测定560nm处吸光值,VC做阳性对照。
其中,A0为去离子水代替样品组,A1为正常实验组,A2为PBS溶液代替NBT试剂空白组。
1.2.4.4 总还原力测定 参照Wu等[25]的方法,取50μL不同浓度(0.025、0.05、0.10、0.15、0.20、0.25mg/mL)提取物水溶液于96孔板中,然后依次加入50μL0.2mol/LpH6.6磷酸盐缓冲溶液、50μLK3Fe(CN)6溶液(1%,W/V)、50μL三氯乙酸(10%,W/V)及25μL氯化铁溶液(0.1%,W/V),室温放置10min后测定700nm处吸光值,以去离子水代替氯化铁溶液做空白,以VC做阳性对照。
总还原力=A1-A2
其中,A1为正常实验组吸光值,A2为去离子水代替氯化铁实验组吸光值。
1.3 统计分析
实验数据采用Origin 8.0、IBM SPSS Statistic 20软件进行分析,利用单因素ANOVA法进行数据处理与分析。
2 结果与讨论
2.1 枸杞芽茶、叶茶提取物的化学成分含量
枸杞芽茶、叶茶中各项化学成分含量见表1。可以看出,枸杞芽茶与叶茶提取物的多酚、黄酮、多糖、蛋白质及氨基酸含量中,除枸杞芽茶黄酮含量(1.88%)稍低于枸杞叶茶(2.00%)外,其他各项成分含量均高于枸杞叶茶,其中多酚、蛋白质及游离氨基酸三项指标差异显著(p<0.01)。对于茶类中起良好抗氧化活性作用的多酚类物质,枸杞芽茶多酚含量(6.32%)显著高于枸杞叶茶(2.96%,p<0.01),分析原因可能是在枸杞芽发育到叶的过程中由于生长需要,枸杞芽中储备的营养物质被消耗,造成枸杞叶茶中蛋白质、氨基酸以及多酚类等物质含量出现一定程度的降低。测定儿茶素含量时,枸杞芽茶、叶茶提取物香荚兰素显色反应并没有和碧螺春茶一样呈现明显红色(图1),吸光度几乎为0(与空白对照一致)。Mocan等[26]对枸杞叶的多酚类物质进行HPLC-MS分析时也发现枸杞叶中的多酚类物质主要为绿原酸、芦丁等,并未发现儿茶素类物质的存在。基于本研究结果及文献报道可以认为枸杞芽茶、叶茶这一新型保健茶品不同于中国传统茶叶,枸杞芽茶与叶茶中的多酚类物质主要以绿原酸类物质形式存在,而并非传统绿茶中广泛存在的儿茶素类物质,这一不同点可以为宁夏枸杞芽茶与叶茶的综合利用及产品开发提供新的思路。

图1 枸杞芽茶与叶茶、绿茶茶汤香荚兰素盐酸显色反应结果对比图Fig.1 Results of vanillin reactions of liquor of green tea,Lycium barbarum bud and leaf teas注:0:蒸馏水(空白对照),#1枸杞芽茶,#2枸杞叶茶,#4碧螺春绿茶。
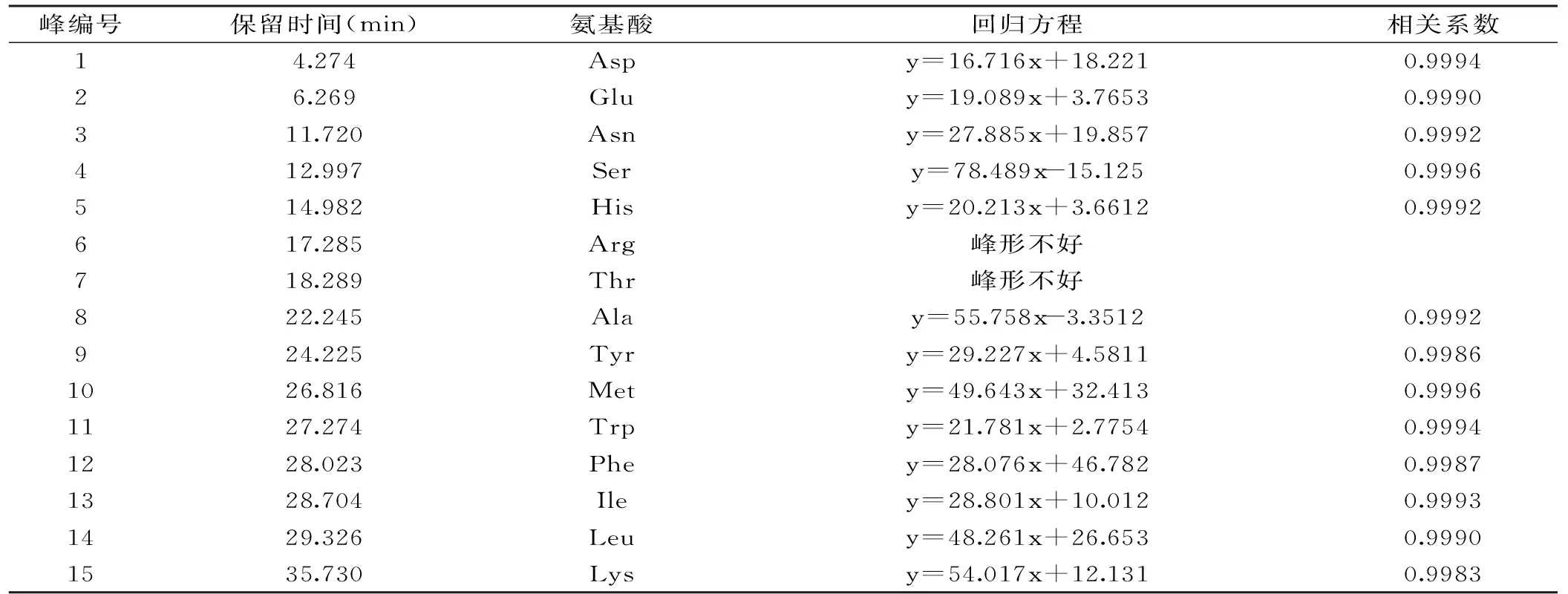
表2 15种氨基酸标准品的回归方程及相关系数Table 2 Retention time,regression equation and R2 of 15 amino acid standards
氨基酸类物质是茶制品中重要的呈味物质,其含量多少会对各种茶制品的滋味品质产生直接影响,枸杞芽茶、叶茶是近年来的新兴茶制品,而目前关于枸杞芽茶、叶茶中氨基酸的种类及含量分析鲜有报道。本实验以固相萃取、柱前衍生结合HPLC法对枸杞芽茶与叶茶中的主要游离氨基酸的组成及含量进行了分析。从图2A中可以看出15种氨基酸除精氨酸(Arg)、苏氨酸(Thr)的色谱峰未完全分开外,其余各氨基酸色谱峰峰形良好,各氨基酸的保留时间及回归方程见表2。图2B与图2C分别为枸杞芽茶与叶茶的游离氨基酸液相色谱图,枸杞芽茶与叶茶中主要游离氨基酸含量见表3。可以看出Asp(天冬氨酸)、Glu(谷氨酸)、Asn(天冬酰胺)、Ser(丝氨酸)、His(组氨酸)、Tyr(酪氨酸)、Leu(亮氨酸)色谱峰相对而言较为明显,为枸杞芽茶与叶茶中的主要游离氨基酸,其中Asn、Asp、His、Leu含量更为丰富;同时可以看出,与枸杞叶茶相比枸杞芽茶中各主要游离氨基酸的含量较高。Wang等[20]对绿茶、红茶以及乌龙茶中游离氨基酸的定性、定量分析中发现,茶氨酸是绿茶、红茶以及乌龙茶中含量最高的游离氨基酸,在绿茶、红茶与乌龙茶中茶氨酸含量分别达到2158.54、1369.12、1287.21 μg/g,组氨酸的含量分别为316.56、217.56、30.20 μg/g。因此该分析结果表明枸杞芽茶与叶茶在游离氨基酸的组成及含量上与传统茶叶存在较大的差异。
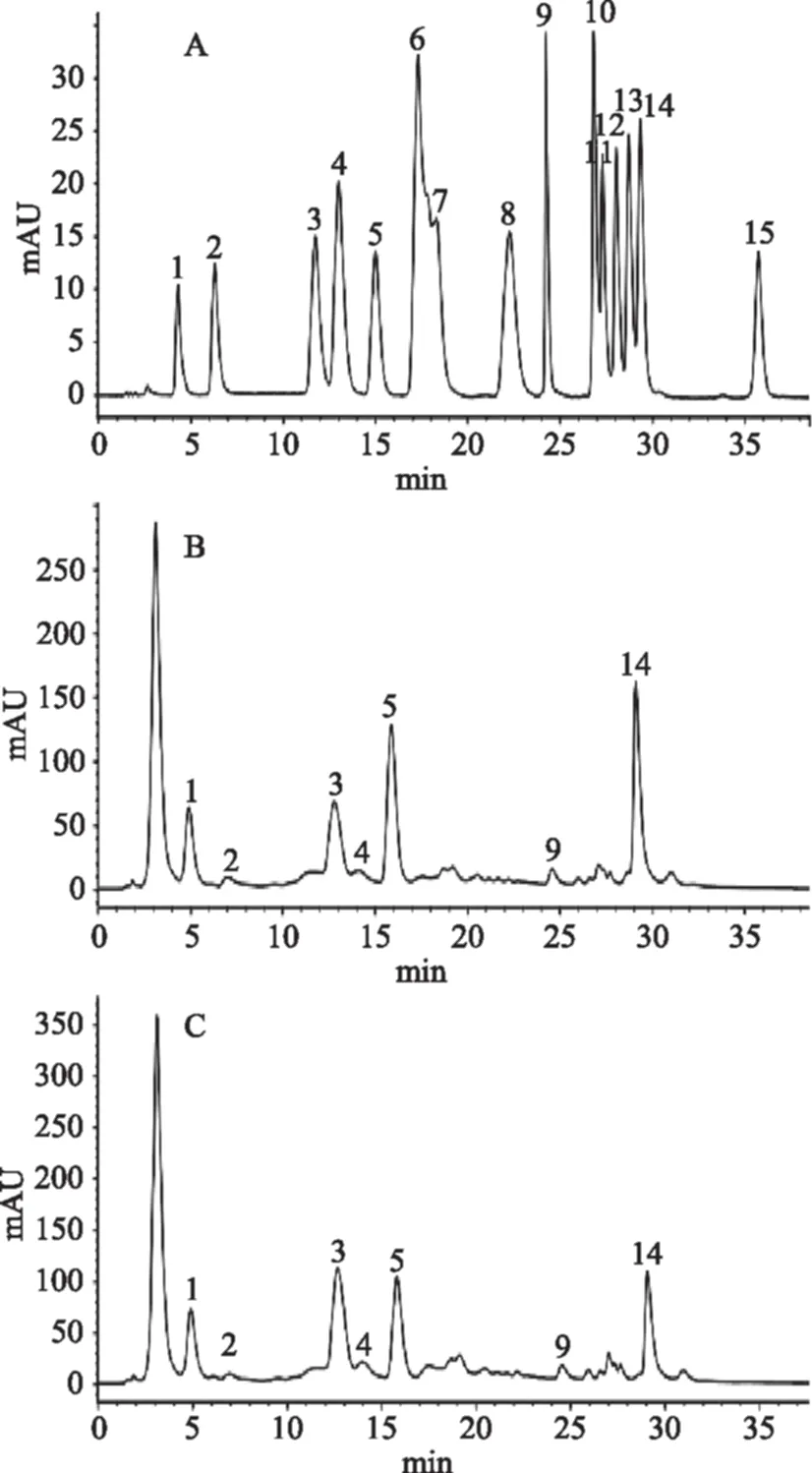
图2 氨基酸标准品(A)、枸杞芽茶(B)与枸杞叶茶(C)高效液相色谱图Fig.2 HPLC chromatograms of amino acid standards(A),Lycium barbarum bud tea(B)and Lycium barbarum leaf tea(C)
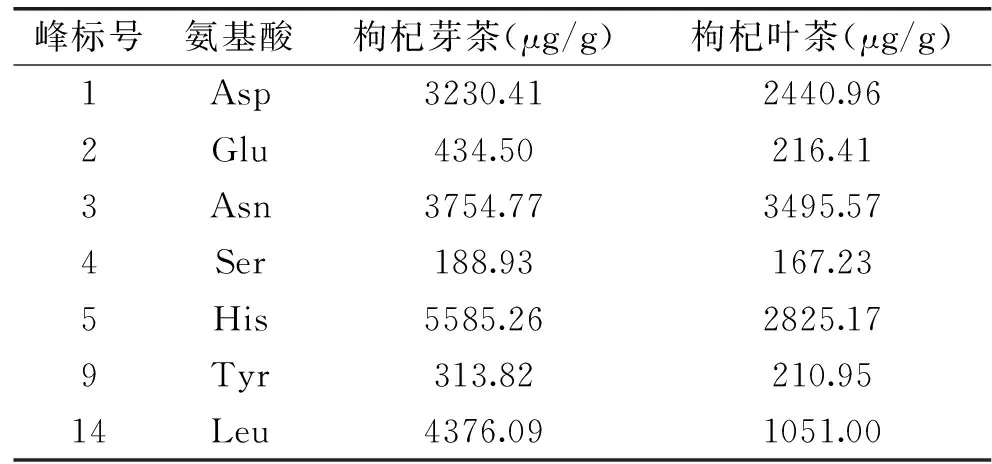
表3 枸杞芽茶与叶茶中的7种主要游离氨基酸含量Table 3 The content of 7 main free amino acids from Lycium barbarum buds and leaf teas
2.2 枸杞芽茶与叶茶的抗氧化活性
2.2.1 DPPH自由基清除能力 枸杞芽茶、叶茶对DPPH自由基的清除能力见图3。从图3中可以看出,在整个实验浓度范围内,枸杞芽茶提取物对DPPH自由基的清除率与阳性对照相比明显较弱,但始终高于枸杞叶茶,在浓度达到0.25 mg/mL时,枸杞芽茶、叶茶提取物对DPPH自由基的清除率分别为59.2%、53.2%,IC50值分别为147.63、241.23 μg/mL。张自萍等[27]在对枸杞子不同提取液抗氧化活性的研究中发现,在相同提取条件下,枸杞子水提取液的DPPH自由基清除活性强于乙醇提取液,且枸杞子乙醇提取液随着乙醇浓度的上升,DPPH自由基清除力逐步下降,IC50(半抑制浓度)具体表现为水(0.902 mg/mL)>50%乙醇(0.953 mg/mL)>80%乙醇(0.971 mg/mL)>95%乙醇(1.828 mg/mL),表明枸杞子中的水溶性提取物具有更好的抗氧化活性,即水提法相对于醇提法更有利于发挥枸杞子的抗氧化活性作用。对比本研究中枸杞芽茶、叶茶对于DPPH自由基的清除活性可以发现,枸杞芽茶与叶茶与枸杞子相比具有更强的DPPH自由基清除力,造成这一现象的原因可能是枸杞子中主要活性物质为多糖类等物质,而枸杞芽、叶中含量较为丰富的多酚类物质结构中含大量酚羟基,研究表明酚羟基极易与自由基反应,提供质子和电子而使自由基失去反应活性[28],因而对众多自由基有着更为显著的清除活性。枸杞芽茶与枸杞叶茶多酚含量(6.32%、2.96%)的不同可能也是造成枸杞芽茶DPPH自由基清除力强于枸杞叶茶的重要原因。
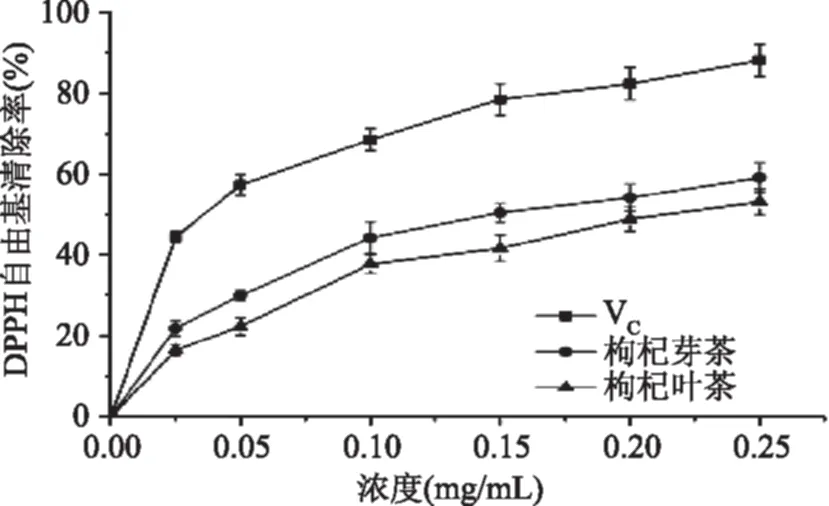
图3 枸杞芽茶、叶茶提取物对DPPH自由基的清除能力Fig.3 Scavenging activities on DPPH radicals of crude extracts from Lycium barbarum bud tea and Lycium barbarum leaf tea
2.2.2 ABTS自由基清除能力 枸杞芽茶、叶茶对ABTS自由基的清除率见图4,阳性对照VC在浓度0.10 mg/mL时清除率已经接近100%;与VC相比,枸杞芽茶、叶茶清除率较低,但枸杞芽茶对ABTS自由基的清除效果明显强于枸杞叶茶,枸杞芽茶、叶茶对ABTS自由基的IC50值分别为109.87、145.32 μg/mL,这一实验结果与DPPH自由基清除率的结果保持一致,表明枸杞芽茶中含量相对较高的多酚等物质作为重要的生物活性成分对于清除ABTS自由基发挥了重要作用。Mocan等[26]通过液质联用分析发现枸杞叶中的多酚类主要为绿原酸、芦丁、对香豆酸、异槲皮素等物质,其中绿原酸含量为5899.29 μg/mL,相对含量最高,枸杞叶乙醇提取物对ABTS自由基的清除力相当于35.72 μg VE/mL。
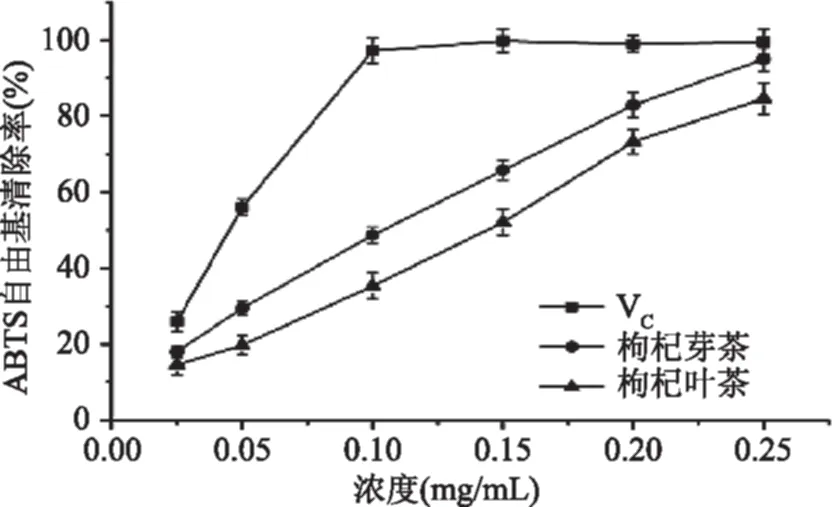
图4 枸杞芽茶、叶茶提取物对ABTS自由基的清除能力Fig.4 Scavenging activities on ABTS radicals of crude extracts from Lycium barbarum bud tea and Lycium barbarum leaf tea
2.2.3 超氧阴离子自由基清除能力 枸杞芽茶、叶茶对超氧阴离子自由基的清除情况见图5。随着浓度的上升,枸杞芽茶、叶茶对超氧阴离子自由基的清除率呈现明显的剂量依赖关系,当浓度达到0.2 mg/mL并进一步增大时,枸杞芽茶、叶茶的清除率增强趋势逐渐放缓,且二者差距逐渐减少,在浓度0.25 mg/mL时,二者对超氧阴离子自由基的清除率分别达到79.5%、78.4%,IC50值分别为46.58、54.32 μg/mL。关炳峰等[29]在对金银花提取物的抗氧化活性与其绿原酸含量的相关性研究中以VC、绿原酸纯品作为阳性对照,分析金银花提取物和与其所含的等量的绿原酸的抗氧化能力的差异,发现金银花提取物对超氧阴离子自由基的清除力与其所含绿原酸含量密切相关,当金银花提取物浓度达到0.2 mg/mL时,对超氧阴离子自由基的清除率高于90%,清除能力显著,略低于VC。枸杞芽、叶中的多酚类生物活性成分主要为绿原酸类物质[26],枸杞芽茶、叶茶中虽然没有检测出儿茶素类物质的存在,但枸杞芽茶、叶茶中的绿原酸等多酚类物质可能发挥了良好的对超氧阴离子自由基的清除作用。
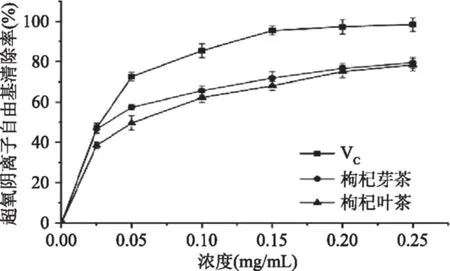
图5 枸杞芽茶、叶茶提取物对超氧阴离子自由基的清除能力Fig.5 Scavenging activities on superoxide radicals of crude extracts from Lycium barbarum bud tea and Lycium barbarum leaf tea
2.2.4 总还原力 枸杞芽茶、叶茶的总还原力结果见图6,可以看出与阳性对照VC相比,枸杞芽茶、叶茶的总还原能力明显较弱,在浓度0.25 mg/mL时,VC、枸杞芽茶、叶茶的总还原力分别为1.84、0.38、0.26,表明枸杞芽茶总还原力稍强于枸杞叶茶。关炳峰等[29]在探讨金银花提取物的超氧阴离子自由基清除率与其绿原酸含量相关性的同时,以K3[Fe(CN)6]反应体系测定了金银花提取物的还原能力,结果表明在较低浓度下绿原酸纯品与金银花提取物还原力较弱,呈平行上升趋势,低于VC的还原能力;在浓度到达0.05 mg/mL并进一步加大至最大浓度0.2 mg/mL的过程中,二者还原能力呈较快增长趋势并逐步接近VC。绿原酸类物质的存在可以为富含绿原酸类物质的植物材料提供良好的还原力,因此含有较丰富绿原酸类物质的枸杞芽茶、叶茶为新型保健茶品的开发利用提供了一定的依据。

图6 枸杞芽茶、叶茶提取物总还原能力Fig.6 Total reducing power of crude extracts from Lycium barbarum bud tea and Lycium barbarum leaf tea
3 结论
枸杞芽茶提取物中多酚、蛋白质、游离氨基酸含量显著高于枸杞叶茶(p<0.01),黄酮、可溶性总糖含量均没有显著差异,而且在枸杞芽茶、叶茶中没有检测出绿茶中常见的儿茶素类多酚物质。HPLC法测定枸杞芽茶与叶茶中游离氨基酸含量的结果表明,天冬氨酸、谷氨酸、天冬酰胺、丝氨酸、组氨酸、酪氨酸、亮氨酸为枸杞芽茶与叶茶中的主要游离氨基酸,其中天冬酰胺、天冬氨酸、组氨酸、亮氨酸含量更为丰富。枸杞芽茶、叶茶对DPPH自由基、ABTS自由基及超氧阴离子自由基均有良好的清除能力,且枸杞芽茶具有更好的抗氧化活性,但与阳性对照VC的抗氧化活性相比,枸杞芽茶、叶茶仍存在一定差距。
[1]李宪明,高治军. 宁夏枸杞叶茶的开发现状和制茶品种比较[J]. 宁夏农林科技,2012,53(12):20-21.
[2]陈玲,余昆,徐桂花,等. 枸杞叶茶保健酒的研究[J]. 酿酒科技,2013(4):77-79.
[3]李建国,马金平,王孝,等. 枸杞芽茶栽培技术[J]. 北方园艺,2015(2):139-140.
[4]毛清黎,施兆鹏,李玲,等. 茶叶儿茶素保健及药理功能研究新进展[J]. 食品科学,2007,28(8):584-589.
[5]Kuroda Y,Hara Y. Antimutagenic and anticarcinogenic activity of tea polyphenols[J]. Mutation Research/fundamental & Molecular Mechanisms of Mutagenesis,1999,436(1):69-97.
[6]Krisetherton P M,Keen C L. Evidence that the antioxidant flavonoids in tea and cocoa are beneficial for cardiovascular health[J]. Current Opinion in Lipidology,2002,13(13):41-49.
[7]Relja B,Töttel E,Breig L,et al. Effects of green tea catechins on the pro-inflammatory response after haemorrhage/resuscitation in rats[J]. British Journal of Nutrition,2011,105(12):1791-1797.
[8]Oz H S,Ebersole J L. Green tea polyphenols mediated apoptosis in intestinal epithelial cells by a fadd-dependent pathway[J]. Journal of Cancer Therapy,2010,1(3):105-113.
[9]Peng Z,Xu Z W. Tea polyphenols protect against irradiation-induced injury in submandibular glands’ cells:a preliminary study[J]. Archives of Oral Biology,2011,56(8):738-743.
[10]邱虹,罗燕枫,孙向平,等. 宁夏无果枸杞芽茶对高血脂患者血脂水平及抗氧化功能的影响[J]. 宁夏医科大学学报,2015,37(11):1249-1252.
[11]魏智清,王吉军,谈永萍. 枸杞叶(芽)茶降血糖作用小鼠实验研究[J]. 农业科学研究,2012,33(3):1-3.
[12]刘丽香,Tanguy Laura,梁兴飞,等. Folin-Ciocalteu比色法测定苦丁茶中多酚含量[J]. 茶叶科学,2008,28(2):101-106.
[13]刘坤,伏圣青,高华,等. 茶叶中儿茶素含量的快速测定方法研究[J]. 青岛大学学报:工程技术版,2010,25(4):87-90.
[14]韦秀芝,张可锋,段小群. 不同品种金花茶叶中总黄酮含量测定[J]. 安徽农业科学,2012,40(10):5869-5869.
[15]王黎明,夏文水. 蒽酮-硫酸法测定茶多糖含量的研究[J]. 食品科学,2005,26(7):185-188.
[16]傅博强,谢明勇,聂少平,等. 茶叶中多糖含量的测定[J].食品科学,2001,22(11):69-73.
[17]邓丽莉,潘晓倩,生吉萍,等. 考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J]. 食品科学,2012(24):185-189.
[18]刘美,马叶萍,柳阳阳,等. 茶叶中游离氨基酸含量的测定[J]. 微量元素与健康研究,2016,33(1):51-52.
[19]邵金良,黎其万,董宝生,等. 茚三酮比色法测定茶叶中游离氨基酸总量[J]. 中国食品添加剂,2008(2):162-165.
[20]W ang L,Xu R,Hu B,et al. Analysis of free amino acids in Chinese teas and flower of tea plant by high performance liquid chromatography combined with solid-phase extraction[J]. Food Chemistry,2010,123(4):1259-1266.
[21]Ying L,Ma S S,Ibrahim S A,et al. Identification and antioxidant properties of polyphenols in lotus seed epicarp at different ripening stages[J]. Food Chemistry,2015,185:159-164.
[22]Hu B,Wang Y,Xie M,et al. Polymer nanoparticles composed with gallic acid grafted chitosan and bioactive peptides combined antioxidant,anticancer activities and improved delivery property for labile polyphenols[J]. Journal of Functional Foods,2015,15:593-603.
[23]Xie M,Hu B,Wang Y,et al. Grafting of gallic acid onto chitosan enhances antioxidant activities and alters rheological properties of the copolymer[J]. Journal of Agricultural & Food Chemistry,2014,62(37):9128-9136.
[24]Bi H,Gao T,Li Z,et al. Structural elucidation and antioxidant activity of a water-soluble polysaccharide from the fruit bodies of Bulgaria inquinans(Fries)[J]. Food Chemistry,2013,138(2-3):1470-1475.
[25]Wu Q,Qu H,Jia J,et al. Characterization,antioxidant and antitumor activities of polysaccharides from purple sweet potato[J]. Carbohydrate Polymers,2015,132:31-40.
[26]Mocan A,Vlase L,Vodnar D C,et al. Polyphenolic content,antioxidant and antimicrobial activities of Lycium barbarum L. andLyciumchinenseMill. leaves[J]. Molecules,2014,19(7):10056-10073.
[27]张自萍,黄文波,廖国玲,等. 枸杞子提取液抗氧化活性的研究[J]. 西北植物学报,2007,27(5):943-946.
[28]胡宗福,于文利,赵亚平. 绿原酸清除活性氧和抗脂质过氧化的研究[J]. 食品科学,2006,27(2):128-130.
[29]关炳峰,谭军,周志娣. 金银花提取物的抗氧化作用与其绿原酸含量的相关性研究[J]. 食品工业科技,2007,28(10):127-129.
Analysis of chemical compositions and antioxidant activities ofLyciumbarbarumbud and leaf teas
ZHOU Zhi-yang1,CAO You-long2,WANG Yi-han1,CHENG Di-jun1,MI Jia2,LI Xiao-ying2,YAN Ya-mei1,2,*,ZENG Xiao-xiong1,2,*
(1.College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China; 2.National Wolfberry Engineering Research Center,Yinchuan 750002,China)
The extracts ofLyciumbarbarumbud and leaf teas were prepared by hot water extraction(ratio of solid to liquid 1∶40,temperature 96 ℃,extraction time 30 min)and their chemical contents were determined,and compositions of free amino acids inLyciumbarbarumbud and leaf teas were analyzed by HPLC. Furthermore,the antioxidant activities ofLyciumbarbarumbud and leaf tea were evaluated by determining of scavenging activities on DPPH radical,ABTS radical and superoxide radical and total reducing power. The results showed that the total polyphenols contents forLyciumbarbarumbud and leaf teas were 6.32% and 2.96%,respectively. Asp(3230.41 and 2440.96 μg/g),Asn(3754.77 and 3495.57 μg/g),His(5585.26 and 2825.17 μg/g)and Leu(4376.09 and 1051.00 μg/g)were relatively abundant inLyciumbarbarumbud and leaf teas. Moreover,bothLyciumbarbarumbud tea and leaf tea exhibited favorable scavenging activities on DPPH(IC50:147.63 and 241.23 μg/mL),ABTS(IC50:109.87 and 145.32 μg/mL)and superoxide radicals(IC50:46.58 and 54.32 μg/mL). Compared withLyciumbarbarumleaf tea,Lyciumbarbarumbud tea showed relatively higher antioxidant activity.
Lyciumbarbarumbud tea;Lyciumbarbarumleaf tea;chemical composition;free amino acid;antioxidant activity
2016-10-11
周志阳(1992-),男,硕士研究生,研究方向:食品生物资源化学,E-mail:2014108068@njau.edu.cn。
*通讯作者:闫亚美(1982-),女,博士,副研究员,研究方向:枸杞加工与贮藏,E-mail:yanyamei@163.com。 曾晓雄(1964-),男,博士,教授,研究方向:食品生物技术,E-mail:zengxx@njau.edu.cn。
宁夏农林科学院对外合作项目(JLC201601);宁夏农林科学院先导项目(NKYG-13-08,NKYJ-14-26,NKYZ-16-0505);江苏高校优势学科建设工程资助项目。
TS201.2
A
1002-0306(2017)10-0129-07
10.13386/j.issn1002-0306.2017.10.017
