基于PepT1—PPARα靶标组合的中药协同机制解析
2017-06-22乔连生陈艳昆雒刚刚路芳刘思佳李
乔连生+陈艳昆+雒刚刚+路芳+刘思佳+李贡宇+张燕玲


[摘要] 协同效应是中药发挥药效的主要作用机制,结合关键靶标组合探讨中药的协同效应是阐释中药协同机制的有效方法之一。寡肽转运蛋白(peptide transporter 1,PepT1)是药物吸收入血的关键靶标之一,约占总转运蛋白含量的50%。过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated recepror α,PPARα)是贝特类降脂药物的作用靶点,其激动剂具有良好的降血脂药效。研究表明PPARα可反式激活PepT1的基因表达,PPARα激动剂可促进PepT1底物的吸收,从而共同发挥协同作用。因此,本研究拟基于PepT1和PPARα的靶标组合,发现中药活性成分中的PepT1底物和PPARα激动剂,并在一定程度上探讨中药活性成分吸收入血与降低血脂的协同机制。该研究基于前期实验室已构建的PPARα激动剂的融合药效团模型,筛选潜在的具有PPARα激动效应的中药活性成分,并追溯其来源中药。同时构建PepT1底物的支持向量机模型,预测中药中潜在的PepT1底物。通过分析2组筛选结果,发现三七-灵芝、三七-丹参组合可能通过PepT1和PPARα协同机制发挥降脂药效。该研究基于PepT1-PPARα的靶标组合,探索中药活性成分吸收与降脂药效的协同机制,为基于靶标组合探讨中药药代动力学参与的协同机制研究提供了一条新思路。
[关键词] PepT1;PPARα;协同机制;SVM;融合药效团;分子对接;虚拟筛选
[Abstract] Synergistic effect is main pharmacological mechanism of traditional Chinese medicine(TCM). The research method based on the key targets combination is an important method to explore the synergistic effect of TCM. Peptide transporter 1 (PepT1) is an essential target for drug uptake into the bloodstream,accounting for about 50% of the total transporter protein content from the small intestine. Peroxisome proliferator-activated receptor α(PPARα) is the lipid-lowering target of fibrates,which have a good hypolipidemic effect by activating PPARα. It has been reported that PPARα could activate the gene expression of PepT1s,and PPARα agonists can promote the uptake of PepT1 substrates,indicating their synergistic effect. In this paper,PepT1 substrates and PPARα agonists from TCM were discovered,and their synergistic mechanism was also been discussed based on the target combination of PepT1 and PPARα. The support vector machine(SVM) model of PepT1 substrates was first constructed and utilized to predict potential TCM components. Meanwhile,merged pharmacophore and docking model of PPARα agonists was used to screen the potential active ingredients from TCM. According to the analysis results of two groups,the TCM combination of Panax notoginseng and Ganoderma lucidum,as well as TCM combination of P. notoginseng and Salvia miltiorrhiza were identified to have the synergistic mechanism based on target combination of PepT1 and PPARα. In this study,synergistic mechanism of TCM was analyzed for absorption and hypolipidemic effect based on target combination,which provides a new way to explore the synergetic mechanism of TCM related to pharmacokinetics.
[Key words] PepT1;PPARα;synergistic mechanism;SVM;merged pharmacophore;docking;virtual screening
中药协同效应研究是中药物质基础与作用机制研究的关键,已有研究多是从经典方剂或药对出发,解析其化学组成与物质基础,进一步探讨其发挥药理作用的分子机制,并阐明其协同效应[1-2]。本研究拟采用逆向的研究思路,即从药物靶标组合出发,结合分子模拟技术,发现潜在的中药活性成分,并在靶标组合的基础上探讨中药的协同机制。传统的靶标组合概念特指具有治疗效应的靶标之间的组合,随着概念的延伸,治疗靶标与吸收、转运、代谢等靶标之间组合也被称为靶标组合[3-4]。本研究选择的研究载体为寡肽转运体(peptide transporter 1,PepT1)和过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)的靶標组合。PepT1主要存在于生物体的小肠部位,是经典的药物转运体,具有极宽泛的底物谱,是多种药物吸收入血的重要途径,约占总转运蛋白含量的50%[5]。PPARα是经典的降脂靶标,其激动剂贝特类药物具有明确的降脂药效,其降脂机制有别于抑制胆固醇合成通路的HMG-CoA还原酶抑制剂,PPARα激动剂可通过调节血脂的代谢通路从而发挥降脂的药效。研究表明PPARα具有调节多种肠道转运体,尤其是PepT1表达的效应,部分PPARα激动剂也被证明具有促进PepT1底物吸收的效应[6-8],因此,基于此靶标组合探讨中药吸收入血与降低血脂的协同机制对中药药代动力学参与的中药协同机制分析具有重要意义。
本研究针对PepT1和PPARα的靶标组合,首先构建PepT1底物预测的支持向量机模型(support vector machine,SVM),并通过多种内测及外测参数挑选最优的SVM模型。基于最优的SVM模型筛选中药中潜在的PepT1底物成分。随后,进一步结合实验室已构建的PPARα激动剂的融合药效团模型和分子对接模型,筛选中药中潜在的PPARα激动活性成分。追溯2个靶标筛选到的活性成分的来源中药,并结合文献探讨高频中药在方剂和药对中可能存在的协同机制,从PepT1和PPARα靶标组合的角度出发,阐释中药吸收入血与降低血脂的协同机制。
1 材料与方法
1.1 PepT1支持向量机模型的构建与验证
1.1.1 数据收集与整理 本文从文献[9-11]中收集PepT1底物共计90个,以此作为阳性化合物构建PepT1支持向量机模型。阴性化合物来源于Drugbank数据库(http://www.drugbank.ca/)中的非PepT1转运的已上市药物。首先,利用Discovery Studio 4.0软件计算所有化合物的8个类药性质描述符,包括AlogP、相对分子质量、氢键供体数目、氢键受体数目、可旋转键数目、脂环数目、芳环数目、分子极性比表面积。随后利用8个描述符,基于主成分分析方法描述化合物的化学结构空间分布[12]。通过比较阳性化合物和阴性化合物化学空间的差异,利用随机选取和等距离抽样的方式挑选用于建模的阴性化合物,并利用KS方法实现化合物数据集的划分。为使训练集具有较好的代表性,数据集划分应保证训练集中阳性化合物和阴性化合物的比例约为1∶1,内部测试集中阳性样本和阴性样本的比例约为1∶3,外部测试集中阳性样本和阴性样本的比例约为1∶3。
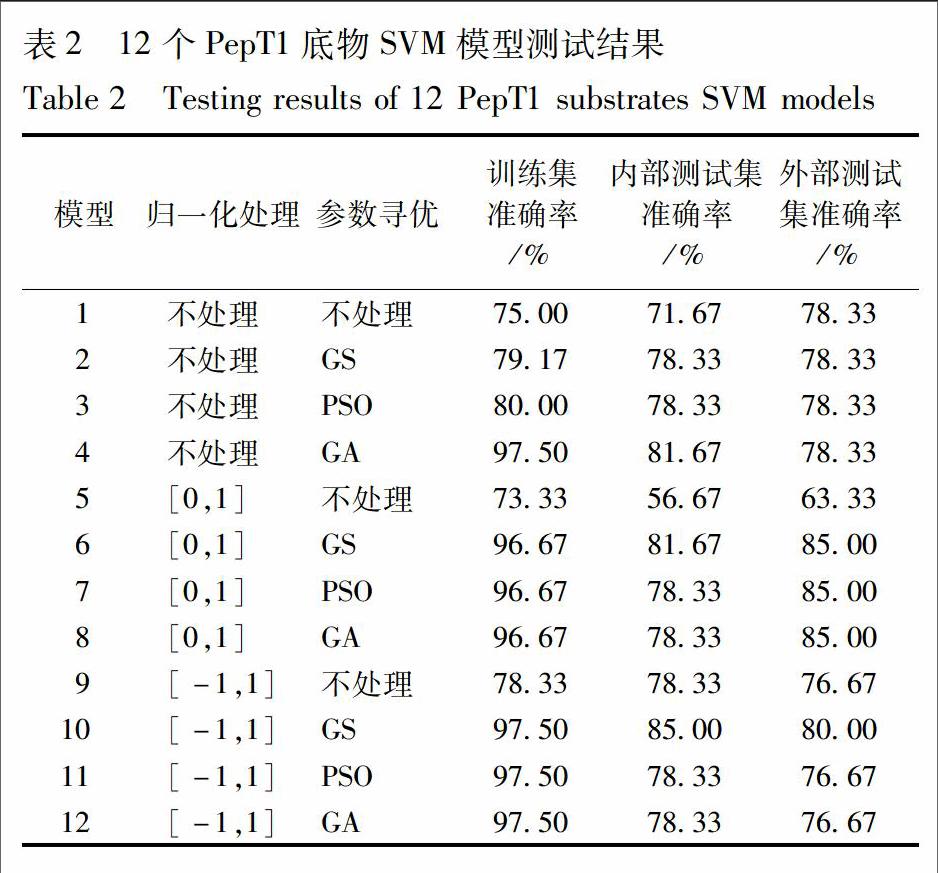
1.1.2 模型的建立 本文利用Dragon 2.1软件计算用于构建模型的化合物的1 481个分子描述符,并利用Weka 3.6.10的BestFirst-D1-N5搜索方法和CfsSubsetEval-P1-E1评估方法,针对训练集和内部测试集的分子描述符,进行降维并去除冗余,得到与所构建模型最相关的分子描述符子集。本研究基于训练集化合物利用SVM建立定性预测模型。实验所用SVM算法采用台湾大学林智仁提供的网络共享算法libsvm3.1(http://www.csie.ntu.edu.tw/~cjlin/libsvm/),并将3种归一化数据处理方法和4种模型参数寻优方法组合并进行建模,通过比较各模型训练集、内部测试集和外部测试集的评价参数,得到最优建模组合。归一化数据处理中包括3种处理方法:不处理、[0,1]归一化和[-1,1]归一化。模型参数寻优处理中选用RBF核函数,4种参数寻优方法包括:不处理,GS,PSO和GA。3种数据处理方式与4种参数寻优方法排列组合共计构建12个SVM模型[13]。其中,寻优参数(C,γ)的选择采用逐一交叉验证的方法确定C和γ,取均方根(RMS)最小时的C和γ值,以防止训练集在过拟合的情况下找到最优参数。综合考虑各模型间训练集、外部测试集和内部测试集的优劣,选择最优实验方案。
1.1.3 模型的验证 针对已构建的12个SVM模型,首先利用内部测试集对模型进行评价,评价指标包括准确率(ACC)、灵敏度(SE)和特异性(SP)。各项指标数值越大,模型性能越好。计算公式为(1)~(3)[14]。其中TP为真阳化合物数目,TN为真阴化合物数目,FP为假阳化合物数目,FN为假阴化合物数目。
ACC=(TP+TN)/(TP+FN+TN+FP)(1)
SE=TP/(TP+FN)(2)
SP=TN/(TN+FP)(3)
随后利用外部测试集对模型进行评价。评价指标同样包括:ACC,SE和SP。同时,绘制外部测试集的ROC曲线,并计算其曲线下面积(AUC)值,从而共同说明模型的准确性。随后,利用获得的最优PepT1底物判别模型预测中药化学成分数据库(TCMD)的成分,追溯其来源中药,分析高频中药的药性及功能主治,通过文献验证,说明筛选结果的合理性。
1.2 基于PepT1-PPARα的协同机制解析
利用实验室前期已构建的PPARα激动剂的融合药效团模型,筛选TCMD数据库[15]。同时,结合PPARα激动剂的分子对接筛选模型(PDB:3KDU),进一步筛选药效团命中的潜在活性成分,并追溯筛选结果的来源中药。随后,针对PPARα激动剂与PepT1底物的来源中药,分析其相互关系,并讨论具有PPARα激动效应的中药成分对PepT1中药底物吸收和药效发挥的促进作用,进一步阐释中药协同作用机制。
2 结果与讨论
2.1 PepT1的支持向量机模型
基于阴性化合物与阳性化合物的化学空间分析,结合随机选取和等距离抽样的方式,共挑选150个阴性化合物用于SVM模型的构建与验证,基于8个类药描述符进行阴性与阳性化合物的主成分分析结果见图1。结果显示,阳性化合物的化学空间可以被阴性化合物所覆盖,说明研究所用数据集中的阴性和阳性化合物在类药性质上没有明显差异,能够确保构建的SVM模型的可靠性[16]。随后基于KS方法进行数据集的划分,结果如下:训练集中包括60个阳性化合物和60个阴性化合物,内部测试集中包括15个阳性化合物和45个阴性化合物,外部测试集中包括15个阳性化合物和45个阴性化合物。本研究进一步利用weka机器平台进行描述符的筛选,共获得28个描述符,模型的描述符名称见表1。
本研究进一步结合3种数据处理方法与4种寻优算法,构建了12个SVM模型,12个模型的训练集、内部测试集和外部测试集的准确率见表2。通過综合考虑各模型间训练集、内部测试集和外部测试集的优劣,选取6号模型为最优模型。该模型对数据采用[0,1]归一化处理和GS参数寻优方法进行建模,C为5.278,γ为1.741 1,得到模型自身预测ACC为96.67%。归一化与参数寻优结果见图2。6号模型内部测试集的SE和SP值分别为86.67%,80.00%,外部测试集的SE和SP值分别为86.67%,86.66%。根据测试集与训练集数据,对PepT1底物模型进行ROC曲线分析,所得曲线下面积(AUC)为0.939,曲线见图2。PepT1底物模型的ACC,SE,SP均在80%以上,AUC大于0.9,结果表明PepT1底物模型具有较好的预测能力。
2.2 PepT1底物与PPARα激动剂的中药活性成分筛选
利用已构建的PepT1底物的SVM模型,筛选经过类药五原则处理的TCMD数据库,共获得194个潜在的PepT1中药底物,结果表明其可通过PepT1转运吸收入血,通过追溯来源中药,排名前9的来源中药见表3,其中,三七和钩藤为常用降脂中药[17]。同时,本研究通过PPARα激动剂的药效团和分子对接模型的联合筛选,共获得潜在的中药活性成分182个,结果表明其具有潜在的降脂药理活性,排名前9的来源中药见表3,其中,灵芝、五味子、罗汉果、茯苓、甘草和丹参为常用降脂中药。由于PPARα激动剂降脂机制有别于抑制胆固醇合成通路的HMG-CoA还原酶抑制剂,PPARα激动剂可通过调节血脂的代谢途径从而发挥降脂的药效。因此,本文筛选结果中并未发现常用降脂中药红曲,中药红曲的降脂机制已经部分解析,其主要成分洛伐他汀可通过抑制HMG-CoA还原酶阻断胆固醇合成通路发挥降脂药效,与本文所述机制激活甘油三酯与胆固醇的代谢通路不同。
本研究以命中的13个灵芝三萜中综合打分最高的灵芝酸ε(CAS:294674-05-8)为例,展示灵芝三萜与PPARα激动剂融合药效团及分子对接的匹配结果,结果见图3。灵芝酸ε与药效团的匹配度(Fitvalue)为8.54,与分子对接打分(libdock score)为112.4。C-15的羰基氧与药效团的氢键受体特征具有良好匹配并與关键氨基酸SER280产生氢键作用[18]。同时,C-25的羧基与药效团的负电特征具有良好的匹配,且其羟基氧与THR279和CYS275产生氢键相互作用。
三七和灵芝分别是包含2个靶标潜在活性成分数最多的中药。三七是常用的止血活血药,具有明确的降血脂活性[19],三七环肽是其主要成分之一[20]。
本研究PepT1底物预测模型命中了大量的三七环肽成分,说明三七中环肽成分可能主要通过PepT1吸收入血,从而发挥药效作用。灵芝具有明确的降血脂药效[21],本研究发现灵芝中大量的灵芝三萜具有较好的PPARα激动效应,说明灵芝可能是通过激动PPARα来调节血浆中甘油三酯和胆固醇的含量,从而发挥降脂药效。灵芝-三七药对是近年来发现的具有良好降脂药效的药对组合,如三七-灵芝孢子粉提取物[22]以及灵芝三七降压片[23]均被证明有良好的降低甘油三酯和胆固醇的作用。基于本研究的预测结果,灵芝中具有的潜在PPARα激动效应的灵芝三萜既能发挥良好的降脂效应,同时又能调节PepT1转运体的表达,从而促进三七环肽等PepT1底物的吸收入血,从而加强其降脂效应。因此,灵芝与三七药对的协同效应,可能是其发挥药效的主要机制之一。
丹参-三七配伍具有活血散瘀,理气止痛之功效[24]。丹参-三七药对是临床常用治疗心脑血管疾病的核心药对之一,其主要参与组成包括复方丹参方和芪参益气方等丹七类方。基于本研究的预测结果,三七环肽可通过PepT1吸收入血,而丹参中部分成分也被发现具有潜在的PPARα激动效应,说明激动PPARα可能是丹参发挥降脂药效的作用机制之一。针对丹七类方的多项研究表明,丹七类方具有良好的治疗心脑血管疾病的药效,其可以显著降低血浆中胆固醇及甘油三酯含量[25-26]。通过本研究的筛选结果分析,丹七类方发挥协同药效的作用机制之一,可能是通过丹参中部分成分激动PPARα,从而上调PepT1转运体的表达,促进三七中环肽及其他成分的加速吸收,增强三七的药理活性,因此进一步针对丹七类方的研究可以从其吸收机制出发,探讨其吸收入血与降低血脂的协同机制。
3 结论
中药协同机制的阐释是中药作用机制解析的关键。本研究从PepT1和PPARα的靶标组合出发,构建其底物及激动剂的辨识模型。进一步通过筛选中药活性成分,追溯其来源中药,在整体中药的层次探讨其协同机制。研究发现三七-灵芝和三七-丹参药对含有可有效激活PepT1-PPARα靶标组合的药效成分,可能是协同发挥其吸收入血与降低血脂的药效的机制之一,研究结果尚需进一步的生物活性验证。本研究为从靶标组合角度出发探讨中药协同机制提供了一个研究范例,为结合中药活性成分的药代动力学性质探讨中药增效机制提供了一个新的研究方法。
[参考文献]
[1] Liu Y,Kong J M,Chia L S,et al. Synergistic effect of traditional Chinese medicine[J]. Asian J Chem,2007,19(2):867.
[2] Jing Z,Zhou T,Chen M,et al. Research progress on synergistic anti-tumor mechanisms of compounds in traditional Chinese medicine[J]. J TCM,2014,34(1):100.
[3] Tiwari A K,Sodani K,Dai C L,et al. Nilotinib potentiates anticancer drug sensitivity in murine ABCB1-,ABCG2-,and ABCC10-multidrug resistance xenograft models [J]. Cancer Lett,2013,328(2):307.
[4] Cavalli A,Bolognesi M. Neglected tropical diseases: multi-target-directed ligands in the search for novel lead candidates against trypanosoma and leishmania[J]. J Med Chem,2009,52(23):7339.
[5] Drozdzik M,Grer C,Penski J,et al. Protein abundance of clinically relevant multidrug transporters along the entire length of the human intestine[J]. Mol Pharm,2014,11(10):3547.
[6] Okamura A,Koyanagi S,Dilxiat A,et al. Bile acid-regulated PPARα activity underlies circadian expression of intestinal peptide absorption transporter PepT1/Slc15a1[J]. J Biol Chem,2014,289(36):25296.
[7] Shimakura J,Terada T,Saito H,et al. Induction of intestinal peptide transporter 1 expression during fasting is mediated via peroxisome proliferator-activated receptor alpha[J]. Am J Physiol Gastrointest Liver Physiol,2006,291(5):851.
[8] Madsen S L,Wong E A. Expression of the chicken peptide transporter 1 and the peroxisome proliferator-activated receptor α following feed restriction and subsequent refeeding[J]. Poultry Sci,2011,90(10):2295.
[9] Biegel A,Knütter I,Hartrodt B,et al. The renal type H+/peptide symporter PEPT2: structure-affinity relationships[J]. Amino Acids,2006,31(2):137.
[10] 孙冬黎,曾苏,蒋惠娣.人寡肽转运体hPepT1及其在前药设计中的应用[J].中国药学杂志,2011,46(3):161.
[11] Xuan S,Wang M,Kang H,et al. Support vector machine(SVM) models for predicting inhibitors of the 3′processing step of HIV-1 integrase[J]. Mol Informatics,2013,32(9/10):811.
[12] Zheng C S,Xu X J,Ye H Z,et al. Computational approaches for exploring the potential synergy and polypharmacology of Duhuo Jisheng Decoction in the therapy of osteoarthritis[J]. Mol Med Rep,2013,7(6):1812.
[13] Qiao L S,Zhang X B,Jiang L D,et al. Identification of potential ACAT-2 selective inhibitors using pharmacophore,SVM and SVR from Chinese herbs[J]. Mol Divers,2016,20:933.
[14] 张景芳,蒋芦荻,张燕玲. 支持向量机在中药神经毒性成分筛查中的应用[J]. 中国中药杂志,2014,39(17):3330.
[15] Qiao L S,He Y S,Huo X Q,et al. Construction and evaluation of merged pharmacophore based on peroxisome proliferator receptor-alpha agonists[J]. Chin J Chem Physics,2016,29(4):508.
[16] 鄭春松,叶蕻芝,刘献祥,等. 海桐皮汤治疗骨性关节炎的化学空间及多靶点效应分析[J]. 中国临床药理学与治疗学,2009,14(1):67.
[17] 钟周,周鸿图,胡志希,等. 140味降脂中药治疗高脂血症的用药规律分析[J]. 湖南中医药大学学报,2015,35(1):64.
[18] Dhoke G V,Gangwal R P,Sangamwar A T. A combined ligand and structure based approach to design potent PPAR-alpha agonists[J]. J Mol Struct,2012,1028(28):22.
[19] 孙欣峰,吴立明,郝芬兰.降脂中药的研究现状及展望[J].中国中医药信息杂志,2001,8(1):25.
[20] 苏磊,姜艳艳,刘斌.《中国药典》收录的植物类中药中含有的寡肽类成分[J].中国中药杂志,2016,41(16):2943.
[21] 唐粉芳,郭豫,张静,等.灵芝菌丝体降脂作用的实验研究[J].食品科学,2003,24(4):145.
[22] 王亚东,王海玉,张桂霞,等. 三七和灵芝孢子粉提取物对高血脂模型大鼠降血脂作用的实验研究[J]. 实用预防医学,2006,13(6):1452.
[23] 雷晓林,刘伟,王瑞丞.灵芝三七降脂片对高脂血症大鼠降血脂作用的实验研究[J].中国实用医药,2009,4(16):24.
[24] 陈锐娥,申东艳,李鹏,等.中药药对的系统研究(Ⅴ)——丹参三七药对研究[J].世界科学技术——中医药现代化,2012,14(2):1342.
[25] 罗颖颖,陈兰英,龚琴,等.冠心丹参片对高脂大鼠球囊损伤术后血管内膜增生的影响[J]. 中国实验方剂学杂志,2011(23):203.
[26] 佘奕钿.丹七汤治疗痰瘀互结型血脂异常的临床观察[D]. 广州:广州中医药大学,2010.
[责任编辑 张宁宁]
