宁夏枸杞内生菌的抗菌和抗肿瘤活性研究
2017-06-22代金霞杜晓宁
代金霞+杜晓宁


[摘要] 为筛选具有抗菌抗肿瘤活性的枸杞内生菌资源,对分离自宁夏枸杞的10株内生菌发酵液的抑菌活性和体外细胞毒活性进行检测,通过ITS 和16S rDNA序列分析对菌株进行了分子鉴定。结果表明,5株内生真菌对供试病原菌都未表现出抑制活性,放线菌AL6对3种病原真菌都有一定的抑制作用,而AL5仅对金黄色葡萄球菌有较强抑制活性。但内生真菌的抗肿瘤活性明显强于放线菌。当发酵液浓度为0.2 g·L-1时,有4株内生真菌至少对1种肿瘤细胞的抑制率高于50%。序列分析表明,5株内生真菌隶属于曲霉属、青霉属和翘孢霉属。5株内生放线菌隶属于链霉菌属、微球菌属和拟诺卡氏菌属。曲霉属菌株FL1对A549和HeLa细胞的抑制活性都较强,其IC50分别为0.022,0.028 g·L-1,值得进一步研究。
[关键词] 枸杞;内生菌;抑菌活性;抗肿瘤活性
[Abstract] The antimicrobial activity and cytotoxicity in vitro of the fermentation broth of 10 endophytic strains isolated from Lycium barbarum were determined to screen high activity endophytic strains. Sequences analysis of ITS and 16S rDNA was used for molecular identification of the strains. The results showed that 5 endophytic fungi had no inhibitory activity against the tested pathogens. Endophytic actinomycete strain AL6 had a certain inhibitory effect on 3 kinds of pathogenic fungi,and strain AL5 only had strong inhibitory activity against Staphylococcus aureus. However,the anti-tumor activity of endophytic fungi was significantly higher than that of actinomycetes. Four endophytic fungi strains exhibited the growth inhibition rate of above 50% against at least one of the tested tumor cells when the concentration of fermentation broth was 0.2 g·L-1. Sequences analysis showed that 5 endophytic fungi strains belonged to genus Aspergillus,Penicillium and Emericella,and the 5 endophytic actinomycetes strains belonged to genus Aspergillus,Penicillium and Emericella. Aspergillus strain FL1 had stronger inhibitory activity against A549 and HeLa cells,and the IC50 values were 0.022,0.028 g·L-1,respectively,which was worthy of further study.
[Key words] Lycium barbarum;endophytes;anti-microbial activities;anti-tumor activities
內生菌(endophyte)是指一类在其部分或全部生活史中存活于健康植物组织内部,而不使宿主植物表现出明显感染症状的微生物[1]。植物内生菌在植物微生态系统中,与宿主建立了和谐的联合关系,不仅能够参与植物次生代谢及成分的转化合成,而且还能够独立产生丰富的次生代谢产物,是天然产物的重要来源[2]。药用植物内生菌次生代谢产物含有与宿主植物相同或相似的药用活性成分,包括抗肿瘤、抗菌、抗炎症、免疫调节、降糖等天然化合物[3]。直到现在人们已发现微生物的代谢产物中有60余种药理作用[4]。尤其是近10年来关于微生物代谢产物的研究越来越受到人们的重视,并且也取得了极为惊人的研究成果。目前药用植物内生菌已成为人们寻找新型药物的重要来源。内生菌代谢产物已作为抗癌药物、抑菌剂、植物激素、杀虫剂、抗氧化剂等服务于人类[5-6]。
枸杞Lycium barbarum L.为茄科多年生落叶小灌木,花、果、叶、根皮均可入药,有很高的营养价值和药用保健功效,不仅是我国传统的药用植物,也是重要的经济资源。宁夏产枸杞因其品质优良成为全国首推的药用枸杞,被《中国药典》收录为大宗道地性中药材。而内生菌与宿主植物在长期共进化过程中形成了稳定的互利共生关系,次生代谢产物是这种关系的物质基础[7]。目前对于枸杞内生菌的相关研究极少,其代谢产物是否具备与宿主植物相同或相似的活性成分,是否具有潜在的药用价值尚未可知。本研究拟以前期分离自宁夏枸杞的5株内生真菌和5株内生放线菌为供试菌株,以5种病原菌为指示菌对菌株的抑菌活性进行测定,以2种肿瘤细胞为指示细胞对菌株的体外细胞毒活性进行检测,筛选具有抗菌抗肿瘤活性的菌株,旨在了解枸杞内生菌的生物学特性及其未知的药理学作用,为开发枸杞内生菌资源、获得能够产生药用功能性成分的内生菌代谢产物提供基础资料。
1 材料
1.1 内生菌
分离自宁夏枸杞的5株内生真菌和5株内生放线菌。其中内生真菌FL1,FL2,FL6和FL9分离自枸杞嫩叶,FR4B分离自枸杞根皮;内生放线菌AF16分离自枸杞花,AL1B,AL3,AL5,AL6分离自枸杞嫩叶。
1.2 致病菌
动物病原细菌包括大肠杆菌Escherichia coli和金黄色葡萄球菌Staphylococcus aureus;植物病原真菌包括玉米大斑病菌Exserohilum turcica、小麦赤霉病菌Fusarium graminearum和番茄炭疽病菌Colletotrichum nigrum,由宁夏大学生命科学学院和农学院保存。
1.3 细胞株
肿瘤细胞株包括人宫颈癌细胞株HeLa和人肺腺癌细胞株A549,以正常细胞人胚肺成纤维细胞株MRC-5为对照。
1.4 试剂
胎牛血清(北京全式金生物有限公司)、二甲基亚砜 (DMSO,美国Sigma公司)、1640培养基(美国,Hyclone 公司)、细胞完全培养基(1640培养基:胎牛血清= 9∶1);MTT(噻唑蓝)溶液:称取100 mg MTT粉末,溶于20 mL PBS溶液中,用0.22 μm微孔滤膜过滤后分装在5个2 mL的无菌离心管中,封口膜封口,-20 ℃避光保存。
2 方法
2.1 抑菌活性检测
将保存的枸杞内生菌、指示菌分别接种于NA、高氏I号和PDA平板上进行活化后,挑取单菌落或菌丝接种于250 mL相应的液体培养基中,在28 ℃,120 r·min-1条件下震荡培养3~7 d,将菌悬液在8 000 r·min-1离心 5 min,取上清液备用。
采用抑菌圈法对菌株的抑菌活性进行检测。取200 μL指示细菌和真菌发酵液分别注入NA和PDA平板中,用灭菌的涂布棒均匀涂布于平板上,干燥后用打孔器在培养基表面均匀打3~4个直径为6.0 mm的孔,取80 μL供试内生菌的发酵上清液接于孔内,每皿接2~3株,分别以灭菌的PDA和高氏I号培养液为阴性对照,每组实验设置3次重复。于28 ℃培养3~7 d观察并测量抑菌圈直径与菌落直径的比值(D/d)。
2.2 抗肿瘤活性测定
将供试菌株发酵液经冻融、匀浆后,8 000 r·min-1離心 10 min,上清液用 0.22 μm 微孔滤膜过滤除菌,经减压浓缩成膏状。分别称取0.2 g膏状发酵产物,用PBS缓冲液配置成20 g·L-1的母液,用0.22 μm微孔滤膜过滤,得到无菌备用液。用RPMI-1640基本培养基稀释备用液至0.2 g·L-1(内生真菌)和2.0 g·L-1(内生放线菌),4 ℃冰箱保存备用。
采用体外细胞毒测定的MTT法和CCK-8法测定菌株发酵液的抗肿瘤活性。把培养好的HeLa,A549,MRC-5 细胞用完全培养基制成单细胞悬浮液,血球计数板计数,按5万个/mL接种100 μL于96孔板,置CO2培养箱中37 ℃培养12 h,待贴壁后吸掉原有培养液,每孔加入100 μL含0.2 g·L-1内生真菌或2.0 g·L-1内生放线菌发酵液的完全培养基,继续培养48 h。以灭菌的完全培养基处理为阴性对照,每处理3次重复。
2.2.1 MTT法 上述处理后每孔加入MTT溶液(5 g·L-1) 20 μL,继续培养4 h后,终止培养。小心吸出孔内培养液,每孔加入150 μL DMSO后震荡10~15 min,使蓝色结晶完全溶解。用酶标仪测定波长490 nm处的吸光值A490。
2.2.2 CCK-8法 每孔加入CCK-8 Solution 10 μL,在培养箱继续培养2.5 h后终止培养。用酶标仪测定450 nm的吸光度A450。用以下公式计算样品对肿瘤细胞生长的抑制率。用改良的寇氏法计算IC50。
2.3 发酵液梯度活性测定
对筛选出的具有较强抗肿瘤活性的菌株进行浓度梯度活性测定。将保存的无菌备用液用完全培养基分别配置成浓度梯度为0.5,0.4,0.3,0.2,0.1 g·L-1的待测液,采用CCK-8法进行抗肿瘤梯度活性试验。分别于处理 24,48 h时用倒置显微镜观察细胞株形态变化。用改良的寇氏法计算样品的IC50(即抑制率为50%时的样品浓度)。用IBM SPSS Statistics 19软件进行数据分析。
2.4 菌株的分子鉴定
提取各菌株基因组DNA,采用引物对ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增内生真菌的ITS序列,用引物对27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)扩增内细菌的16S rDNA序列。扩增产物经1%琼脂糖凝胶电泳检测合格后,委托上海生工生物工程技术服务有限公司进行测序。测序结果在GenBank中进行blast同源性搜索,用MEGA5.0构建系统发育树,确定菌株的分类地位。
3 结果与分析
3.1 枸杞内生菌的抑菌活性
抑菌实验结果表明,5株枸杞内生真菌对所选病原菌均未表现出抑制活性。而内生放线菌中,菌株AL6对番茄炭疽病菌、玉米大斑病菌、小麦赤霉病菌的生长都有一定抑制作用,抑菌圈与菌落直径比值(D/d)分别为2.31,2.45,3.92,但对2种动物病原细菌没有抑制作用;菌株AL5仅对金黄色葡萄球菌表现出较强的抑制活性,D/d达到3.98;其余菌株对各病原菌均无抑制活性(图1)。
3.2 枸杞内生菌的抗肿瘤活性
本研究采用 MTT法与CCK-8法,以肿瘤细胞HeLa和A549为指示细胞株,对10株枸杞内生菌发酵物的体外细胞毒活性进行分析。2种方法的测定结果基本一致,而CCK-8法操作更为简便,且灵敏度略强。当内生真菌发酵液浓度为0.2 g·L-1时,有4株内生真菌对2种肿瘤细胞的生长均具有抑制作用(表1)。其中菌株FL1和FL6对HeLa和A549的抑制活性都较强,抑制率分别达到78.8%,89.2%和65.7%,55.7%;菌株FL2对HeLa细胞有明显的抑制作用,抑制率为71.2%,而FL9则对A549细胞的生长抑制率为51.8%;FR4B对HeLa细胞的生长没有抑制作用,对A549的抑制作用也不明显。
内生放线菌发酵液浓度为2.0 g·L-1时,仅菌株AL6和AL5对HeLa细胞、AL1B对A549有一定的抑制作用,其余菌株对供试肿瘤细胞均未表现出抑制活性。总体上看,枸杞内生真菌对供试肿瘤细胞的抑制活性明显强于内生放线菌。
3.3 内生菌发酵液梯度活性
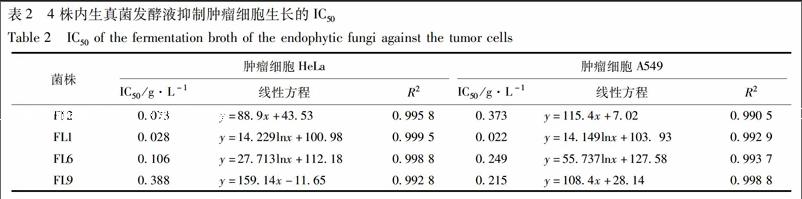
根据各菌株的抗肿瘤活性结果,选取对2种肿瘤细胞均具有抑制活性的4株内生真菌进行梯度活性试验。结果表明内生真菌发酵液浓度与其对肿瘤细胞的抑制活性成线性正相关关系,即随着浓度的不断增大,对肿瘤细胞的抑制活性也不断增强(图2)。4株内生真菌对HeLa细胞抑制浓度的IC50为0.028~0.388 g·L-1,抑制活性表现为FL1>FL2>FL6>FL9。对肿瘤细胞A549抑制浓度的IC50为0.022~0.373 g·L-1,抑制活性表现为FL1>FL9>FL6>FL2;其中菌株FL1对2株肿瘤细胞的抑制活性均最强,其IC50分别为0.022,0.028 g·L-1(表2)。
比较细胞毒活性最强的菌株FL1对肿瘤细胞A549,HeLa和正常细胞MRC-5生长的影响。在各细胞贴壁12 h后,用0.5 g·L-1的 FL1代谢产物进行处理,用完全培养基处理做阴性对照,分别于处理24,48 h后观察各细胞形态。结果表明在处理24 h时,实验组肿瘤细胞出现明显凋亡现象,细胞核变大,细胞形态明显分化,细胞变薄,颜色变深,数目没有增多,而对照组細胞形态正常,数量增多。处理48 h后,实验组细胞形态进一步异化,HeLa细胞出现明显的凋亡现象,而A549的细胞核明显变圆变大,细胞形态明显分化变形,出现凋亡迹象,对照组细胞形态没有明显变化,数量进一步增多。而相同浓度的代谢产物对正常细胞MRC-5的形态与数量均没有明显影响(图3)。
3.4 菌株的鉴定
通过序列测定,获得5株枸杞内生真菌约500 bp左右ITS序列,5株放线菌约1 400 bp的16S rDNA序列。系统发育分析表明(图4),内生真菌FL1,FL6,FL9隶属于曲霉属Aspergillus,分别与该属A. fumigatus,A. flavus和A. tubingensis聚为一支;菌株FR4B属于青霉属Penicillium,与P. chrysogenum的序列相似性为99%;FL2则与翘孢霉Emericella quadrilineata聚为一支。内生放线菌AL5,AL6和AL1B隶属于链霉菌属Streptomyces,与链霉菌属参比菌株Streptomyces sp.,S. lividans 和S. badius 以99%~100%的序列相似性聚为一支;EAF16和AL3分别隶属于微球菌属Micrococcus和拟诺卡氏菌属Nocardiopsis属,与二者有着高的序列相似性。
4 讨论
内生菌在与宿主植物长期的协同进化过程中形成了密切的关系,而维持这种关系的物质基础是内生菌产生的或由其诱导宿主植物合成的次生代谢产物。内生菌次生代谢产物的研究对于阐明生物进化的机制,加深对生物体之间竞争与生存关系的了解以及丰富微生物多样性均具有重要的意义。目前对植物内生菌的研究显示,约有30%的内生真菌能够产生具有抗菌活性的物质,对多种病原菌具有广谱或专一抗性[8]。本研究对枸杞内生菌的抑菌活性结果表明,供试的5株内生真菌对供试病原菌均未表现出抑制活性,仅有2株链霉菌属菌株对部分病原菌的生长有一定抑制作用,但抑菌活性不强。内生菌代谢产物的活性因菌株不同而有很大差异,即使同属的菌株其活性也大不相同,如链霉菌属的AL5,AL6和AL1B,菌株AL6对3种病原真菌都表现出抑制作用,菌株AL5仅对金黄色葡萄球菌有抑制活性,而AL1B则对所有病原菌都未表现出抑制活性。苏林涓等[9]、张志斌等[10]分离自茶树和野生稻的链霉菌对许多病原菌的生长都具有较强的抑制作用,表现出广谱的抑菌活性。王营等[11]从广藿香中分离的曲霉属菌株具有广谱抗菌活性;而刘雷[12]分离自川麦冬的曲霉属菌株仅对白色念珠菌具有抑制活性,对其他动物病原细菌则无抑制作用;这些研究结果表明,植物内生菌对不同病原菌的抑制作用既表现出一定的选择性,也具有专一性。
抗肿瘤实验结果表明,枸杞内生真菌具有较强的细胞毒活性,对肿瘤细胞的抑制效果明显强于放线菌。尤其是曲霉属菌株FL1,对2种供试肿瘤细胞都表现出强的细胞毒活性。王胤等[13]的研究发现,烟曲霉对人肺癌A549细胞的生长有明显的抑制活性,而且活性成分主要存在于胞内;在本研究中曲霉属菌株FL1的胞外次级代谢产物中具有抗肿瘤活性成分,这与陈传文等[14]的研究结果一致。这表明不同药材基因型和同种异质对内生菌的功能具有一定的影响。内生菌次生代谢产物的多样性可导致其代谢功能的差异,也是内生菌生物学作用多样性的根本原因。许多内生菌代谢产物中所含的黄酮类化合物,能够产生强的细胞毒活性,对肿瘤细胞的生长有明显的抑制作用[15-16]。而黄酮类物质也是宁夏枸杞的主要活性成分之一,那么,本研究筛选出的对2种肿瘤细胞具有强抑制活性的内生真菌FL1,其活性成分是否与其宿主的代谢产物黄酮类相关,还值得进一步研究。
[参考文献]
[1] Hallmann J,Quadt-Hallmann A,Mahaffee W F. Bacterial endophytes in agricultural crops[J].Can J Microbiol,1997,43(10): 895.
[2] Verma V C,Kharwar R N,Strobel G A. Chemical and functional diversity of natural products from plant associated endophytic fungi[J]. Nat Prod Commun,2009,4(11):1511.
[3] Hazalin N A,Ramasamy K,Lim S M,et al. Induction of apoptosis against cancer cell lines by four ascomycetes from Malaysian rainforest [J]. Phytomedicine,2012,19(7): 609.
[4] 张玲琪,王海昆,邵华,等. 美登木内生真菌产抗癌物质球毛壳甲素的分离及鉴定[J].中国药学杂志,2002,37(3): 172.
[5] 曼琼,邓毅,杨志军,等. 甘草内生菌菌株对痰浊阻肺型大鼠干预作用的对比研究[J]. 中国现代应用药学,2017,34(2): 161.
[6] 徐慧超,孙婷媛,翟李欣,等. 产甘草次酸内生真菌RE7的鉴定及抑菌活性研究[J]. 中国新药杂志,2016(1): 102.
[7] Wang L W,Zhang Y L,Lin F C,et al. Natural products with antitumor activity from endophytic fungi [J]. Mini Rev Med Chem,2011,11(12):1056.
[8] 杨明俊,李娟,,薛鸿燕,等. 水仙内生真菌的分离及抑菌和抗肿瘤活性研究[J]. 中草药,2014,45(6): 819.
[9] 苏林涓,陈丹,杨民和. 一株茶树内生放线菌的分离鉴定及抗菌活性测定[J]. 福建师范大学学报:自然科学版,2012,28(3):94.
[10] 张志斌,邓映明,熊瑶瑶,等. 东乡野生稻内生放线菌分离及菌株S123次级代谢产物分析[J]. 微生物学通报,2015,42(9): 1662.
[11] 王营,李浩华,谭国慧,等. 广藿香内生真菌类群分析及其抗菌活性研究[J]. 中国中药杂志,2017,42(4):657.
[12] 刘雷,潘峰,杨远兵,等. 川麦冬内生真菌分离和鉴定及抑菌活性初步研究[J]. 中草药,2016,47 (8):1382.
[13] 王胤. 烟曲霉次級代谢产物抗菌与抗肿瘤活性研究[J]. 化学与生物工程,2011,28(4): 70.
[14] 陈传文,孙前光,朱军,等. 三种药用植物内生菌的分离及其抗肿瘤活性菌株的筛选[J]. 微生物学通报,2010,37(10): 1462.
[15] Wagenaar M M,Clardy J D. New antibiotic and cytotoxic dimers produced by the fungus Phomopsis longicolla isolated from an endangered mint[J]. J Nat Prod,2001,64: 1006.
[16] 阮丽军,尚新艳,戈梅,等. 植物内生真菌HCCB00189代谢产物研究[J]. 中国新药杂志,2007,16(1):52.
[责任编辑 孔晶晶]
