CD123单抗修饰的载丹参酮ⅡA免疫脂质体的制备及其体外评价
2017-06-22王银刘芙蓉向虹霖卿红陈晨毛声俊
王银+刘芙蓉+向虹霖+卿红+陈晨+毛声俊+李慧


[摘要] 研制CD123单抗修饰的载丹参酮ⅡA免疫脂质体(CD123-TanⅡA-ILP),以期实现对白血病细胞的主动靶向给药。采用正交试验法优化脂质体处方,薄膜分散-探头超声法制备载丹参酮ⅡA长循环脂质体(TanⅡA-LP),以后插入法得到CD123-TanⅡA-ILP。流式细胞术检测NB4细胞对脂质体的摄取率,改良MTT法检测CD123-TanⅡA-ILP对NB4细胞的增殖抑制作用。研究结果表明,NB4细胞对CD123单抗修饰的免疫脂质体的摄取显著高于对游离药物及其载药脂质体的摄取;TanⅡA,TanⅡA-LP和CD123-TanⅡA-ILP与NB4细胞共培养48 h,其IC50分别为20.87,11.71,7.17 μmol·L-1。CD123-ILP有望为AML的治疗提供新的靶向给药策略。
[关键词] 丹参酮ⅡA;CD123;免疫脂质体;NB4
[Abstract] In the study,we developed a novel formulation,CD123 mono-antibody (mAb) modified tanshinone ⅡAloaded immunoliposome (CD123-TanⅡA-ILP) to achieve the targeted drug delivery for leukemia cells. Orthogonal test was used to optimize liposome preparation,and the TanⅡA-loaded PEGylated liposomes (TanⅡA-LP) of S100PC-Chol-(mPEG2000-DSPE)-TanⅡAat 19∶5∶1∶1 molar ratio were prepared by the thin film hydration-probe ultrasonic method. A post-insertion method was applied to prepare CD123-TanⅡA-ILP via thiolated mAb conjugated to the terminal of maleimide-PEG2000-DSPE. The cellular uptake assay was measured by flow cytometry,and the inhibitory effect of CD123-TanⅡA-ILP on NB4 cells proliferation was tested by using MTT assay. The results of cellular uptake assay showed that CD123-ILP could significantly increase the drug uptake of NB4 cells as compared with free drugs and LP. The IC50 values at 48 h incubation were 20.87,11.71,7.17 μmol·L-1 respectively for TanⅡA,TanⅡA-LP and CD123-TanⅡA-ILP. CD123-ILP demonstrated a potential and promising targeted drug delivery strategy for acute myelogenous leukemia (AML) treatment.
[Key words] tanshinoneⅡA;CD123;immunoliposome;NB4
丹參酮ⅡA(tanshinoneⅡA,TanⅡA)是中药丹参根中的主要脂溶性成分,其具有抗炎、抗菌、抗氧化、抗肿瘤等多种药理活性[1]。有研究表明,丹参酮ⅡA可诱导肿瘤细胞分化、凋亡,抑制肿瘤的生长、增殖和侵袭性转移[2],其对白血病细胞株如K562[3],NB4[4],HL-60[5]等具有增殖抑制与促凋亡作用。
免疫脂质体给药系统是当前肿瘤靶向治疗领域的研究热点之一。CD123系白介素-3受体(IL-3R)α链,为特异性高表达于急性髓系白血病(acute myeloid leukemia,AML)克隆性细胞及其干细胞表面的抗原,其可促进肿瘤细胞增殖、分化,并抑制细胞凋亡[6]。研究表明,CD123阳性表达率与AML患者的生存期呈负相关,提示不良预后,故CD123可作为预测复发率和生存率的评价指标[7-8]。由此可见,CD123为改善甚至根治AML提供了潜在的治疗靶点[9]。据此,本研究首次尝试研制CD123单抗(monoclonal antibody,mAb)修饰的载丹参酮Ⅱ免疫脂质体(CD123-TanⅡA-ILP),以期为治疗AML提供新的靶向给药策略。
1 材料
PHS-3C pH计(上海雷磁仪器厂);R-201型旋转蒸发仪(上海申顺生物科技有限公司);DZF-6050型真空干燥箱(上海精宏实验设备有限公司);SK5200H型超声仪(上海科导超声仪器有限公司);JY88-Ⅱ型超声波细胞粉碎机(宁波新芝科器研究所);微孔板恒温振荡器(杭州奥盛仪器有限公司);Zetasizer Nano-ZS90粒度分析仪(英国Malvern);安捷伦1100液相色谱仪(美国 Agilent);IF-1型脂质体挤出器、聚碳酸酯膜(100 nm)(加拿大Avestin);CO2细胞培养箱(日本SANYO);CFM-500型倒置荧光显微镜(上海长方光学仪器厂);Model-680酶标仪(美国BIO-RAD);TDL-50B型低速台式离心机(上海申安医疗器械厂);FACSCalibur型流式细胞仪(美国BD Biosciences)。
TanⅡA(西安天丰生物科技有限公司,纯度≥99%);注射用大豆磷脂(S100PC)、mPEG2000-DSPE(德国 Lipoid);Mal-PEG2000-DSPE(美国Avanti Polar Lipids);胆固醇(Chol)(上海惠世生化试剂有限公司);BCA(Bicinchonininc acid)蛋白定量试剂盒、青霉素-链霉素溶液(江苏凯基生物);3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯(SPDP)(美国Pharmacia Biotech);二硫苏糖醇(DTT)、Ellman′s reagent(DTNB)、四甲基偶氮唑蓝(MTT)、透析袋(MWCO,7000)(美国Sigma-Aldrich);葡聚糖凝胶Sephadex-G50(瑞典Pharmacia);交联琼脂糖凝胶Sepharose CL-4B(上海源叶生物);RPMI-1640培养液、胎牛血清(美国Invitrogen Gibco);鼠抗人CD123单克隆抗体(Clone 7G3)、鼠抗人CD123-APC、鼠IgG2a-APC(美国Becton Dickinson );AML细胞株NB4(American Type Culture Collection);氯仿、甲醇、乙二胺四乙酸(EDTA)、二甲基亚砜(DMSO)为分析纯,水为超纯水。
2 方法与结果
2.1 TanⅡA-LP的处方优化与制备
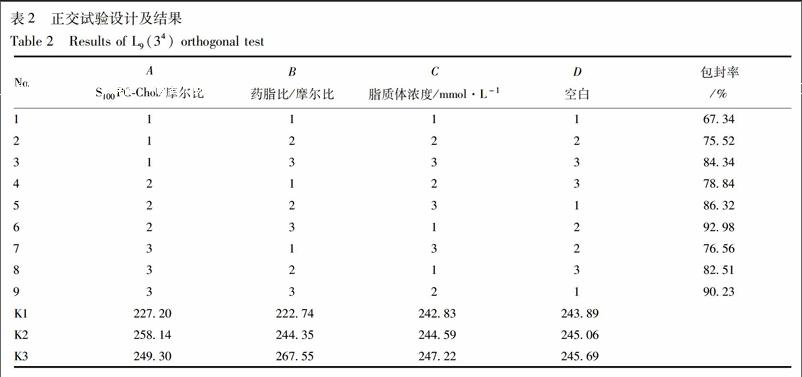
2.1.1 正交试验设计筛选处方 在单因素试验的基础上,以包封率为指标,选取S100PC与Chol的摩尔比(A)、药脂比(B)、脂质体浓度(C)作为考察因素,每个因素选取3个水平,见表1。
2.1.2 TanⅡA-LP的处方优选 采用薄膜分散-探头超声法制备TanⅡA-LP[10]。分别称取适量S100PC,Chol,mPEG2000-DSPE,TanⅡA于混合溶液(氯仿-甲醇 2∶1)中,充分溶解后将其移入25 mL圆底烧瓶中,于37 ℃下减压旋蒸15 min,除去有机溶剂,使成均匀脂膜,真空干燥4 h;加入适量磷酸盐缓冲液(PBS,pH 7.4)于上述圆底烧瓶中,超声水化脱膜,于37 ℃条件下恒温振荡(200 r·min-1)30 min,置冰水浴中探头超声100 s,整粒;续用脂质体挤出器(聚碳酸酯膜100 nm)挤出TanⅡA-LP,重复20次,制得粒径均一的载TanⅡA长循环脂质体混悬液。取TanⅡA-LP上样Sephadex-G50柱,以PBS进行洗脱,除去TanⅡA游离药物。按不同处方制备的载药脂质体,实验结果见表2。药脂比是影响TanⅡA-LP包封率的主要因素,其次是S100PC与Chol的摩尔比,脂质体浓度对包封率的影响最小。筛选的最佳处方确定为A2B3C3,即S100PC-Chol 4∶1;药脂比为1∶25;脂质体浓度为12 mmol·L-1。按優化后的脂质体处方连续制备3批TanⅡA-LP,其中S100PC-Chol-(mPEG2000-DSPE)-Tan ⅡA =19∶5∶1∶1,测得其包封率分别为89.2%,92.9%,91.4%。
2.2 CD123-TanⅡA-ILP的制备
首先将CD123 mAb巯基化,选用SPDP作为抗体巯基化试剂,DTT作为还原剂[11]。用DMSO配制SPDP溶液(25 mmol·L-1),用醋酸盐缓冲液(0.2 mmol·L-1,pH 4.5,含5 mmol·L-1 EDTA)配制DTT溶液(50 mmol·L-1)。按CD123 mAb-SPDP=1∶10(摩尔比)混合,于室温下缓慢振荡1 h,制得CD123 mAb-PDP。透析法除去过量SPDP,醋酸盐缓冲液(pH 4.5)为透析液。按(CD123 mAb-PDP)-DTT 1∶10(摩尔比)混合,于室温充氮气保护下反应30 min,透析除去DTT,透析液为PBS(含5 mmol·L-1 EDTA),最终制得巯基化CD123 mAb。采用Ellmans法测定巯基化CD123抗体中的巯基量[12],结果显示[SH]/[CD123]≈5,即表明每个CD123 mAb分子可生成约5个巯基。量取适量Mal-PEG2000-DSPE溶液(溶于氯仿)于25 mL圆底烧瓶中,60 ℃下真空旋蒸1 h形成薄膜。将巯基化CD123 mAb加入上述薄膜中[CD123 mAb-(Mal-PEG2000-DSPE) 1∶10(摩尔比)],超声脱膜后封口置于微孔板恒温振荡器中,于25 ℃,200 r·min-1条件下振荡12 h。CD123 mAb上的巯基与Mal-PEG2000-DSPE中的马来酰亚胺基团中的双键发生加成反应,形成CD123-PEG2000-DSPE胶束。按CD123 mAb-S100PC 1∶400(摩尔比)向上述胶束中加入相应体积的TanⅡA-LP,于25 ℃,200 r·min-1振荡8 h,过凝胶CL-4B柱,以PBS为洗脱液,除去游离CD123-PEG2000-DSPE,即得CD123-TanⅡA-ILP。采用BCA蛋白定量试剂盒测定抗体连接率和抗体结合效率,具体操作按BCA试剂盒操作说明进行。根据7G3的相对分子质量约150 kDa,每个脂质体包含磷脂分子数约8万,可计算脂质体表面连接的抗体的密度[13]。计算公式如下: CD123 mAb连接率=(ILP中mAb含量/mAb加入量)×100%;CD123 mAb密度=[mAb摩尔量/mAb相对分子质量(150 kDa)]/S100PC摩尔量×8万。计算结果显示,CD123 mAb的连接率在45%~60%,CD123 mAb密度即每个脂质体上抗体个数约48个。
2.3 CD123-TanⅡA-ILP的药剂学特性表征
2.3.1 形态、粒径及Zeta电位的测定 采用磷钨酸负染,透射电镜法观察TanⅡA-LP,CD123-TanⅡA-ILP的形态,结果见图1。分别取200 μL TanⅡA-LP及CD123-TanⅡA-ILP,用PBS稀释10倍后,采用激光粒度分析仪(Zetasizer Nano-ZS90)测定脂质体的粒径、多分散系数(PDI)和 Zeta 电位。测得TanⅡA-LP粒径为(105.3±2.5) nm,PDI为0.12±0.04,Zeta电位为(-24.5±1.2) mv;CD123-TanⅡA-ILP的粒径为(113.3±3.5) nm,PDI为0.16±0.05,Zeta电位为(-34.8±1.8) mv。
2.3.2 包封率与载药量的测定 采用反相高效液相色谱法(RP-HPLC)测定脂质体的包封率和载药量。取过柱后的TanⅡA-LP和CD123-TanⅡA-ILP各100 μL,用PBS稀释至1 mL,加入1 mL无水乙醇,用力振摇破坏脂质体,静置10 min,使脂质体内包载的TanⅡA充分溶解,溶液经0.22 μm滤膜过滤,取滤液10 μL进样HPLC,色谱条件见参考文献[14]。按上述方法操作,测得脂质体内的药物量MTan。另取含相同脂质体量的未过柱分离的脂质体溶液同法操作,测得药物总量MTotal。包封率(EE)=(MTan/MTotal)×100%;载药量=MTan/MLP×100%;MLP为载药脂质体的总质量。根据上述计算公式,测得TanⅡA-LP和CD123-TanⅡA-ILP的包封率分别为(91.2±1.5)%,(88.6±2.1)%(n=3);载药量为(1.36±0.02)%,(1.32±0.03)%。
2.3.3 脂质体稳定性考察 将TanⅡA-LP与CD123-TanⅡA-ILP在4 ℃条件下保存,分别测定其在不同时间0,2,4,6,8,10,20,30 d的粒径和药物渗漏率,初步评价其物理稳定性。于预先设定的时间点取样200 μL脂质体混悬液,过Sephadex-G50柱,除去游离TanⅡA。按2.3.2项下方法测定药物含量,计算药物渗漏率。结果显示,放置10 d后制备的脂质体中药物渗漏率均不超过3%,30 d后脂质体中药物渗漏率均不超过5%;粒径变化不显著(P>0.05);TanⅡA-LP和CD123-TanⅡA-ILP溶液在各时间点均未见分层及凝聚现象,30 d时仍为均匀混悬液。
另外,考察TanⅡA-LP和CD123-TanⅡA-ILP在PBS(pH 7.4)缓冲液中的稳定性。分别取1 mL不同脂质体制剂加入9 mL PBS,混合均匀,置于37 ℃恒温箱中,在不同时间点0,4,8,12 h取1 mL混合液测定粒径、PDI考察其稳定性,见表3。由结果可知脂质体在37 ℃的PBS中,随时间推移,粒径和PDI都略有上升,但变化不显著(P>0.05)。由于温度较高,TanⅡA随时间变化缓慢释放,没有突释现象。
2.4 NB4细胞对CD123-ILP的摄取
NB4细胞为AML细胞FAB-M3型,该类AML亚型患者的白血病细胞上高表达CD123,100%的病人呈阳性表达(N=9)[15],据此作者确定选用NB4细胞作为CD123-ILP的靶细胞。为便于观察与定量,在此项研究中作者选用荧光物质香豆素-6(coumarin-6,Cou)为模型药物,制备载香豆素-6脂质体(Cou-LP)与载香豆素-6免疫脂质体(CD123-Cou-ILP),采用流式细胞术检测NB4细胞对Cou-LP,CD123-Cou-ILP的摄取差异。上述2种脂质体的制备方法按2.1.2项操作。
收集对数期生长的NB4细胞,调整细胞密度至1×1060个/mL,按每孔加入1 mL细胞接种于12孔板中。设置游离Cou,Cou-LP,CD123-Cou-ILP 3组,每组3个复孔。各组均稀释至相同药物浓度,每孔分别加入供试样品溶液200 μL,37 ℃下孵育1 h,空白组加入等量RPMI-1640培养基。收集细胞,用预冷的PBS洗涤3次,除去未与细胞结合的药物,加入200 μL PBS重悬,移置流式管中,混匀,上机检测。实验结果见图2。由各组细胞中的药物平均荧光强度(MFI)可知,NB4细胞对CD123-Cou-ILP的摄取量分别为游离Cou,Cou-LP的3.5,2倍(P<0.01),表明脂质体经CD123 mAb修饰后,可显著增加靶细胞对其的摄取,有利于增加NB4细胞内的药物浓度。
2.5 NB4细胞增殖抑制作用考察
由于NB4细胞是悬浮细胞,因此采用改良MTT法[16]测定游离TanⅡA,TanⅡA-LP和CD123-TanⅡA-ILP對其增殖抑制作用。TanⅡA用DMSO溶解,配制成30 mmol·L-1的储备液,用RPMI-1640培养液稀释至浓度分别为1.0,5.0,10.0,20.0,30.0 μmol·L-1,DMSO最终浓度小于0.1%(DMSO浓度小于0.1%时对细胞活力无影响)。TanⅡA-LP和CD123-TanⅡA-ILP分别用RPMI-1640培养液稀释至相同系列浓度,0.22 μm滤膜过滤除菌,备用。收集对数期生长的NB4细胞,调整细胞密度至1×1060个/mL,按每孔加100 μL细胞接种于96孔板中。分别设置空白对照组、游离TanⅡA组、TanⅡA-LP组和CD123-TanⅡA-ILP组。各实验组每孔分别加入20 μL不同浓度的药物,每组设3个复孔。将96孔板置于培养箱中培养48 h,每孔加入20 μL MTT溶液(5 g·L-1),继续培养4 h。培养结束后每孔加入100 μL十二烷基硫酸钠(SDS)三联溶解液,置于培养箱中过夜,直至生成的甲瓒结晶完全溶解,于酶标仪上测定波长570 nm(参考波长680 nm)处的吸光度A,计算细胞抑制率和半数抑制浓度(IC50)。每组试验均重复3次。不同制剂在系列TanⅡA浓度下的细胞抑制率见图3。通过SPSS 17.0软件计算TanⅡA,TanⅡA-LP和CD123-TanⅡA-ILP的IC50分别为20.87,11.71,7.17 μmol·L-1。由结果可知,与游离TanⅡA相比,各浓度下TanⅡA-LP和CD123-TanⅡA-ILP对NB4细胞的抑制率均有明显提高,其IC50较TanⅡA分别降低了1.8,2.9倍(P<0.05)。
2.6 统计学处理
实验均重复3次,数据结果通过SPSS 17.0软件回归分析,数值以±s表示,组间比较采用One way ANOVA检验,P<0.05为具有统计学差异。
3 讨论
近年来靶向至CD123阳性表达细胞的免疫治疗方法成为研究热点,如bsscFv[CD123×CD123]和[CD123×CD12]主要通過诱导机体自身的CD16+自然杀伤细胞和CD3+ T细胞对CD123+AML细胞产生细胞免疫效应[17-18]。此外,以CD123介导的嵌合抗原受体(chimeric antigen receptor,CAR)修饰T细胞为基础的肿瘤靶向免疫治疗,通过基因修饰获得可识别CD123受体的T细胞,进而发展成为提高T细胞靶向杀伤效果的个体化治疗方法[19]。然而,目前尚未见CD123 mAb修饰的微粒靶向给药系统的研究报道。因此,本研究首次尝试将CD123 mAb修饰于脂质体表面制备免疫脂质体,以期实现对CD123+AML细胞的主动靶向给药。由于TanⅡA是多药耐药蛋白Pgp的底物与抑制剂,Pgp的外排作用和首过效应使其口服利用度极低[20]。CD123 mAb修饰的载TanⅡA免疫脂质体可通过CD123抗体与其抗原的特异结合,将载药脂质体选择性靶向AML细胞,进而通过脂质体与胞膜的融合作用,将抗癌药物导入肿瘤细胞内发挥作用[21]。
本实验采用薄膜分散―探头超声法制备载TanⅡA长循环脂质体,其操作较为简单,适用于载脂溶性药物脂质体的制备。加入的mPEG2000-DSPE可增加脂质体的亲水性,减少脂质体间的聚集而增加其稳定性,其可避免RES系统对脂质体的吞噬,延长其血循环时间,从而有利于提高肿瘤靶向效率[22]。将抗体连接到脂质体表面的方法有几种[23],本研究首先利用抗体上的氨基与SPDP试剂反应,以DTT作为还原剂生成巯基,抗体上的巯基再与Mal-PEG2000-DSPE上的马来酰亚胺基团发生化学交联反应生成CD123-PEG2000-DSPE,其DSPE端因具有亲脂性,易于插入脂质体中而得到免疫脂质体,采用后插入法的优点在于抗体均连接在脂质体的表面,从而增加了抗体密度与可利用性。制备的TanⅡA-LP和CD123-TanⅡA-ILP粒径均在100 nm左右,免疫脂质体的粒径略有增加,这可能与CD123 mAb修饰有关。制备的脂质体在4 ℃条件下稳定性良好,药物渗漏率低;在37 ℃,pH 7.4 PBS中,粒径和PDI略有升高,药物缓慢释放。流式结果表明,NB4细胞对CD123-Cou-ILP的摄取显著增加,有利于提高NB4细胞内的药物浓度。对NB4细胞的药效学研究结果表明,CD123-TanⅡA-ILP可显著增强TanⅡA对AML细胞的增殖抑制作用,为其后续的体内抑癌研究奠定了实验基础。
综上,CD123-ILP 有望为AML提供新颖的主动靶向给药载体,也为该类疾病的治疗拓展了新的靶向给药策略。
[参考文献]
[1] 李筱筱,武雪玲,贾世亮,等.丹参酮ⅡA药理作用的研究进展[J]. 生物学杂志,2016(6):91.
[2] 闫俊,冯娟,杨雪,等. 丹参酮ⅡA的药理作用及疾病治疗的最新进展[J]. 实用药物与临床,2015(8):972.
[3] Jung J H,Kwon T R,Jeong S J,et al. Apoptosis induced by tanshinone IIA and cryptotanshinone is mediated by distinct JAK/STAT3/5 and SHP1/2 signaling in chronic myeloid leukemia K562 cells[J].Evid-Based Compl Alt,2013,2013:805639.
[4] Zhang K,Li J,Meng W,et al. Tanshinone IIA inhibits acute promyelocytic leukemia cell proliferation and induces their apoptosis in vivo[J]. Blood Cell Mol Dis,2016,56(1):46.
[5] 单卿卿,龚玉萍,郭勇,等. 六种中药提取物对白血病细胞株的体外抑制作用研究[J]. 四川大学学报:医学版,2012,43(3):362.
[6] Liu K,Zhu M,Huang Y,et al. CD123 and its potential clinical application in leukemias[J]. Life Sci,2015,122:59.
[7] Li X Q,Li J A,Du W,et al. Relevance of immunophenotypes to prognostic subgroups of age,WBC,platelet count,and cytogenetics in de novo acute myeloid leukemia[J]. Apmis,2011,119:76.
[8] Testa U,Pelosi E,Frankel A. CD123 is a membrane biomarker and a therapeutic target in hematologic malignancies[J]. Biomarker research,2014,2(1):4.
[9] Jin L,Lee E M,Ramshaw H S,et al. Monoclonal antibody-mediated targeting of CD123,IL-3 receptor alpha chain,eliminates human acute myeloid leukemic stem cells[J]. Cell Stem Cell,2009,5(1):31.
[10] 张兆颖,储婷,马伟从,等. 丹参酮ⅡA脂质体的制备及对HepG2/ADR细胞增殖的抑制作用[J]. 华西药学杂志,2014(1):33.
[11] Zhang L,Gao H G,Chen L F,et al. Tumor targeting of vincristine by mBAFF-modified PEG liposomes in B lymphoma cells[J]. Cancer Lett,2008,269(1):26.
[12] Fujimoto S,Mizuno R,Saito Y,et al. Quick measurement of protein sulfhydryls with Ellman′s reagent and with 4,4′-dithiodipyridine[J]. Heart Vessels,2004,19(1):19.
[13] Zhang J Y,Tang Y M,Shen H Q,et al. Targeting and internalization of sterically stabilized liposome modified with ZCH-4-2E8[J]. J Huazhong Univ Sci Technol,2009,29(3):273.
[14] 杨新. 用高效液相色谱法测定丹参药材中丹参酮ⅡA含量的最优测定条件分析[J]. 当代医药论丛,2014(1):156.
[15] Ehninger A,Kramer M,Rollig C,et al. Distribution and levels of cell surface expression of CD33 and CD123 in acute myeloid leukemia[J]. Blood Cancer J,2014,4:e218.
[16] 蒋艳,胡群,刘双又,等. 雷公藤、鹽酸小檗碱及柔红霉素在MOLT-4细胞中的药物作用及不同噻唑蓝法比较[J]. 实用儿科临床杂志,2005(7):684.
[17] Stein C,Kellner C,Kugler M,et al. Novel conjugates of single-chain Fv antibody fragments specific for stem cell antigen CD123 mediate potent death of acute myeloid leukaemia cells[J]. Brit J Haematol,2010,148(6): 879.
[18] Kuo S R,Wong L,Liu J S. Engineering a CD123xCD3 bispecific scFv immunofusion for the treatment of leukemia and elimination of leukemia stem cells[J]. Protein Eng Des Sel,2012,25(10): 561.
[19] Cheadle E J,Sheard V,Hombach A A,et al. Chimeric antigen receptors for T-cell based therapy[J]. Methods Mol Biol,2012,907:645.
[20] Yu X Y,Lin S G,Zhou Z W,et al. Role of P-glycoprotein in the intestinal absorption of tanshinone IIA,a major active ingredient in the root of Salvia miltiorrhiza Bunge[J]. Curr Drug Metab,2007,8(4): 325.
[21] Sapra P,Shor B. Monoclonal antibody-based therapies in cancer: advances and challenges[J]. Pharmacol Ther,2013,138(3):452.
[22] Wang R R,Xiao R Z,Zeng Z W,et al. Application of poly(ethylene glycol)-distearoylphosphatidylethanolamine(PEG-DSPE) block copolymers and their derivatives as nanomaterials in drug delivery[J]. Int J Nanomed,2012,7: 4185.
[23] Manjappa A S,Chaudhari K R,Venkataraju M P,et al. Antibody derivatization and conjugation strategies: application in preparation of stealth immunoliposome to target chemotherapeutics to tumor[J]. J Controlled Release,2011,150(1):2.
[责任编辑 孔晶晶]
