一线化疗联合三氧化二砷对肢体转移性骨肉瘤的疗效分析
2017-06-22谢璐郭卫杨毅姬涛李晓许婕
谢璐 郭卫 杨毅 姬涛 李晓 许婕
·临床研究与应用·
一线化疗联合三氧化二砷对肢体转移性骨肉瘤的疗效分析
谢璐 郭卫 杨毅 姬涛 李晓 许婕
目的:通过回顾北京大学人民医院骨与软组织肿瘤中心十年以上的肢体骨肉瘤肺转移的病例,对其预后、治疗过程进行总结,以期发现三氧化二砷(arsenic trioxide,ATO)联合一线化疗药物对早期肺转移病例的疗效。方法:回顾性分析北京大学人民医院骨肿瘤科自1998年3月至2014年12月收治的肢体骨肉瘤肺转移的连续病例,挑选出治疗过程中出现早期肺转移及初治肺转移曾经使用过ATO长期输液联合一线化疗药物(阿霉素、顺铂、大剂量氨甲喋呤和异环磷酰胺)进行治疗的病例。共计119例符合本研究条件,65例为初治肺转移,54例为治疗过程中发现肺转移。结果:该组的病例经治疗,2年及5年总生存率分别为52.6%和30.9%。虽然仅20例接受了肺部切除手术(16.8%),但本中心选择治疗后的病例5年总生存情况和国际上其他区域的的生存情况类似(意大利Rizzoli的5年生存率为37%)。通过比较各项临床病理学因素,发现骨转移、双侧肺转移、出现≥3个肺转移结节以及不完全切除肺内病灶,提示患者预后不佳。结论:ATO合并一线化疗可能是一种有效且患者可耐受的新的治疗选择。肺切除手术应该严格挑选合适的病例,以获得最大的临床受益。
骨肉瘤 肺转移 三氧化二砷 一线化疗
目前骨肉瘤治疗亟待解决的问题仍然是治疗过程中出现肺转移或复发的病例,其5年总生存率为18%~33%[1-4]。约90%的肿瘤复发由肺转移导致,单发肺结节的切除可显示生存获益,且对部分病例是治愈的手段[2]。但是,这项操作对反复肺内转移者仍待进一步验证。三氧化二砷(arsenic trioxide,ATO, As2O3)对早幼粒细胞白血病显示有潜在的临床受益[5-7]。一些研究表明小剂量的ATO被认为是一种免疫调节剂且使用相对安全[8],对骨髓抑制的影响较小,适合联合用药[9]。基于既往砷剂相关临床前研究[10-11],本研究自10余年前开始使用传统一线化疗联合ATO(作为一种辅助用药)作用于转移性骨肉瘤。本研究旨在总结相关人群用药后的临床预后以及可能的不良反应。
1 材料与方法
1.1 材料
自1998年3月至2014年12月,回顾性分析北京大学人民医院骨与软组织肿瘤中心初治的、组织学证实为肢体高级别骨肉瘤775例的临床资料。其中124例含有肺内结节,临床高度怀疑转移,5例失访,最后入组119例。入组病例中,65例为初治含有肺内结节,54例为在治疗过程中或治疗结束后出现肺有结节。同时,124例患者中,70例患者含双肺多发肺内结节,49例患者仅为单侧肺内结节。而在后者仅为单侧肺转移的人群中,仅4例在整个治疗过程及随访过程中肺内结节的数量少于3个。骨肉瘤的诊断是通过切开或粗针活检获得标本并在组织学镜下确认。此外,所有患者均在临床常规通过胸部薄层CT来评估肺的转移灶。但是,也考虑到和其他肿瘤一样,由于有的病例没有手术病理确认是骨肉瘤肺转移,这些患者中可能有部分为假阳性(实际上肺内多发结节有可能是良性结节)。肺部薄层CT无论结节的大小和数量均可在影像学资料上显示,故在读片过程中排除了1 cm以下结节的病例。
入组的119例病例均具有以下特点:1)组织学确诊为高级别骨肉瘤,其中包括骨母细胞型、软骨母细胞型、纤维母细胞型、混合型以及毛细血管扩张型、小细胞型和其他未分类型;2)没有既往治疗史;东部肿瘤协作组一般状态评分(Eastern cooperative oncolo⁃gy group,ECOG)≤2分;3)正常的肾脏、肝脏和造血功能。肺内结节是否能手术完整切除取决于胸外科医生、骨肿瘤科手术医生及骨肿瘤化疗科医生的讨论和协商。总体来说,能手术完整切除的肺内结节情况如下:1)原发病灶可以手术切除;2)所有薄层CT可见的结节必须是胸外科医生认为解剖学上可以完整切除;3)没有胸膜或新包膜积液;4)预期肺叶切除后保留的肺功能不影响日常工作或生活;5)没有肺外转移的病灶。本研究通过了北京大学人民医院伦理委员会的批准。所有的病例均在知情同意的基础上使用药物,患者或其授权亲属签署了知情同意书。
1.2 方法
本研究所有入组的患者均接受了标准的一线化疗和手术治疗(保肢或截肢手术)。虽然局部的手术治疗技术以及肺转移灶的胸外科肺叶切除技术在近几十年来发生巨大的变化,但是其手术的宗旨仍然是为了获得手术扩大切除所有病灶以达到安全边界。目前的标准治疗手段包括术前化疗(新辅助化疗),手术切除局部病灶(条件允许同时也切除肺内转移灶)和术后化疗(辅助化疗)。其他的治疗手段包括血管栓塞、动脉置管化疗药物局部灌注、伽玛刀切除肺内转移性病灶等。本研究在化疗的过程中关注相关肺内结节的变化情况,仅在这些结节于治疗过程中稳定4个月以上时才推荐患者进行肺内病灶的局部治疗,例如切肺手术(开胸手术或胸腔镜手术)、放疗手术(伽玛刀或者射波刀)等。一线化疗药物包含以下几种:多柔吡星(阿霉素)、顺铂、大剂量氨甲喋呤(HDMTX)和异环磷酰胺(阿霉素60mg/m2,顺铂100~120mg/m2,大剂量氨甲喋呤8~12 g/m2,异环磷酰胺10~12 g/m2)。与此同时,所有临床考虑含有肺内转移结节的患者均接受了长期6~10mg/d的ATO输液(通常成人每日的砷剂用量为10mg,而<10岁的儿童、体重<30 kg的患者每日剂量为5mg)每28天为一个周期,休养14天后进行下一个周期的输液。在临床观察的过程中,如果疾病明显进展或者患者在完成一线化疗6个月内再次肿瘤复发,建议患者停止砷剂输液和一线化疗方案,直接推荐二线化疗或者入组其他药物临床试验。
1.3 有效性评估
在治疗开始之前,患者需进行胸部薄层CT、骨扫描或PET/CT以及局部CT和/或核磁检查。基线评估包括全血细胞分析、血清生化、物诊和相关的心肺功能检查。在化疗过程中,所有相关的检查会每8周重复一遍,除非出现明显毒副作用或者怀疑出现疾病进展。本研究的重点为总生存率(overall survival,OS),无事件生存率(event-free survival,EFS)、无进展生存率(progression-free survival,PFS)(疾病进展、局部复发和/或转移和由于疾病死亡都认为是负性事件)也同时作为评估项目。但是,在仔细收集相关临床数据的同时,疾病进展在过去的几十年间也发生了变化,这基于病灶的检测技术精确性以及某些病灶缓慢进展,历经了更长一段时间(如:通过对比病灶的大小,发现每2个月的对比变化不大,但6个月前后的影像学对比病灶明显增大)。更重要的是,基于影像学病灶大小的评估也不能真实地反映成骨病灶对化疗的反应。因此对肺内转移病灶的评估采用的是RECIST 1.1的评价方法[12-13]。OS对于初治肺转移的患者是自开始接受治疗到死亡或最后一次随访结束。而疾病PFS是自开始接受治疗到第一次发生负性事件或者最后一次随访结束。对治疗过程中肺转移的患者,OS是自第一次发现肿瘤转移开始到死亡或最后一次随访结束,而PFS则是自第一次发现肿瘤转移开始到第一次发生负性事件或最后一次随访结束。OS、PFS、反应时间(duration of response)都是根据Kaplan-Meier方法并使用95%的置信区间。另一个值得注意的指标为疾病-进展时间(disease-free interval),该指标是针对治疗过程中肺转移的患者,是指自诊断性活检开始到第一次发现肺转移的时间。
1.4 统计学分析
采用SPSS 13.0软件进行统计学分析。所有的参数都使用单因素分析,χ2分析用来比较不相关的样本。生存分析使用Kaplan-Meier方法[14]。Log-rank检测用来比较生存曲线[15]。因为样本量不大,单因素Cox分析生存学指标比较不同的临床病理学参数。只有当变量在单因素分析中出现了显著的预后影响后,才纳入多因素Cox分析。所有P值均为双侧性,以P<0.05为差异具有统计学意义。
2 结果
2.1 入组人群的生存情况
直至最后一次随访,4例患者生存大于5年。在这些患者中,1例含有肺内孤立病灶直径>1 cm,其不愿意接受任何肺部手术治疗来切除这个结节。其他的3例患者均含有双肺多发结节,其中2例患者未进行任何肺部局灶手术,化疗后定期随访这些结节,多年来无明显变化(图1);而另1例患者历经了一线和二线化疗以及光子刀放疗手术切除最大的肺内结节,此例患者在随访的第6年死于骨肉瘤多发转移灶进展。平均随访时间为36.5(3~150)个月(IOR 18.9~106.3个月)。
2年和5年的OS分别为52.6%和30.9%(图2)。初治肺转移患者的2年和5年的总生存率分别为56.8%和34.9%。而对治疗过程中出现肺转移的患者,2年和5年的OS分别为46.8%和27.3%(P=0.351,图2)。而初治肺转移患者的2年和5年PFS分别为34.8%和30.9%。对治疗过程中肺转移的患者,2年和5年的PFS无显著性差异(P=0.164),分别为28.3%和18.0%。
2.2 影响预后的因素
在比较了所有可能影响预后的临床病理学参数后,发现合并骨转移(P=0.021)、双侧肺转移(P= 0.001)、不完全肺内病灶切除(P=0.001)可明显恶化疾病和影响生存预后。同时,性别(P=0.532)、年龄(P=0.302)、组织学亚型(P=0.939)、原发肿瘤的部位(P=0.087)、肿瘤坏死率(P=0.107)、是否合并病理骨折(P=0.307)、是否有局部复发(P=0.335)、是否有ALP和LDH水平的升高(P=0.323,P=0.101)、是否进行了肺内病灶的局部治疗(包括肺部手术和放疗手术)(P=0.213)可能对长期的生存无显著相关性(表1)。共有54例患者(45.4%)出现治疗过程中的肺转移。自开始治疗到出现第一次肺转移无病间期(dis⁃ease-free interval,DFI)为9.35(2~63.6)个月。根据对生存函数的单因素分析,注意到DFI明显影响预后(P=0.001)。根据本研究结果的四分位数,把DFI以2年为界分为两组。通过比较两组的生存情况,发现在2年内肿瘤复发的病例预后更差(P=0.001)。本研究对以上所有参数进行Cox多因素分析,发现单侧或双侧肺转移(P=0.017),是否肉眼完全切除肺内病灶(P=0.029)明显影响OS。然而,当这些因素用来评估合并有骨转移的患者时,对生存可能无明显影响(P= 0.682)。
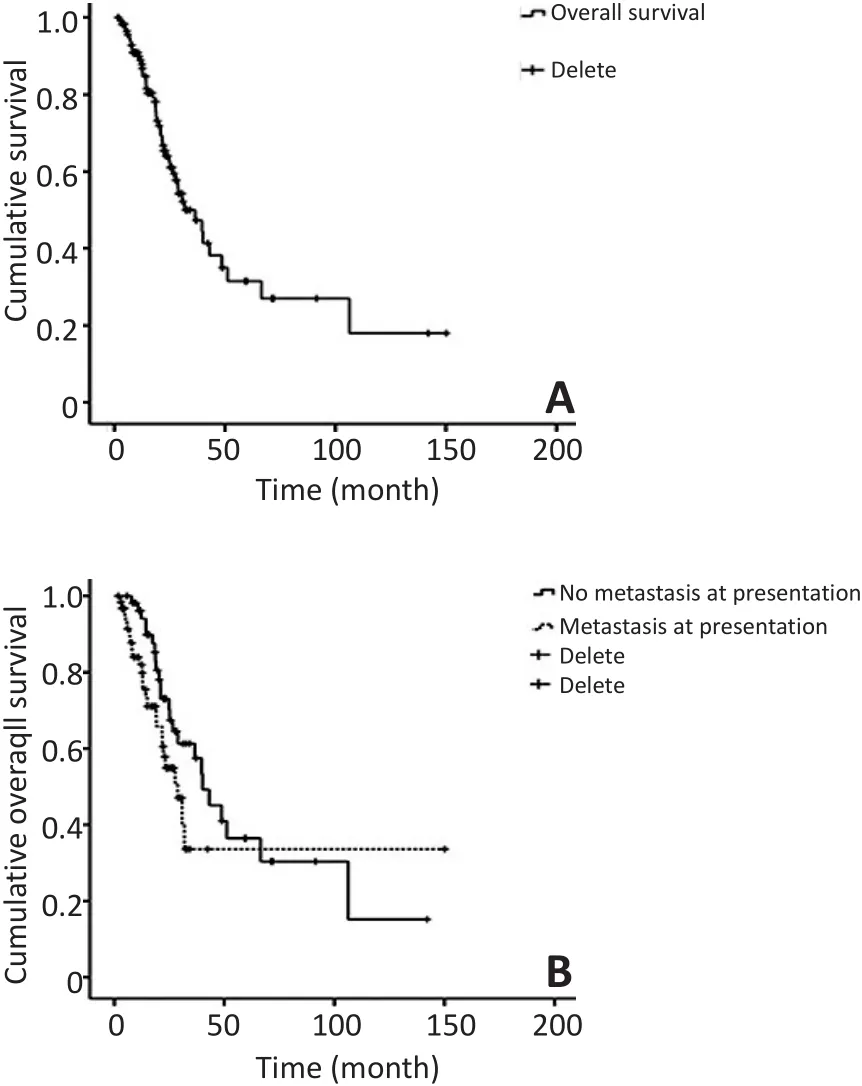
图1 患者的Kaplan-Meier生存曲线Figure 1 Patients'Kaplan-Meier survivalcurves
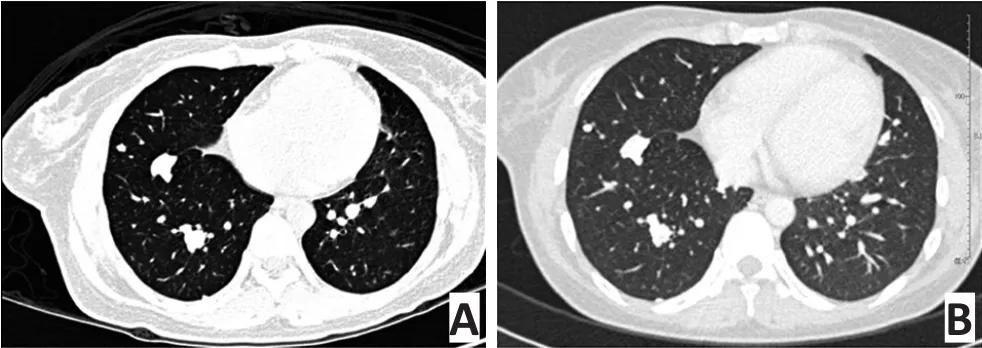
图2 生存时间>10年的24岁骨肉瘤患者的肺部CT表现Figure 2 The chest CT of a 24-year old patient who survived longer than ten years follow ing this chemo-protocol(multiple calcifications in relation tometastatic lesions)
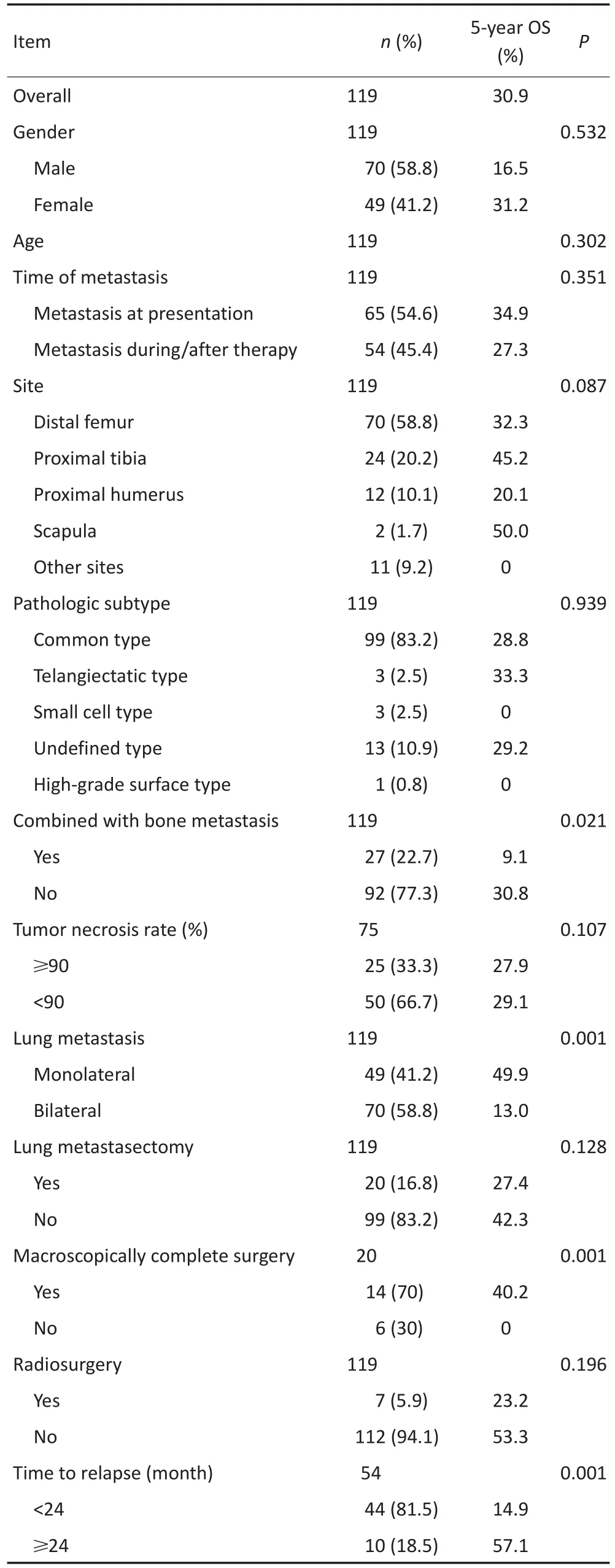
表1 本研究中患者的临床病理学参数Table 1 Characteristicsof the patients reviewed in thisstudy
2.3 药物不良反应
患者总共经历了930个周期的化疗。均1/3的患者由于骨髓恢复延迟、异常的实验室检查结果(主要肝酶的升高)、手术并发症、MTX的延迟代谢或其他问题经历了化疗的延迟(≥1周)。合并使用ATO的一线化疗方案对患者是可以耐受的,约30%的患者也经历了3~4级的化疗不良事件。这种联合使用的最明显的不良反应为骨髓抑制的加剧-几乎所有用药的患者主诉需要更长的休养间期。而在这些患者中,1/4的患者出现了Ⅳ度的骨髓抑制。出现频率比较高的负性事件包括恶心和呕吐、腹泻、疲劳、心律失常和神经病变。而上述的不良反应均可通过对症治疗得到缓解。1例患者在用药过程中出现了持续的腹痛和皮肤、指甲的色素沉着,经过血液学检测,发现体内的砷剂浓度>10μmol/L(正常<2μmol/L)。此例患者由于慢性砷中毒被迫中止治疗,2个月后该患者的血清砷浓度水平恢复正常。
3 讨论
骨肉瘤(osteosarcoma)的年发病率仅为0.2%,是少见的恶性肿瘤[16]。在诊断骨肉瘤时,约10%~20%的患者出现了肉眼可见的转移灶,主要为肺、骨和极少见的脑转移[17]。但是,80%~90%的病例被认为有微小转移灶,目前常规的诊断手段难以发现[18]。30%~40%的局灶骨肉瘤患者在治疗过程中会出现局部复发或转移[19]。约90%的肿瘤为肺转移,一般出现在诊断最初的2~3年[20],被认为是预后不佳的征兆。对有肺转移的患者来说总体的5年总生存率报道为19.1%~37%[21-22]。
积极的多学科联合会诊有助于延长患者生存期,尤其是对化疗敏感的患者生存质量有所提高[20,23]。目前,常用的骨肉瘤化疗方案基于以下四种药物:多柔吡星(阿霉素)、顺铂、大剂量氨甲喋呤联合四氢叶酸解救和异环磷酰胺[1]。但是,对同时或先后出现肺转移的病例,全世界的治疗策略尚未标准化但治疗方法上存在一些共识。对孤立或可转移灶的切除即是一种治疗方案的选择,并与生存的获益相关,可能潜在治愈一部分个体。虽然不是结论性的,但是既往的回顾性病例结果支持谨慎地选择手术切除肺内转移的患者。最主要的选择标准为挑选那些能完全切除病灶的患者。从既往大规模回顾性研究试验[4,19,24-27]和本研究结果来看,骨肉瘤患者均可肉眼及镜下完成切除病灶。但是,对不可完全切除病灶的患者,肺内转移灶切除手术并没有改善预后反而带来了更大的痛苦。
从研究的数据中,可以看到本中心肺部切除手术比例较低(16.8%),双侧肺转移、结节数>3例的患者量远大于近年来其他报道的大宗回顾性报告[25-26]。由于这两点均与预后负相关,也意味着本研究中患者群的预后相较于文献中同类研究结果更差。本研究中的肺转移灶切除率较低,预后情况会更差,但是本研究中的5年总生存率相比于既往研究并未明显地减少(初治肺转移为34.9%,治疗过程中肺转移27.3%)。这可能间接反映了本研究内科治疗手段的有效性,也许ATO合并一线化疗可发挥增强药物对肿瘤的抑制作用。
对ATO,很多人认为是一种传统中医中的毒药。本研究通过10余年研究该制剂作用于骨肉瘤细胞系,发现其可以通过抑制MAPK信号通路阻抑骨肉瘤细胞系的侵袭[10]。这些临床前及其他肿瘤的临床试验结果,促使在一线化疗的基础上联合ATO来治疗转移性骨肉瘤。在骨肉瘤的内科治疗中,二线化疗的反应率为10%~20%[2],使骨肉瘤的二线化疗几乎改变不了进展期骨肉瘤的生存受益。在20世纪末期,在没有其他更为有效的治疗手段的情况下,本中心经过和北京大学人民医院血液科和肿瘤内科医生的讨论和共识,一线化疗的疾病控制率相比于二线化疗药物更为可靠,增加砷剂作为一种辅助的治疗制剂也成为临床治疗过程中的一种选择。
虽然本研究为一个回顾性的病例分析,部分患者在临床过程中失访。但发现即便对肺内结节>1 cm的进展期病灶,在一线化疗的基础上添加ATO,可使进展的病灶保持疾病稳定(stable disease,SD),且SD的时间往往>3个月,钙化的成分在影像学上明显增多。这对于肺转移的骨肉瘤病灶来说,也许是病理学完全缓解(complete response,CR)的影像学表现。但是,由于本组肺切除患者偏少,缺乏病理学评估的指标,这些钙化的病灶在临床上一直作为SD的评估,而没有被纳入病理学CR的范围。因而在评估这些病例的时候,以OS来评价更为合适,因为PFS对于短期的评估可能更加敏感,但OS对长期随访的患者来说,才是真正有意义的指标。在本研究中,4例患者肺内结节生存>5年。其中,仅有1例为单发结节(未切除),但4例最大肺内结节直径均>1 cm。这些均是临床意义上的肺转移患者,由于骨肉瘤相比于其他肿瘤可能出现长期钙化或骨化的肺内结节,进展缓慢。在一些非随机的研究中[28-30],这样的长期钙化可能是由于肿瘤生长异质性而不是由于药物的有效性。但是本研究认为在高级别的骨肉瘤治疗过程中,临床医生观察到的肿瘤转移结节“自发”停止生长的情况是一个小概率事件,对于大多数患者群来说,这种情况发生的可能性很小。无论如何,对这部分人群采用总生存评估ATO合并使用一线化疗的疗效是有意义的,肺内转移病灶的瘤体缩小或者病灶钙化、体积不变>3个月的结果至少在某种意义上说明了内科治疗的合理性。需要进一步通过前瞻性的药物临床试验来验证该药物的可靠性。
4 结论
ATO合并传统一线化疗药物可能对骨肉瘤肺转移患者来说是一种有效且可耐受的治疗选择。切肺手术应严格把握适应证,筛选能从手术中受益的患者群。通过本研究,建议进一步设计多中心前瞻的随机对照药物临床试验来验证ATO的免疫调节作用及其对高级别肺转移骨肉瘤患者的临床价值。
[1]Luetke A,Meyers PA,Lew is I,et al.Osteosarcoma treatmentwhere do we stand?A state of the art review[J].Cancer Treat Rev, 2014,40(4):523-532.
[2]Jaffe N,Puri A,Gelderblom H,et al.Osteosarcoma:evolution of treatment paradigms[J].Sarcoma,2013,2013:203531.
[3]Meyers PA,Chou AJ.Muramyl tripeptide-phosphatidyl ethanolam ine encapsulated in liposomes(L-MTP-PE)in the treatment of osteosarcoma[J].Adv Exp Med Biol,2014,804:307-321.
[4]Whelan JS,Bielack SS,Marina N,etal.EURAMOS-1,an internationalrandom ised study forosteosarcoma:results from pre-random isation treatment[J].Ann Oncol,2015,26(2):407-414.
[5]SuiM,Zhang Z,Zhou J,et al.Inhibition factors of arsenic trioxide therapeutic effects in patientsw ith acute promyelocytic leukem ia [J].Chin Med J(Engl),2014,127(19):3503-3506.
[6]Efficace F,MandelliF,AvvisatiG,etal.Random ized phase IIItrialof retinoic acid and arsenic trioxide versus retinoic acid and chemotherapy in patientsw ith acute promyelocytic leukem ia:health-related quality-of-life outcomes[J].JClin Oncol,2014,32(30):3406-3412.
[7]Wang H,Cao F,Li J,et al.Arsenic trioxide and mannitol for the treatment of acute promyelocytic leukem ia relapse in the central nervoussystem[J].Blood,2014,124(12):1998-2000.
[8]Thomas-Schoemann A,Batteux F,Mongaret C,et al.Arsenic trioxide exerts antitumor activity through regulatory T cell depletion mediated by oxidative stress in amurinemodelof colon cancer[J]. JImmunol,2012,189(11):5171-5177.
[9]Griffin RJ,Williams BW,Park HJ,etal.Preferentialaction ofarsenic trioxide in solid-tumorm icroenvironment enhances radiation therapy[J].Int JRadiatOncolBiolPhys,2005,61(5):1516-1522.
[10]Tingting R,WeiG,Changliang P,etal.Arsenic trioxide inhibitsosteosarcoma cellinvasivenessviaMAPKsignaling pathway[J].Cancer BiolTher,2010,10(3):251-257.
[11]Yang GF,Li XH,Zhao Z,et al.Arsenic trioxide up-regulates Fas expression in human osteosarcoma cells[J].Chin Med J(Engl),2010, 123(13):1768-1773.
[12]Duffaud F,Therasse P.New guidelines to evaluate the response to treatment in solid tumors[J].BullCancer,2000,87(12):881-886.
[13]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors.European Organization for Research and TreatmentofCancer,NationalCancer Institute of the United States,NationalCancer Institute of Canada[J].J NatlCancer Inst,2000,92(3):205-216.
[14]Schindler B,BrielM,Gunther J,et al.Painting by number--Survival curves and Kaplan-Meier method[J].Med Monatsschr Pharm,2015,38(5):186-191.
[15]AlbertiC,Timsit JF,Chevret S.Survivalanalysis-the log rank test[J]. RevMalRespir,2005,22(5Pt1):829-832.
[16]Bielack S,Carrle D,Casali PG,et al.Osteosarcoma:ESMO clinical recommendations for diagnosis,treatment and follow-up[J].Ann Oncol,2009,20 Suppl4:137-139.
[17]Kager L,Zoubek A,Potschger U,etal.Primarymetastaticosteosarcoma: presentation and outcome of patients treated on neoadjuvant cooperative osteosarcoma study group protocols[J].JClin Oncol,2003, 21(10):2011-2018.
[18]Geller DS,Gorlick R.Osteosarcoma:a review of diagnosis,management,and treatment strategies[J].Clin Adv HematolOncol,2010,8 (10):705-718.
[19]Kempf-Bielack B,Bielack SS,Jurgens H,et al.Osteosarcoma relapse after combined modality therapy:an analysis of unselected patients in the Cooperative Osteosarcoma Study Group(COSS)[J].J Clin Oncol,2005,23(3):559-568.
[20]BacciG,Rocca M,Salone M,et al.High grade osteosarcoma of the extrem itiesw ith lungmetastases at presentation:treatment w ith neoadjuvant chemotherapy and simultaneous resection of primary andmetastatic lesions[J].JSurg Oncol,2008,98(6):415-420.
[21]Carrle D,Bielack S.Osteosarcoma lung metastases detection and principles ofmultimodal therapy[J].Cancer Treat Res,2009,152: 165-184.
[22]HoefnagelCA,Bruning PF,Cohen P,etal.Detection of lungmetastases from osteosarcoma by scintigraphy using 99m Tc-methylene diphosphonate[J].Diagn Imaging,1981,50(5):277-284.
[23]Briccoli A,Rocca M,Salone M,et al.High grade osteosarcoma of the extrem itiesmetastatic to the lung:long-term results in 323 patients treated combining surgery and chemotherapy,1985-2005[J]. Surg Oncol,2010,19(4):193-199.
[24]Steliga M,Vaporciyan A.Surgical treatment of pulmonarymetastases from osteosarcoma in pediatric and adolescent patients[J].Cancer Treat Res,2009,152:185-201.
[25]BacciG,FerrariS,LonghiA,et al.Therapy and survivalafter recurrence of Ew ing's tumors:the Rizzoli experience in 195 patients treated with adjuvant and neoadjuvant chemotherapy from 1979 to 1997[J].Ann Oncol,2003,14(11):1654-1659.
[26]BacciG,ForniC,FerrariS,et al.Neoadjuvant chemotherapy for osteosarcoma of the extrem ity:intensification of preoperative treatment doesnot increase the rate ofgood histologic response to the primary tumor or improve the finaloutcome[J].JPediatr Hematol Oncol,2003,25(11):845-853.
[27]Anninga JK,Gelderblom H,Fiocco M,et al.Chemotherapeutic adjuvant treatment forosteosarcoma:where dowe stand[J]?Eur JCancer,2011,47(16):2431-2445.
[28]Harting MT,Blakely ML,Jaffe N,et al.Long-term survival after aggressive resection of pulmonary metastases among children and adolescentswith osteosarcoma[J].JPediatr Surg,2006,41(1):194-199.
[29]Chen YB,Hahn LJ,Yao YT.Long-term survivalofmandibular osteosarcoma[J].Br JPlast Surg,1999,52(3):243-244.
[30]Shibamoto Y,HoriiN,TakahashiM.Long-term control ofmultiple lungmetastases from osteosarcoma obtained by conventional radiotherapy:a case report[J].OncolRep,1999,6(5):1085-1087.
(2017-02-12收稿)
(2017-05-06修回)
(编辑:杨红欣校对:郑莉)
Effects of arsenic trioxide combined with first-line chemotherapy on osteosarcoma of patients with pulmonary extremity metastasis
Lu XIE,Wei GUO,Yi Yang,Tao JI,Xiao LI,Jie XU
MusculoskeletalTumorCenter,Peking University People'sHospital,Beijing100044,China
WeiGUO;E-mail:bonetumor@163.com
Objective:After establishing standardmulti-modal therapy,prognosis of refractory andmetastatic high-grade osteosarcoma remains dismaland unchanged over the last decades.Early clinical intervention to new ly detectedmetastatic lesions is crucialand effective for better prognosis.Arsenic trioxide(ATO)isone of the oldest remediesused in traditionalorientalmedicine and is recently rediscovered as an immunomodulator due to its activity against other solid tumors.This study aims to evaluate the efficiency of ATO combined w ith first-line chemotherapy in treating pulmonarymetastatic osteosarcoma patientsw ith long-term follow-up in our institution.Methods:Osteosarcoma patientsw ith pulmonarymetastasiswere intravenously adm inistered with ATO(5-10mg)daily combined w ith first-line chemotherapy for their treatment.A totalof 119 patientswere finally enrolled;65 presented metastasis,and 54 relapsed w ith lungmetastasis.Results:Two-year and five-year overallsurvival(OS)rates for these patients reached 52.6%and 30.9%, respectively.Only 20 casesunderwent thoracotom ies(16.8%).Our five-yearOSwasnearly sim ilar to thatofother institutions(37%in Rizzoli,Italy).We observed that combined w ith bonemetastasis,bilateralmetastasis,and>3 pulmonary nodules,incomplete resection of pulmonary lesionsdeteriorated the disease and significantly influenced survivalas comparedw ith allother parameters.Conclusion: Combined w ith conventionalchemotherapy,ATOmay be effective and well-tolerated asnew therapeutic option for patientsw ith nonresectable pulmonary metastatic osteosarcoma.Lungmetastasectomy should be strictly selected only for populations who benefit from this treatment.
osteosarcoma,pulmonarymetastasis,arsenic trioxide,first-line chemotherapy
10.3969/j.issn.1000-8179.2017.10.153

北京大学人民医院骨与软组织肿瘤中心(北京市100044)
郭卫bonetum or@163.com
谢璐专业方向为骨与软组织肿瘤的化疗及靶向药物治疗,以及骨转移瘤的内科治疗。
E-mail:sweetdoctor@163.com
