转录因子FOXP3在不同肿瘤中的表达及功能研究进展*
2017-06-22任贺李鑫
任贺 李鑫
·国家基金研究进展综述·
转录因子FOXP3在不同肿瘤中的表达及功能研究进展*
任贺 李鑫
作为调节性T细胞中最重要的转录因子,转录因子叉头蛋白(forkheadbox protein 3,FOXP3)在T细胞研究领域已被广泛关注。然而最新研究表明,FOXP3在多种肿瘤组织中均有表达,在不同肿瘤中的表达量及发挥的功能亦不相同,部分肿瘤中FOXP3作为抑癌基因抑制肿瘤的增殖与转移,部分肿瘤中则作为癌基因促进肿瘤免疫逃逸。本文总结了FOXP3在不同肿瘤组织中的表达情况及其功能,旨在为今后FOXP3的研究和靶向治疗提供依据。
肿瘤 转录因子 FOXP3 癌基因 抑癌基因
FOXP3是转录因子叉头蛋白家族的一员,作为重要的转录因子对调节性T细胞的形成及其免疫抑制功能起到至关重要的作用[1-2]。FOXP3表达异常可导致人类自身免疫性疾病,良性以及恶性肿瘤的发生。初识FOXP3是在T细胞中,然而FOXP3不仅在T细胞中表达,在多种组织和肿瘤中均有表达。FOXP3在不同肿瘤中的表达情况以及发挥的功能截然不同,其作为抑癌基因时,可调控其下游致癌基因的表达及其他信号通路抑制肿瘤的发生和发展,而在部分肿瘤中表达使得肿瘤细胞具有了类似Treg功能时,便与肿瘤的进展以及免疫逃逸有关,发挥着促癌的作用。本文对FOXP3在不同肿瘤中的表达以及功能研究进行总结,旨在为肿瘤的个体化治疗提供新的思路。
1 FOXP3的结构和功能
FOXP3基因定位在X染色体Xp11.23,其编码基因包含11个外显子以及3个非编码外显子。编码基因翻译43 kd的蛋白,包含431个氨基酸。FOXP3蛋白由3个α螺旋区(H1、H2、H3)以及3个β链(S1、S2、S3)构成,包含一个与蛋白激活及抑制状态有关的N末端结构域,核心的锌指结构域和亮氨酸拉链,以及与DNA结合的C末端的叉头结构域[3]。FOXP3是调节性T细胞最特异的生物学标记,对Treg细胞的分化、维持及其免疫抑制功能具有重要作用[4]。FOXP3作为核内转录因子,通过直接结合靶基因启动子区或与其他转录因子协同作用调节下游靶基因表达,参与肿瘤细胞增殖、凋亡、侵袭、转移以及血管生成等多种生物学功能。
2 FOXP3在不同肿瘤中的表达及作用
FOXP3在不同肿瘤组织以及细胞系中的表达水平不尽相同,根据已有文献报道,原因可能有以下几方面:1)与不同类型肿瘤中FOXP3基因突变位点的不同有关,涉及单核苷酸多态性以及微卫星多态性[5];2)不同类型肿瘤其本身遗传背景的差异也会使FOXP3呈现不同的表达水平;3)不同肿瘤局部微环境的差异,不仅影响FOXP3的表达水平,甚至与其在特定肿瘤部位中发挥的生物学功能差异有关。
2.1 胰腺癌
FOXP3在胰腺癌中发挥促癌的作用。本课题组收集天津医科大学肿瘤医院120例手术切除胰腺癌样本,通过免疫组织化学染色发现在正常胰腺组织以及低度恶性胰腺肿瘤(包括浆液性囊腺瘤、胰腺上皮内瘤变以及神经内分泌瘤)中FOXP3的表达均为阴性,而在胰腺导管腺癌以及4种胰腺癌细胞系(PANC-1、BxPC-3、ASPC-1、MIA PaCa-2)的胞核与胞质中多为中、高表达,强阳性组与肿瘤大小等恶性表型以及更短的生存期呈显著相关,提示高表达FOXP3的患者预后不良。动物实验研究表明,在胰腺癌皮下成瘤小鼠模型中高表达FOXP3组肿瘤体积显著增大,深入研究发现肿瘤细胞中FOXP3可以直接转录激活趋化因子CCL5的表达,继而招募FOXP3+Treg细胞向肿瘤周围浸润,抑制肿瘤微环境中细胞毒性T细胞对肿瘤的杀伤活性[6],当应用CCL5阻断剂后,高表达FOXP3组肿瘤局部浸润Treg的减少比例更为明显,且抑瘤率更高。Hinz等[7]应用胰腺癌细胞系研究发现表达FOXP3的肿瘤细胞可抑制活化T细胞的增殖,特异性降低FOXP3的表达后可部分降低其抑制T细胞增殖的作用。另外FOXP3的表达部分抑制了TGF-β与IL-10的表达和分泌。同时本课题组的研究亦提示胰腺癌细胞表达的FOXP在肿瘤免疫微环境中可能发挥抑制免疫活性的作用,并参与免疫重塑以及肿瘤免疫逃逸状态。
2.2 乳腺癌
与胰腺癌截然不同,FOXP3在乳腺癌中为抑癌基因,发挥着抑制肿瘤发生发展的作用。研究显示正常乳腺上皮高表达FOXP3,而在乳腺癌组织中FOXP3表达显著降低。Zuo等[8]通过检测人类与鼠源肿瘤组织以及乳腺癌细胞系发现,FOXP3在转录水平以及组织水平的表达量均不同程度低于正常乳腺上皮组织。在其它研究中,乳腺癌中FOXP3的表达越高,患者的生存率越低,且FOXP3阳性可作为判断不良预后的分子标记[9]。另外,高表达FOXP3与肿瘤负荷、淋巴结转移均无相关性,但与肿瘤分级显著相关[10-11]。深入研究其分子机制发现,正常乳腺上皮细胞中野生型FOXP3作为乳腺癌X染色体重要的抑癌基因可直接结合并抑制ErbB2和Skp2的转录表达,使得HER-2与Skp2维持在较低的水平,维持正常细胞周期与生长[8],而突变后的FOXP3通过下调丝氨酸/苏氨酸蛋白激酶编码基因2(LATS2),增加HIPPO信号通路中的YAP致癌基因的表达,影响细胞的正常凋亡过程。因此,FOXP3在乳腺癌的发生阶段便可影响细胞周期、生长与凋亡[12]。在乳腺癌上皮细胞中FOXP3可直接转录调控诱导产生的miR-146抑制白介素1受体相关激酶1(IRAK1)以及TNF受体相关因子6(TRAF6)降低NF-κB,进而增加肿瘤细胞的凋亡,延缓乳腺癌的进展[13]。另外,FOXP3可直接结合黏附分子CD44的启动子区并抑制其表达,从而参与抑制肿瘤细胞黏附和侵袭的过程[14]。特异性降低胞核FOXP3的表达将增加CXCR4的表达,并显著增加CXCL12的定向趋化,进而提高了乳腺癌的转移能力[15]。这些研究均提示FOXP3在乳腺癌发生发展中起抑制作用。
2.3 前列腺癌
FOXP3在前列腺癌中表达的作用与乳腺癌相似,作为抑癌基因同样高表达在正常前列腺上皮细胞中,肿瘤组织中表达低,甚至为基因水平的缺失[16]。Wang等[16]应用基因工程小鼠单基因敲除正常前列腺上皮FOXP3后观察到前列腺上皮向癌前病变发展的现象,另外,Liu等[17]同样在前列腺癌中发现了FOXP3-miR146-NF-κB轴在肿瘤发生阶段所起到的作用,提示FOXP3可能在前列腺癌的发生阶段起到重要作用。进一步发现无论是在正常前列腺组织还是恶性组织中,FOXP3均是抑制c-myc表达的必要的转录基因,FOXP3与致癌基因c-myc之间呈负相关,而突变型FOXP3可激活c-myc以及NF-κB亚基P65的表达[16-17],进而参与抑制肿瘤凋亡并促进肿瘤进展。此外Santio等[18]研究发现FOXP3是致癌基因PIM的直接下游靶点,其抑制肿瘤的作用被PIM介导的氧化磷酸化所抑制。综合上述研究结果可以发现,相比正常前列腺上皮细胞,在肿瘤细胞中FOXP3的表达降低,不仅其抑制致癌基因的能力下降,还与上游调控基因抑制其表达有关。
2.4 胃癌
FOXP3在胃癌中同样发挥抑制作用。在胃癌细胞中FOXP3在细胞核与胞质均有表达,且癌组织高于癌旁组织,高表达FOXP3提示患者更长的生存期与较好的预后[19-20]。另外肿瘤源性FOXP3阳性表达与多种临床病理特征呈负相关[21]。深入机制研究表明肿瘤源性FOXP3可通过抑制肿瘤细胞增殖、促进凋亡、降低迁移能力等多种途径影响肿瘤细胞的恶性行为。过表达FOXP3可增加促凋亡分子如PARP、caspase-3和caspase-9的表达,同时使抗凋亡分子如c-IAP1和Bcl-2的表达减少[19],同时Suh等[21]研究还提示胃癌中FOXP3的表达与Hippo通路中的关键分子Lats2以及YAP的表达密切相关,FOXP3还可抑制NF-κB的活性,进而减少COX2的表达,降低肿瘤的转移能力[22]。此外,研究显示FOXP3通过与淋巴细胞相互作用而影响胃癌免疫微环境[20-21]。
2.5 胆管癌
FOXP3在肿瘤细胞中表达相比癌旁组织显著增多,且与淋巴结转移相关,虽然FOXP3低表达的样本中生存期比高表达者长,但两者之间差异无统计学意义。降低肿瘤细胞中FOXP3的表达可抑制肿瘤的侵袭。进一步研究发现,FOXP3的表达与MMP-9和MMP-2的表达呈正相关,下调FOXP3可使MMP-9和MMP-2的表达减少而抑制肿瘤细胞的侵袭。此外,FOXP3还参与肿瘤的免疫逃逸,特异性降低FOXP3的表达后,肿瘤细胞IL-10与TGF-β1的分泌也随之减少,且对T细胞杀伤作用的抵抗能力增强。可以推测在胆管癌中FOXP3可能发挥促癌的作用[23]。
2.6 恶性黑色素瘤
Gerber等[24]研究显示原位肿瘤组织中FOXP3的表达量(包含所有FOXP3+细胞)与内脏转移有显著相关性,并且表达量越高,提示OS与DFS短、预后较差。Tan等[25]研究进一步明确肿瘤源性FOXP3在晚期恶性黑色素瘤组织中表达的阳性率仅为12%,且核表达阳性者占肿瘤细胞总数<1%。在黑色素瘤细胞系中FOXP3mRNA的表达也是较低的水平,正常黑色素细胞中转录水平的表达更是极低。作为抑癌基因的FOXP3基因突变在乳腺癌以及前列腺癌中均被报道,Tan等[26]研究发现在黑色素瘤细胞系中无任何外显子突变。为深入研究FOXP3的分子机制,研究者在细胞系中特异性过表达FOXP3,体内外研究表明FOXP3通过抑制肿瘤细胞的增殖并促进凋亡而具有抑制肿瘤进展的能力。FOXP3的过表达还与增加黑色素细胞分化与色素形成的表型、降低克隆形成能力相关[25]。另一方面,在另一项研究中FOXP3的表达与B7-H1、TGF-β1与TGF-β2等免疫共刺激分子的表达呈正相关,过表达FOXP3的细胞系有抑制效应T细胞增殖的功能,降低FOXP3的表达后,抑制作用被部分减弱。该研究也提示,FOXP3在黑色素瘤中的表达使得黑色素瘤细胞具有类似Treg的作用。FOXP3在黑色素瘤中抑癌或促癌的作用都有待继续探索,或许可以大胆假设,其在黑色素瘤中表达量极低,可能并非作为一种关键转录因子而发挥作用,或因其表达被上游调控基因所抑制。
2.7 肺癌
FOXP3在正常支气管上皮表达较低而在肿瘤组织及癌旁组织中过表达,且非小细胞肺癌细胞核与胞质中均有表达,其表达与淋巴结转移以及TNM分期存在显著相关性[27-28]。Fu等[28]研究发现在非小细胞肺癌组织以及细胞系中FOXP3与TLR4表达均很高,且呈正相关。Li等[27]研究也发现FOXP3的表达与免疫抑制因子TGF-β1、IL-35以及HMOX1的表达呈正相关,提示FOXP3参与到非小细胞肺癌的免疫逃逸状态中。另一方面,过表达FOXP3促进肿瘤细胞的增殖、迁移以及侵袭,当特异性降低FOXP3的表达后,相应的恶性生物学行为也随之减少。深入机制研究发现,FOXP3的表达与细胞周期G1/S检查点基因CCND1的表达显著相关,FOXP3可增加CCND1的表达从而促进非小细胞肺癌细胞的增殖[27]。上述研究结果表明FOXP3在肺癌中发挥促癌作用。
2.8 结直肠癌
与正常组织相比,结肠癌细胞中FOXP3表达增高,且高表达与患者的不良预后相关[29-30]。结肠癌细胞中FOXP3的表达与免疫抑制因子IL-10和TGF-β的表达及分泌呈正相关,并参与抑制效应T细胞增殖。因此,FOXP3+结肠癌细胞很可能与Treg协同作用参与到肿瘤免疫逃逸中[29]。在结直肠癌中FOXP3作为一个新的免疫应答指标,其具体机制尚有待深入研究。
2.9 宫颈癌
现有研究结果显示FOXP3在宫颈癌中可能发挥促癌作用。正常宫颈上皮中FOXP3的表达为阴性,相比正常CIN组织,癌变组织中FOXP3高表达于宫颈癌细胞的胞核胞浆[31],且阳性患者总体生存期显著缩短[32]。临床病理特征中,FOXP3的表达与FIGO分级以及肿瘤大小显著相关[31-33]。Luo等[31]研究发现FOXP3在宫颈癌上皮内瘤变进展中表达增加,p16INK4a是HPV感染宿主细胞的重要标记,而FOXP3的表达与p16INK4a的表达呈正相关,另外,与肿瘤细胞分化相关的因子CK10的表达也与FOXP3表达显著相关,提示FOXP3可能参与宫颈癌的去分化和肿瘤生长过程。体外研究发现,在细胞系中特异性降低FOXP3表达后,p16INK4a的表达随之下降,凋亡率明显增加,细胞周期中S期与G2期的细胞数显著减少,G1期显著增多[31],提示FOXP3的表达下调会减少宫颈癌细胞自身的增殖,促进其凋亡。除此之外,FOXP3与B7-H3、B7-H4、TLR4的相关性表明其在肿瘤的免疫逃逸过程中也发挥重要的作用。
2.10 头颈部肿瘤以及甲状腺癌
口咽部鳞状细胞癌(OHSCC)与喉癌(LSCC)组织中均高表达FOXP3,但仅前者中FOXP3的高表达提示与不良预后有相关性[34]。当FOXP3联合其他指标判断预后时发现准确率极大提高,Weller等[35]发现在OHSCC中FOXP3与侵袭标志物CORTACTIN或COX2联合,LSCC中FOXP3与AHNAK的联合均比单独标记物判断预后更有意义。在甲状腺癌中FOXP3的研究提示其促癌作用。甲状腺乳头状癌中FOXP3的表达相比滤泡状腺瘤与滤泡癌为最高,且胞质、细胞核均为阳性。在正常甲状腺组织中,FOXP3仅呈极微弱的表达。胞质中表达FOXP3是甲状腺恶变的独立危险因素,细胞核FOXP3的表达在更年轻患者中以及诊断时已有转移的患者中更强[36]。进一步研究发现,FOXP3在甲状腺癌细胞中的表达影响肿瘤细胞的增殖、迁移与凋亡,体外深入研究发现,当特异性降低FOXP3的表达后,PPAR-γ的表达及活性随之增强,而P65与细胞周期蛋白D1的表达被下调,另外凋亡蛋白3的表达水平增加[37]。
2.11 尿路膀胱上皮癌
Winerdal等[38]收集37例T1~4期尿路膀胱上皮癌患者手术标本,首次评价FOXP3在尿路膀胱上皮癌中的表达以及与患者生存期的相关性。该研究显示尿路膀胱上皮癌中浸润FOXP3阳性的淋巴细胞提示较好生存率,相反,尿路膀胱上皮癌细胞FOXP3阳性的患者长期生存率却低于FOXP3阴性者。目前,FOXP3在尿路膀胱上皮癌中的研究仅局限在表达与预后,亟需更大样本量的统计与验证,其在肿瘤细胞中的具体功能与分子机制尚有待探索。
FOXP3在不同肿瘤中的表达、作用及相关分子见表1。
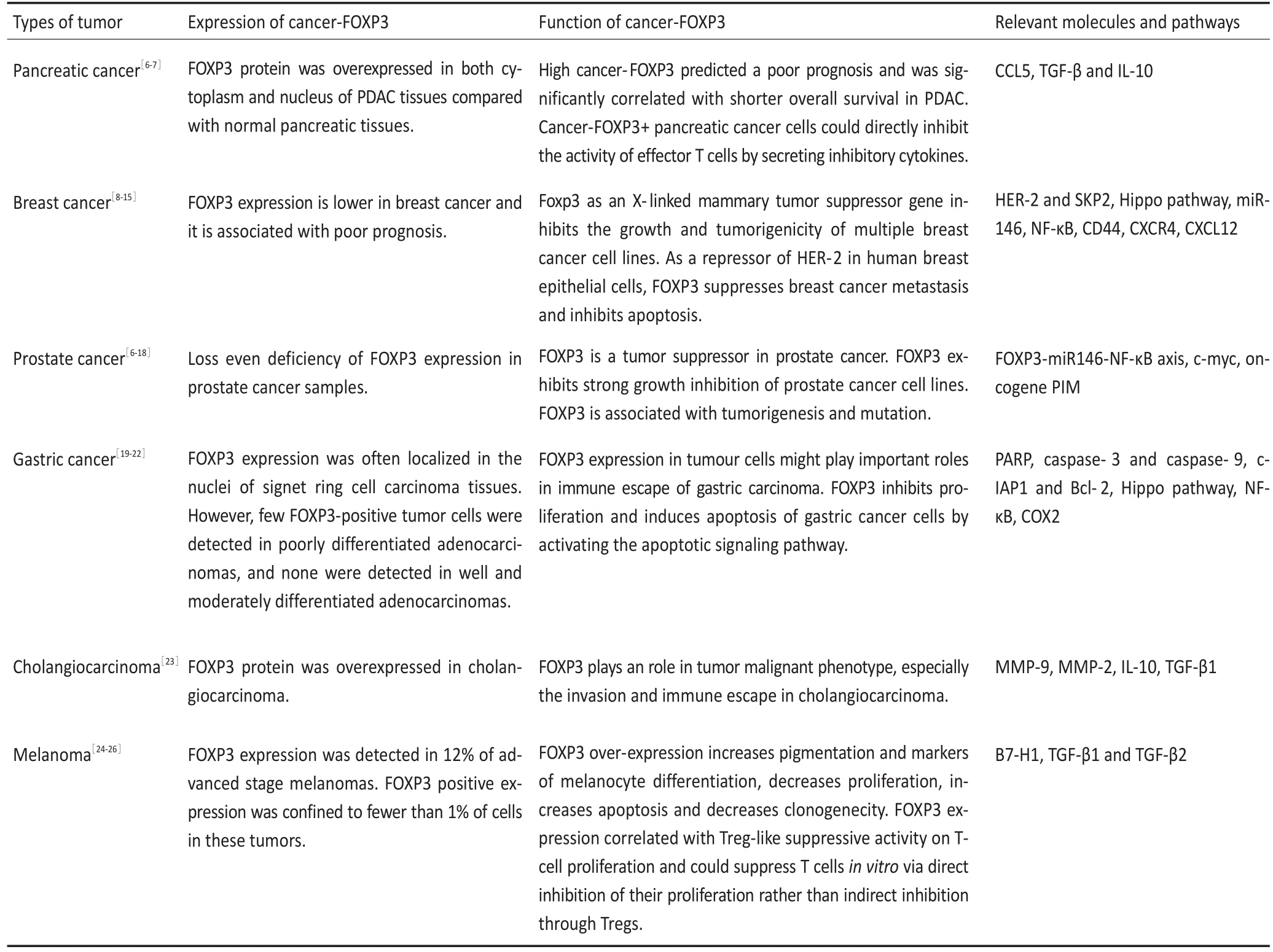
表1 FOXP3在不同肿瘤中的表达、作用及相关分子Table 1 Expression and function of cancer-FOXP3 in differenthuman tumorsw ith relevantmoleculesand pathways
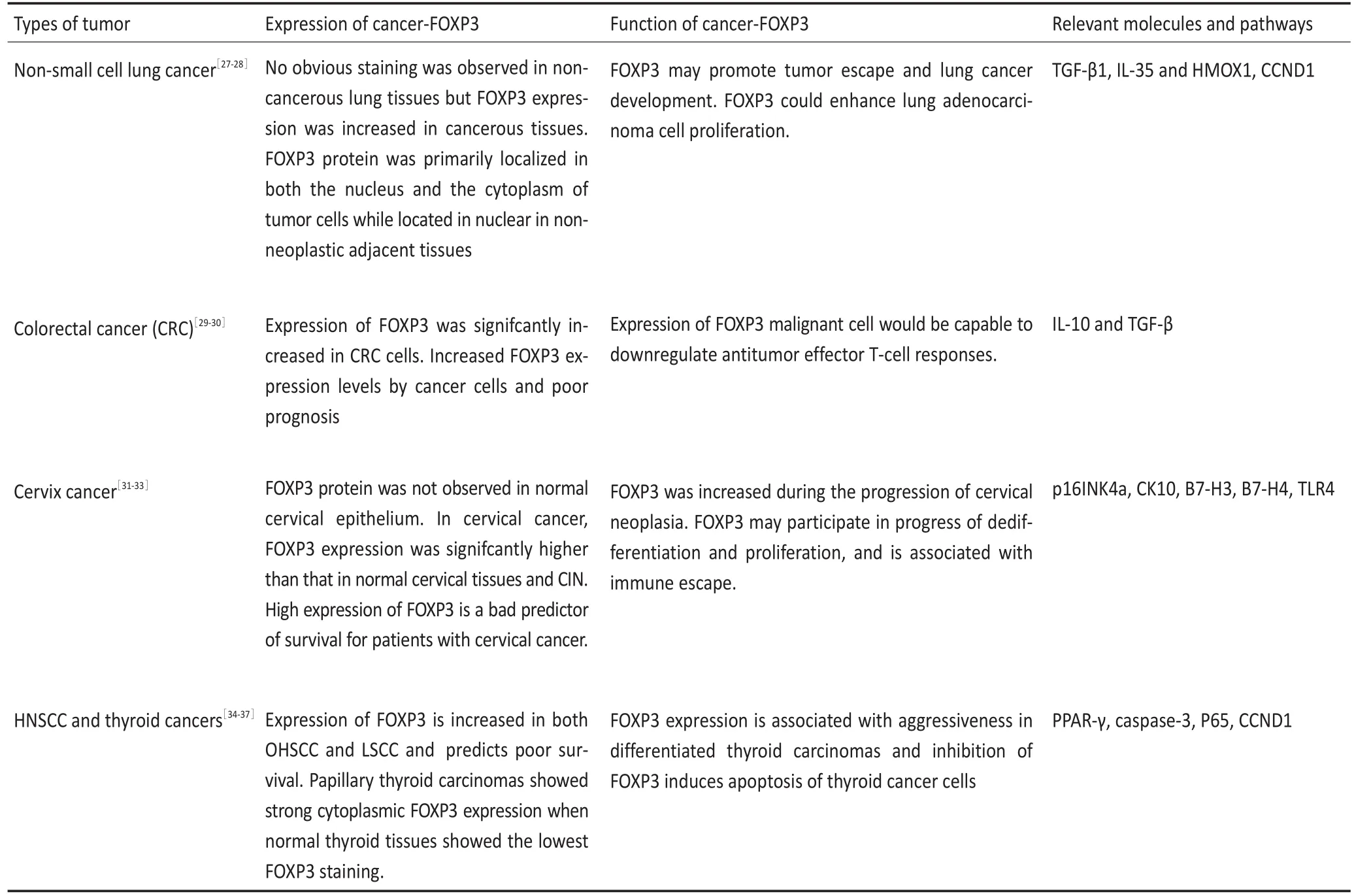
表1 FOXP3在不同肿瘤中的表达、作用及相关分子(续表1)Table 1 Expression and function of cancer-FOXP3 in differenthuman tumorsw ith relevantmoleculesand pathways
3 肿瘤源性FOXP3在癌症治疗中的研究
由于FOXP3在不同肿瘤类型中的表达及功能截然不同,因此需要根据肿瘤发生部位以及其分子机制制定干预策略。然而,目前缺乏特异性阻断肿瘤源性FOXP3的中和抗体或药物,同时由于Treg中FOXP3高表达,阻断FOXP3带来的Treg细胞的减少将引起严重的自身免疫性疾病。因此,直接以FOXP3为靶点进行干预并不可行。目前肿瘤源性FOXP3的临床意义主要体现为两点。首先,可以通过干预FOXP3的下游靶分子进行治疗,如本课题组研究显示,由于肿瘤源性FOXP3可直接转录激活CCL5的表达及分泌从而增加了肿瘤局部Treg细胞的趋化及聚集进而促使了肿瘤细胞的免疫逃逸。因此,特异性地针对FOXP3高表达的胰腺癌患者应用CCL5/CCR5制剂将获得更好的疗效[6]。其次,肿瘤源性FOXP3可以作为肿瘤免疫抑制微环境的标志。因此,其可作为免疫治疗优势人群的筛选指标。
4 小结
总结FOXP3在肿瘤中的研究发现,FOXP3作为转录因子可在Treg细胞中及肿瘤细胞中调控多种下游基因的表达并发挥多方面的作用,直接影响肿瘤细胞本身的发生发展、增殖凋亡与侵袭迁移;其在肿瘤细胞与局部浸润免疫细胞之间的相互作用中也扮演不可忽视的角色,参与肿瘤免疫微环境的重塑、肿瘤免疫逃逸以及免疫抑制状态。FOXP3在肿瘤细胞中的研究不仅提示患者的预后,并且通过评估肿瘤细胞和(或)间质中FOXP3的表达情况,可以反映微环境中的免疫状态,筛选优势人群,指导治疗。然而对于FOXP3的研究目前多在Treg细胞中,而对肿瘤细胞FOXP3表达与调控仍知之甚少[39]。FOXP3上游调控基因或相关通路,以及翻译后表观遗传修饰与降解途径等科学问题均需要进一步研究。通过胰腺癌动物模型可探索在胰腺癌变的不同阶段中FOXP3的表达模式,结合组学研究手段(蛋白质组学、转录组学)深入挖掘与FOXP3相关的调控基因,从而明确FOXP3在胰腺癌中的表达调控网络及潜在功能。对FOXP3在肿瘤细胞中相关作用的深入研究与认识有望为肿瘤治疗提供新思路。
[1]SakaguchiS,Yamaguchi T,Nomura T,et al.Regulatory T cells and immune tolerance[J].Cell,2008,133(5):775-787.
[2]Bennett CL,Christie J,RamsdellF,etal.The immune dysregulation, polyendocrinopathy,enteropathy,X-linked syndrome(IPEX)is caused bymutationsof FOXP3[J].NatGenet,2001,27(1):20-21.
[3]Lopes JE,Torgerson TR,Schubert LA,et al.Analysis of FOXP3 revealsmultiple domains required for its function asa transcriptional repressor[J].JImmunol,2006,177(5):3133-3142.
[4]Vadasz Z,ToubiE.FoxP3 expression inmacrophages,cancer,and B cells-is it real[J].Clin Rev Allergy Immunol,2016,52(3):364-372.
[5]Jiang LL,Ruan LW.Association between FOXP3 promoter polymorphisms and cancer risk:ameta-analysis[J].Oncol Lett,2014,8(6): 2795-2799.
[6]Wang X,Lang M,Zhao T,et al.Cancer-FOXP3 directly activated CCL5 to recruit FOXP3+Treg cells in pancreatic ductaladenocarcinoma[J].Oncogene,2016,doi:10.1038/onc.2016.458.
[7]Hinz S,Pagerols-Raluy L,Oberg HH,et al.Foxp3 expression in pancreatic carcinoma cells as a novelmechanism of immune evasion in cancer[J].Cancer Res,2007,67(17):8344-8350.
[8]Zuo T,Wang L,Morrison C,etal.FOXP3 isan X-linked breast cancer suppressor gene and an important repressor of the HER-2/ErbB2 oncogene[J].Cell,2007,129(7):1275-1286.
[9]Merlo A,CasaliniP,Carcangiu ML,etal.FOXP3 expression and overall survivalin breast cancer[J].JClin Oncol,2009,27(11):1746-1752.
[10]Lopes LF,Guembarovski RL,Guembarovski AL,et al.FOXP3 transcription factor:a candidate marker for susceptibility and prognosis in triple negative breast cancer[J].Biomed Res Int,2014,(2014): 341654.
[11]Ladoire S,Arnould L,M ignot G,et al.Presence of Foxp3 expression in tumor cells predicts better survival in HER2-overexpressing breast cancer patients treated w ith neoadjuvant chemotherapy[J]. Breast Cancer Res Treat,2011,125(1):65-72.
[12]LiW,Wang L,Katoh H,etal.Identification ofa tumor suppressor relay between the FOXP3 and the Hippo pathways in breastand prostate cancers[J].CancerRes,2011,71(6):2162-2171.
[13]Liu R,Liu C,Chen D,et al.FOXP3 controls an m iR-146/NF-kappaB negative feedback loop that inhibitsapoptosis in breast cancer cells [J].Cancer Res,2015,75(8):1703-1713.
[14]Zhang C,Xu Y,Hao Q,et al.FOXP3 suppressesbreast cancermetastasis through downregulation of CD44[J].Int JCancer,2015,137(6): 1279-1290.
[15]Douglass S,Meeson AP,Overbeck-Zubrzycka D,et al.Breast cancer metastasis:demonstration that FOXP3 regulates CXCR4 expression and the response to CXCL12[J].JPathol,2014,234(1):74-85.
[16]Wang L,Liu R,LiW,etal.Somatic single hits inactivate the X-linked tumor suppressor FOXP3 in the prostate[J].Cancer Cell,2009,16(4): 336-346.
[17]Liu R,YiB,WeiS,etal.FOXP3-m iR-146-NF-kappaBAxisand Therapy for Precancerous Lesions in Prostate[J].Cancer Res,2015,75(8):1714-1724.
[18]Santio NM,Salmela M,Arola H,et al.The PIM 1 kinase promotes prostate cancer cellmigration and adhesion viamultiple signalling pathways[J].Exp CellRes,2016,342(2):113-124.
[19]Ma GF,Chen SY,Sun ZR,etal.FoxP3 inhibitsproliferation and induces apoptosisofgastric cancer cellsby activating the apoptotic signaling pathway[J].Biochem BiophysResCommun,2013,430(2):804-809.
[20]Ma GF,M iao Q,Liu YM,etal.High FoxP3 expression in tumour cells predictsbetter survival in gastric cancer and its role in tumourm icroenvironment[J].Br JCancer,2014,110(6):1552-1560.
[21]Suh JH,Won KY,Kim GY,et al.Expression of tumoral FOXP3 in gastric adenocarcinoma is associated w ith favorable clinicopathological variables and related w ith Hippo pathway[J].Int JClin Exp Pathol,2015,8(11):14608-14618.
[22]Hao Q,Zhang C,Gao Y,et al.FOXP3 inhibits NF-kappaBactivity and hence COX2 expression in gastric cancer cells[J].Cell Signal,2014, 26(3):564-569.
[23]Ma C,Peng C,Lu X,etal.Downregulation of FOXP3 inhibits invasion and immune escape in cholangiocarcinoma[J].Biochem Biophys ResCommun,2015,458(2):234-239.
[24]Gerber AL,Munst A,Schlapbach C,et al.High expression of FOXP3 in primarymelanoma is associated w ith tumour progression[J].Br JDermatol,2014,170(1):103-109.
[25]Tan B,Anaka M,Deb S,et al.FOXP3 over-expression inhibitsmelanoma tumorigenesis via effects on proliferation and apoptosis[J]. Oncotarget,2014,5(1):264-276.
[26]Tan B,Behren A,Anaka M,et al.FOXP3 is notmutated in human melanoma[J].Pigment CellMelanoma Res,2012,25(3):398-400.
[27]LiY,LiD,YangW,etal.Overexpression of the transcription factor FOXP3 in lung adenocarcinoma sustainsmalignant character by promoting G1/Stransition gene CCND1[J].Tumour Biol,2016,37(6):7395-7404.
[28]Fu HY,LiC,Yang W,et al.FOXP3 and TLR4 protein expression are correlated in non-smallcell lung cancer:implications for tumor progression and escape[J].Acta Histochem,2013,115(2):151-157.
[29]Grimm ig T,Kim M,Germer CT,et al.The role of FOXP3 in disease progression in colorectalcancer patients[J].Oncoimmunology,2013, 2(6):e24521.
[30]Ganapathi SK,Beggs AD,Hodgson SV,et al.Expression and DNA methylation of TNF,IFNG and FOXP3 in colorectalcancer and their prognostic significance[J].Br JCancer,2014,111(8):1581-1589.
[31]Luo Q,Zhang S,WeiH,et al.Roles of Foxp3 in the occurrence and development of cervical cancer[J].Int JClin Exp Pathol,2015,8(8): 8717-8730.
[32]Huang C,Zhou L,Chang X,et al.B7-H3,B7-H4,Foxp3 and IL-2 expression in cervicalcancer:Associationsw ith patient outcome and clinicalsignificance[J].OncolRep,2016,35(4):2183-2190.
[33]Zeng C,Yao Y,Jie W,et al.Up-regulation of Foxp3 participates in progression of cervicalcancer[J].Cancer Immunol Immunother,2013, 62(3):481-487.
[34]Song JJ,Zhao SJ,Fang J,et al.Foxp3 overexpression in tumor cells predictspoorsurvivalin oralsquamouscellcarcinoma[J].BMCCan-cer,2016,(16):530.
[35]Weller P,BankfalviA,Gu X,et al.The role of tumour Foxp3 asprognosticmarker in different subtypesof head and neck cancer[J].Eur JCancer,2014,50(7):1291-1300.
[36]Cunha LL,MorariEC,NonogakiS,et al.Foxp3 expression isassociated w ith aggressiveness in differentiated thyroid carcinomas[J].Clinics(Sao Paulo),2012,67(5):483-488.
[37]Chu R,Liu SY,Vlantis AC,et al.Inhibition of Foxp3 in cancer cells induces apoptosis of thyroid cancer cells[J].Mol Cell Endocrinol, 2015,(399):228-234.
[38]WinerdalME,Marits P,WinerdalM,etal.FOXP3 and survivalin urinarybladder cancer[J].BJU Int,2011,108(10):1672-1678.
[39]Szylberg L,Karbownik D,Marszalek A.The Role of FOXP3 in Human Cancers[J].Anticancer Res,2016,36(8):3789-3794.(2017-02-16收稿)(2017-04-21修回)
Expression and role of FOXP3 in different humantumors
He REN,Xin LI
Department of Pancreatic Cancer,Tianjin MedicalUniversity Cancer Institute and Hospital;National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer;Tianjin 300060,China
He REN;E-mail:renhe@tjmuch.com
As themost important transcription factor in regulatory Tcells,forkheadbox protein 3(FOXP3)hasbeen extensively investigated in T cells.However,FOXP3,a tumor type-dependent transcription factor,is expressed at different levels in different tumors.In some tumors,FOXP3,as a suppressor,inhibits proliferation andmetastasis.In other tumors,FOXP3,as an oncogene,mediates tumor immune escape.In this review,we summarize the expression levels and functions of FOXP3 in different tumor types to provide evidence for further research.
cancer,transcription factor,FOXP3,oncogene,tumorsuppressorgene
10.3969/j.issn.1000-8179.2017.10.181

天津医科大学肿瘤医院胰腺肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060)
*本文课题受国家自然科学基金项目(编号:81272685)资助
李鑫l570718801@163.com
This work was supported by the NationalNaturalScience Foundation of China(No.81272685)
任贺专业方向为胰腺癌基础与临床转化、抗肿瘤纳米药物设计与开发、胰腺癌分子诊断技术研究。
E-mail:renhe@tjmuch.com
