不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质的影响
2017-06-21蔡路昀马帅李秀霞吕艳芳赵元晖林洪励建荣
蔡路昀,马帅,李秀霞,吕艳芳,赵元晖,林洪,励建荣*
1(渤海大学 食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁 锦州,121013) 2(西南大学 食品科学学院,重庆,400715)3(中国海洋大学 食品科学与工程学院,山东 青岛,266100)
不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质的影响
蔡路昀1, 2,马帅1,李秀霞1,吕艳芳1,赵元晖3,林洪3,励建荣1, 2*
1(渤海大学 食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁 锦州,121013) 2(西南大学 食品科学学院,重庆,400715)3(中国海洋大学 食品科学与工程学院,山东 青岛,266100)
为揭示不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质的影响,以新鲜鲽鱼皮为研究对象,采用酸法和酶法从其中提取胶原蛋白,得到酸溶性胶原蛋白(ASC)和酶促溶性胶原蛋白(PSC),并对这2种胶原蛋白的结构特征和功能性质进行比较研究。紫外光谱扫描结果表明,ASC和PSC在230 nm处均有强吸收峰,在280 nm处无明显的吸收峰,均符合胶原蛋白的结构特征;傅里叶红外光谱扫描结果显示ASC和PSC都存在酰胺A、酰胺B、酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ,均保持了胶原蛋白三维螺旋结构的完整性;SDS-PAGE凝胶电泳证实了ASC和PSC均为Ⅰ型胶原蛋白。吸湿性和保湿性结果表明,随着时间的变化,ASC和PSC的吸湿率呈现逐渐增大的趋势,而其保湿率呈现下降的趋势;浊度及聚集特性结果表明,ASC和PSC溶液的聚集动力学曲线均呈现S型趋势,且在整个过程中ASC的聚集能力大于PSC的聚集能力;吸水性和吸油性结果显示,ASC和PSC均有一定的吸水性和吸油性,且两者的吸油性均大于各自的吸水性。以上结果表明,不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质有一定的影响。
鲽鱼皮;提取方法;胶原蛋白;结构特征;功能性质
鲽鱼(Pleuronichthyscoconuts)又称比目鱼(Pleuronectiformes),是我国海水鱼养殖种类中重要的组成部分。其肉质鲜美、营养丰富,具有较高的食用和经济价值[1-3]。在鲽鱼加工过程中,会产生诸如鱼头、鱼皮、鱼骨、鱼鳞和鱼内脏等加工副产物,这些加工副产物富含蛋白质、脂肪、矿物质、氨基酸和胶原蛋白等物质,具有较高的利用价值。
胶原蛋白(collagen)是动物体内分布最广、含量最多的一种糖蛋白,具有调节细胞、支撑器官和保护机体的作用[4-5]。人们已从哺乳动物体内分离出28种不同遗传类型的胶原蛋白分子[6],胶原蛋白在食品、化妆品及医学材料等行业中都有广泛的应用[7-13]。传统上,胶原蛋白主要来源于猪、牛等陆生动物的皮和骨骼[14-15],然而,近年来牛海绵状脑病(BSE)、传染性海绵状脑病(TSE)及口蹄病(FMD)的爆发引起了人们对牲畜来源生产的胶原蛋白及其衍生产品安全性的担忧[16]。因此,急于寻找一种新的富含胶原蛋白的原料来替代从陆源动物中提取的胶原蛋白。近年来,鱼胶原蛋白因其来源广、低抗原性、低过敏性和使用安全等特点深受研究者的广泛重视。鱼胶原蛋白逐渐替代了传统的胶原蛋白,为鱼类加工副产物的高值化利用提供了一条新的途径。
胶原蛋白的提取方法可分为:热水提取法、酸法、碱法、酶法及中性盐提取法[17]。不同的提取方法对所提取的胶原蛋白结构特征和功能性质存在着不同程度的影响[18]。本文以新鲜的鲽鱼皮为原料,采用酸法和酶法从其中提取胶原蛋白,得到ASC和PSC,并对这2种胶原蛋白的结构特征和功能性质进行比较研究。
1 材料与方法
1.1 材料与试剂
新鲜鲽鱼于2016年5月2日,由大连天宝绿色食品股份有限公司提供,规格一致,每条鱼质量为(1 000±50) g;胃蛋白酶(50万 U/g),吉宝(青岛)生物科技有限公司;NaOH、正丁醇、冰乙酸、NaCl、KBr、十二烷基硫酸钠(SDS)、丙烯酰胺(Acr)、四甲基乙二胺(TEMED)、三羟甲基氨基甲烷(Tris)、N, N’-甲叉双丙烯酰胺(Bis)、β-巯基乙醇、过硫酸铵(APS)、甘氨酸(Glycine)、溴酚蓝(BPB)和考马斯亮蓝R-250等均为优级纯,购于锦州国药器化玻有限公司;标准蛋白(分子质量10 k~200 ku),购于加拿大Fermentas公司。
1.2 仪器与设备
PL602-L电子天平,梅特勒-托利多仪器(上海)有限公司;Free Zone2.5真空冷冻干燥机,美国Labconco公司;Milli-Q超纯水系统,美国Millipore公司;Biofuge stratos台式高速冷冻离心机,美国Thermo公司;UV-2550型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;Scimitar 2000傅里叶变换红外光谱仪,美国Agilent公司;Mini Protean 3凝胶电泳仪,美国Bio-Rad公司;ZD-9556脱色摇床,常州市凯航仪器有限公司;GS-800拍照系统,美国Bio-Rad公司;HTC-100恒温恒湿培养箱,上海三腾仪器有限公司;SZ-1快速混匀器,江苏金坛市金城国胜实验仪器厂;DF-101S集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司。
1.3 实验方法
1.3.1 鲽鱼皮的制备
将新鲜的鲽鱼采用击晕处死→在冰上取下鱼皮,剔除鱼皮上残留的鱼鳞和碎肉等杂质,再用超纯水冲洗干净,剪成0.5 cm×0.5 cm大小,在-20 ℃下贮藏、备用。
1.3.2 鲽鱼皮的预处理
参考MATMAROH[6]等的方法略作修改,取一定量的鱼皮,先用超纯水冲洗3次,除去鱼皮上残留的杂质。在4 ℃下,以料液比1∶20(g∶mL)加入0.1 mol/L的NaOH溶液搅拌浸泡24 h,每6 h更换1次NaOH溶液,以除去鱼皮中的非胶原蛋白和色素,然后用超纯水冲洗鱼皮至中性,充分沥干后,以料液比1∶30(g∶mL)加入10%正丁醇搅拌浸泡24 h,每6 h更换1次正丁醇溶液,以除去脂肪,然后用超纯水冲洗鱼皮至中性,充分沥干,备用。
1.3.3 酸法提取鲽鱼皮胶原蛋白的工艺流程
参考WU[4]等的方法略作修改,取适量的预处理鱼皮,以料液比1∶30(g∶mL)加入0.5 mol/L的冰乙酸溶液,在4℃低速搅拌24 h,在4℃条件下10 000 r/min离心15 min,取上清液,然后将未提取彻底的鱼皮再次用等量的0.5 mol/L冰乙酸溶液提取,反复提取3次后,混合上清液,再向上清液中加入一定量的氯化钠搅拌,至最终盐浓度为0.9 mol/L,静置12 h;在4℃条件下5 000 r/min离心20 min后弃上清液,再将沉淀溶于0.5 mol/L冰乙酸溶液,以8 000 r/min离心20 min除去不溶性杂质,经3次盐析后,将沉淀先用0.1 mol/L的冰乙酸溶液透析12 h,每6 h换1次透析液,再用超纯水进行透析,每6 h换1次超纯水。直到透析液中不存在银离子时,停止透析,最后对透析过的胶原蛋白溶液进行冷冻干燥,得到ASC。
1.3.4 酶法提取鲽鱼皮胶原蛋白的工艺流程
参考WANG[19]等的方法略作修改,取经过前处理的鲽鱼皮,放入30倍的超纯水中,用0.5 mol/L冰乙酸溶液调节pH值为1.9左右,加入鲽鱼皮质量4%的胃蛋白酶,在4℃低速搅拌24 h,在4℃条件下10 000 r/min离心15 min,取上清液,然后将未提取彻底的鱼皮用同样的方法重提一次,合并2次离心后的上清液,先加入NaOH溶液使溶液pH值至8.0以上,使酶失去活性,后续方法同1.3.3,最后对透析过的胶原蛋白溶液进行冷冻干燥,得到PSC。
1.3.5 ASC和PSC的紫外全波长扫描(UV)
参考JEEVITHAN[20]等的方法稍作修改,分别取适量干燥的ASC和PSC样品溶于0.5 mol/L的冰乙酸溶液中,配制成0.5 mg/mL的胶原蛋白溶液,以0.5 mol/L的冰乙酸溶液作空白对照。在190~400 nm近紫外光区以2 nm/s的速度对胶原蛋白溶液进行扫描,分辨率为0.5 nm。
1.3.6 ASC和PSC的红外光谱扫描(FT-IR)
参考CHEN[21]等的方法稍作修改,分别取适量干燥的ASC和PSC样品与干燥的KBr于玛瑙研钵中研磨均匀,装样,手动压片,取出样品迅速小心放入样品室,用Scimitar 2000傅里叶变换红外光谱仪在4 000~500 cm-1范围内进行检测,分辨率为0.5 cm-1。
1.3.7 ASC和PSC的SDS-PAGE电泳分析
参考LAEMMLI等[22]的方法稍作修改,分别将ASC和PSC样品溶于0.1 mol/L的冰乙酸溶液中配制成1 mg/mL的胶原蛋白溶液,以体积比1∶2的比例与上样缓冲液(250 mmol/L Tris-HCl pH 6.8、10%SDS、0.5%BPB、50%甘油)混合,之后以体积比1∶2的比例加入10%β-巯基乙醇,用移液枪混匀后沸水蒸煮3 min,电泳采用12%分离胶和4%浓缩胶,与蛋白质Marker一起上样,采用直流稳定电源,浓缩胶电压为80 V,进入分离胶之后电压加至120 V,结束后取出电泳胶后将胶片转移到染色盒中,加入染色液(0.25%考马斯亮蓝+10%冰乙酸+40%乙醇),在摇床上染色40 min,随后采用乙醇-冰乙酸脱色40 min,最后采用凝胶成像系统进行拍照。
1.3.8 ASC和PSC的吸湿性和保湿性
吸湿性测定:精确称取干燥的ASC和PSC样品各0.500 g,分别置于称量瓶中,放入密闭恒温恒湿箱(温度30 ℃,湿度60%)中,每隔一段时间精确测定样品的重量,同时用甘油作对照,做3次平行试验,计算样品和甘油的吸湿率,以时间为横坐标,吸湿率为纵坐标作吸湿曲线[23-24]。按公式(1)计算吸湿率:
(1)
式中:X为吸湿率;mt为t小时后样品或甘油的质量,g;m0为试验开始时样品或甘油的质量,g。
保湿性测定:精确称取ASC和PSC样品各0.500 g,分别置于称量瓶中,同时在各称量瓶中加入样品质量10%的超纯水,将称量瓶放入干燥器中,每隔一段时间测定每个样品重量,同时以甘油作对照,做3次平行试验,计算样品和甘油的保湿率,以时间为横坐标,保湿率为纵坐标作保湿曲线[23-24]。按公式(2)计算保湿率:
(2)
式中:Y为保湿率;m0为试验开始时样品或甘油的含水量,g;mt为t小时后样品或甘油的含水量,g。
1.3.9 ASC和PSC的浊度与聚集特性测定
参考COBOS等[25]的方法稍作修改,取适量干燥的ASC和PSC样品溶于浓度为0.2 mol/L磷酸盐缓冲溶液(pH 6.8)中,配制成质量浓度为5 mg/mL的胶原蛋白溶液,后置于30 ℃水浴中,以0.2 mol/L的磷酸盐缓冲溶液作空白对照。每隔2 h,采用UV-2550型紫外可见分光光度计测定其在300 nm波长处的吸光度值,以表征溶液中胶原蛋白是否聚集。
1.3.10 ASC和PSC的吸水性和吸油性
吸水性(water absorption capacity, WAC)测定参考闫明艳[26]的方法稍作修改,分别精确称取0.020 g ASC和PSC样品与25 mL(V0)的超纯水混合,然后在SZ-1型快速混匀器上尽快混合30 s,在室温(22℃)下静置0.5 h,然后以5 000×g离心0.5 h,记录上清液的体积(V1)。按照公式(3)计算吸水性:
(3)
式中:V0为加入超纯水的体积(25 mL);V1为离心后上清液的体积,mL;m为加入ASC的样品质量,g。
吸油性(oil absorption capacity, OAC)测定参考闫明艳[26]的方法稍作修改,分别精确称取0.020 g ASC和PSC样品与25 mL(Vh)的花生油混合,然后在SZ-1型快速混匀器上尽快混合30 s,在室温(22℃)下静置0.5 h,然后以5000×g离心0.5 h,记录上清液的体积(Vs)。按照公式(4)计算吸油性:
(4)
式中:Vh为加入花生油的体积(25 mL);Vs为离心后上清液的体积,mL;m为加入ASC的样品质量,g。
1.4 数据处理
每个实验均重复3次,采用Excel 2003软件及Orign 8.5软件进行数据统计分析与作图;采用SPSS statistics 19.0分析显著性差异(P<0.05)。
2 结果与分析
2.1 ASC和PSC的紫外光谱扫描分析结果
一般来说,大多数蛋白质均含有色氨酸、苯丙氨酸等氨基酸,在280 nm处一般有特征吸收峰,然而胶原蛋白基本上不含以上氨基酸,因此在280 nm处不会出现强吸收峰。又由于胶原蛋白含有脯氨酸和羟脯氨酸,在230 nm左右有强的吸收峰,这一特点可以作为鉴定胶原蛋白的一个方法[27]。鲽鱼皮ASC和PSC紫外吸收图谱如图1所示。
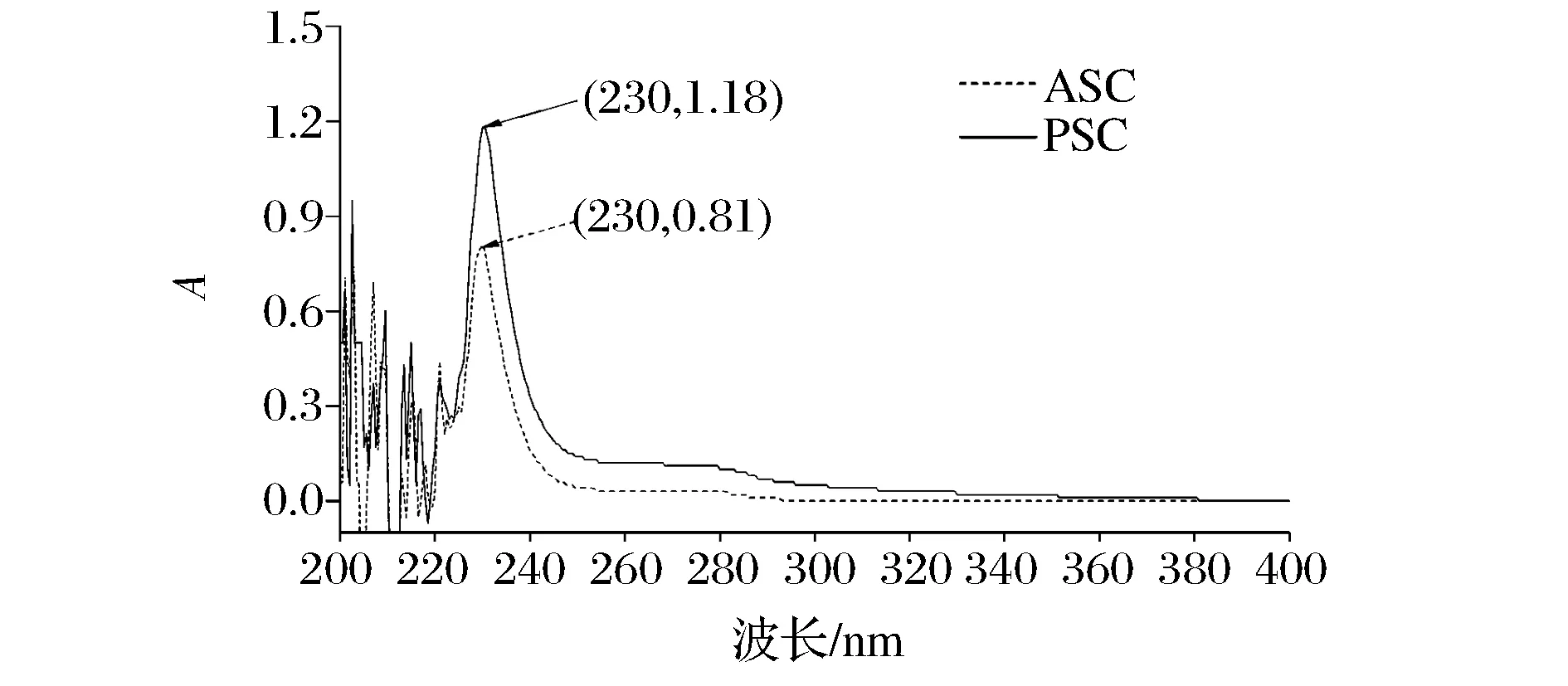
图1 鲽鱼皮ASC和PSC的紫外吸收光谱Fig.1 The ultraviolet absorption spectroscopy of ASC and PSC from flounder skin

2.2 ASC和PSC的红外光谱扫描分析结果
酰胺A与N—H基团的伸缩振动有关,其中在红外光谱中N—H基团伸缩振动所产生的酰胺A的吸收峰往往在3 400~3 440 cm-1,然而,当含有N—H基团的分子肽段参与氢键的形成时,N—H的伸缩振动会向低频率移动,使N—H的伸缩振动产生的吸收峰减低到3 300 cm-1左右[30]。由表1和图2可知,ASC 和PSC的酰胺A的吸收峰分别位于3 334、3 325 cm-1,均符合酰胺A的特征吸收,说明了PSC有更多的N—H基团参与氢键的形成;而由于蛋白质分子的亚甲基基团会发生不对称的伸缩振动,使得ASC 和PSC的酰胺B的吸收峰分别位于2 926 cm-1、2 929 cm-1;由于羰基的伸缩振动导致了酰胺Ⅰ和酰胺Ⅱ的存在,这与肽链之间的交联程度有关,振动频率越大说明肽链结合越紧密,ASC 和PSC的酰胺Ⅰ的吸收峰分别位于1 643、1 631 cm-1,酰胺B的吸收峰分别位于1 531、1 537 cm-1,说明 PSC比ASC的3条α-肽链结合得更紧密;一般来说,酰胺Ⅲ的存在可以说明胶原蛋白的三维螺旋结构能否保持完整,且其吸收峰往往在1 200~1 300 cm-1处。从表1和图2中可知,ASC和PSC分别在1 240、1 242 cm-1处有明显的吸收峰,这表明ASC和PSC均存在酰胺Ⅲ带,说明酸法和酶法提取胶原蛋白保持了胶原蛋白三螺旋结构的完整性。

表1 鲽鱼皮ASC和PSC红外光谱出峰位置及图谱解析
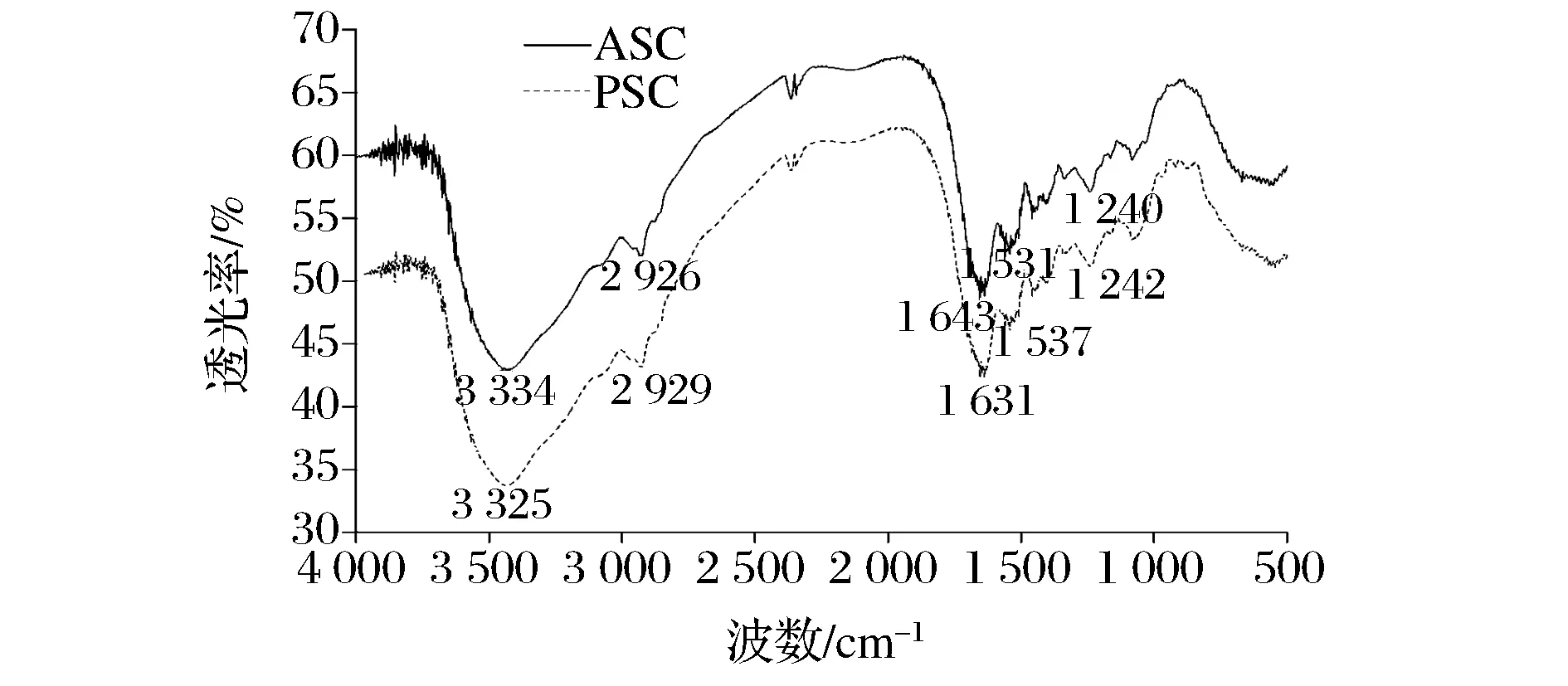
图2 鲽鱼皮ASC和PSC的红外光谱图Fig.2 The infrared spectra of ASC and PSC from flounder skin
2.3 ASC和PSC的SDS-PAGE电泳图谱分析
鲽鱼皮ASC和PSC的SDS-PAGE图谱如图3所示。
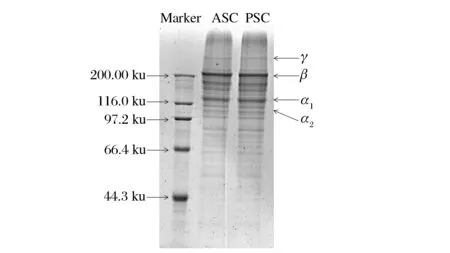
图3 鲽鱼皮ASC和PSC的SDS-PAGE电泳图谱Fig.3 SDS-PAGE electrophoresis pattern of ASC and PSC from flounder skin
从图3可以看出,鲽鱼皮ASC和PSC中均存在α、β和γ组分,其中2种胶原蛋白均含有2条α链,分别为α1和α2链,分子质量在116.0 ku附近,且比例接近2∶1,这符合Ⅰ型胶原蛋白的特征[31]。在分子质量200.0 ku附近出现β链,说明胶原蛋白分子中存在分子内和分子间的交联作用。相比于ASC,PSC中的β和γ链的含量有所降低,α链含量有所升高,这可能是由于胃蛋白酶的作用使部分胶原蛋白降解成小分子造成的[32]。
2.4 ASC和PSC的吸湿性和保湿性
胶原蛋白作为一种重要的化妆品原材料,其吸水性和保湿性是护肤化妆品的关键指标,这2个指标的测定可以为鲽鱼皮ASC和PSC在化妆品的应用提供一定的科学依据,同时对ASC和PSC吸湿性和保湿性的差异进行分析研究,可以更好地指导人们选择更适合的胶原蛋白产品。从图4-A可以看出,随着时间的变化,酸法和酶法提取的胶原蛋白的吸湿率变化曲线类似,均呈随着时间的延长其吸湿率逐渐增大的趋势,由于提取方法的不同,导致了ASC和PSC暴露的亲水集团也存在差异,造成了胶原蛋白的吸湿性呈现PSC>ASC;由图4-B可知,随着时间的延长,其ASC和PSC的保湿性均呈现下降的趋势,保湿性也与样品的结构和暴露的亲水基团有关,从图4-B可以看出,甘油的保湿效果最好,PSC保湿效果相对优于ASC。
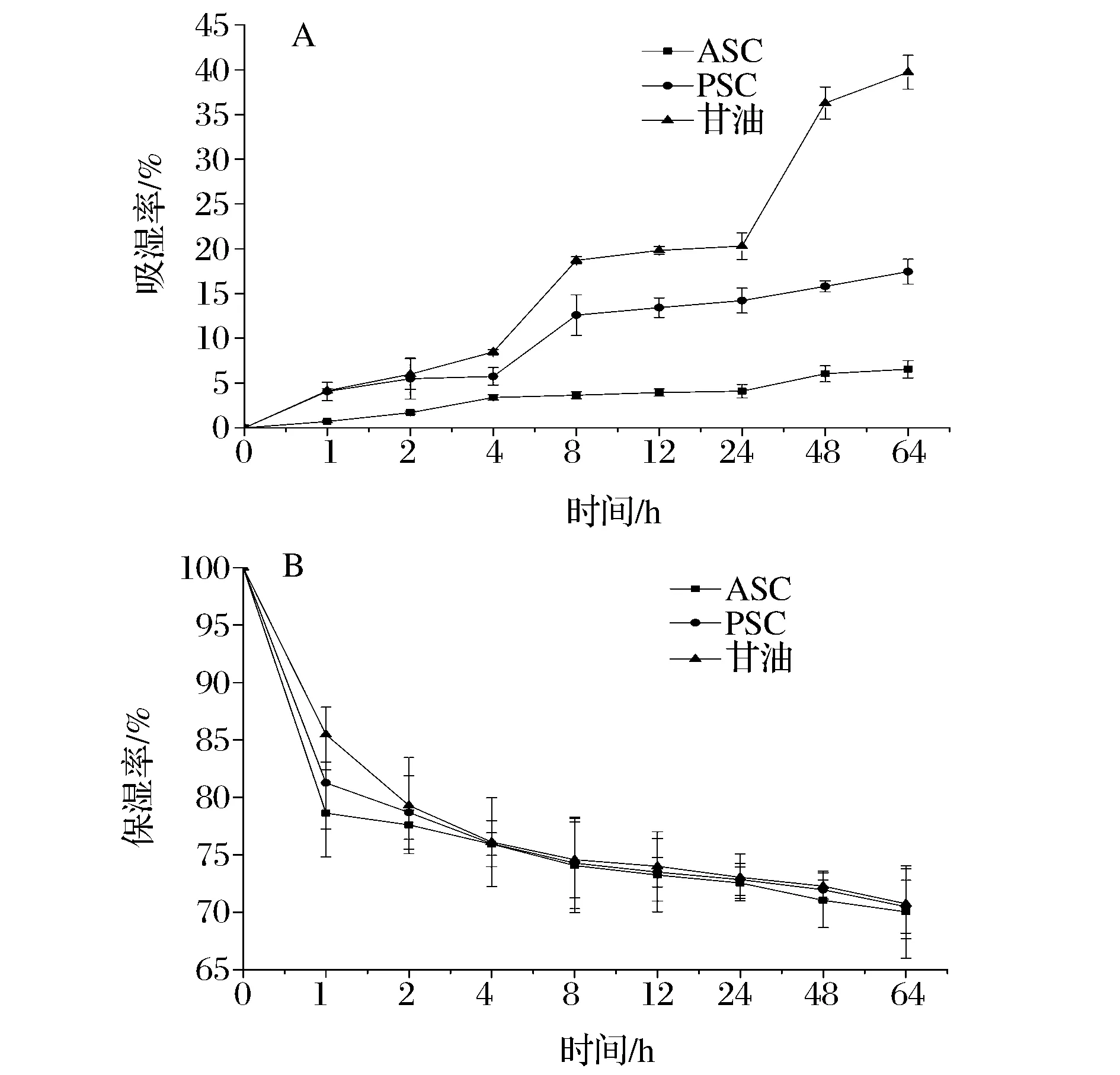
图4 鲽鱼皮ASC、PSC和甘油的吸水性(A)和保湿性(B)曲线Fig.4 The curve of water absorption (A) and moisture (B) aboutASC and PSC from flounder skin and glycerol
2.5 鲽鱼皮ASC和PSC的浊度及聚集特性分析
HUELIN等[33]研究表明,在体外,胶原蛋白能够在25~37 ℃和近中性条件下发生聚集。从理论上讲胶原蛋白溶液在紫外可见范围的吸光度值可以作为胶原蛋白样品溶液中颗粒直径和浓度的测定指标,因此,测定反应过程中胶原蛋白溶液的吸光度值,可以动态地跟踪聚集过程中聚集体的浓度和大小的变化趋势。鲽鱼皮ASC和PSC溶液的聚集动力学曲线如图5所示,由图5可知,随着时间的延长,ASC和PSC溶液的聚集动力学曲线均呈现S型趋势,且在整个过程中ASC的聚集能力大于PSC的聚集能力,这可能是因为胃蛋白酶的作用使其部分胶原蛋白水解成多肽所致,这与Na等[34]的研究结果相类似。
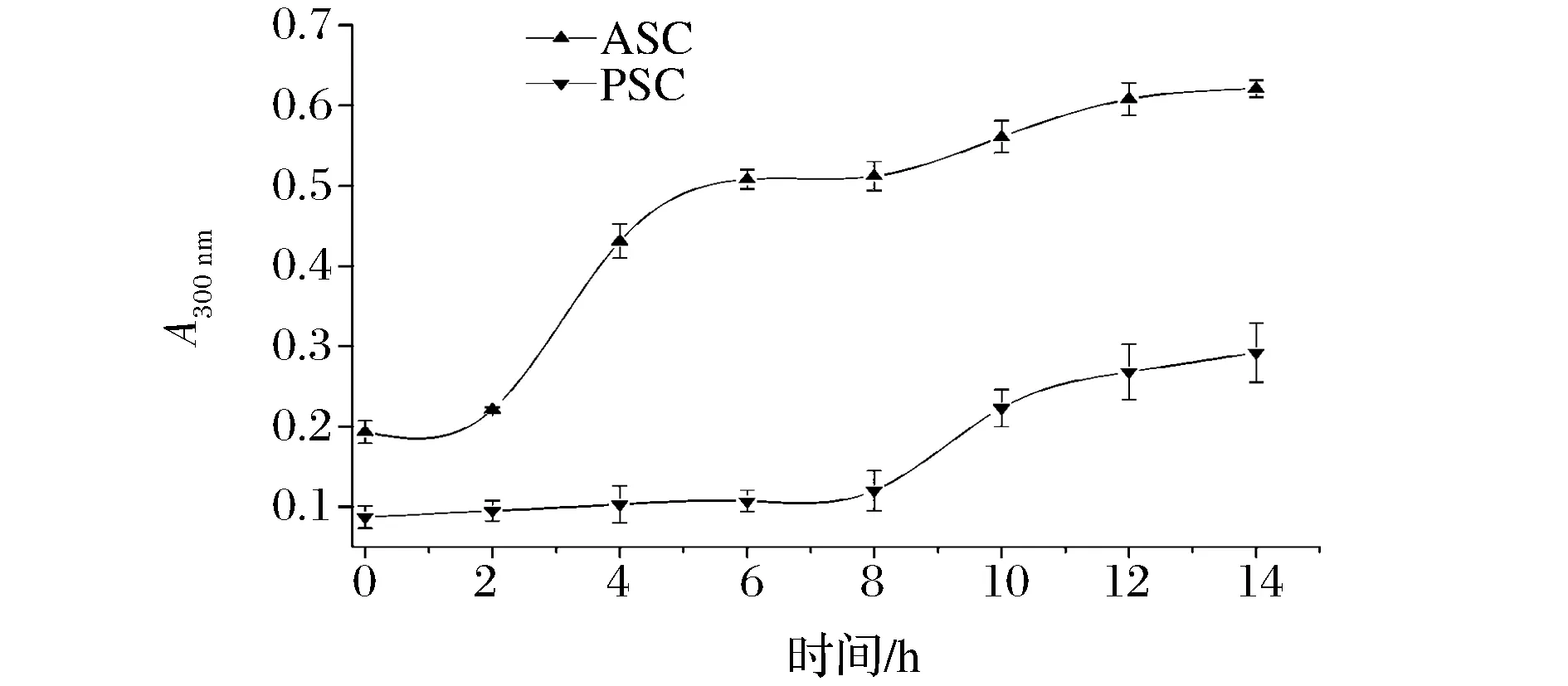
图5 鲽鱼皮ASC和PSC的聚集动力学曲线Fig.5 Aggregation kinetic curves of ASC and PSC from flounder skin
2.6 ASC和PSC的吸水性和吸油性
鲽鱼皮ASC和PSC的吸水性和吸油性测定结果如图6所示。
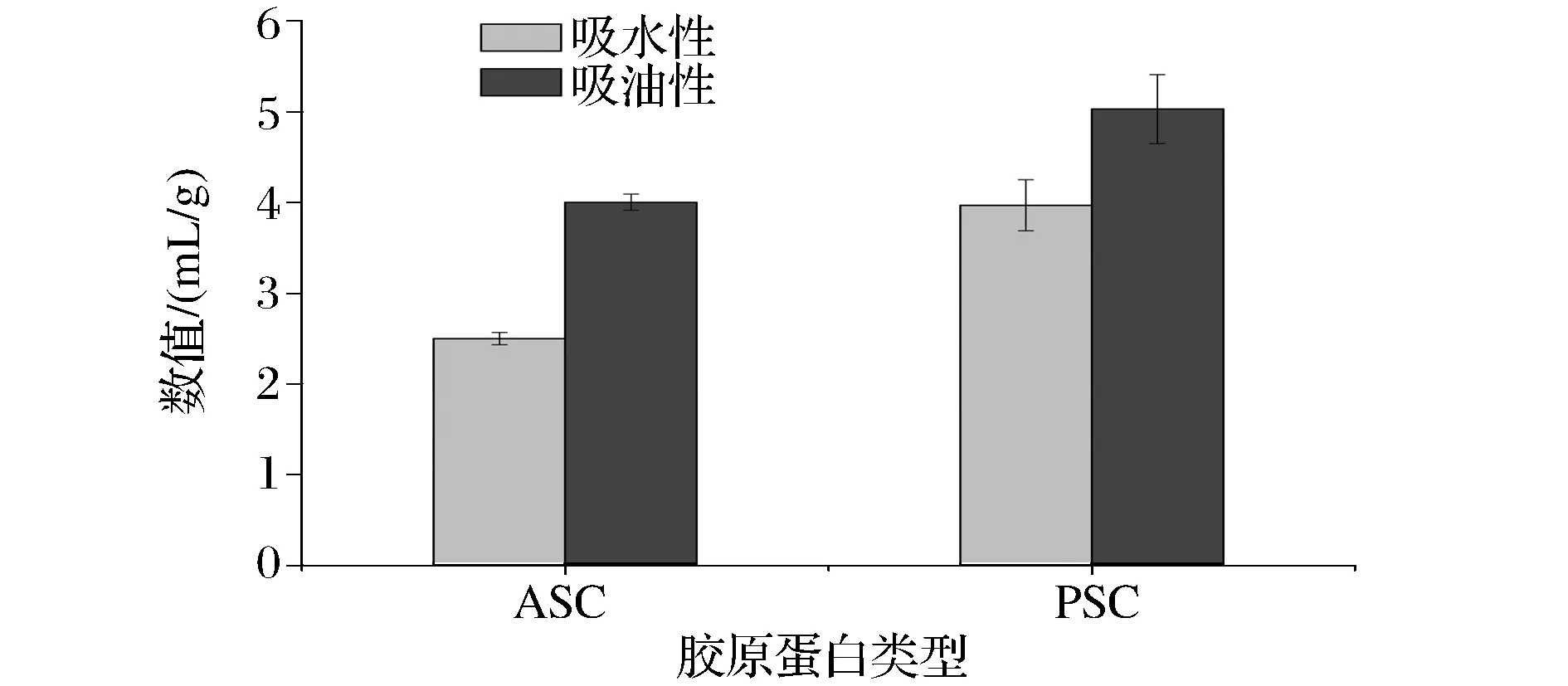
图6 鲽鱼皮ASC和PSC的吸水性和吸油性Fig.6 Water and oil absorption capacity of ASC and PSC from flounder skin
由图6可知,ASC和PSC均有一定的吸水性和吸油性,且两者的吸油性均大于各自的吸水性,又PSC的吸水性((3.970±0.280) mL/g)和吸油性((5.030±0.380) mL/g)均略高于ASC的吸水性[(2.500±0.068) mL/g]和吸油性[(4.003±0.089) mL/g],这可能是因为酶法提取法制备的胶原蛋白含有较多的亲水基团和疏水集团导致其吸水性和吸油性增大[35]。这与曾庆祝等[36]的研究结果相一致。
3 结 论
本文以新鲜鲽鱼皮为研究对象,采用酸法和酶法从其中提取胶原蛋白,得到ASC和PSC,并研究了ASC和PSC的结构特征及功能性质。
(1)紫外扫描光谱结果发现,ASC和PSC在230 nm左右有较强的吸收峰,在280 nm处无明显的吸收峰,ASC和PSC的特征吸收峰相差不明显,由此证明ASC和PSC的一级结构有一定的相似性;
(2)红外光谱扫描结果发现,ASC和PSC分别在1 240、1 242 cm-1处有明显的吸收峰,这表明ASC和PSC均存在酰胺Ⅲ带,说明酸法和酶法提取胶原蛋白保持了胶原蛋白三螺旋结构的完整性;
(3)SDS-PAGE电泳图谱表明,ASC和PSC中均存在α、β和γ组分,其中这2种胶原蛋白均含有两条α链,分别为α1和α2链,分子质量在116.0 ku附近,且比例接近2∶1,这符合Ⅰ型胶原蛋白的特征,相比于ASC,PSC中的β和γ链的含量有所降低,α链含量有所升高;
(4)随着时间的延长,ASC和PSC溶液的聚集动力学曲线均呈现S型趋势,且在整个过程中ASC的聚集能力大于PSC的聚集能力;ASC和PSC均有一定的吸水性、吸油性和吸湿性、保湿性。
综上所述,ASC和PSC的结构特征和功能性质略有差异,可以根据这2种胶原蛋白不同的结构特征和功能性质应用在不同领域,以期为鲽鱼皮综合利用以及高值化产品的开发提供一定的理论基础和科研依据。
[1] JOKINEN H, WENNHAGE H, LAPPALAINEN A, et al. Decline of flounder (Platichthysflesus(L.)) at the margin of the species' distribution range[J]. Journal of Sea Research, 2015, 105: 1-9.
[2] NISSLING A, THORSEN A, DA SILVA FF G. Fecundity regulation in relation to habitat utilisation of two sympatric flounder (Platichtysflesus) populations in the brackish water Baltic Sea[J]. Journal of Sea Research, 2015, 95: 188-195.
[3] 农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2015.
[4] WU X, CAI L, CAO A, et al. Comparative study on acid-soluble and pepsin-soluble collagens from skin and swim bladder of grass carp (Ctenopharyngodonidella) [J]. Journal of the Science of Food and Agriculture, 2016, 96(3): 815-821.
[5] PATI F, ADHIKARI B, DHARA S. Isolation and characterization of fish scale collagen of higher thermal stability[J].Bioresource Technology, 2010, 101(10): 3 737-3 742.
[6] MATMAROH K, BENJAKUL S, PRODPRAN T, et al. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneusheptacanthus) [J]. Food Chemistry, 2011, 129(3): 1 179-1 186.
[7] 楚水晶, 农绍庄, 柳春山. 酶法提取马面鱼鱼皮胶原蛋白的工艺研究[J]. 食品科技, 2010, 35(5) : 234-237.
[8] HARRIS J R, SOLIAKOV A, LEWIS R J. In vitrofibrillogenesis of collagen type I in varying ionic and pH conditions[J]. Micron, 2013, 49: 60-68.
[9] NEEL E AA, BOZEC L, KNOWLES J C, et al. Collagen-emerging collagen based therapies hit the patient[J]. Advanced Drug Delivery Reviews, 2013, 65(4): 429-456.
[10] MIYAMOTO T, SHIMIZU Y, KOBAYASHI H, et al.Studies of collagen binding with immobilized Salmonella enteritidis and inhibition with synthetic and naturally occurring food additives by a surface plasmon resonance biosensor[J]. Sensors and Materials, 2003, 15(8): 453-466.
[11] WASZKOWIAK K, DOLATA W. The application of collagen preparations as carriers of rosemary extract in the production of processed meat[J]. Meat Science, 2007, 75(1): 178-183.
[12] BRONGO S, MOCCIA L S, NUNZIATA V, et al.Keratoacanthoma arising after site injection infection of cosmetic collagen filler[J]. International Journal of Surgery Case Reports, 2013, 4(4): 429-431.
[13] KIM S H, PARK H S, LEE O J, et al.Fabrication of duck’s feet collagen-silk hybrid biomaterial for tissue engineering[J]. International Journal of Biological Macromolecules, 2016, 85: 442-450.
[14] CAO H, ZHAO Y, ZHU Y B, et al. Antifreeze and cryoprotective activities of ice-binding collagen peptides from pig skin[J]. Food Chemistry, 2016, 194: 1245-1253.
[15] QIANG T, WANG X, WANG X,et al. Study on the improvement of water vapor permeability and moisture absorption of microfiber synthetic leather base by collagen[J]. Textile Research Journal, 2015, 85(13): 1 394-1 403.
[16] AHMAD M, BENJAKUL S. Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (aluterus monocerous)[J]. Food Chemistry, 2010, 120(3): 817-824.
[17] WANG L, ZOU Y, JIANG S, et al. Chromatographic separation and physicochemical properties of collagen species in the skin of deep-sea redfish (Sebastesmentella)[J]. Food Hydrocolloids, 2011, 25(5): 1 134-1 138.
[18] 郝淑贤, 林婉玲, 李来好, 等. 不同提取方法对罗非鱼皮胶原蛋白理化特性的影响[J]. 食品科学, 2014, 35 (15) : 59-62.
[19] WANG L, LIANG Q, CHEN T,et al. Characterization of collagen from the skin of Amur sturgeon (Acipenserschrenckii) [J]. Food Hydrocolloids, 2014, 38: 104-109.
[20] JEEVITHAN E, WU W, NANPING W, et al. Isolation, purification and characterization of pepsin soluble collagen isolated from silvertip shark (Carcharhinusalbimarginatus) skeletal and head bone[J]. Process Biochemistry, 2014, 49(10): 1 767-1 777.
[21] CHEN J, LI L, YI R, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromisniloticus)[J]. LWT-Food Science and Technology, 2016, 66: 453-459.
[22] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[23] 施昌松, 崔凤玲, 张洪广, 等. 化妆品常用保湿剂保湿吸湿性能研究[J]. 日用化学品科学, 2007, 30(1): 25-30.
[24] 陶宇, 李志皓, 侯虎, 等. 不同方法提取沙海蜇皮胶原蛋白的对比分析[J]. 食品工业科技, 2012, 33(14): 310-312,326.
[25] COBOS E S, FILIMONOV V V, GLVEZ A, et al. The denaturation of circular enterocin AS-48 by urea and guanidinium hydrochloride[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2002, 1598(1): 98-107.
[26] 闫明艳. 狭鳕鱼皮胶原蛋白结构和物理特性的研究[D]. 青岛: 中国海洋大学, 2009.
[27] 赵苍碧, 黄玉东,李艳辉.从牛腱中提取胶原蛋白的研究[J].哈尔滨工业大学学报, 2004, 36(4): 516-519.
[28] DUAN R, ZHANG J, DU X, et al. Properties of collagen from skin, scale and bone of carp (Cyprinuscarpio)[J]. Food Chemistry, 2009, 112(3): 702-706.
[29] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadfin bream (Nemipterushexodon): Characteristics and effect of pepsin hydrolysis[J]. Food Chemistry, 2011, 125(2): 500-507.
[30] LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69.
[31] ZHANG J, DUAN R, TIAN Y, et al.Characterisation of acid-soluble collagen from skin of silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2009, 116(1): 318-322.
[32] ZHANG M, LIU W, LI G. Isolation andcharacterisation of collagens from the skin of largefin longbarbel catfish (Mystusmacropterus)[J]. Food Chemistry, 2009, 115(3): 826-831.
[33] HUELIN S D, BAKER H R, PODUSKA K M, et al. Aggregation and adsorption of type I collagen near an electrified interface[J]. Macromolecules, 2007, 40(23): 8 440-8 444.
[34] NA G C, BUTZ L J, BAILEY D G, et al. In vitro collagen fibril assembly in glycerol solution: evidence for a helical cooperative mechanism involvingmicrofibrils[J]. Biochemistry, 1986, 25(5): 958-966.
[35] 陈日春, 郑宝东. 鲢鱼鱼鳞酶溶性胶原蛋白理化特性研究[J]. 中国食品学报, 2013, 13(12): 83-88.
[36] 曾庆祝, 许庆陵, 郭恒斌. 鱿鱼皮胶原蛋白的功能特性[J]. 水产学报, 2009, 33(1): 139-145.
Effects of different extraction methods on structure characteristics and functional properties of collagen from the skin of flounder (Pleuronichthyscornutus)
CAI Lu-yun1,2, MA Shuai1, LI Xiu-xia1, LYU Yan-fang1, ZHAO Yuan-hui3,LIN Hong3, LI Jian-rong1, 2*
1(College of Food Science and Engineering of Bohai University, National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Lab of Liaoning Province,Jinzhou 121013, China) 2(College of Food Science, Southwest University, Chongqing 400715, China) 3(College of Food Science and Engineering, Qingdao 266100, China)
To reveal the effects of different extraction methods on structure characteristics and functional properties of collagen from flounder skin, ASC and PSC were extracted from the skin of flounder and the structure characteristics and functional properties were compared and studied. Ultraviolet spectrum scanning revealed that ASC and PSC had a strong absorption peak at 230 nm, and there was not a strong absorption peak at 280 nm, which demonstrated the two kinds of proteins were in accordance with the characteristics of the collagen. The ASC and PSC proved the existences of amide A, amide B, amideⅠ, amideⅡ, amideⅢ, revealing that ASC and PSC were very similar in their protein secondary structures. SDS-PAGE profiles confirmed that both ASC and PSC were type I collagen. Moisture retention and hygroscopicity indicated that moisture absorption rate of PSC was significantly higher than ASC (P<0.05). However, there was not significant difference for ASC and PSC in moisture-retention ability (P>0.05). With the extension of time, the aggregation kinetics curves of ASC and PSC showed a S trend, and the aggregation ability of ASC was higher than that of PSC in the whole process. Water absorption capacity (WAC) and oil absorption capacity (OAC) indicated that both ASC and PSC had a certain water absorption and oil absorption capacity, suggesting that the WAC and OAC of PSC were higher than that of ASC. These results described above showed that different extraction methods had certain effects on structure characteristics and functional properties of collagen from flounder skin.
Pleuronichthyscornutus; fish skin; extraction methods; collagen; structure characteristics; functional properties
10.13995/j.cnki.11-1802/ts.201705039
博士,副教授(励建荣教授为通讯作者,E-mail: li34008@126.com)。
国家自然科学基金(31401478);中国博士后基金面上项目(2015M570760);辽宁省自然科学基金(20170540006);重庆市博士后特别资助项目(Xm2015021)
2016-07-01,改回日期:2016-08-02
