QuEChERS—超高效液相色谱—串联质谱法测定食用菌中7种荧光增白剂
2017-06-21张宪臣李蓉周艳萍薄艳娜王京力胡
张宪臣+李蓉+周艳萍+薄艳娜+王京力+胡仪光
摘 要 建立了QuEChERS超高效液相色譜串联质谱法(UPLCMS/MS)测定食用菌中7种荧光增白剂残留量的检测方法。样品前处理采用QuEChERS方法, 食用菌样品用水浸润后, 以甲酸和乙腈提取目标物, C18填料、正丙基乙二胺(PSA)和MgSO4净化, C18色谱柱分离, 乙腈和0.1%甲酸梯度洗脱, 多反应监测(MRM)正离子模式扫描。在优化条件下, 7种荧光增白剂在一定质量浓度范围内线性关系良好, 相关系数均大于0.991, 方法检出限(S/N=3)在0.05~0.40 μg/kg之间, 定量低限(S/N≥10)在0.2~1.3 μg/kg之间, 方法的平均回收率在70.1%~109.2%之间。本方法具有操作简单快捷、灵敏度高等优点。
关键词 超高效液相色谱串联质谱法; 荧光增白剂; 食用菌
1 引 言
荧光增白剂(Fluorescent whitening agents, FWAs)是一种荧光染料, 又称为白色染料, 是一种能吸收不可见的紫外光(波长300~400 nm), 再激发出可见的蓝色或蓝紫色荧光(波长420~480 nm)的复杂有机化合物[1]。食用菌中荧光增白剂的来源主要有两方面: 人为添加和包装材料污染。食用菌中常检测到的荧光增白剂包括化学结构属香豆素类型荧光增白剂(如C.I. 140)、化学结构属吡唑啉类型荧光增白剂(如C.I. 135、C.I. 185、 C.I. 367、C.I. 393、 C.I. 184)和化学结构属三嗪氨基二苯乙烯型荧光增白剂(如C.I. 353), 这些荧光增白剂在人体内不易被分解, 其毒性累积在肝脏或其它重要器官, 成为潜在的致癌因素[2]。国家卫生标准GB/T 307982014食品用洗涤剂试验方法——荧光增白剂的测定中明确规定: 食品包装用原纸、餐具洗涤剂、食品工具设备用洗涤剂与洗涤消毒剂中均不得检出荧光性物质, 但至今未见关于食用菌中荧光增白剂的测定的国家和行业标准, 仅有2009年四川省地方标准DB 51/T9072009食用菌中荧光增白剂检验规程的相关报道, 但是该标准采用紫外分光光度法进行检测, 仅能对食用菌中荧光增白剂进行定性分析, 无法对荧光增白剂的种类和含量进行测定, 且人为误差大。
目前, 荧光增白剂的检测方法主要有光谱法和色谱法。 光谱法包括白度法、荧光分光光度法和紫外分光光度法; 色谱法则包括高效液相色谱法(HPLC)[3]和高效液相色谱法质谱联用法(HPLCMS/MS)[4~9]等。光谱法只能对荧光增白剂进行半定量检测, 且受人为因素和设备的影响较大; 对于组成复杂的样品, 测定结果的准确性难以保证, 不适用于监督执法部门的相关执法检测。液相色谱法只能依靠化合物的保留时间定性, 易受杂质干扰。液相色谱质谱联用法采用保留时间与特征离子对比例对已知目标物进行定性和定量分析, 准确性和灵敏度优势明显。目前, 对食品接触材料中的荧光增白剂研究较多[10], 尚未见关于食用菌中荧光增白剂检测的报道。黄薇等[11]采用高效液相色谱法测定食用菌中10种荧光增白剂, 张建莹等[12]采用超高效液相色谱法质谱联用法(UPLCMS/MS)测定食用菌中3种荧光增白剂, 这些研究均采用固相萃取对样品进行前处理。QuEChERS(Quick, Easy, Cheap, Effective, Rugged and Safe)是基于分散固相萃取发展起来的一种集萃取和净化为一体的新型前处理方法, 能够有效缩短前处理时间, 提高检测效率, 已在农药残留检测、临床医学、兽药及医药残留等领域中广泛应用[4~12] 。本研究利用QuEChERS前处理方法对食用菌中荧光增白剂进行净化处理, 平行定量浓缩仪浓缩提取液, 采用UPLCMS/MS进行测定, 建立食用菌中7种常用的荧光增白剂的检测方法。
2 实验部分
2.1 仪器、试剂与材料
Ekspert Ultra LC100超高效液相色谱系统、AB5500三重四极杆质谱仪(美国AB公司); BECHMAN Coulter Avanti J26XP超高速冷冻离心机; 平行定量浓缩仪、再循环冷却系统B740、真空泵V700/701(瑞士BUCHI公司); 涡旋振荡器(德国IKA公司); DTYB1200(电子天平, 福州华志科学仪器有限公司)。
标准品: C.I. 162(纯度≥94.0%)、C.I. 140(纯度≥94.0%)、C.I. 135(纯度≥95.0%)、C.I. 185(纯度≥98.0%)、C.I. 367(纯度≥98.0%)、C.I. 393(纯度≥98.0%)和C.I. 184(纯度≥98.0%), 均购自美国International Laboratory 公司; 甲醇、乙腈 、无水MgSO4(色谱纯, 美国Fisher公司); 丙基乙二胺(Primary secondary amine, PSA)、C18(分析纯, 粒径40~63 μm上海安谱公司)。实验用MilliQ超纯水(美国Millipore公司)。鲜香菇、鲜平菇、鲜金针菇和干香菇由中山检验检疫局食品监管科提供, 冻干松茸由中山援藏工作组提供。
2.2 标准溶液配制
准确称取荧光增白剂标准品50.0 mg, 用三氯甲烷溶解并定容至50 mL, 制成质量浓度为1 mg/mL的标准储备液, 置于4℃保存。
准确吸取适量的C.I. 162, C.I. 140, C.I. 135, C.I. 185, C.I. 367, C.I.393和C.I. 184储备液于100 mL容量瓶中, 用乙腈定容至, 配成各荧光增白剂相应浓度为320 μg/mL混合标准工作液。
2.3 液相色谱条件
2.3.1 色谱条件 色谱柱: Phenomenex Kinetex (100 mm×2.1 mm, 2.6 μm); 柱温: 40℃; 进样量: 10 μL; 流动相: A为乙腈, B为0.1%甲酸溶液。梯度洗脱程序: 0~1.0 min, 10% A; 1.0~8.0 min, 10%~90% A; 8.0~15.5 min, 90% A; 15.5~16.0 min, 90%~10% A; 16.0~20.0 min, 10% A。
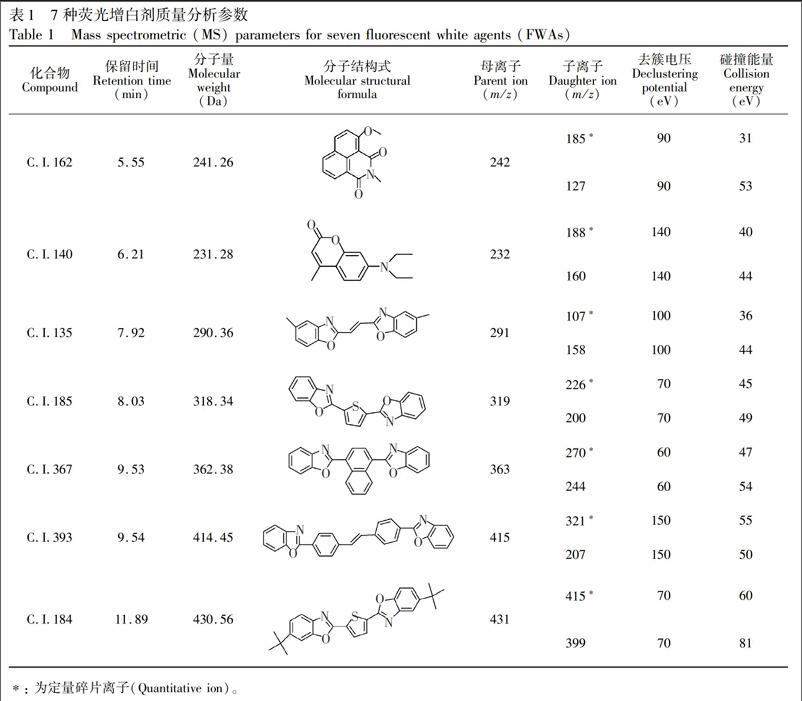
2.3.2 质谱条件 电喷雾离子(ESI)源; 离子源温度: 550℃; 正离子扫描; 多反应监测(MRM)模式检测; 雾化气(Gas1)流量:55.0 L/h; 加热辅助气(Gas2)流量: 55.0 L/h; 气帘气(Curtain gas)流量: 30.0 L/h; 喷雾电压(IS): 5500 V; 其余质谱参数见表 1。
2.4 样品预处理
称取粉碎均匀试样2.0 g(干制食用菌样品称样量为1.0 g), 加入10 mL水, 然后加入10 mL 2%甲酸乙腈溶液(2∶98, V/V)和2.0 g NaCl, 渦旋振荡5 min, 在4℃ 15000 r/min离心10 min, 上层液转移至已提前放入 50 mg C18、120 mg PSA、500 mg MgSO4的15 mL离心管中, 涡旋振荡5 min, 在5℃以15000 r/min离心10 min, 上清液移至15 mL离心管中, 于50℃平衡定量浓缩仪中浓缩至干。 残留物加1.0 mL乙腈涡旋溶解, 过0.2 μm滤膜, 超高效液相色谱串联质谱测定。
3 结果与分析
3.1 色谱条件优化
选择对弱极性较强化合物分离较好的3种色谱柱Phenomenex Kinetex C18(100 mm × 2.1 mm, 2.6 μm)、 RESTEK ultra AQ C18 (100 mm×2.1 mm, 3.0 μm)和Thermo Hypersil GOLD C18 (100 mm × 2.1 mm, 3.0 μm)对7种荧光增白剂进行分离, 结果表明, ESTEK ultra AQ C18和Thermo Hypersil GOLD C18这两款色谱柱无法保留C.I. 162, 且其它6种荧光增白剂保留时间不稳定; Phenomenex Kinetex C18色谱柱对7种荧光增白剂有较好的保留, 稳定性好, 因此选择Phenomenex Kinetex C18进行分析。 通过对3种色谱柱的比较, 发现色谱柱的粒径对7种荧光增白剂的分离有较大影响, 粒径越小, 分离效果越好。
在不同流动相色谱条件下3种色谱柱均难以基线分离C.I. 367和C.I. 393, 只能进行质谱分离。
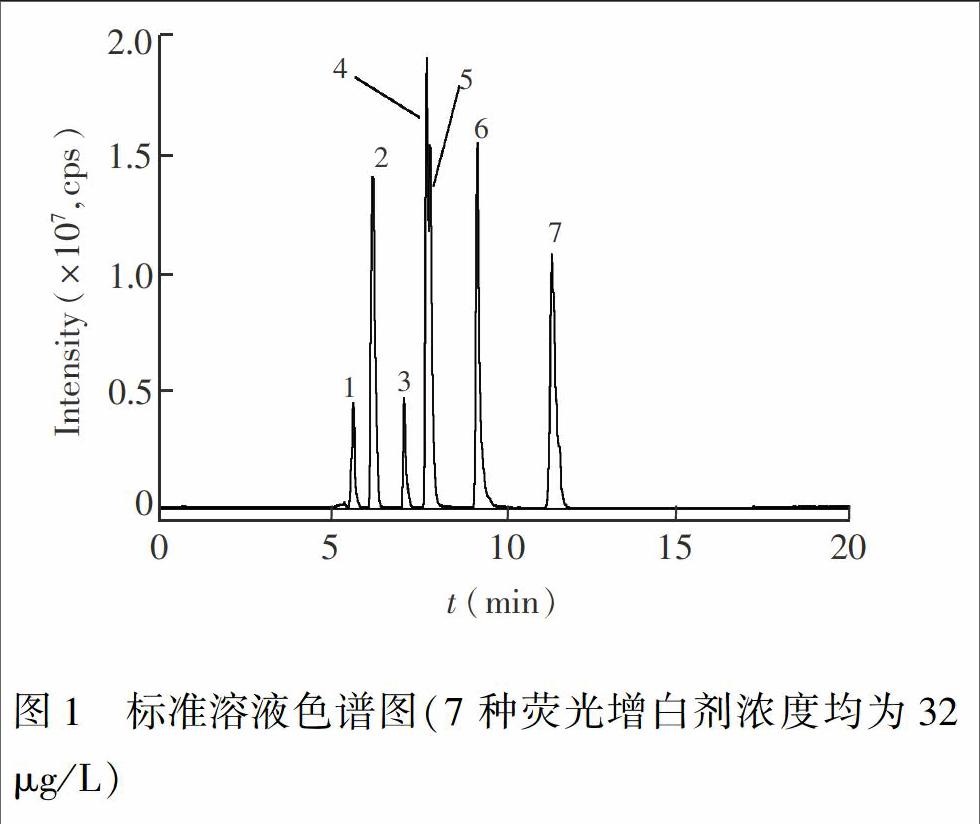
比较了乙酸铵溶液和甲酸溶液缓冲溶液对7种荧光增白剂的质谱响应和色谱分离的影响, 结果表明, 使用乙腈0.1%甲酸溶液为流动相, 7种目标化合物的质谱响应显著增加, 色谱峰峰形尖锐, 对称性好, 所以本研究选择乙腈0.1%甲酸溶液为流动相(图1)。
3.2 质谱条件优化
质谱条件的优化通过在流动注射模式下对1.0 μg/mL的7种荧光增白剂单独进样完成。在正离子模式下, ESI中7种荧光增白剂的灵敏度明显高于APCI。采用一级质谱对目标化合物进行母离子全扫描, 分析得到[M+H]+分子离子峰; 再采用二级质谱, 以分子离子为母离子, 优化CE、DP、EP、CXP等参数, 对目标化合物的子离子进行全扫描, 选择信噪比比较高的两个子离子, 与分子离子组成定性和定量离子对。由于C.I.367和C.I.393结构相似, 色谱条件难以分离, 通过优化质谱条件, C.I.367的母离子为m/z 363、定量离子为m/z 270; C.I.393的母离子为m/z 415、定量离子为m/z 321, 两种荧光增白剂通过质谱可以很好地进行定性与定量分析。7种荧光增白剂分子结构中都含有苯基集团, 分子结构比较稳定, 因此, 优化过程中所需的碰撞能量较大。
3.3 QuEChERS处理条件优化
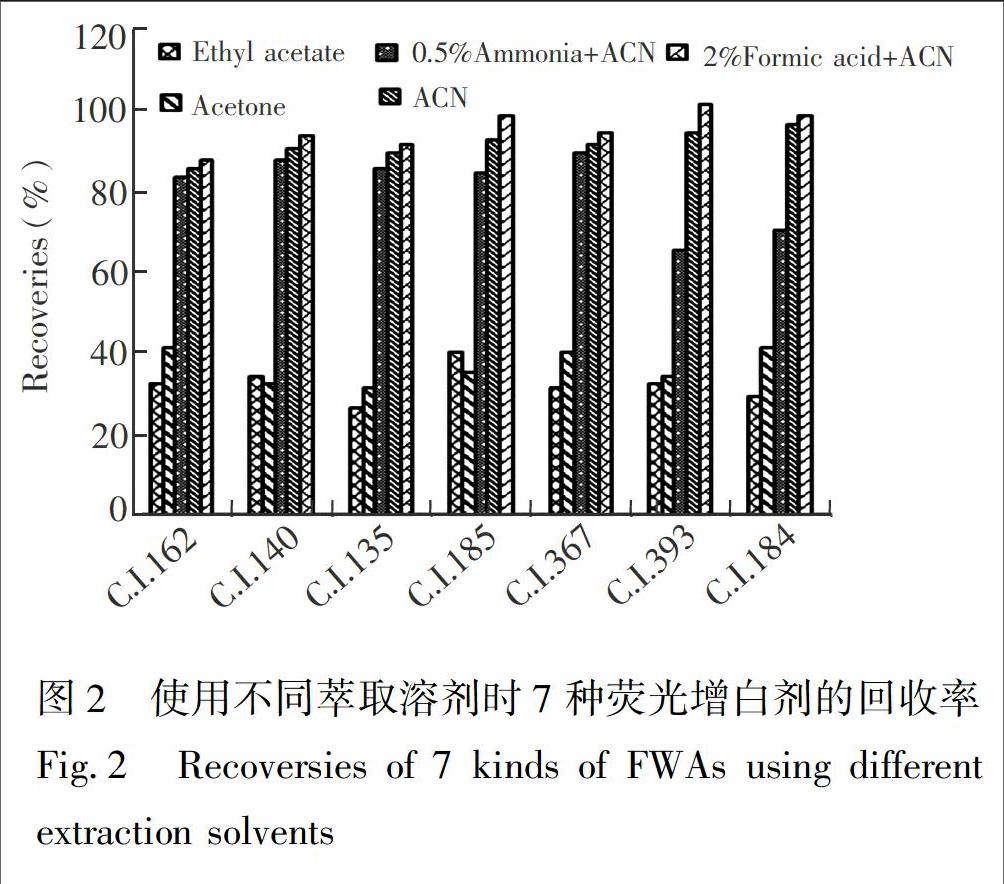
3.3.1 萃取溶剂的优化 选择阴性鲜香菇为实验材料, 添加3.0 μg/kg 混合标准品溶液, 每个样品平行测定3次,采用外标法对萃取溶剂进行优化。萃取溶剂选取了QuEChERS方法中常用的5种试剂: 乙腈、2%甲酸乙腈溶液(2∶98, V/V)、0.5%氨水乙腈溶液(0.5∶99.5, V/V)、乙酸乙酯、丙酮。
结果(见图2)表明, 用乙酸乙酯和丙酮提取时, 7种荧光增白剂的回收率低于50%, 达不到检测要求; 用0.5%氨水乙腈溶液提取时, C.I. 393和C.I. 184的回收率达不到检测要求; 用乙腈、酸化乙腈提取时, 回收率均可满足检测方法的要求, 但是乙腈提取时C.I.184峰形较差, 基质影响大; 加入2%甲酸后, 减少了基质对各种荧光增白剂组分干扰。因此, 本研究选择2%甲酸乙腈溶液作为提取剂。
3.3.2 吸附条件的优化 目前常用的吸附剂主要有 C18、PSA 和 GCB(石墨化炭黑)。本研究选择阴性鲜香菇为实验材料, 添加3.0 μg/kg混合标准品溶液, 每个样品平行测定3次, 采用外标法对吸附剂进行优化(图3)。结果表明, C18用量在20~90 mg范围内, 7种荧光增白剂的回收率在35%~104%之间, C18用量为50 mg时7种荧光增白剂回收率达到最高(95%~104%); PSA用量在40~200 mg范围内, 7种荧光增白剂的回收率为25%~102%, 用量为120 mg时7种荧光增白剂回收率达到最高(94%~102%); MgSO4用量在200~900 mg范围内, 7种荧光增白剂的回收率在36%~106%之间, 在500 mg时, 7种荧光增白剂回收率达到最高(94%~106%)。 本研究最终选择50 mg C18, 120 mg PSA和500 mg MgSO4为最佳吸附条件。
3.3.3 离心条件和浓缩条件的优化 QuEChERS前处理方法中多采用无水MgSO4替代无水Na2SO4作为脱水剂, 因为无水MgSO4具有更强的脱水效果、更细的颗粒, 但其在吸水过程中放热剧烈, 在涡旋过程中产生的热气会将离心管的盖冲开, 影响7种荧光增白剂的回收率。 本实验采用低温高速离心分离提取液, 再加入无水MgSO4等, 此时放热比较温和, 不会出现很多的热气, 而放出的热量刚好将提取液的温度提高到37℃左右, 这个温度既不会导致7种荧光增白剂分解, 还可以减少食用菌基质干扰, 提高提取效率。为了提高7种荧光增白剂的检出限量, 本研究选择平行样品定量浓缩仪减压浓缩样品提取液, 并对浓缩的条件进行优化, 确定浓缩温度为40℃; 冷凝温度为
2℃; 真空度采用梯度下降的方式(30.0 kPa 6 min, 10.0 kPa 6 min, 4.0 kPa浓缩至干)。本方法可以同时浓缩处理24份样品提取液, 完全浓缩至干仅需0.5 h, 有效降低了检测成本, 提高了检测质量和效率。
3.3.4 盐浓度的影响 在提取过程中, 向样品溶液中加入无机盐, 既可以改变待测组分的提取效率, 又可以使两相间的分层更加明显[4]。在其它实验条件不变的情况下, 选择阴性鲜香菇为实验材料, 添加3.0 μg/kg混合标准品溶液, 每个样品平行测定3次, 采用外标法对NaCl的添加量(0.0~4.0 g)进行优化(图3)。结果表明, 加入2.0 g NaCl时, 7种荧光增白剂的回收率最高, 增加NaCl的添加量, 回收率反而下降, 这是因为适量的NaCl能增加溶液的离子强度, 加大目标物从水相到萃取剂的传质效率, 但NaCl浓度过大会导致萃取效率降低。因此, 本实验选择在样品中加入2.0 g NaCl。
3.4 方法学验证
3.4.1 标准曲线、检出限和定量限 准确量取适量混合标准储备工作液, 用乙腈溶液稀, 配制混合标准品工作液。结果表明, 各种化合物在质量浓度范围内线性良好, 相关系数(r)均大于0.9900, 以3倍和10倍信噪比分别计算检出限(LOD)和定量限(LOQ)(以鲜食用菌计), 结果见表2。
3.4.2 方法准确度和精密度 在阴性食用菌样品(包括鲜平菇、干香菇和冻干松茸)中进行加标回收实验, 并进行精密度验证。 在鲜平菇样品中添加1.5、 3.0和15 μg/kg浓度水平标准品,进行6次平行加标实验, 平均回收率在70.1%~109.2%之间, 相对标准偏差(RSD)在1.2%~7.0%之间(见表3); 在干香菇样品中添加3.0、 6.0和30 μg/kg标准品,进行浓度水平6次平行加标实验, 平均回收率在74.2%~107.5%之间, RSD在3.2%~7.2%之间(表4); 在冻干松茸样品中添加3.0、 6.0和30 μg/kg浓度水平标准品,进行6次平行加标实验, 平均回收率在76.4%~108.5%之间, RSD在2.5%~6.5%之间(见表5)。
3.5 实际样品分析
利用本方法检测14批实际样品(包括3批鲜香菇样品、5批鲜平菇样品、4批干香菇样品和2批冻干松茸样品), 在1批鲜香菇样品中检出荧光增白剂C.I. 393, 检出量为16.7 μg/kg。
本研究结果表明, 建立的食用菌中7种荧光增白剂的 UPLCMS/MS的检测方法灵敏、快速、简单、准确、省时、稳定, 实用性强, 方法学结果满足GB/T 274042008《实验室质量控制规范》的技术要求, 适用于食品实验室大批量检测食用菌样品。
References
1 ZHU BaiJun, WANG HuaZhou, JING Li, CHENG DeWen. Textile Auxiliaries, 2009, 26(5): 47-52
竹百均, 王华周, 姜 莉, 程德文. 印染助剂, 2009, 26(5): 47-49
2 SHEN YongJia, XU Xi. Chemical Technology Market, 2002, 8: 5-8
沈永嘉, 許 煦. 化工科技市场, 2002, 8: 5-8
3 YU Kun, HAN Yi, ZHANG ChengMing, MENG Xia, JIANG LiHong, MIAO MingMing. Chemical Reagents, 2013, 35(6): 417-422
喻 坤, 韩 熠, 张承明, 孟 霞, 蒋丽红, 缪明明. 化学试剂, 2013, 35(6): 417-422
4 XU NengBin, QIAN FeiZhong, FENG JiaYong, WANG ShengLe, HONG ZhengFang, XU LiHong, CHEN ZhongQuan. Chinese J. Anal. Chem., 2015, 43(2): 251-256
徐能斌, 钱飞中, 冯加永, 汪晟乐, 洪正昉, 徐立红, 陈钟佺. 分析化学, 2015, 43(2): 251-256
5 WANG HeXing, ZHOU Ying, JIANG QingWu. Chinese J. Anal. Chem., 2011, 39(9): 1323-1328
王和兴, 周 颖, 姜庆五. 分析化学, 2011, 39(9): 1323-1328
6 GUO MengMeng, WU HaiYan, LI ZhaoXin, TAN ZhiJun, ZHAI YuXiu. Chinese J. Anal. Chem., 2013, 41(9):1322-1327
郭萌萌, 吴海燕, 李兆新, 谭志军, 翟毓秀. 分析化学, 2013, 41(9): 1322-1327
7 XU DuoQi, ZHANG LeiPing, WANG JiFen, HUANG Jian, GUO Zhen, LIN Kuan. Chinese J. Anal. Chem., 2016, 44(7): 1059-1064
徐多麒, 张蕾萍, 王继芬, 黄海健, 郭 震, 林 宽. 分析化学, 2016, 44(7): 1059-1064
8 Usui K, Hayashizaki Y, Hashiyada M, Funayama M. Legal Med., 2012, 14(6): 286-296
9 Cajka T, Sandy C, Bachanova V, Drabova L, Kalachova K, Pulkrabova J, Hajslova J. Anal. Chim. Acta, 2012, 743(18): 51-60
10 Jiang D G, Chen L S, Fu W S, Qiu H Q. J. Sep. Sci, 2015, 38(4): 605-611
11 HUANG Wei, ZHU LongLong, SUN WenFang, LIU XiangPing. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2015, 51(11): 1576-1579
黄 薇, 朱龙龙, 孙文芳, 刘祥萍. 理化检验化学分册, 2015, 51(11): 1576-1579
12 ZHANG JianYing, XIAO Feng, YE Gang, YUE ZhenFeng, LUO Yao, DENG HuiFen. Journal of Food Safety and Quality, 2014, 5(9): 2682-2688
张建莹, 肖 锋, 叶 刚, 月振峰, 罗 耀, 邓慧芬. 食品安全质量检测学报, 2014, 5(9): 2682-2688
