慢性血栓栓塞性肺动脉高压的外科治疗
2017-06-21刘盛
刘盛
慢性血栓栓塞性肺动脉高压的外科治疗
刘盛
肺动脉高压; 血栓栓塞; 手术
慢性血栓栓塞性肺动脉高压(chronicthromboembolicpulmonaryhypertension,CTEPH)是一类肺动脉梗阻性疾病,其原因主要为血栓栓塞导致肺动脉堵塞,肺血管重塑,进而产生肺动脉高压。2013年国际肺高压研讨会还将肺动脉肉瘤栓塞,肿瘤细胞栓塞,肺囊虫病,异物栓塞和先天性、获得性肺动脉狭窄等导致的肺动脉堵塞或狭窄归到此类肺高压[1]。
一、流行病学
慢性血栓栓塞性肺动脉高压发病率不详。美国每年预计有50~60万人发生急性肺栓塞,而其中存活下来的患者中有接近0.1%~0.5%的人会进展为CTEPH[2]。2004年新英格兰医学杂志发表意大利帕多瓦大学研究,该研究认为,既往有急性肺栓塞病史的患者中3.8%的患者会发生CTEPH[3]。Kim等[4]总结了9个临床研究发现,急性肺栓塞后发生CTEPH的发病率为0.4%~9.1%。
二、病理生理及临床预后
CTEPH的发病机制仍然未知。既往认为,下肢深静脉血栓是急性和慢性肺栓塞的重要原因。然而,近一半的CTEPH患者既往并没有急性栓塞发生的临床表现,临床表现为隐匿型,40.0%的患者未发现下肢深静脉血栓或深静脉病变[5]。其他原因还包括系统性红斑狼疮,抗磷脂抗体综合征,Ⅷ因子过度表达和蛋白C及蛋白S突变。其他少见性原因还包括慢性炎症性疾病,骨髓增生综合征和脾切除术后。近年来发现医源性(如永久起搏器植入)也是CTEPH的病因之一[6-8]。
血栓堵塞超过40.0%的肺动脉血管床时,就会引起肺动脉高压,慢性或反复肺动脉栓塞导致肺血管阻力持续增高,有些学者提出肺动脉高压是因肺血管重建(小血管病变)引起,肺血管重建继发于原始的栓塞事件。CTEPH若不经治疗最终因呼吸衰竭、右心衰竭而死亡,死亡率极高[9-10]。
三、CTEPH的治疗现状
CTEPH的治疗包括药物治疗,外科肺动脉内膜剥脱术(PEA),介入肺动脉球囊扩张术和肺移植治疗。抗凝药物治疗是CTEPH的基础治疗方案,绝大多数患者需要终生口服抗凝药物。目前仅有利奥西胍这一种靶向药物对降低CTEPH患者的肺动脉压力,提高生活质量有一定疗效[4,11],但价格昂贵不能被大多数患者接受。Hollister等[12]首先报道了PEA用于治疗CTEPH。PEA手术经历漫长的探索过程,从20世纪50年代到1984年,圣地亚哥医学中心仅完成了84例PEA,到2001年,全世界共完成了1000例PEA手术,目前美国每年的PEA手术数量仅有300例左右。南加州圣地亚哥医学中心是世界最大CTEPH的手术治疗中心,已经完成3000余例的PEA手术,建立成熟的PEA治疗方案,术后30天死亡率已经控制在2.2%以内[13],近5年手术死亡率已经下降到1.0%。欧洲和加拿大的17个中心平均PEA手术死亡率也下降到4.7%(还包括部分年手术量小于10例的中心)[4]。亚洲的PEA手术水平近年来也有长足的进步:Soo等[14]报道PEA手术死亡率为10.8%,Nobuhiro等[15]报道PEA手术死亡率由最初14.0%(上世纪90年代)降到7.5%;中国医学科学院阜外医院PEA手术死亡率由早年的11.0%,下降到近5年手术死亡率2.0%以下[16]。
四、PEA手术前评估
PEA手术被认为是可以治愈CTEPH的唯一方案[4]。所有诊断CTEPH的患者都需要进行PEA手术的评估。CTEPH患者的治疗决策,应该包括内科医师、放射科医师和专业的外科医师在内的CTEPH治疗团队通过多学科讨论制定[4]。国际肺高压协会强调,对于即使被认定不可手术的CTEPH患者,还需要到第二家有PEA手术经验的中心进行可否手术的二次评估[4]。
PEA手术的指征,首先是正规抗凝时间>3个月,其次是患者NYHA分级Ⅱ级以上,肺血管阻力>300dyne·s/cm5;第三,肺血管影像学检查有慢性血栓的表现,患者的血流动力学损害程度与其解剖学表现符合,且预期外科手术可以剥离;还需排除影响手术的严重合并症[17-18]。还有一部分患者在静息状态表现为正常肺血管阻力,他们也许不能诊断CTEPH,而称为慢性血栓栓塞性肺血管病,尤其是单侧栓塞的患者,但他们确实能从PEA手术获益[19]。CTEPH评估流程见图1。
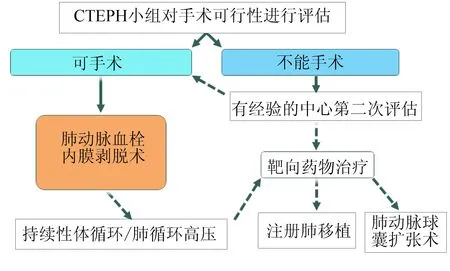
图1 CTEPH评估流程
通气/灌注扫描不仅用于诊断,而且通过区分大血管和小血管病变来评估手术可行性,前者表现为多发段水平灌注缺损,后者表现为不一致的斑点样改变,其敏感性和特异性分别>96.0%和90.0%[20]。高分辨率计算机断层扫描肺血管造影对CTEPH诊断和评估手术可行性的应用越来越多,但是CT表现没有近端血栓并不能排除外科可以治疗的慢性疾病,另一方面即使存在中心性血栓也不能完全确定CTEPH的诊断。右心导管肺血管造影仍然是诊断确认慢性血栓性肺疾病,评价手术可行性的金标准。有经验的治疗中心,CTPA可以作为替代选择[4,21]。
PEA手术的禁忌证包括有严重的影响手术或限制术后生存的合并症,以及肺动脉压力与栓塞病变不匹配。另外远端病变、高肺血管阻力、高龄也是需要考虑权衡的因素[13]。CTEPH的分型是进行PEA手术必须考虑的因素,Ⅰ型和Ⅱ型病例术后的肺动脉压力和肺血管阻力改善明显优于Ⅲ型和Ⅳ型,Ⅰ型、Ⅱ型围术期生存率为98.1%,明显高于Ⅲ型、Ⅳ型的86.7%,87.9%的Ⅰ/Ⅱ型患者的NYHA心功能分级改善,而7例Ⅳ型患者仅有1例心功能改善[9]。术前肺血管阻力(PVR)高低与术后死亡率相关。Madani等[13]报道,术前PVR>1000dyne·s/cm5的围术期死亡率比其他病例增加两倍以上。评价手术可行性的因素还与外科医生的经验和技术、诊疗中心在诊断、决策和术后管理的水平有关。圣地亚哥中心在2003年报道的500例手术患者中,Ⅲ型和IV仅占13.6%,而在2012年报道的结果显示,两型病例达到了47.0%,而围术期死亡率明显下降[13]。
五、CTEPH病理分型
圣地亚哥医学中心根据手术中探查和剥离的血栓内膜标本将CTEPH分为4型,Ⅰ型是在主肺动脉及左右肺动脉主干内存在血块,占12.0%;Ⅱ型在大肺动脉内没有血栓,但可见叶动脉水平血管增厚的内膜,表面附着网格样纤维,占38.0%;Ⅲ型为远端段及亚段水平,占39.4%;Ⅳ型为远端小血管病变,占7.6%[13]。对于Ⅰ型Ⅱ型病变术中比较容易鉴别,易于处理,而且剥离后的肺动脉压力和肺血管阻力下降明显,是PEA的良好指征;但对于Ⅲ型和Ⅳ型病变,病变位置远端小血管术中不容易处理,术后肺动脉血压及肺血管阻力下降不理想,要到有经验的中心进行手术[13]。
六、PEA手术方案
动脉内膜切除术最早于上世纪 60 年代开展,在随后的几年中不断得到完善。目前以南加州大学圣地亚哥医学中心的方案为主流手术方案。正中胸骨切开术,深低温停循环技术,双侧剥离到亚段水平是手术的关键。深低温、间断停循环可以避免体循环至肺循环的侧支分流,保持一个无血的视野,更完整地将肺血管树样血栓及内膜剥离到亚段水平。同时应用深低温(19℃)防止脑损害。一些医学中心已经通过使用顺行脑灌注成功的开展不需要完全循环停止的PEA。最近的一个随机研究显示,接受顺行脑灌注和接受传统方法手术患者的认知功能之间无显著差异,而部分患者因术中回血过多影响远端分支剥离而停止顺行脑灌注转为完全停循环手术[4,22]。
在剥脱过程中找到正确的解剖层次尤为重要,因为这个层次决定了所有肺叶,肺段或亚段肺动脉层次[13]。对于Ⅰ型Ⅱ型病变术推荐采用从主肺动脉或左右肺动脉近端内膜开始“内翻式”剥离;对于Ⅲ型和Ⅳ型病变可以采用肺动脉段开口或亚段水平栓塞的直接剥离,而这种直接从段开口以下剥离的方式需要借助尖端纤细的镊子和剥离吸引器完成,同时这样的手术技术需要在熟练掌握常规“内翻式”剥离技术后再开始练习[13]。在剥离过程中需要避免肺动脉中层的损伤。对于肺动脉血栓合并肺动脉壁钙化的病例,应避免钙化斑块剥离后肺动脉壁穿透性损伤。
双侧内膜剥脱完成后恢复循环并开始复温,这期间可同期行其他手术,如冠状动脉旁路移植、瓣膜修复置换、房间隔缺损的闭合等。继发于CTEPH的三尖瓣返流为功能性返流,多不必修复,随着术后右心室功能的恢复及右心室重构,返流会减轻[13,23]。残余肺动脉压力较高的患者三尖瓣返流改善较差,这会延长住院时间,增加房颤的发生率,Ogino等[24]推荐可能残存肺高压的患者进行三尖瓣成形术。多数中心主张对卵圆孔未闭进行闭合,当考虑术后残余压力高时建议保持卵圆孔开放[21]。
PEA手术过程中麻醉和体外循环医生的配合尤其重要。手术需要在深低温停循环情况下进行,全身均匀降温、复温,脑保护、脊髓保护都是不可忽视的环节。通过容量控制减低心排量进而减少肺灌注性损伤,缩血管药物控制体肺侧支。圣地亚哥医学中心推荐使用一氧化氮控制术后残余肺动脉高压[9]。
对于CTEPH患者,尤其是既往有深静脉血栓病史的患者,圣地亚哥医学中心常规在术前植入下腔静脉滤器来防止围术期栓塞复发[25]。一项针对外科医生的调查发现,使用滤器的比例为50∶50,多数中心选择在有近端深静脉血栓的肺栓塞高危患者放置滤器[21,24],但对于腓肠肌间静脉血栓导致的Ⅲ型和Ⅳ型病变患者,下腔静脉滤器的使用仍有争议。目前没有随机对照试验(RCT)支持常规放置下腔静脉滤器,其使用的证据水平较低。
七、手术并发症
PEA手术难度高,学习曲线长,手术并发症发生率高,有与其他心外科手术类似的并发症,比如心律失常、出血、肺不张、胸腔积液、心包积液、膈肌功能障碍等,然而再灌注肺水肿和残余肺动脉高压是PEA手术独有的增加术后死亡率的严重并发症。
再灌注肺水肿主要发生于内膜剥脱后再灌注的肺部区域,血管通透性增加,表现为肺泡出血和严重低氧血症,明显增加机械通气时间和ICU停留时间,发生率大约是10.0%~40.0%。再灌注肺水肿在术后短时发生占60.0%,在术后48小时内发生占30.0%,48小时以后发生仅占10.0%[13,26]。严重的术前肺动脉高压及术后残余肺动脉压力均增加再灌注肺水肿的风险[16,27]。回顾性研究报道术前对支气管肺侧支动脉行介入栓塞能降低再灌注肺水肿的发生率[28],但这项干预措施仅为单中心回顾报道,没有前瞻随机对照研究以及多中心的研究数据。另外试验表明,尽量减少强心药使用和低潮气量通气可以降低再灌注肺损伤的发生率及死亡率[29]。再灌注肺水肿的治疗主要是支持治疗,使用足够的机械通气并给予高呼气末正压,限水利尿以减少肺水,避免高的心输出量,降低氧耗。对于有严重呼吸窘迫综合征的患者,侧卧位给氧明显好于仰卧位[21]。吸入NO以及体外肺膜氧合(ECMO)支持对于严重再灌注肺水肿病例是十分必要的[30]。
残余肺动脉高压在PEA术后的发生率大概是5.0%~35.0%[8,11,25,31],是围术期死亡的常见原因,术后严重残余肺动脉高压是术后死亡的重要预测因子[25]。不可逆性肺动脉高压是肺动脉远端慢性血栓栓塞病变或者合并了小血管病变的结果,这些病变不能用PEA手术治愈[32]。近期英国的一项研究在术后3~6个月的随访中发现51.0%的患者mPAP≥25mmHg,mPAP≥30mmHg的患者应该启用肺血管扩张药物治疗,并长期密切随访,mPAP≥38mmHg和PVR≥425dyne·s/cm5的患者远期生存率较差[33]。另外有报道,PEA术后3个月31.0%的患者有残余肺动脉高压,但如果不考虑患者的症状及活动耐力情况,其5年生存率与没有残余肺动脉高压患者相似[34]。PEA术后严重的RPH以及合并右心衰竭时治疗困难,通常使用强心药物支持,利尿改善右心室前负荷。降低肺动脉压力的血管舒张药物通常不奏效,而且有导致体循环低血压的风险。术后即刻开始吸入NO或者伊洛前列素可以降低肺血管阻力且不影响外周血压。
再灌注肺水肿和残余肺动脉高压病情严重时传统的治疗无效,此时需用ECMO等循环支持措施。存在血流动力学不稳定时推荐使用静脉-动脉ECMO,这更符合患者的病理生理特点。可以使用心脏插管的经中心方式,也可使用股动静脉插管的外周方式。血液通过管道转离心和肺,从而使肺动脉压下降、右心室负荷降低,同时提供心输出量和气体交换。对于血流动力学稳定的肺再灌注损伤,静脉-静脉ECMO支持比较合适。使用ECMO支持治疗的重要原则是患者能在预期的支持时间内恢复[4]。UCSD均采取静脉-静脉ECMO,住院生存率为30%[31];Berman等[30]报道因血流动力学差、右心功能不全而行静脉-动脉ECMO,平均支持时间5天,院内生存率为57.0%。目前,ECMO已经推荐为PEA术后严重并发症的标准治疗措施[4]。
术后抗凝治疗易尽早应用,推荐在手术当日夜,但应该排除出血并发症。为避免血栓复发,所有患者都要终身抗凝治疗[21]。
八、手术结果
PEA手术结果:顶级肺栓塞外科手术中心已经将手术死亡率控制到1.0%~4.0%[13]。术后肺血管阻力大于500dyne·s/cm5患者的死亡率(5.7%)明显高于术后肺血管阻力小于500dyne·s/cm5患者的死亡率(1.2%)[17]。圣地亚哥医学中心报道,PEA术后mPAP从45.5mmHg下降到26.0mmHg,心输出量从4.3L/min上升到5.6L/min。国际CTEPH数据库显示肺血管阻力从736dyne·s/cm5降低到248dyne·s/cm5,圣地亚哥医学中心数据显示从719dyne·s/cm5降低到253dyne·s/cm5。 圣地亚哥医学中心在1970~1994年共完成肺动脉内膜剥脱手术308例,6年生存率为75%[13]。Corsico等报道,1994~2006年完成肺动脉内膜剥脱手术157例,5年生存率为84.0%;Ogino等[24]报道,术后5年和10年生存率分别为84.0%和82.0%;中国医学科学院阜外医院PEA术后10年生存率78.0%。
九、总结
PEA是治疗CTEPH患者的有效手段,随着手术团队的进步,手术死亡率下降,手术疗效有了长足的进步,多数治疗中心获得了较低的住院和远期死亡率,特别是在有经验的中心,远端Ⅲ型病变已经不再是手术禁忌证,同样能取得良好的疗效。但是,并非所有的CTEPH患者都适于接受PEA,手术难以完美的原因与解剖和生理学有关,成功的关键还需要一个技术过硬的外科、麻醉、体外循环、术后监护和内科团队的整体配合。对于CTEPH,我们面临着诸多挑战,勇敢面对挑战,将这些挑战转化成治愈顽疾的契机。
[1]GalièN,HumbertM,VachieryJL.2015ESC/ERSGuidelinesforthediagnosisandtreatmentofpulmonaryhypertension[J].RevEspCardiol(EnglEd),2016,69(2):177.
[2]JamiesonSW,KapelanskiDP.Pulmonaryendarterectomy[J].CurrProblSurg,2000,37(3):165-252.
[3]PengoV,LensingAW,PrinsMH.Incidenceofchronicthromboembolicpulmonaryhypertensionafterpulmonaryembolism[J].EnglJMed,2004,27,350(22):2257-2264.
[4]KimNH,DelcroixM,JenkinsDP.Chronicthromboembolicpulmonaryhypertension[J].JAmCollCardiol,2013,62(25Suppl):D92-99.
[5]HoeperMM,BarberaJA,ChannickRN,etal.Diagnosis,assessment,andtreatmentofnon-pulmonaryarterialhypertensionpulmonaryhypertension[J].JAmCollCardiol,2009,54(1):S85-96.
[6]WolfM,Boyer-NeumannC,ParentF,etal.Thromboticriskfactorsinpulmonaryhypertension[J].EurRespirJ,2000,15:395-399.
[7]TanabeN,KimuraA,AmanoS,etal.AssociationofclinicalfeatureswithHLAinchronicpulmonarythromboembolism[J].EurRespirJ,2005,25(1):131-138.
[8]BondermanD,Skoro-SajerN,JakowitschJ,etal.Predictorsofoutcomeinchronicthromboembolicpulmonaryhypertension[J].Circulation,2007,115:2153-2158.
[9]ShenoyV,AntonJM,CollardCD,etal.Pulmonarythromboendarterectomyforchronicthromboembolicpulmonaryhypertension[J].Anesthesiology,2014,120(5):1255-1261.
[10]EdwardJA,MandrasS.Anupdateonthemanagementofchronicthromboembolicpulmonaryhypertension[J].Currentproblemsincardiology,2017,42(1):7-38.
[11]JoannaPepke-Zaba,PavelJansa,NickHetal.Chronicthromboembolicpulmonaryhypertension:roleofmedicaltherapy[J].EurRespirJ,2013,41(4):985-990.
[12]HollisterLE,CullVL.Thesyndromeofchronicthromboembolismofthemajorpulmonaryarteries[J].AmJMed,1956,21(2):312-320.
[13]MadaniMM,AugerWR,PretoriusV,etal.Pulmonaryendarterectomy:Recentchangesinasingleinstitution'sexperienceofmorethan2,700patients[J].AnnThoracSurg,2012,94(1):97-103.
[14]SooHanKim,JaeWonLee,Jung-MinAhn.Long-termoutcomesofsurgeryforchronicthromboembolicpulmonaryhypertensioncomparedwithmedicaltherapyatasingleKoreancenter[J].KoreanJInternMed,2016.[Epubaheadofprint]
[15]NobuhiroTanabe,ToshihikoSugiura,KoichiroTatsumi.Recentprogressinthediagnosisandmanagementofchronicthromboembolicpulmonaryhypertension[J].RespiratoryInvestigation,2013,51(3):134-146.
[16]李源,朱家德,杜鹃.56例肺动脉内膜剥脱术的围术期处理和结果[J].中国循环杂志,2017,32(5).
[17]ThistlethwaitePA,MoM,MadaniMM,etal.Operativeclassificationofthromboembolicdiseasedeterminesoutcomeafterpulmonaryendarterectomy[J].JThoracCardiovascSurg,2002,124(6):1203-1211.
[18]WittineLM,AugerWR.Chronicthromboembolicpulmonaryhypertension[J].CurrTreatOptionsCardiovascMed,2010,12(2):131-141.
[19]LangIM,MadaniM.Updateonchronicthromboembolicpulmonaryhypertension[J].Circulation,2014,130(6):508-518.
[20]TunariuN,GibbsSJ,WinZ,etal.Ventilation-perfusionscintigraphyismoresensitivethanmultidetectorctpaindetectingchronicthromboembolicpulmonarydiseaseasatreatablecauseofpulmonaryhypertension[J].JNuclMed,2007,48(5):680-684.
[21]JenkinsDP,MadaniM,MayerE,etal.Surgicaltreatmentofchronicthromboembolicpulmonaryhypertension[J].EurRespirJ,2013,41(3):735-742.
[22]VuylstekeA,SharplesL,CharmanG,etal.Circulatoryarrestversuscerebralperfusionduringpulmonaryendarterectomysurgery(PEACOG):arandomisedcontrolledtrial[J].Lancet,2011,378:1379-1387.
[23]IshidaK,MasudaM,ImamakiM,etal.Improvementoftricuspidregurgitationafterpulmonarythromboendarterectomy[J].AsianCardiovascular&ThoracicAnnals,2010,18(3):229-233.
[24]OginoH.Recentadvancesofpulmonaryendarterectomyforchronicthromboembolicpulmonaryhypertensionincludingjapaneseexperiences[J].GenThoracCardiovascSurg,2014,62(1):9-18.
[25]JamiesonSW,KapelanskiDP,SakakibaraN,etal.Pulmonaryendarterectomy:Experienceandlessonslearnedin1,500cases[J].AnnThoracSurg,2003,76(5):1457-1462.
[26]RobbinsIM,PughME,HemnesAR.Updateonchronicthromboembolicpulmonaryhypertension[J].Circulation,2017,27(1):29-37.
[27]KerrKM,AugerWR,MarshJJ,etal.Efficacyofmethylprednisoloneinpreventinglunginjuryfollowingpulmonarythromboendarterectomy[J].Chest,2012,141(1):27-35.
[28]GanHL,ZhangJQ,SunJC,etal.Preoperativetranscatheterocclusionofbronchopulmonarycollateralarteryreducesreperfusionpulmonaryedemaandimprovesearlyhemodynamicfunctionafterpulmonarythromboendarterectomy[J].JThoracCardiovascSurg,2014,148(6):3014-3019.
[29]MaresP,GilbertTB,TschernkoEM,etal.Pulmonaryarterythromboendarterectomy:Acomparisonoftwodifferentpostoperativetreatmentstrategies[J].AnesthesiaandAnalgesia,2000,90(2):267-273.
[30]BermanM,TsuiS,VuylstekeA,etal.Successfulextracorporealmembraneoxygenationsupportafterpulmonarythromboendarterectomy[J].AnnalsofThoracicSurgery,2008,86(4):1261-1267.
[31]ThistlethwaitePA,MadaniMM,KempAD,etal.Venovenousextracorporeallifesupportafterpulmonaryendarterectomy:Indications,techniques,andoutcomes[J].AnnThoracSurg,2006,82(6):2139-2145.
[32]KimNH,FeslerP,ChannickRN,etal.Preoperativepartitioningofpulmonaryvascularresistancecorrelateswithearlyoutcomeafterthromboendarterectomyforchronicthromboembolicpulmonaryhypertension[J].Circulation,2004,109(1):18-22.
[33]CannonJE,SuL,KielyDG,etal.Dynamicriskstratificationofpatientlong-termoutcomeafterpulmonaryendarterectomy:Resultsfromtheunitedkingdomnationalcohort[J].Circulation,2016,133(18):1761-1771.
[34]FreedDH,ThomsonBM,BermanM,etal.Survivalafterpulmonarythromboendarterectomy:Effectofresidualpulmonaryhypertension[J].JThoracCardiovascSurg,2011,141(2):383-387.
(本文编辑:杨泽平)
10.3969/j.issn.1005-6483.2017.05.003
100037 北京,中国医学科学院阜外医院心血管外科
2017-04-01)
