禽网状内皮组织增生症病毒蛋白酶PR酵母双杂交诱饵载体的构建及鉴定
2017-06-21姜莉莉蒋培红温海燕樊兆斌
姜莉莉 , 蒋培红, 温海燕 , 樊兆斌
(1.菏泽学院药物科学与技术系 , 山东菏泽274015 ; 2.锦州医科大学畜牧兽医学院 , 辽宁锦州121001)
禽网状内皮组织增生症病毒蛋白酶PR酵母双杂交诱饵载体的构建及鉴定
姜莉莉1,2, 蒋培红1, 温海燕1, 樊兆斌1,2
(1.菏泽学院药物科学与技术系 , 山东菏泽274015 ; 2.锦州医科大学畜牧兽医学院 , 辽宁锦州121001)
为研究禽网状内皮组织增生症病毒(Reticuloendotheliosisvirus, REV)蛋白酶PR与宿主细胞的相互作用,将REV PR基因克隆入酵母双杂交诱饵载体pGBKT7,构建诱饵载体pGBK-PR,经菌落PCR 、酶切鉴定及测序验证正确后,将重组诱饵质粒转化酵母菌株Y2H Gold感受态,进行重组诱饵载体在酵母中的自激活活性和毒性检测。结果表明,成功构建诱饵载体pGBK-PR,此载体在酵母细胞Y2H Gold中无自激活活性和毒性。研究结果为进一步利用酵母双杂交技术筛选与REV 蛋白酶PR互作的宿主蛋白奠定了基础。
禽网状内皮组织增生症病毒 ; PR ; 酵母双杂交 ; 诱饵载体
禽网状内皮组织增生症是由禽网状内皮组织增生症病毒(ReticuloendotheliosisVirus, REV)引起的一种重要的肿瘤性免疫抑制病。REV感染能引起慢性肿瘤、矮小综合征[1]。还可引起免疫器官的萎缩,引发重剧的免疫抑制,造成免疫失败或继发其他传染病[2]。近年来,REV 已在全球范围内流行[3],在我国的流行愈发严重,鸡群中REV的血清抗体阳性率逐渐增高,存在普遍的混合感染[4-5],对养禽业危害严重。
REV属反转录病毒科,哺乳动物C型反转录病毒亚科,γ逆转录病毒属,为双倍体单股正链 RNA 病毒[6]。REV基因组有两个开放阅读框,有3个主要编码基因:衣壳蛋白基因(gag)、聚合酶基因(pol)和囊膜蛋白基因(env),主要编码gag、pol和env三种结构蛋白[7]。pol基因主要编码REV的功能性蛋白,包括反转录酶(RT)及其衍生的蛋白酶(PR)和整合酶(IN)等。PR 的功能是水解前体蛋白以使之形成成熟蛋白。目前,对REV PR研究较少,尚未见该蛋白与宿主细胞之间相互作用的研究报道。为更好理解 PR的生物学功能,本试验构建了REV PR酵母双杂交诱饵载体,检测其是否在酵母细胞中表达,为利用酵母双杂交技术进一步开展该蛋白与其他相关蛋白的相互作用研究奠定基础。
1 材料与方法
1.1 菌株、质粒、主要试剂及引物 pT-Rpol 质粒由药物科学技术学院预防兽医学研究室构建和保存;载体质粒pGBKT7、pGADT7,酵母菌株Y2H、X-α-Gal、Aureobasidin Minimal SD Base、Minimal SD Agar Base、Yeastmaker Carrier DNA、酵母共转化试剂盒等,均购自 Clontech公司;CEF cDNA酵母表达文库由本研究室构建;DDO(SD/-Leu/-Trp)、QDO(SD/-Ade/-His/-Leu/-Trp)、QDO/X/A(SD/-Ade/-His/-Leu/Trp/X-α-Gal/Aureobasidin A)培养基按常规方法制备;EcoRI、BamHI、T4 DNA Ligase、DNA 聚合酶等,均购自宝生物工程(大连)有限公司;PR基因扩增引物由上海生工基因股份有限公司合成(见表1)。
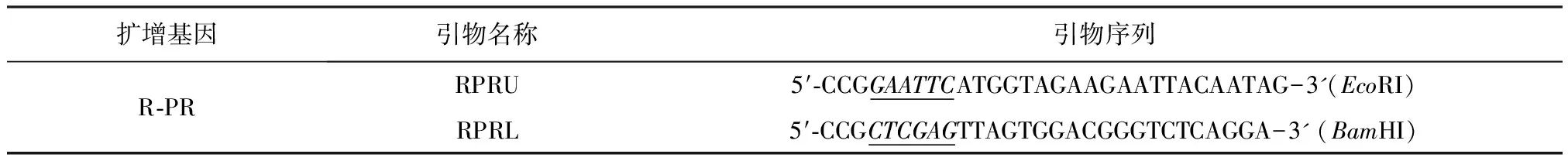
表1 PR基因扩增引物
1.2 PR基因的扩增 根据pGBKT7载体的多克隆位点,设计扩增REV PR的引物RPRU/RPRL(上下游分别引入EcoRI和BamHI、酶切位点),以pT-Rpol为模板进行PCR扩增。PCR反应体系:5×PrimeSTAR Buffer (Mg2+Plus)10 μL,dNTP Mixture (each 2.5 mmol/L) 4 μL,上、下游引物各1 μL,模板1 μL,PrimeSTAR®HS DNA Polymerase 0.5 μL,加ddH2O至50 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72℃延伸10 min。PCR反应结束后在反应体系加入rTaq0.5 μL,72 ℃延伸10 min,使PCR产物末端加A,并进行胶回收。
1.3 PR诱饵载体的构建 用EcoRI、BamHI对回收纯化的PR PCR产物和载体pGBKT7分别进行双酶切处理。酶切体系:10×H Buffer 5 μL,PR PCR产物10 μL(pGBKT7 5 μL),EcoRI、SalI各2.5 μL,加ddH2O至50 μL;37 ℃水浴2 h。酶切产物回收后进行连接反应,连接体系:T4 DNA连接酶1 μL,10×T4 Buffer 1 μL,PR回收产物6 μL,pGBKT7回收产物2 μL,16 ℃连接过夜。转化大肠杆菌DH5α,提取质粒。重组质粒经双酶切鉴定正确后,送华大基因生物工程技术服务有限公司进行测序,将正确插入RPR基因的诱饵载体命名为pGBK-PR。
1.4 诱饵载体自激活活性和毒性检测 复苏酵母菌Y2H Gold,按照YeastmakerTMYeast Transformation System 2(Clontech)操作规程,利用醋酸锂法,制备Y2H Gold酵母感受态细胞。分别将诱饵载体pGBK-PR与空捕获载体pGADT7转化Y2H酵母感受态细胞。将待转化质粒1 μL(100 ng/μL)、Yeastmaker Carrier DNA 5 μL(10 μg/μL)、新鲜制备的50% PEG/LiAc 500 μL和50 μL酵母感受态细胞加入1.5 mL无菌EP管,混匀。30 ℃水浴30 min,每隔10 min轻振混匀;加入20 μL DMSO,混匀,42 ℃水浴15 min,每隔5 min轻振混匀;12 000 r/min离心10 s,弃上清,沉淀用100 μL 0.9%NaCl重悬,取100 μL重悬菌液涂于SD/-Trp(SDO) 固体培养板上,30 ℃倒置培养3~5 d,观察2 个平板酵母菌菌落生长的大小、数量、形态、颜色等有无差异,进行诱饵质粒pGBK-PR的毒性检测。将上述已转化好的pGBK-PR菌液各100 μL,分别涂于SD/-Trp(SDO)、SD/-Trp /X-α-Gal(SDO/X) 和SD/-Trp /X-α-Gal /AbA (SDO/X/A) 固体培养板上, 30 ℃倒置培养3~5 d,观察各个平板酵母菌菌落生长的大小、数量、形态、颜色,进行诱饵质粒pGBK-PR的自激活活性检测。同时设阳性对照组:pGBKT7-53 / pGADT7-T共转化组,和阴性对照组:pGBKT7-Lam/pGADT7-T共转化组。
2 结果
2.1 PR基因扩增及序列分析 PCR反应产物经1%琼脂糖凝胶电泳,在接近750 bp处可见清晰条带,大小与预期相符(图1)。测序结果显示,扩增的PR基因为648 bp。
2.2 诱饵载体的构建 重组诱饵质粒pGBK-PR转化大肠杆菌感受态DH5α,经EcoRI、BamHI双酶切,经1%琼脂糖凝胶电泳,在7.3 kb和700 bp附近,均出现目的条带(图2)。与空载体片段7.3 kb和预期插入片段648 bp大小相近,将重组质粒送华大基因生物工程技术有限公司测序,比对结果显示插入片段正确,表明重组质粒pGBK-PR构建正确。
2.3 诱饵载体自激活作用和毒性检测 图3为pGBK-PR诱饵载体和pGBKT7空载体在SDO、SDO/X、SDO/X/A三种平板上的生长状况以及阴阳性对照生长情况。由图3可以看出,阳性对照组(pGADT7-53 / pGADT7-T共转组)在SDO/X/A平板上菌落颜色变蓝;阴性对照组(pGADT7-Lam / pGADT7-T共转组)在SDO/X/A平板上无菌落生长,说明阴阳性对照组成立。pGBKT7 空载体转化菌在SDO/X平板上生长正常,菌落颜色为白色,在SDO/X/A平板上无菌落生长。pGBK-PR转化菌在SDO/X平板上可见与pGBKT7空载体转化菌类似的白色菌落,酵母生长状况良好,菌落数量和大小与pGBKT7空载体转化相比无明显差异,说明构建的诱饵载体pGBK-PR对酵母菌株无毒性作用。pGBK-PR转化菌在SDO和SDO/X平板上生长正常,菌落颜色为白色,在SDO/X/A平板上无菌落生长,说明诱饵载体pGBK-PR无自激活活性。因此,构建的诱饵载体pGBK-PR可以用于下一步文库的筛选试验。
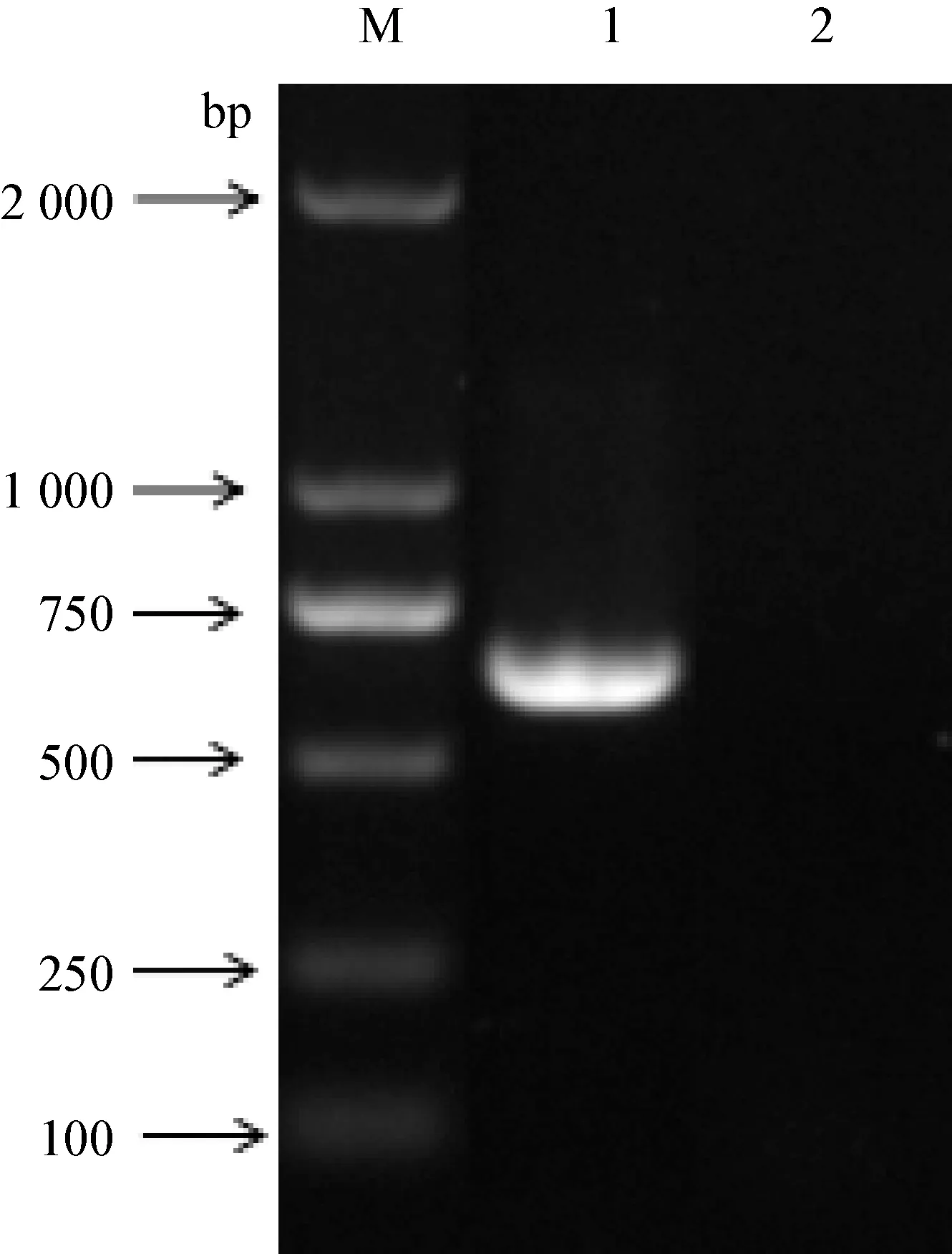
图1 PR基因扩增

图2 诱饵载体pGBK-PR双酶切鉴定
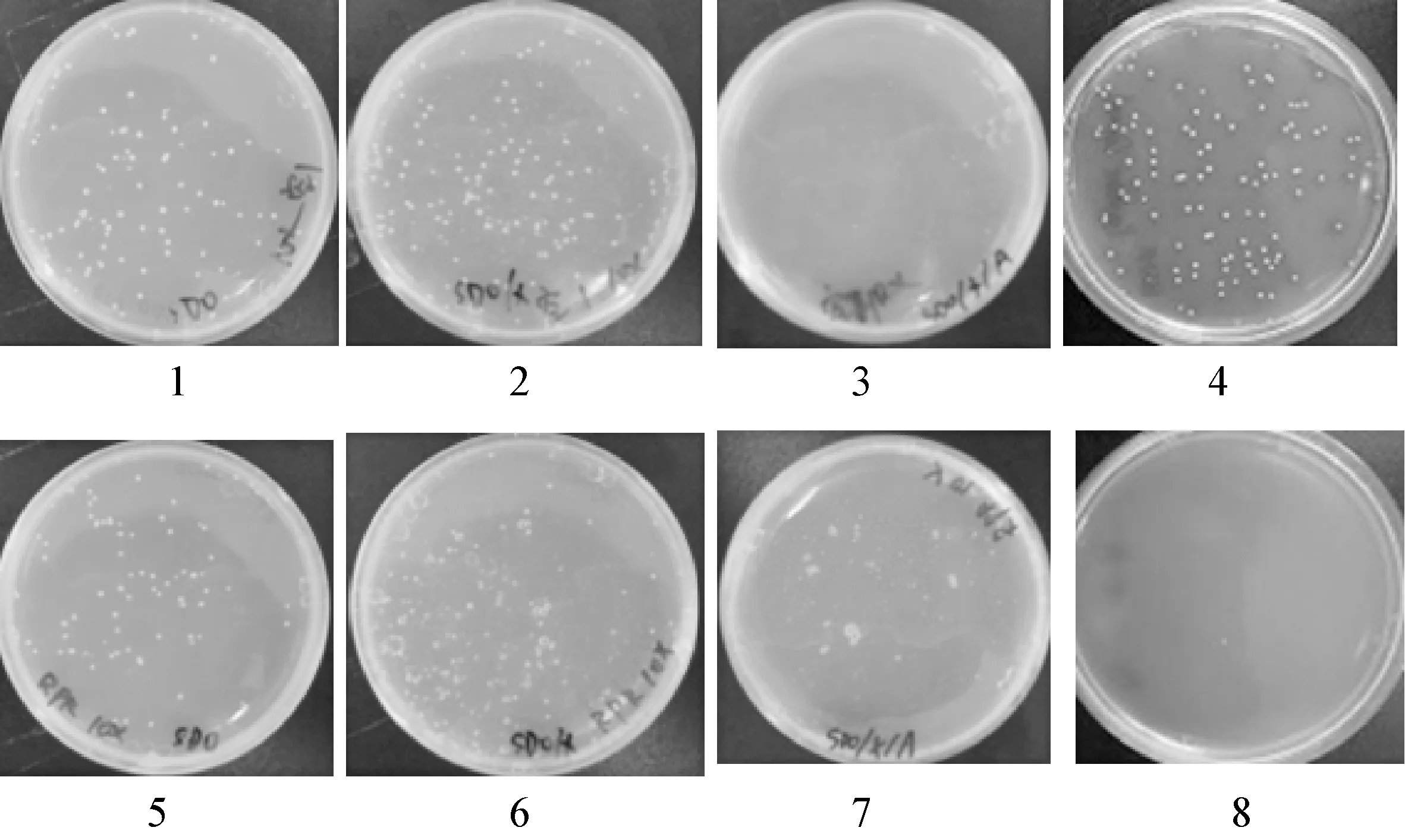
图3 pGBK-PR诱饵质粒自激活活性与毒性检测
3 讨论
酵母双杂交技术是一种经典的蛋白互作研究技术,外源蛋白能在真核酵母细胞内表达,并通过不同的营养条件筛选相互作用的蛋白。作为研究病毒与宿主相互作用的常用方法之一,酵母双杂交技术既可检测已知蛋白之间的相互作用,又能筛选与已知蛋白相互作用的未知蛋白,可用于蛋白文库中筛选与已知蛋白相互作用的蛋白[8-9]。且该系统可捕捉活细胞内蛋白之间微弱的、瞬时的作用信号,适用于高通量筛选相互作用蛋白[10]。
REV病毒粒子有3种酶蛋白:反转录酶(RT)、蛋白酶(PR)和整合酶(IN)。REV的PR来自Gag-Pro蛋白前体,类似于其他逆转录病毒,REV编码的蛋白酶(PR),能专一地切割病毒的多聚蛋白,使之形成成熟蛋白和复制所需要的酶,在病毒的复制过程中发挥重要作用[11]。此外,逆转录病毒PR也可以催化包括细胞骨架蛋白和细胞支架相关蛋白在内的宿主细胞蛋白的水解作用[12]。
PR与逆转录病毒的生命周期和感染的过程密切相关,本试验扩增REV 蛋白酶PR基因,将其定向克隆到酵母双杂交诱饵pGBKT7载体上,成功构建pGBK-PR酵母诱饵载体,以期通过酵母双杂交技术进一步研究REV PR蛋白功能。将构建的诱饵载体pGBK-PR转化Y2H Gold 酵母感受态细胞,涂布SDO和SDO/X培养基,发现pGBK-PR转化菌在两种培养基上长出白色菌落,生长状况良好,与pGBKT7空载体转化组相比,菌落数量、大小无明显差异,说明构建的诱饵载体pGBK-PR对酵母菌株无毒性作用。且pGBK-PR转化菌在SDO/X/A培养基上无菌落生长,说明诱饵载体pGBK-PR无自激活活性。本试验构建的诱饵载体pGBK-PR可应用于酵母双杂交筛选,为进一步研究与REV蛋白酶PR相互作用的宿主蛋白奠定了基础。
[1] Bohls R L, Linares J A, Gross S L,etal. Phylogenetic analyses indicate little variation among reticuloendotheliosis viruses infecting avian species, including the endangered Attwater's prairie chicken[J]. Virus Res,2006,119: 187-194.
[2] Moore K M, Davis J R, Sato T,etal. Reticuloendotheliosis virus (REV) long terminal repeats incorporated in the genomes of commercial fowl poxvirus vaccines and pigeon poxviruses without indication of the presence of infectious REV[J]. Avian Dis,2000, 44:827-841.
[3] Guillermo Z, Sunny C, Taylor B,etal. Enzootic Reticuloendotheliosis in the Endangered Attwater’s and Greater Prairie Chickens[J]. Avian Dis,2006, 50: 520-525.
[4] 崔治中,孟珊珊,姜世金,等. 我国白羽肉用型鸡群中CAV、REV和REOV感染状况的血清学调查[J]. 畜牧兽医学报, 2006,37(2): 152-157.
[5] 秦立廷,高玉龙,潘伟,等.我国部分地区蛋鸡群ALV-J及与REV、MDV、CAV混合感染检测[J]. 中国预防兽医学报, 2010,32(2): 90-93.
[6] Coffin J M. Structure of the retroviral genome. RNA tumor viruses. Molecular Biology of Tumor Viruses. Cold Spring Harbor Laboratory[J]. Cold Spring Harbor, 1982, NY: 261-368.
[7] Barbosa T, Zavala G, Cheng S,etal. Full genome sequence and some biological properties of reticuloendotheliosis virus strain APC-566 isolated from endangered Attwater's prairie chickens[J]. Virus Res,2007,124(1-2):68-77.
[8] Yu Y, Li Y, Zhang Y. Yeast Two-Hybrid Screening for Proteins that Interact with the Extracellular Domain of Amyloid Precursor Protein[J]. Neurosci Bull,2016,32(2):171-176.
[9] Zhao T, Huang X, Xia Y. Human heart cell proteins interacting with a C-terminally truncated 2A protein of coxsackie B3 virus: identification by the yeast two-hybrid system[J].Virus Genes, 2016,52(2):172-178.
[10] Yu H, Braun P, Yildirim M A,etal. High-quality binary protein interaction map of the yeast interactome network [J]. Science, 2008, 322(5898): 104-110.
[11] Weaver T A, Talbot K J , Panganiban A T.Spleen necrosis virus gag polyprotein is necessary for particle assembly and release but not for proteolytic processing[J].J Virol, 1990,64 :2642-2652.
[12] Shoeman R L, Honer B, Stoller T J,etal. Human immunodeficiency virus type 1 protease cleaves the intermediate filament proteins vimentin, desmin, and glial fibrillary acidic protein[J]. Proc Natl Acad Sci U.S.A,1990 ,87(16):6336-6340.
Construction and Identification of the Bait Vector ofReticuloendotheliosisvirusPR using Yeast Two-hybrid System
JIANG Li-li1,2, JIANG Pei-hong1, WEN Hai-yan1, FAN Zhao-bin1,2
(1.Drug Bioscience and Technology Department, Heze University, Heze 274015, China; 2.Institute of animal husbandry veterinary, Jinzhou Medical University, Jinzhou 121001, China)
To investigate the interaction betweenReticuloendotheliosisvirus(REV) PR and the host cells, PR cDNA was amplified and subcloned into the bait vector pGBKT7 of yeast two-hybrid system, and the recombinant bait vector pGBK-PR was constructed. After verifying by PCR amplification, enzymatic detection and sequencing validation, the yeast bait plasmid was transformed into Yeast strain Y2H Gold competent cells. Then the self-activation and toxicity of the bait vector were tested using the Matchmaker Gold Yeast Two-Hybrid System. Results showed that the bait vector pGBK-PR was successfully constructed with no self-activation and toxicity to Y2H Gold yeast cells. This study laid the foundation for further researches on the effect and mechanism of the interaction betweenREVPR and its host cells.
Reticuloendotheliosisvirus; PR ; yeast two-hybrid ; bait vector
FAN Zhao-bin
2016-07-19
家禽产业技术体系北京市创新团队项目(BAIC04-2017)
赵世颖(1988-),女,工程师,硕士,从事实验动物饲养管理工作,E-mail:syzhao@genetics.ac.cn
张国中,E-mail:zhanggz@cau.edu.cn
S854.43
A
0529-6005(2017)05-0027-03
