探讨鸦胆子素 D 对骨肉瘤细胞增殖、凋亡与自噬的作用
2017-06-21郑颖王刚阳陈瑞玲华莹奇蔡郑东
郑颖 王刚阳 陈瑞玲 华莹奇 蔡郑东
. 临床研究与实践 Clinical research and practice .
探讨鸦胆子素 D 对骨肉瘤细胞增殖、凋亡与自噬的作用
郑颖 王刚阳 陈瑞玲 华莹奇 蔡郑东
目的探讨鸦胆子素 D 对骨肉瘤细胞 ( 143B HOS ) 增殖,骨肉瘤细胞凋亡与自噬的作用。方法用 CCK8 实验观察鸦胆子素 D 对 143B HOS 增殖的影响;用平板克隆实验观察鸦胆子素 D 对 143B HOS细胞集落形成的影响;用流式细胞仪检测鸦胆子素 D 对 143B HOS 周期阻滞以及诱导凋亡的作用情况;用Western Blot 检测 143B HOS 基础凋亡与自噬以及经鸦胆子素 D 诱导之后的凋亡与自噬情况;用荧光显微镜检测 143B 细胞基础 LC3 荧光鼬合蛋白表达以及经鸦胆子素 D 诱导之后的 LC3 荧光鼬合蛋白表达情况。结果( 1 ) CCK8 实验显示鸦胆子素 D 作用后 143B HOS 细胞的存活率下降,同时,也减少了 143B HOS 细胞克隆数的形成;( 2 ) 流式细胞仪检测细胞周期显示鸦胆子素 D 使 143B HOS 的 G0 / G1 期细胞比例增高;( 3 ) 流式细胞仪检测细胞凋亡实验显示,鸦胆子素 D 使 143B HOS 的细胞凋亡比例增加;Western Blot 检测 143B HOS 细胞Cleaved PARP 的表达,结果显示,鸦胆子素 D 诱导 Cleaved PARP 表达增加;( 4 ) Western Blot 检测 143B HOS细胞 LC3B 的表达,结果显示,鸦胆子素 D 诱导 LC3B-II 的表达增加;荧光显微镜检测 143B 细胞的 LC3 荧光鼬合蛋白实验,结果显示,鸦胆子素 D 诱导 143B 细胞绿色荧光斑点生成增多。结论( 1 ) 鸦胆子素 D 抑制骨肉瘤细胞增殖;( 2 ) 鸦胆子素 D 诱导骨肉瘤细胞的凋亡;( 3 ) 鸦胆子素 D 诱导骨肉瘤细胞自噬。
骨肉瘤;鸦胆子素;细胞增殖;细胞凋亡;自噬
骨肉瘤是临床最常见的原发性恶性骨肿瘤,以10~20 岁青少年发病居多。据统计,每年每 100 万0~20 岁的人群中就有约 4~5 人发病[1]。好发部位为股骨远端、胫骨近端以及肱骨近端的干骺端。约80% 患者死于肿瘤的远处转移,其中多为肺转移。针对转移患者治疗方法有限,已发生转移患者的生存率在近几十年里并没有显著提高[2]。研究表明:新辅助化疗下的外科手术治疗是目前骨肉瘤的主要治疗方法[3]。手术前化疗效果 ( 使用 Huvos 分级进行评分 ),是骨肉瘤患者预后好坏的关键因素[4]。在最近 20 年里,随着新型化疗药物的应用,使得骨肉瘤的 5 年生存率从不足 20% 提高至 65%~75%。尽管临床中已取得较大进步,现今仍有超过 30%~40%的患者即便是在采用高强度化疗后仍得不到有效治疗[5]。因此,开发出更为有效,毒副作用相对低的化疗药物不失为提高患者生存率的可行之策。
鸦胆子是一种中药植物,鸦胆子素 D ( Bruceine D ) 是从鸦胆子中分离提取出来的一种化合物。研究表明,鸦胆子素 D 对肝癌细胞[6]、胰腺癌细胞[7]等均有不同程度的抑制作用。但其对骨肉瘤细胞的抑制作用尚未见报道。为了研究鸦胆子素 D 对骨肉瘤细胞的作用,笔者选取了 143B HOS 两个细胞系作为研究对象,使用 CCK8 实验与平板克隆实 验研究不同物质量浓度下,鸦胆子素 D 对骨肉瘤细胞增殖的作用效果。同时,使用流式细胞仪来检测不同物质量浓度下的鸦胆子素 D 对骨肉瘤细胞的周期及诱导凋亡的作用;使用蛋白质印迹实验对凋亡相关蛋白、自噬相关蛋白表达检测,探讨鸦胆子素 D 对骨肉瘤细胞的作用。
材料与方法
一、实验设计
细胞分子生物学体外实验。
本实验于 2016 年 6~12 月在上海交通大学附属第一人民医院上海市骨肿瘤研究所完成。
二、实验材料
人骨肉瘤细胞株 143B HOS 购自美国菌种保藏中心 ( ATCC )。鸦胆子素 D ( 分析标准品;纯度HPLC>98%,货号 B21415 -20 mg,购自上海源叶生物科技有限公司 ) 将其溶于二甲基亚砜中,配置成 20 mmol / L 的工作母液,置于 -20 ℃ 的冰箱中备用,使用前用 DMEM 血清培养液调至所需浓度。DMEM 高糖培养基,胎牛血清 ( 美国 Thermo 公司 );Cleaved PARP 抗体,LC3B 抗体,GAPDH 抗体,辣根过氧化物酶标记二抗 ( 斯信生物科技有限公司 );二甲基亚砜 ( 美国 Sigma 公司 );0.02% EDTA+0.25% 胰蛋白酶 ( 德国 Miltenyi Biotec 公司 );恒温培养箱 ( 上海茸研仪器公司 );流式细胞仪 ( 美国 Becton Dickinson 公司 );多功能酶标仪 ( 美国 Molecular Devices 公司 );DMI3000B 荧光显微镜( 德国 Leica 公司 )。
三、实验方法
1. 细胞培养:将骨肉瘤细胞株 143B HOS 培养在 DMEM 完全培养液中 ( 含有体积分数为 10% 胎牛血清、0.1 g / L 链霉素、100 U / ml 青霉素 ),于37 ℃、体积分数为 5% CO2恒温培养箱中培养。待细胞融合度达到 85% 左右时,用 0.02% EDTA+0.25% 胰蛋白酶混合消化液进行消化,然后收集细胞 600 g 离心 3 min,传代培养。
2. CCK8 检测细胞增殖情况:收集对数生长期的 143B HOS 细胞,PBS 清洗,计数,分管,按3000 个 / 孔细胞数加入 96 孔板中,培养 24 h 使细胞贴壁,之后加入不同物质的量浓度鸦胆子素 D ( 0,0.25,0.5,1,2,4 μM ) 进行培养 24 h,然后进行检测。每孔加入用 DMEM 培养基稀释 10 倍的 CCK8试剂 100 μl 于 37 ℃ 孵育 45 min。使用酶标仪检测各孔在 450 nm 处的吸光度值。
3. 平板克隆实验:用不同物质的量浓度的鸦胆子素 D ( 0,1,2,4 μM ) 对 143B HOS 细胞进行处理,作用 24 h 后吸去上层液体,用 4% 多聚甲醛固定 15 min,PBS 漂洗 3 次,用 0.1% 结晶紫染色10 min,PBS 漂洗 2 次,风干后拍照。
4. 免疫印迹实验检测细胞凋亡与自噬相关蛋白:分别提取用含 0,1,2,4 μM 不同浓度鸦胆子素 D 培养液培养 24 h 的 143B HOS 细胞中的总蛋白,检测凋亡蛋白 Cleaved PARP 和自噬蛋白 LC3B的表达,进行定量,然后使用 10% 的分离胶进行电泳。在冰浴下 100 V 转膜 1 h。使用 5% 脱脂牛奶室温封闭 1 h,加入相对应的一抗 ( Cleaved PARP 抗体,LC3B 抗体和内参蛋白 GAPDH 抗体 ) 4 ℃ 孵育过夜,采用 TBST 进行洗涤 3 次,每次 10 min。之后加入二抗,37 ℃ 孵育 1 h,使用 TBST 洗涤 3 次,每次 15 min,在暗室中压片,然后进行显影、定影。
5. 流式细胞仪检测细胞周期:将 143B HOS 细胞加入到含有不同物质的量浓度鸦胆子素 D ( 0,1,2,4 μM ) 的培养液中进行培养,24 h 后收集细胞,600 g 离心 1 min PBS 清洗。用 70% 乙醇固定,加入周期试剂盒 PI 染液,室温避光孵育 15 min,用流式细胞仪进行检测。图像使用 ModFit 软件进行分析。重复实验 3 次。
6. 流式细胞仪检测细胞凋亡:将 143B HOS 细胞加入到含有不同物质的量浓度鸦胆子素 D ( 0,1,2,4 μM ) 的培养液中进行培养,24 h 后收集细胞,600 g 离心 1 min,PBS 清洗。然后使用 Annexin-VFITC / PI 细胞凋亡检测试剂盒检测其凋亡情况,将细胞加入到 100 μl 1×Binding 缓冲液中重悬,添加 5 μl Annexin V-FITC 和 2.5 μl PI 染料,进行避光振荡混匀,室温反应 15 min,然后再加入 300 μl 1×Binding 缓冲液,混匀,行流式细胞仪检测。重复试验 3 次。
7. LC3 荧光鼬合蛋白检测实验:将 GFP-LC3 质粒瞬时转染至 143B 细胞内,随后使用不含鸦胆子素D 和含有 2 μM 鸦胆子素 D 的培养基对转染成功后的143B 细胞作用 24 h。之后使用 PBS 清洗 2 次,使用4% 多聚甲醛固定 20 min,使用 0.1% Triton X-100 通透化处理,用 DAPI 作用 15 min,最后用荧光显微镜进行观察。
四、观察指标
不同物质的量浓度鸦胆子素 D 对骨肉瘤细胞增殖、凋亡以及自噬的影响。
五、统计学处理
采用 SPSS 19.0 软件进行统计学分析。计量资料用 x-±s 表示,采用 t 检验,两两比较组间差异,P<0.05 为差异有统计学意义。
结 果
一、鸦胆子素 D 抑制骨肉瘤细胞增殖
含有 0、0.25、0.5、1.0、2.0、4.0 μM 6 种不同浓度鸦胆子素 D 的培养液培养骨肉瘤细胞 24 h 与48 h,不同作用浓度及作用时间下 143B HOS 细胞增值率结果如表 1 所示。相同作用时间内随着鸦胆子素 D 物质的量浓度的升高,细胞的增殖率下降,与对照组 ( 0 μM ) 相比差异有统计学意义 ( P<0.05 ) ( 图 1a )。此外,随着药物浓度的增加,细胞的克隆形成数逐渐减少 ( 图 1b )。
二、鸦胆子素 D 引起骨肉瘤细胞周期阻滞
用含 0、1.0、2.0、4.0 μM 鸦胆子素 D 的培养液培养细胞 24 h,流式细胞仪检测其各周期相占比。实验结果如表 2 所示。可见,随着作用浓度的升高,处于 G0 / G1 期的细胞比例逐渐升高,处于G2 / M 期的细胞比例逐渐下降,与对照组 ( 0 μM ) 相比差异有统计学意义 ( P<0.05 ) ( 图 2 )。
三、鸦胆子素 D 促进骨肉瘤细胞凋亡
用含 0、1.0、2.0、4.0 μM 鸦胆子素 D 的培养液培养细胞 24 h,流式细胞仪检测其凋亡率。实验结果如表 3 所示。随着鸦胆子素 D 质量浓度的升高,细胞的凋亡率增加 ( 图 3 )。不同物质的量浓度鸦胆子素 D 处理的细胞与对照组 ( 0 μM ) 相比在凋亡率上差异均有统计学意义。
此外,采用蛋白质印迹实验检测了在 0、1.0、2.0、4.0 μM 不同浓度鸦胆子素 D 培养液处理下细胞凋亡相关蛋白 Cleaved PARP 的表达水平。加有鸦胆子素 D 组细胞中 Cleaved PARP 蛋白的表达水平高于未加药组,且随着药物浓度的升高,Cleaved PARP蛋白的表达也随之上升 ( 图 4 )。

表 1 鸦胆子素 D 对骨肉瘤细胞增殖的影响 ( x- ± s,% )Tab.1 Effects of Bruceine D on the proliferation of osteosarcoma cells ( x- ± s, % )

表 2 鸦胆子素 D 对骨肉瘤细胞周期的影响 ( x- ± s,% )Tab.2 Effects of Bruceine D on the cell cycle of osteosarcoma cells ( x- ± s, % )

图 1 鸦胆子素 D 抑制骨肉瘤细胞增殖 a~b:CCK8 实验检测鸦胆子素 D 对 143B HOS 细胞增殖的影响;c~d:平板克隆实验检测鸦胆子素 D 对 143B HOS 细胞克隆形成的影响 ( 与对照组 0 μM 相比,*P < 0.05 )Fig.1 Bruceine D inhibited the proliferation of osteos arcoma cells a - b: The anti-proliferative effects of Bruceine D on 143B HOS cells were detected by CCK8 assay; c - d: The results of colony formation assay showed the effects of Bruceine D on the colony formation of colonies of 143B HOS cells (*P < 0.05, when compared to 0 μM in the control group )
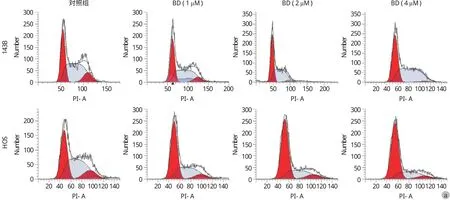

图 2 鸦胆子素 D 诱导骨肉瘤细胞 G0 / G1 期阻滞a:鸦胆子素 D 诱导骨肉瘤细胞周期阻滞结果;b:直方图 ( 与对照组 0 μM 相比,*P < 0.05 )Fig.2 Bruceine D induced G0 / G1 phase arrest in osteosarcoma cells a: The results of cell cycle arrest assay; b: Histogram (*P < 0.05, when compared to 0 μM in the control group )
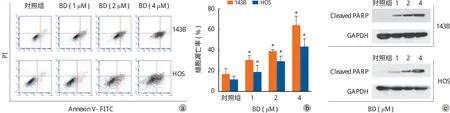
图 3 鸦胆子素 D 诱导骨肉瘤细胞凋亡 a:鸦胆子素 D 诱导骨肉瘤细胞凋亡的流式细胞仪分析结果;b:直方图 ( 与对照组 0 μM 相比,*P < 0.05 );c:Western Blot 检测不同浓度鸦胆子素 D 作用下 143B HOS 细胞 Cleaved PARP 的表达情况Fig.3 Evidence that Bruceine D induced apoptosis in osteosarcoma cells a: The apoptosis proportion of 143B HOS cells treated with various concentrations of Bruceine D was analyzed by fl ow cytometry; b: Histogram (*P < 0.05, when compared to 0 μM in the control group ); c: The expression of Cleaved PARP in 143B HOS cells treated with various concentrations of Bruceine D was detected by western blot assay
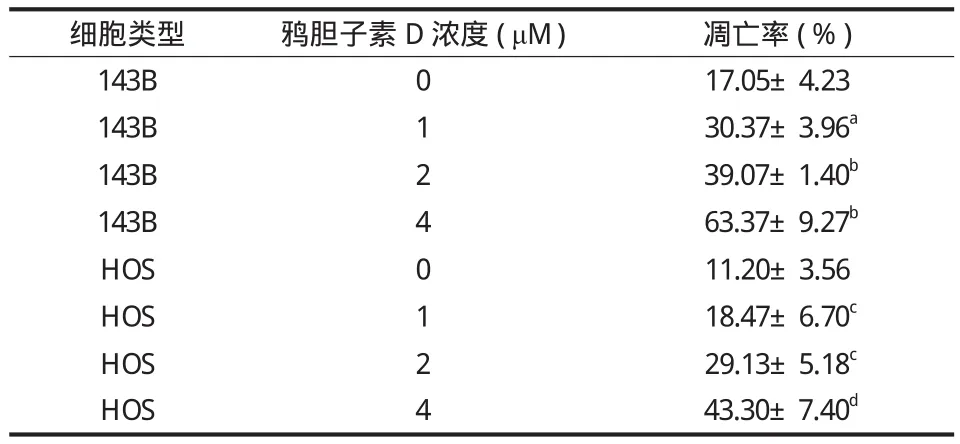
表 3 鸦胆子素 D 对骨肉瘤细胞凋亡的影响 ( x- ± s,% )Tab.3 Effects of Bruceine D on the apoptosis of osteosarcoma cells ( x- ± s, % )
四、鸦胆子素 D 诱导骨肉瘤细胞发生自噬
用 0、1.0、2.0、4.0 μM 4 种不同浓度鸦胆子素 D 培养液处理 143B HOS 细胞 24 h,采用蛋白质印迹实验检测了不同药物浓度下细胞自噬相关蛋白LC3B 的表达情况 ( 图 4b ),随着药物浓度的增加,LC3B-I 蛋白的表达量逐渐减少,LC3B-II 蛋白的表达量逐渐增加。之后,采用 LC3 荧光鼬合蛋白检测实验来检测自噬体的存在。与对照组相比,经过鸦胆子素 D 培养液处理的 143B 细胞的绿色荧光斑点明显增多 ( 图 4a )。
讨 论
CCK8 实验可以用于检测药物对细胞的增殖抑制情况。实验结果显示,随着药物浓度的升高,细胞的存活率逐渐下降,说明鸦胆子素 D 具有抑制骨肉瘤细胞增殖的作用。平板克隆实验可用于研究药物对细胞的毒性以及细胞对药物的敏感性[8],也可以反映细胞增殖特点以及群体依赖性,结果显示,随着药物浓度的提高,细胞克隆数也随之减少,这也进一步证实了鸦胆子素 D 对骨肉瘤细胞的增殖抑制作用。
细胞分裂的周期大致分为四个时相:G1 期、S 期、G2 期以及 M 期。一些细胞周期特异性药物只对增殖周期的某一时相敏感,可通过将细胞阻滞于某一周期进而抑制细胞的增殖。为了探究鸦胆子素 D 是否具有这一特征,笔者进行了细胞周期检测。流式细胞仪检测显示,在 0、1.0、2.0、4.0 μM 不同浓度鸦胆子素 D 作用下,处于 G0 / G1期的 143B HOS 细胞比例随着药物浓度的增加而增加,各浓度与对照组 ( 0 μM ) 相比差异有统计学意义 ( P<0.05 )。这表明鸦胆子素 D 具有阻滞 G0 / G1期细胞,延长细胞增殖周期作用。而这也一定程度上解释了鸦胆子素 D 为什么会抑制骨肉瘤细胞的增殖。
目前认为细胞程序性死亡主要有三种方式:凋亡[9]、坏死及细胞自噬导致的自噬性细胞死亡[10]。为了探究诱发细胞凋亡是否为鸦胆子素 D 抑制细胞增殖的原因,笔者使用流式细胞仪检测在 0、1.0、2.0、4.0 μM 不同浓度鸦胆子素 D 作用下 143B HOS细胞的凋亡情况。结果显示,对照组 ( 0 μM ) 细胞中凋亡细胞比例很少,随着药物浓度增加,凋亡细胞比例明显升高,与对照组相比差异有统计学意义 ( P<0.05 )。为了进一步确证鸦胆子素 D 对骨肉瘤细胞的凋亡促进作用,笔者又检测了药物作用下143B HOS 细胞中 Cleaved PARP 的蛋白表达情况。PARP ( 聚腺苷酸二磷酸核糖转移酶 ) 可识别结构损伤的 DNA 片段,有助于修复蛋白与 DNA 结合并进行修复[11]。当细胞发生凋亡时,其被 caspase-3 裂解形成 Cleaved PARP 从而失去活性[12],故可作为细胞发生凋亡的标志蛋白之一。在蛋白质印迹试验中,对照组的 Cleaved PARP 蛋白几乎不表达,而随着药物浓度的增加,c-PARP 的表达也逐渐增高这进一步说明了鸦胆子素 D 可以诱导骨肉瘤细胞的凋亡。
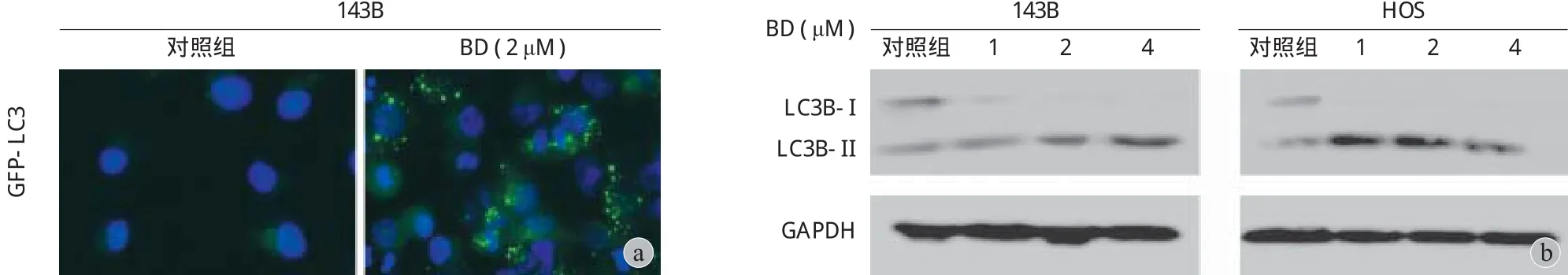
图 4 鸦胆子素 D 诱导骨肉瘤细胞自噬 a:不同浓度鸦胆子素 D 作用下 143B 细胞内 GFP-LC3 荧光斑点的荧光显微镜分析,比例尺为50 μM;b:Western Blot 检测不同浓度鸦胆子素 D 作用下 143B HOS 细胞 LC3B-I 与 LC3B-II 的表达情况Fig.4 Evidence that Bruceine D induced autophagy in osteosarcoma cells a: The punctate patterns of GFP-LC3 expression in 143B cells treated with various concentrations of Bruceine D were examined using fl uorescent microscope. Scale bars = 50 μM; b: The expressions of LC3B-I and LC3B-II in 143B HOS cells treated with various concentrations of Bruceine D were detected by western blot assay
为进一步探究鸦胆子素 D 是否可以诱导骨肉瘤细胞的自噬,笔者对不同药物浓度处理后的143B HOS 细胞 LC3B 蛋白的表达进行了蛋白质印迹检测。LC3B 为 LC3 蛋白的一种,LC-3 为目前检测最为广泛的自噬相关蛋白之一,从 LC3B-I 到LC3B-II 的转变以及 LC3B-II 的积聚可以从一定程度上反应细胞自噬的发生[13]。实验结果显示,随着药物浓度的增加,LC3B-II 的表达也随之升高。LC3 荧光鼬合蛋白检测实验也是常见的检测细胞自噬的方法之一,与对照组 ( 0 μM ) 相比,经 2 μM 鸦胆子素D 处理后的 143B 细胞的绿色荧光斑点显著增多,提示鸦胆子素 D 使得 143B 细胞的自噬体生成增多,这说明鸦胆子素 D 可以诱导骨肉瘤细胞自噬的发生。
综上所述,鸦胆子素 D 具有抑制骨肉瘤 细胞增殖,诱导骨肉瘤细胞凋亡和自噬作用。这意味着鸦胆子素 D 在骨肉瘤治疗方面可能存在着潜在的价值,但对骨肉瘤细胞作用的具体机制并不明了,还需更多后续研究。
[1] Zheng Y, Cheng Y, Chen J, et al. Injectable hydrogelmicrosphere construct with sequential degradation for locally synergistic chemotherapy[J]. ACS Appl Mater Interfaces, 2017, 9(4):3487-3496.
[2] Flores RJ, Kelly AJ, Li Y, et al. A novel prognostic model for osteosarcoma using circulating CXCL10 and FLT3LG[J]. Cancer, 2017, 123(1):144-154.
[3] Serra M, Hattinger CM. The pharmacogenomics of osteosarcoma[J]. Pharmacogenomics J, 2017, 17(1):11-20.
[4] Salas S, Jiguet-Jiglaire C, Campion L, et al. Correlation between ERK1 and STAT3 expression and chemoresistance in patients with conventional osteosarcoma[J]. BMC Cancer, 2014, 14:606.
[5] Jabeen S, Holmboe L, Alnaes GI, et al. Impact of genetic variants of RFC1, DHFR and MTHFR in osteosarcoma patients treated with high-dose methotrexate[J]. Pharmacogenomics J, 2015, 15(5):385-390.
[6] Xiao Z, Ching Chow S, Han Li C, et al. Role of microRNA-95 in the anticancer activity of Brucein D in hepatocellular carcinoma[J]. Eur J Pharmacol, 2014, 728:141-150.
[7] Lau ST, Lin ZX, Leung PS. Role of reactive oxygen species in brucein D-mediated p38-mitogen-activated protein kinase and nuclear factor-kappaB signalling pathways in human pancreatic adenocarcinoma cells[J]. Br J Cancer, 2010, 102(3):583-593.
[8] Plumb JA. Cell sensitivity assays: clonogenic assay[J]. Methods Mol Med, 2004, 88:159-164.
[9] Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. Br J Cancer, 1972, 26(4):239-257.
[10] Clarke PG. Developmental cell death: morphological diversity and multiple mechanisms[J]. Anat Embryol (Berl), 1990, 181(3):195-213.
[11] Eustermann S, Videler H, Yang JC, et al. The DNA-binding domain of human PARP-1 interacts with DNA single-strand breaks as a monomer through its second zinc fi nger[J]. J Mol Biol, 2011, 407(1):149-170.
[12] Meguro T, Chen B, Parent AD, et al. Caspase inhibitors attenuate oxyhemoglobin-induced apoptosis in endothelial cells[J]. Stroke, 2001, 32(2):561-566.
[13] Kimura S, Fujita N, Noda T, et al. Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol, 2009, 452:1-12.
( 本文编辑:裴艳宏 )
Effects of Bruceine D on the proliferation, apoptosis and autophagy of osteosarcoma cells
ZHENG Ying, WANG Gang-yang, CHEN Rui-ling, HUA Ying-qi, CAI Zheng-dong. Department of Orthopedics, the fi rst People’s Hospital Aff i liated to Shanghai Jiaotong University, Shanghai Bone Tumor Instituticn, Shanghai, 200080, China
CAI Zheng-dong, Email: czd856@vip.163.com
ObjectiveTo investigate the definite effects of Bruceine D on inhibiting the proliferation of osteosarcoma cells and inducing the apoptosis and autophagy in osteosarcoma cells.MethodsThe anti-proliferative effects of Bruceine D on 143B HOS cells were detected by CCK8 assay. Colony formation assay was used to detect the colony formation of 143B HOS cells treated with Bruceine D. The Bruceine D’s effects of cell cycle arresting on 143B HOS cells were analyzed by fl ow cytometry. The Bruceine D’s effects of inducing apoptosis in 143B HOS cells were investigated by fl ow cytometry and Western blot assay. We measured the autophagy associated proteins expressed in 143B HOS cells treated with Bruceine D by fl uorescence microscope. The Bruceine D’s effects of inducing autophagy were also investigated by GFP-LC3 punctate assay.Results( 1 ) The CCK8 assay showed that the cell viability and number of colonies of 143B HOS treated with Bruceine D were decreased. ( 2 ) A higher ratio of G0 to G1 phase cells in 143B HOS was caused by Bruceine D, which was found by using fl ow cytometry. ( 3 ) The apoptosis proportion of 143B HOS treated with Bruceine D was increased, which was found by using fl ow cytometry; The western blot assay showed the expression level of Cleaved PARP was increased in 143B HOS. ( 4 ) The western blot assay showed the expression level of LC3B-II was increased in 143B HOS; The 143B cells treated by Bruceine D displayed a punctate pattern of GFP-LC3 expression, which was found by using fl uorescence microscope.Conclusions( 1 ) Bruceine D inhibits the proliferation of osteosarcoma cells. ( 2 ) Bruceine D induces the apoptosis of osteosarcoma cells. ( 3 ) Bruceine D induces the autophagy of osteosarcoma cells.
Osteosarcoma; Bruceine; Cell proliferation; Apoptosis; Autophagy
10.3969/j.issn.2095-252X.2017.06.007
R738.1, R915
国家自然科学基金项目 ( 81202115 )
作者单位:200080 上海交通大学附属第一人民医院骨科,上海市骨肿瘤研究所
蔡郑东,Email: czd856@vip.163.com
2017-01-20 )
