高效液相色谱法测定牛羊杂碎等肉类中嘌呤及尿酸
2017-06-19王静莹薄海波吉生军程子毓陈秀红
王静莹,薄海波*,吉生军,程子毓,陈秀红
1(青海师范大学,青海 西宁,810000) 2(青海省出入境检验检疫局,青海 西宁,810000)
高效液相色谱法测定牛羊杂碎等肉类中嘌呤及尿酸
王静莹1,薄海波1*,吉生军1,程子毓1,陈秀红2
1(青海师范大学,青海 西宁,810000) 2(青海省出入境检验检疫局,青海 西宁,810000)
建立同时测定肉类食品中尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤和腺嘌呤的高效液相色谱分析方法,并测定肉类样品中上述4种嘌呤及尿酸的含量。色谱条件:资生堂CAPCELL PAK-C18(4.6 mm×250 mm,5 μm)色谱柱,柱温30℃;流动相为7×10-3mol/L KH2PO4-H3PO4(pH=3.83),流速1.0 mL/min;检测器为紫外检测器,检测波长254 nm;进样量10 μL。结果:在上述条件下4种嘌呤和尿酸分离和测定效果良好,4种嘌呤和尿酸的质量浓度和峰面积在0.05~50 μg/mL线性范围内线性关系良好,相关系数均在0.999 6以上,检出限在0.010~0.024 μg/mL之间,精密度检测RSD为0.25%~0.81%,各组分回收率为92.0%~105.0%,方法精密度RSD为6.27%~11.09%。结论:该方法简便,快捷,可靠,各组分分离度好,可应用于肉类食品中嘌呤和尿酸的同时分析测定。
高效液相色谱(HPLC);牛羊杂碎;嘌呤;尿酸
嘌呤(C5H4O4)是一类生物碱,是核酸的重要组成部分,人体内嘌呤的主要来源有体内合成、人体组织中核酸分解以及食物中摄取,而饮食是人体嘌呤的一个重要来源。常见的嘌呤主要有腺嘌呤(adenine)、鸟嘌呤(guanine)、黄嘌呤(xanthine)和次黄嘌呤(hypoxanthine) 4 种[1],嘌呤经体内代谢最终转化生成尿酸(Uric acid),正常情况下主要经肾排出体外。尿酸是人体内特有的天然水溶性抗氧化剂,具有刺激树突状细胞及T细胞成熟以维护机体免疫力、维持血压、促进伤口愈合等功能[2]。长期摄入高嘌呤的食品再加上一些诱导因素会导致嘌呤在体内的最终产物——尿酸的沉积,最终引发痛风。
食品嘌呤含量的检测方法和样品前处理方法多种多样,目前国内外没有建立统一的标准。嘌呤检测的方法主要有液相色谱法、纸层析法、电泳法、薄层色谱法、气相色谱法和离子色谱法等[3],随着液相色谱法日渐普及,并因其方便、快速、灵敏、选择性高,已成为检测嘌呤的主流方法。样品中嘌呤的提取方法有酸提取法[4-7]、有机溶剂萃取[8-9]和超声辅助萃取法[10-12]。研究者多采用HClO4[13-19]、三氟乙酸和甲酸[20-21]进行样品水解。HClO4水解样品,分离效果较好,准确度和精密度较高,检测时间短。因此本实验采用高氯酸对样品进行水解。
本研究建立了同时测定青藏高原牛羊杂碎等风味肉制品中腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤及尿酸的高效液相色谱分析方法,并对4种嘌呤和尿酸含量进行同时测定。
1 材料与方法
1.1 材料与试剂
样品:新鲜黄牛肉、牦牛肉、手抓羊肉、牛肉、牛头肉;牛腩、牛肚、牛筋、羊肝、羊心、羊肠等牛羊内脏;牛杂碎(含有牛肚,牛筋,牛肺,牛肠,牛腩等内脏)、羊杂碎(含有羊肚,羊心,羊肺,羊肠,羊肝等内脏)购自西宁市各大市场。-20 ℃冷冻保存。
标准品:尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤标准品(纯度>98.0%),Agilent公司。
称取尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤和腺嘌呤标准品各0.050 0 g,加20 mL 0.1 mol/L的NaOH溶液助溶,分别用10%甲醇溶液定容至100 mL容量瓶中,摇匀,即得500 μg/mL的标准单一储备液。-20 ℃保存。
试剂:甲醇(色谱纯),天津市光复精细化工研究所;HClO4(分析纯),天津东方化工厂;KH2PO4(分析纯),北京红星化工厂;H3PO4(分析纯),天津市滨海科迪化学试剂有限公司;KOH(分析纯),四川成都化工厂;实验用水均为超纯水。
1.2 仪器与设备
U1tiMate3000高效液相色谱仪(配有紫外检测器),美国戴安公司;FW-100高速万能粉碎机,绍兴市科弘仪器有限公司;雷磁PHS-3C型pH计,上海仪电科学仪器股份有限公司;L600离心机,湘仪公司;WB-2000水浴锅,郑州长城科工贸有限公司;TG332A微量分析天平,湘仪天平仪器厂。
1.3 方法
1.3.1 色谱条件
色谱柱:资生堂CAPCELL PAK-C18(4.6 mm×250 mm,5 μm),柱温30 ℃;流动相:7×10-3mol/L KH2PO4-H3PO4(pH=3.83),流速1.0 mL/min;检测器:紫外检测器,检测波长254 nm;进样量10 μL。
1.3.2 样品的制备与前处理
将样品室温下自然解冻,新鲜黄牛肉、牦牛肉、手抓羊肉、牛肉、牛头肉等肉类和牛腩、牛肚、牛筋、羊肝、羊心、羊肠等牛羊内脏;用刀切碎,再用高速万能粉碎机绞碎并匀浆,贴明标签,-20 ℃冷冻保存备用。
将市购的牛杂碎(含有牛肚,牛筋,牛肺,牛肠,牛腩等内脏)和羊杂碎(含有羊肚,羊心,羊肺,羊肠,羊肝等内脏)分别分样为牛杂碎肉(干物质)、牛杂碎汤、牛杂碎肉和汤(混合物)、羊杂碎肉(干物质)、羊杂碎汤、羊杂碎肉和汤(混合物),用高速万能粉碎机绞碎并匀浆,贴明标签,-4 ℃冷冻保存备用。
称取0.200 0 g样品于10 mL具塞刻度离心管中,加入3 mL 体积分数10%的HClO4,摇匀后在沸水浴中水解60 min,冷却。用1 mol/L的KOH溶液调节pH至3.8,再用超纯水定容至10 mL,以3 000 r/min的转速离心30 min,上清液滤纸过滤,再用0.22 μm微孔水膜过滤,待进样分析。
2 结果与分析
2.1 实验条件的优化
2.1.1 色谱柱的选择
CAPCELL PAK-C18柱采用高纯度多孔球形硅胶作为基质,表面包覆单层有机硅聚合物薄膜,并在其上键合十八烷基(C18)等各种官能团的高性能填料填充的色谱柱。该填料既具有硅胶类填料的高分离能力,又具有聚合物填料的耐久性。该色谱柱适合测定极性成分,能与极性较强的水流动相兼容使分离的各组分呈现出良好的色谱峰形。实验结果表明:使用资生堂CAPCELL PAK-C18能将4种嘌呤和尿酸完全分离。
2.1.2 检测波长的选择
尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤和腺嘌呤都有着共轭双键,在紫外区220~300 nm之间有强吸收峰。综合考虑4种嘌呤和尿酸的吸收峰,选择以波长254 nm作为实验检测波长。
2.1.3 流动相的优化
2.1.3.1 流动相pH的选择
流动相的酸度对嘌呤类物质的分离程度和保留时间影响较大,应选择合适的pH值使4种嘌呤和尿酸达到最佳分离效果。考察了浓度相同(7.0×10-3mol/L),不同pH(3.65,3.83、3.93、4.15)的KH2PO4- H3PO4溶液对4种嘌呤及尿酸峰形和分离效果的影响。见图1。
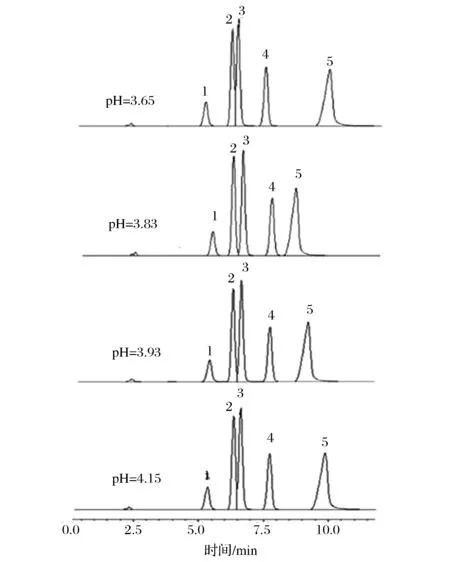
1-尿酸;2-鸟嘌呤;3-次黄嘌呤;4-黄嘌呤;5-腺嘌呤图1 流动相pH为3.65、3.83、3.93、4.15的色谱图Fig.1 Chromatogram of mobile phase pH is 3.65、3.83、 3.93、 4.15
观察上图中4种嘌呤和尿酸的分离情况结果,在pH为3.83时,4种嘌呤和尿酸可以完全分离,而且基线稳定,重复性最好,出峰顺序依次为尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤。因此确定流动相pH为3.83。
2.1.3.2 流动相浓度的选择
采用KH2PO4- H3PO4溶液做流动相,考察了相同pH(3.83),不同浓度(2.0×10-4、5.0×10-3、7.0×10-3、1.0×10-2、2.0×10-2mol/L)的KH2PO4-H3PO4溶液对4种嘌呤及尿酸峰形和分离效果的影响,见图2。
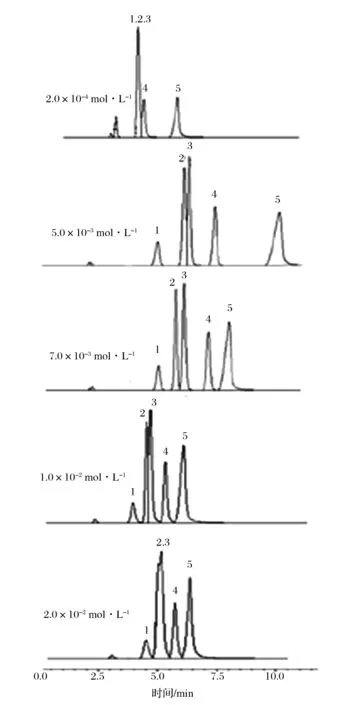
1-尿酸;2-鸟嘌呤;3-次黄嘌呤;4-黄嘌呤;5-腺嘌呤图2 流动相浓度为2.0×10-4、5.0×10-3、7.0×10-3、1.0×10-2、2.0×10-2 mol/L的色谱图Fig.2 Chromatogram of mobile phase concentration is 2.0×10-4、5.0×10-3、7.0×10-3、1.0×10-2、2.0×10-2 mol/L
观察上图中4种嘌呤和尿酸的分离情况,流动相的浓度对于峰形、分离度影响较大。在浓度7.0×10-3mol/L的情况下,基线较稳定,分离度好。因此最终确定流动相浓度为7.0×10-3mol/L[22]。
2.2 线性范围及检出限、定量限
分别移取500 μg/mL标准单一储备液,用超纯水稀释至0.05、 10、 20、30、40、50 μg/mL的标准系列混合溶液。将系列标准混合溶液分别用0.22 μm微孔滤膜过滤至进样瓶中, 在1.3.1所述的色谱条件下,各进样10 μL,绘制标准曲线。
采用外标法对进样的系列标准溶液的峰面积和相应质量浓度进行线性回归计算,得峰面积(Y)与质量浓度(X)的线性方程和相关系数。按3倍信噪比计算检出限(LOD),10倍信噪比计算定量限(LOQ)。数据结果见表1。
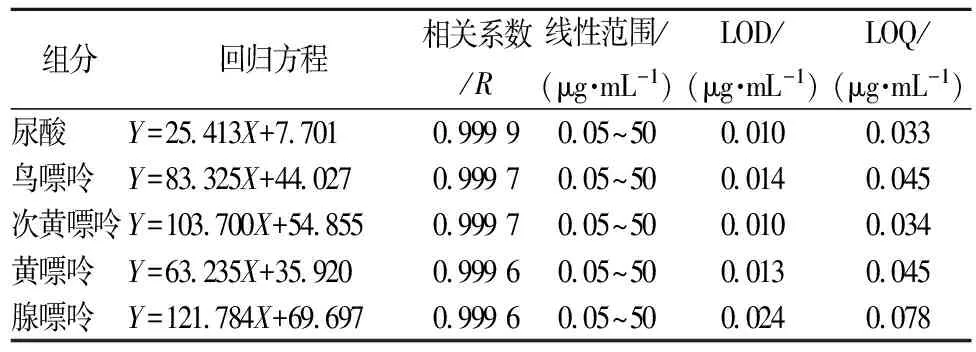
表1 四种嘌呤和尿酸的回归方程和线性范围
表1数据结果显示:4种嘌呤和尿酸的质量浓度和峰面积在0.05~50 μg/mL线性范围内线性关系良好,相关系数(R)在0.999 6~0.999 9之间,检出限在0.010~0.024 μg/mL之间。说明此方法适合实际样品的测定。
2.3 精密度考察
将20 μg/mL的混合标准溶液在日内连续进样6次,根据定量的质量浓度分别计算4种嘌呤和尿酸的精密度。数据结果见表2。
表2数据结果显示:尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤和腺嘌呤的相对标准偏差为0.25%~0.81%,精密度良好。
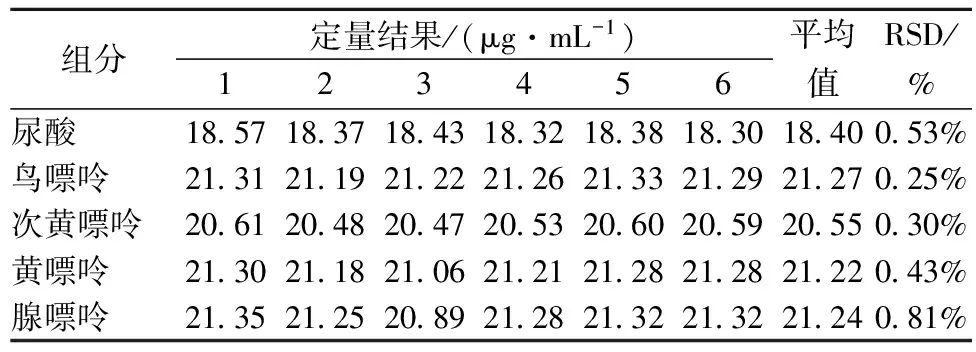
表2 精密度实验结果
2.4 回收率考察
采用牛肚作为实验样品进行添加回收率实验,取已知4种嘌呤和尿酸含量的牛肚样品18份,每份0.200 0 g,加入3个不同浓度水平的四种嘌呤和尿酸的标准混合溶液,每个浓度水平平行6份,按照1.3.2节中的前处理方法进行处理后,根据添加的标准样品质量浓度和测定出的加标样品质量浓度计算4种嘌呤和尿酸的回收率,尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤的平均加标回收率分别为99.1%、99.0%、105.0%、92.0%、92.6%,根据实验测得的18份加标样品中4种嘌呤和尿酸的回收率,计算出方法精密度RSD为6.27%~11.09%,均符合分析测定的要求。
2.5 样品测定结果
将牛羊杂碎等肉类样品按1.3.3节进行处理,按1.3.1节的色谱条件下进样分析。采用外标法对实测样品的4种嘌呤和尿酸进行定性定量分析。部分样品色谱图见图3~图5。样品测定数据结果见表3。
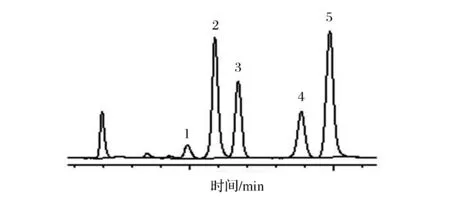
1-尿酸;2-鸟嘌呤;3-次黄嘌呤;4-黄呤;5-腺嘌呤图3 牛肚色谱图Fig.3 Chromatogram of tripe
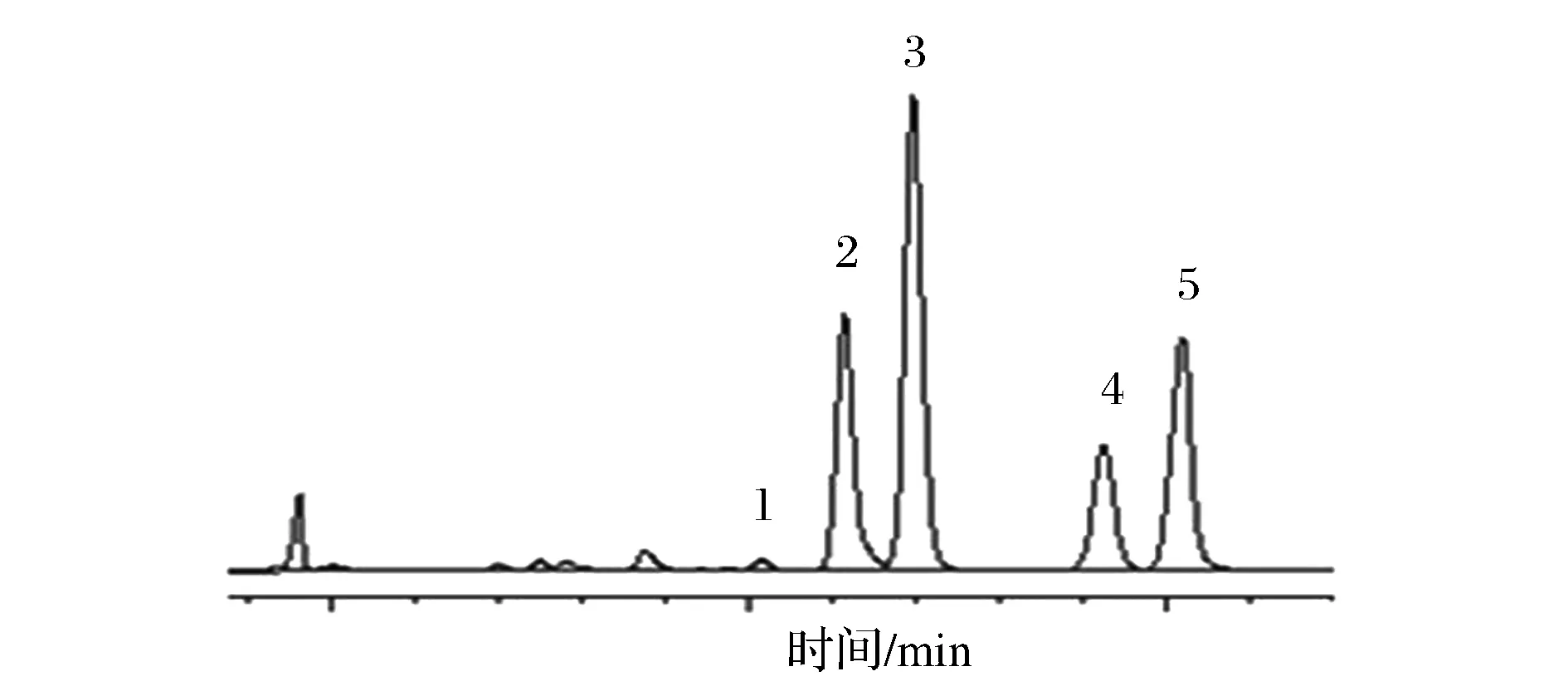
1-尿酸;2-鸟嘌呤;3-次黄嘌呤;4-黄嘌呤;5-腺嘌呤图4 牛肉色谱图Fig.4 Chromatogram of beef
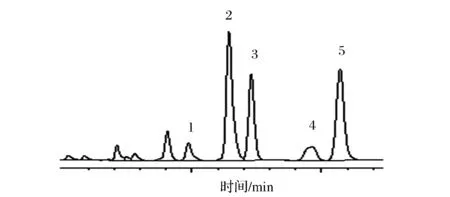
1-尿酸;2-鸟嘌呤;3-次黄嘌呤;4-黄嘌呤;5-腺嘌呤图5 羊肝色谱图Fig.5 Chromatogram of Sheep liver
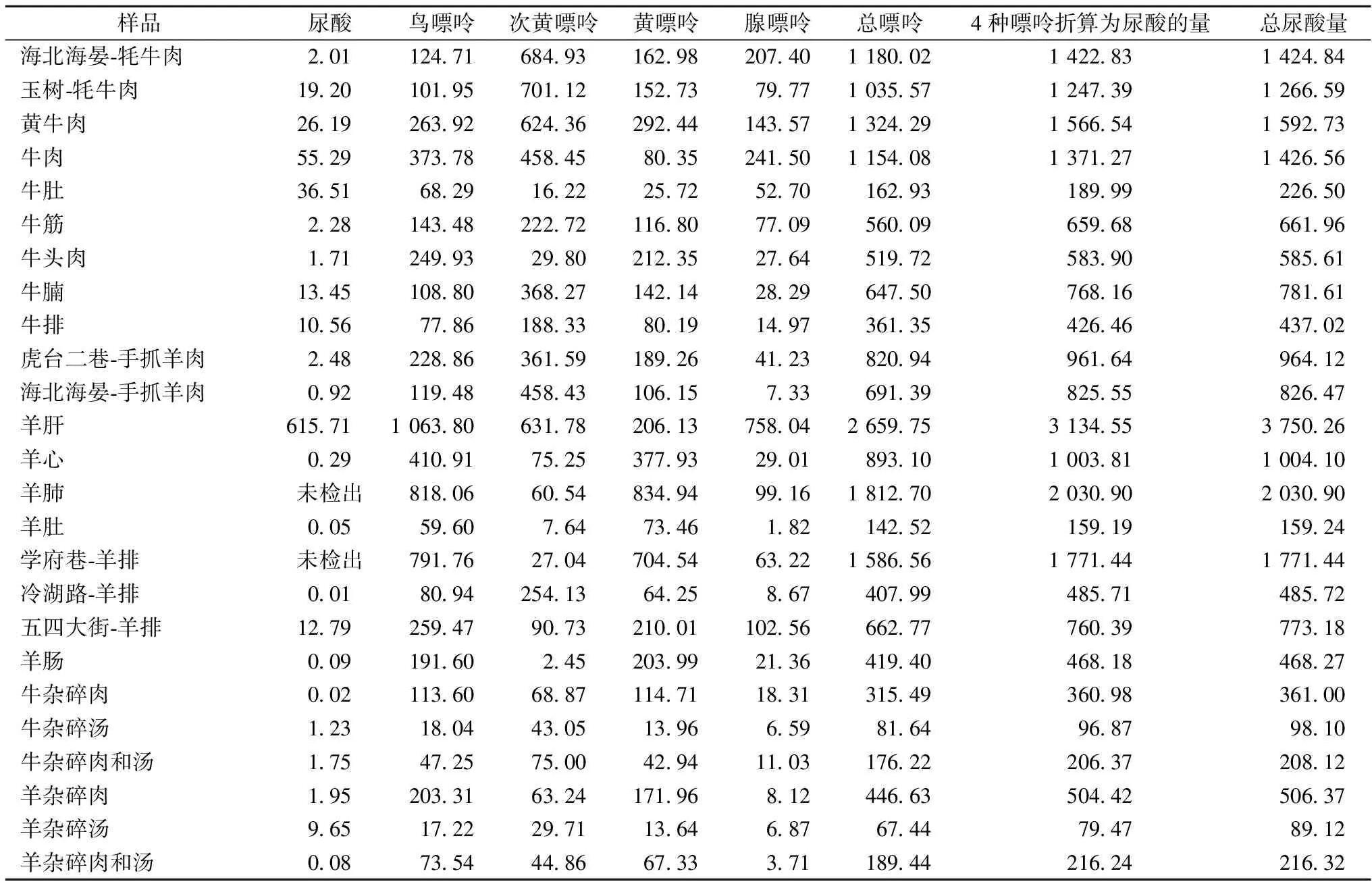
表3 样品中4种嘌呤和尿酸的含量 单位:mg/kg
注:4种嘌呤折算为尿酸的量是根据相对分子质量计算4种嘌呤转化为尿酸的理论含量值。
表3结果显示:青藏高原牛羊杂碎等风味肉制品中总尿酸含量为89.12~3 750.26 mg/kg,总嘌呤含量为67.44~2 659.75 mg/kg。在实测样品中羊肝的尿酸和总嘌呤含量最高,其总嘌呤含量达到2 659.75 mg/kg,牦牛肉、黄牛肉、牛肉和学府巷-羊排中总嘌呤含量次之;牛羊杂碎汤中总嘌呤含量最低,牛羊肚次之。采用本方法在羊肺和学府巷-羊排中未检测到尿酸;在羊心、羊肚、冷湖-羊排、羊肠、牛杂碎肉和羊杂碎肉和汤中尿酸含量较低。
在牛肉和牛杂碎中总嘌呤含量顺序为:黄牛肉>牛肉>牦牛肉>牛腩>牛筋>牛头肉>牛排>牛杂碎肉>牛杂碎肉和汤>牛肚>牛杂碎汤;在羊肉和羊杂碎中总嘌呤含量顺序为:羊肝>羊肺>学府巷-羊排>羊心>手抓羊肉>五四大街-羊排>羊杂碎肉>羊肠>冷湖路-羊排>羊杂碎肉和汤>羊肚>羊杂碎。
由表3可知,不同地方购买的牛羊杂碎等肉类中总嘌呤和尿酸含量差异较大,尤其是不同地的羊排中总嘌呤和尿酸含量有着显著的差异,羊排中总嘌呤含量学府巷-羊排>五四大街-羊排>冷湖路-羊排,三个地区结果差异较大。嘌呤含量差异大可能是由于生物体生长环境和自身生长情况不一样,造成同一部位的肉中嘌呤含量差异较大。
在痛风发病率高的青藏高原地区,为预防和治疗痛风症,建议人们少量食用高嘌呤含量的黄牛肉、牦牛肉、牛肉、羊肺、羊排,尤其是嘌呤含量特高的羊肝;可合理食用牛羊肚和牛羊杂碎等嘌呤含量较低的食物。
3 结论
本研究建立的方法对尿酸、鸟嘌呤、次黄嘌呤、黄嘌呤和腺嘌呤分离效果好,能快速、准确的检测定量肉类食品中4种嘌呤和尿酸的含量。此方法在线性范围0.05~50 μg/mL内线性关系良好,相关系数(R)在0.999 6~0.999 9之间,方法检出限在0.010~0.024μg/mL之间,精密度RSD为0.25%~0.81%,各组分回收率在92.0%~105.0%之间,方法精密度RSD为6.27%~11.09%,适用于4种嘌呤和尿酸的同时分析测定。应用此方法测定的青藏高原牛羊杂碎等特色肉类食品中嘌呤和尿酸的含量数据,可为通风发病率高的青藏高原地区消费者提供科学健康的饮食指导。
[1] 王新宴,凌云,储晓刚,等.肉制品中四种嘌呤含量在水煮过程中的变化[J].食品科学,2008,29(7):67-69.
[2] 李迪,王军波.食物与人体血尿酸水平关系研究进展[J].中国食物与营养,2014,20(10):86-89.
[3] 杨海斌.各类肉质食物中嘌呤类物质的检测[D].太原:山西医科大学,2012,1-29.
[4] 宋晶萍,朱敏.HPLC测定鹿胎软胶囊中4种嘌呤的含量[J].中药材,2014,37(1):19-21.
[5] 吕兵兵,张进杰,储银,等.反相高效液相色潽法检测带鱼糜中的嘌呤含量[J].中国食品学报,2012,12(7):192-198.
[6] 彭建春,杨靖,赵华.反相高效液相色潽法同时测定人血浆5种嘌呤物质的含量[J].重庆医科大学学报,2012,37(1):71-74.
[7]FANH,YANGFQ,LISP.DeterminationofpurineandpyrimidinebasesinnaturalandculturedCordycepsusingoptimumacidhydrolysisfollowedbyhighperformanceliquidchromatography[J].JournalofPharmaceuticalandBiomedicalAnalysis, 2007,45(1):141-144.
[8] 王萍,漆淑华,黄丽思,等. 南海中华小尖柳珊瑚中嘌呤和嘧啶类化合物的研究[J]. 天然产物研究与开发,2012,24(1):4-7.
[9]CLARIANAM,GRATACOS-CUBARSM,HORTOSM,etal.Analysisofsevenpurinesandpyrimidinesinporkmeatproductsbyultrahighperformanceliquidchromatography-tandemmassspectrometry[J].JournalofChromatographyA, 2010, 1217(26):4 294-4 299.
[10] 王艳,杨培民,代龙,等.HPLC测定水蛭仿生酶解有效部位中次黄嘌呤及尿苷[J].中国实验方剂学杂志,2011,17(13):74-76.
[11] 宋艳,王智鼎,李岳飞,等.兔心肌中次黄嘌呤纯化工艺的优化[J].中国生化药物杂志,2012,33(6):836-841.
[12] 程庆红,张颖,孟凡艳,等. 高效液相色谱法测定虾仁和牡蛎中嘌呤类物质[J]. 应用化工,2013,42(10):1923-1926.
[13] 谢芳钦,陈爱平,罗朝晨,等.常见饮品中嘌呤含量的测定[J]. 中国预防医学杂志,2013,14(7):551-552.
[14]KANEKOK,YAMANOBET,FUJINMORIS.Determinationofpurinecontentsofalcoholicbeveragesusinghighperformanceliquidchromatography[J].BiomedicalChromatography, 2009, 23(8): 858-864.
[15] 崔素萍,车康,谢微,等. 高效液相色谱测定脱脂豆粕中嘌呤含量[J]. 中国食品学报,2014,14(7):224-229.
[16] 施政,刘健,申屠建中,等. 高效液相色谱法定量尿酸、黄嘌呤和次黄嘌呤在人体血清中的浓度[J]. 中国临床药理学与治疗学,2013,18(5):532-536.
[17] 鲁洋,钱和,张伟国,等. 纳豆芽孢杆菌发酵液中嘌呤碱基的检测[J]. 食品工业科技,2014,35(2):59-62.
[18]INAZAWAK,SATOA,KATOY,etal.DeterminationandprofilingofpurinesinfoodsbyusingHPLCandLC-MS[J].Nucleosides,NucleotidesandNucleicAcids, 2014, 33(4-6): 439-444.
[19]YAMAOKAN,KANEKOK,KUDOY,etal.Analysisofpurineinpurine-richcauliflower[J].Nucleosides,NucleotidesandNucleicAcids, 2010, 29(4-6): 518-521.
[20] 凌云,王新宴,雍炜,等.高效液相色谱法检测肉类食品中四种嘌呤碱[J].分析化学,2008,36(6):724-728.
[21] 曲欣,林洪,隋建新. 高效液相色谱法测定食品中嘌呤含量[J]. 中国海洋大学学报(自然科学版),2014,44(12):41-47.
[22] 杨海斌, 张加玲,刘桂英,等. 高效液相色谱法同时测定肉类食品中的嘌呤和尿酸[J]. 卫生研究,2012,41(2):303-306.
Determination of purine and uric acid in cooked cow and sheep offal by high performance liquid
WANG Jing-ying1, BO Hai-bo1*, JI Sheng-jun1, CHENG Zi-yu1, CHEN Xiu-hong2
1(Department of Chemistry, Qinghai Normal University, Xining 810008, China) 2(Qinghai Entry-Exit Inspection and Quarantine Bureau, Xining 810008, China)
A high performance liquid Chromatography method for the determination of uric acid, guanine, hypoxanthine, xanthine and adenine in meat was established and applied. The detecting method for Chromatography was: Shiseido CAPCELL PAK-C18(4.6 mm×250 mm, 5 μm)column, column temperature was at 30 ℃.The mobile phase was 7×10-3mol/L KH2PO4-H3PO4(pH=3.83)at a flow rate of 1.0 mL/min. The UV detector was used and the wavelength was set at 254 nm and the Sample volume was 10 μL. Result: Under the above conditions, good separation was obtained and four kinds of purines and uric acid was showed in the range of 0.05-50 μg/mL; a good linear relation was observed between the concentration and peak area,and all the correlation coefficients are higher than 0.9996, the limit of detection was between 0.010-0.024 g/mL, precision detection of RSD% was between 0.25%-0.81%,the recovery rate of each component was between 92.0%-105.0%, the precision RSD% was between6.27%-11.09%. Conclusion: The method was simple, rapid and reliable,had a good separation for each component, and can be used for the analysis and determination of purine and uric acid in meat products.
HPLC; cooked chopped entrails of cattle and sheep; purine; uric acid
10.13995/j.cnki.11-1802/ts.201704037
硕士研究生(薄海波教授为通讯作者,E-mail:1025104004@qq.com)。
青藏高原特色风味食品中危害物质高通量筛查及快速检测技术研究(2014-ZJ-722)
2016-08-23,改回日期:2016-10-16
