砷超标食用牛肝菌的红外光谱快速鉴别
2017-06-19李杰庆杨天伟王元忠刘鸿高李涛
李杰庆,杨天伟,王元忠,刘鸿高*,李涛
1(云南农业大学 农学与生物技术学院,云南 昆明,650201) 2(云南省农业科学院药用植物研究所,云南 昆明,650200) 3(云南省省级中药原料质量监测技术服务中心,云南 昆明,65200) 4(玉溪师范学院 资源环境学院,云南 玉溪,653100)
砷超标食用牛肝菌的红外光谱快速鉴别
李杰庆1,杨天伟1,王元忠2,3,刘鸿高1*,李涛4
1(云南农业大学 农学与生物技术学院,云南 昆明,650201) 2(云南省农业科学院药用植物研究所,云南 昆明,650200) 3(云南省省级中药原料质量监测技术服务中心,云南 昆明,65200) 4(玉溪师范学院 资源环境学院,云南 玉溪,653100)
红外光谱结合偏最小二乘判别分析建立快速区分牛肝菌砷含量是否超标的方法。采集美味牛肝菌和绒柄牛肝菌共85份样品的红外光谱信息,对光谱进行平滑、二阶导数和标准正态变量优化处理;采用电感耦合等离子体发射光谱仪测定牛肝菌中砷含量,根据GB 2762—2012规定的食用菌中砷限量标准评价牛肝菌的食用安全性;将红外光谱数据与牛肝菌的砷含量值进行拟合建立砷超标与未超标样品的分类模型。结果显示:(1)牛肝菌的砷元素含量为0.033~8.301 mg/kg (DW),不同种类、不同产地牛肝菌砷元素含量具有差异;(2)多数牛肝菌样品砷含量超过GB 2762—2012的限量标准,其中采自普洱思茅区的绒柄牛肝菌砷超标较为严重,食用有潜在风险;(3)砷超标与未超标牛肝菌的红外光谱在峰形、峰位上没有明显差异;优化处理后的光谱数据进行偏最小二乘判别分析,其主成分得分散点图能将砷超标样品和未超标样品区分开,分类正确率达到91.76%,能为快速检测食用菌中砷含量是否超标提供新方法。
红外光谱;牛肝菌;砷;健康风险;鉴别
野生食用菌具有重要的生态价值和食药用价值,被誉为“山珍佳肴”和绿色健康食品[1-3]。云南野生菌种类和产量均居全国之首,2014年野生食用菌产量达8万t,总产值67.8亿元,其中牛肝菌、松茸、块菌等被销往德国、英国、日本等40多个国家,是云南省出口创汇的支柱产品,其创汇额仅次于云南的烟草、咖啡和蔬菜。然而,随着人们对食品安全问题的重视,食用菌中重金属超标、农残超标等现象引起了人们的关注,日本及欧洲部分国家建立了一些“绿色壁垒”措施,对云南野生食用菌的出口产生影响[4]。大量研究显示,野生食用菌对重金属的富集能力强于绿色植物和栽培菌[5-7],同时近年来工业三废的排放及含重金属农药、化肥等的大量使用,生态环境污染日益突出[8-10],食用菌中砷、镉、汞、铅等有毒重金属含量超标现象屡见不鲜[11-14]。砷为主要有毒元素之一,有致畸、致癌、致突变等危害[15],砷能被食用菌富集后通过食物链进入人体[12],长期或过量食用砷超标食用菌对人体健康有潜在威胁。
YIN等[16]采用ICP-MS测定了云南地区9种野生食用菌中砷含量,结果显示莲座革菌(Thelephoravialis)中砷含量最高,为44 mg/kg (DW);LIU等[17]采用同样的分析方法测定了云南地区部分食用菌的砷含量,结果显示美味牛肝菌(Boletusedulis)、松口蘑(Tricholomamatsutake)、印度块菌(Tuberindicumcookeet massee)等物种的砷含量超过国家标准,成年人60 kg食用300 g新鲜食用菌部分样品摄入的砷超过FAO/WHO规定的每周砷允许摄入量,食用有安全风险。国内外学者研究发现蜡蘑属真菌对砷的富集能力较强,例如:ZHANG等[18]采用原子荧光光谱法测定了云南不同地区蜡蘑属真菌中砷的含量,结果显示紫晶蜡蘑(Laccariaamethysthea)、红蜡蘑(Laccarialaccata)和红榛色蜡蘑(laccariavinaceoave)的菌盖中砷含量分别为135, 14.1~143和130~163 mg/kg (DW);欧洲地区的红蜡蘑中砷含量为146.9 mg/kg (DW)[19];采自丹麦国家受污染地区的红蜡蘑砷富集量能达到1 420 mg/kg (DW),食用有健康风险[20]。因此快速分析食用菌中砷元素含量并进行食用安全评估显得重要。
目前测定样品中砷含量主要采用AFS、ICP-MS、ICP-AES等方法[18,21-22],这些分析方法准确度高、稳定性好,但需要用浓HNO3消解样品,具有仪器操作复杂、耗时、昂贵和污染环境等缺点。红外光谱是近几年快速发展起来的定性、定量分析技术,红外光谱根据样品中所含化合物官能团的相对振动和分子转动信息,从化学本质上反映样品的差异,具有方便、快捷、绿色环保、样品无需前处理等优点[23-24]。微量元素在红外光区没有吸收峰,但它一般能与有机物形成螯合物或络合物的形式存在,此外微量元素含量与其他成分含量有关[25],根据这些原理国内外学者采用红外光谱技术成功地对样品中的微量元素进行定量分析。MOROS等[26]采用近红外光谱和傅里叶衰减全反射中红外光谱结合偏最小二乘模型分析了河口沉积物中砷、镉、铅等14种微量元素的含量,得到满意的预测效果;作者采用同样的方法测定了西班牙穆尔西亚地区土壤中砷、镉、铬等微量元素,结果显示砷的决定系数(R2)达到0.9,预测效果较好[27]。FONT等[28]采用近红外光谱结合改进偏最小二乘法测定了北美苋中总砷含量,结果显示该方法能准确预测总砷含量,并能区分不同砷含量的样品。此外,研究者采用红外光谱结合化学计量学方法成功预测了大米、港口沉积物等样品中镉、汞、铅等重金属元素含量[29-30]。
本研究以云南常见的美味牛肝菌和绒柄牛肝菌(Boletustomentipes)为研究对象,采用ICP-AES法测定样品中总砷含量,根据GB 2762—2012规定的食用菌中砷限量标准,评价食用安全性。将牛肝菌样品的傅里叶变换红外光谱信息与砷元素含量进行拟合,借助多元统计分析建立快速筛分砷超标与未超标样品的方法。
1 材料与方法
1.1 实验材料
牛肝菌样品采集后除去枯枝、杂草、砂石后用清洗干净,50 ℃烘干,粉碎过80目筛,用自封袋室温保存、备用;样品来源见表1。

表1 牛肝菌样品信息
1.2 仪器及试剂
仪器:ICPE-9000电感耦合等离子体原子发射光谱仪,日本岛津公司;MARS6微波消解仪,美国CEM公司;Fronter型傅里叶变换红外光谱仪,美国Perkin Elmer公司;YP-2型压片机,上海市山岳科学仪器有限公司。
试剂:65%硝酸(优级纯);30% H2O2(分析纯);砷元素标准溶液(济南众标科技有限公司);茶叶标准物质(GBW07605,地矿部物化探研究所);超纯水;KBr(分析纯)。
1.3 牛肝菌中砷含量测定
1.3.1 样品消解
准确称取0.3 g样品于消解罐中,加入6 mL HNO3和3 mL H2O2,在微波消解仪中消解完全,冷却后将消解液转移至25 mL比色管,用超纯水定容至25 mL,摇匀,静置澄清后待测。采用同样的方法消解茶叶标准物质(GBW07605)。
1.3.2 建立砷元素标准曲线及含量测定
用10% HNO3将砷元素标准储备液(10 μg/mL)逐级稀释配制成0.0、0.02、0.05、0.1、0.5、1.0 μg/mL的标准溶液,建立标准曲线。ICPE-9000工作参数设定为:载气流速:0.7 L/min;辅助气流速:0.6 L/min;等离子体气流速:10 L/min;高频频率:27.12 MHz,输出功率:1.2 kW。砷元素测定波长选择189.042 nm,得到标准曲线方程为:y=0.069 7x+0.018 6相关系数r2=0.999 7。茶叶标准物质中砷含量测定值为0.283 mg/kg与标准值0.280 mg/kg相近,加标回收实验显示牛肝菌样品的砷加标回收率为93.1%。
1.4 牛肝菌红外光谱
称取牛肝菌样品(1.5±0.2) mg和KBr粉末(100±2) mg,放入玛瑙研钵中充分混合磨成细粉,压成厚度均匀的薄片,测试牛肝菌红外光谱,光谱扫描范围设为:4 000~400 cm-1,累积扫描16次,分辨率为4 cm-1,每个样品重复测定3次,计算平均光谱,实验过程已扣除KBr背景光谱。
1.5 数据处理
采用平滑、一阶导数、二阶导数、标准正态变量、多元散射校正等对牛肝菌原始光谱进行预处理,消除或减小仪器噪音干扰,提高光谱分析准确度。将预处理后的光谱数据与砷含量值拟合并进行偏最小二乘判别分析。
2 结果与分析
2.1 牛肝菌中砷元素含量分析
美味牛肝菌和绒柄牛肝菌中砷含量测定结果见表2。由表2可知,不同产地、不同种类牛肝菌样品的砷含量差异明显,从物种水平分析可知多数绒柄牛肝菌对砷的富集能力强于美味牛肝菌。采自普洱思茅区的绒柄牛肝菌砷含量总体偏高,如50号样品的砷含量最高,为8.301 mg/kg (DW),其次是样品47、49砷含量分别达到7.079 mg/kg (DW)和6.66 mg/kg (DW),这可能由于该样品采样点距城市较近,土壤、水体等牛肝菌生长环境受到砷污染。采自玉溪峨山小街的绒柄牛肝菌(样品53)砷含量最低,仅为0.033 mg/kg (DW)。
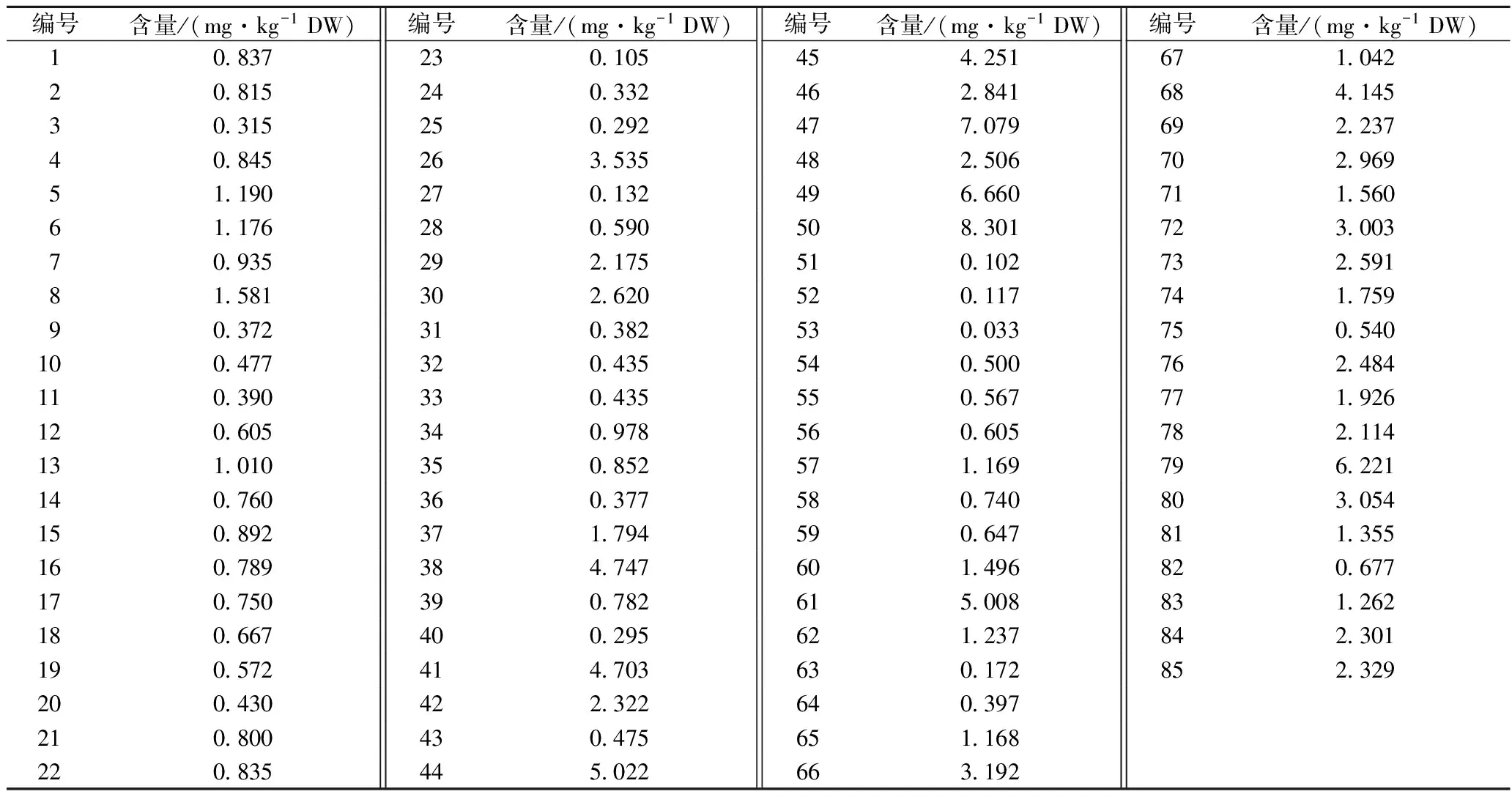
表2 牛肝菌砷含量测定结果
2.2 牛肝菌食用安全评估
2012年中华人民共和国卫生部制定的《食品安全国家标准 食品中污染物限量》(GB 2762—2012),规定食用菌及其制品中砷含量应低于0.5 mg/kg。根据表2测定结果可知,只有样品3,样品31等少数美味牛肝菌和绒柄牛肝菌砷含量低于GB 2762—2012规定的限量标准,其余多数牛肝菌的砷含量超标,其中采自普洱思茅区的绒柄牛肝菌(样品50)砷含量偏高,食用有一定的风险。
2.3 牛肝菌红外光谱分析


图1 美味牛肝菌(A)和绒柄牛肝菌(B)的平均红外光谱图Fig.1 Mean infrared spectra of B. edulis and B. tomentipes
2.4 红外光谱预处理
红外光谱采集过程易受到仪器噪音、温度、散射光等的干扰,适当的光谱预处理能够减小干扰信息,提高光谱数据分析的精确度。采用OMNIC8.0软件对原始光谱进行平滑和纵坐标归一化处理,以减小光谱噪音和不同取样量的影响;在此基础上采用TQ Analyst 8.6软件进行标准正态变量和二阶求导,以消除样品或KBr研磨细度不均匀产生的散射光干扰和基线漂移,二阶导数光谱可以提高光谱分辨率,区分重叠峰和弱峰,光谱预处理结果见图2。由图2可知,光谱经平滑、二阶导数、标准正态变量等预处理后,显示了更多吸收峰,如原始图谱(a)在2 925 cm-1附近只有一个吸收峰,但经过二阶导数处理后显示了多个吸收峰,能更直观反映样品间的差异,提高光谱分析的精确度。

图2 美味牛肝菌红外光谱原始图(a)和预处理后的光谱(b)Fig.2 Infrared spectra of B. edulis before(a) and after(b) preprocessed figure
2.5 牛肝菌砷元素含量筛分
以GB 2762—2012规定的食用菌中砷限量标准0.5 mg/kg为阈值,将牛肝菌分为砷超标样品[As>0.5 mg/kg (DW)]和未超标样品[As≤0.5 mg/kg (DW)],由表2可知只有21个牛肝菌样品砷含量未超标,其余64个样品均超标。图3为砷超标美味牛肝菌样品(a)和未超标样品(b)的红外光谱图,由图3可看出,两者的图谱在峰形、峰位上几乎没有差异,在3 357 cm-1、1 641 cm-1等处吸光度有微小差异,但也无法证明这些差异和砷含量有关,因此,需要借助化学计量学方法进一步分析光谱数据。

图3 砷超标美味牛肝菌样品(a)和未超标美味牛肝菌样品(b)的红外光谱Fig.3 Infrared spectra of arsenic exceeded (a) and qualified(b) of B. edulis sample
将牛肝菌样品砷含量与优化处理后的光谱数据拟合并且进行偏最小二乘判别分析,建立砷超标样品与未超标样品的分类模型,结果见图4、图5。
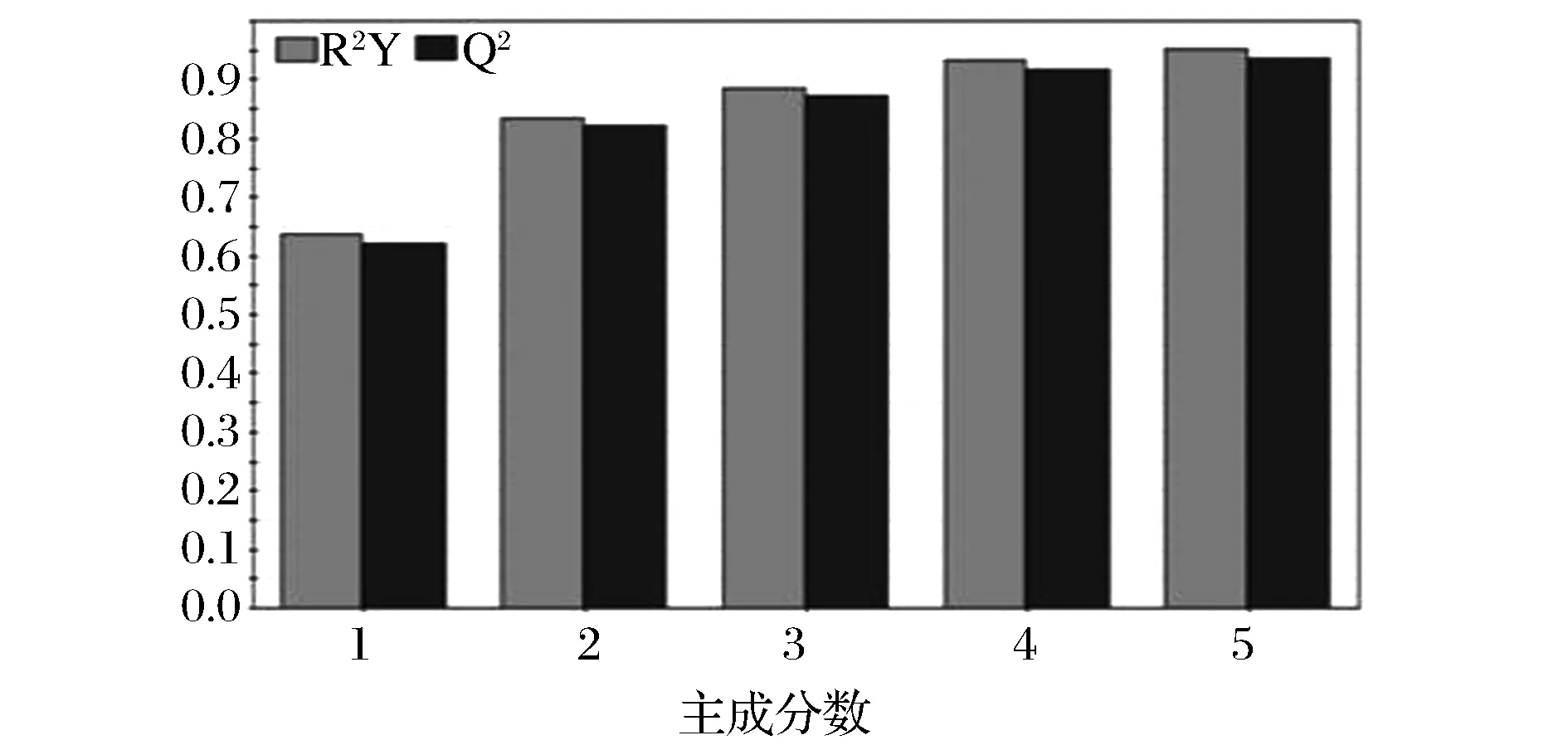
图4 偏最小二乘判别分析的主成分数及R2Y、Q2值Fig.4 Principal component number and R2Y, Q2 values by PLS-DA

图5 主成分得分散点图Fig.5 principal components scores scatter plot
图4中R2Y、Q2能反映主成分对光谱信息的解释效果,是选取主成分数的重要依据,两者均接近1且差异较小时,所建立模型效果越好;由图4可知偏最小二乘判别分析的前5个主成分R2Y和Q2值分别达到0.95和0.93,差值仅为0.02,表明选取5个主成分能够解释光谱的大量信息,适宜建立模型。图5为偏最小二乘判别分析的主成分得分散点图,由图5可看出,样品49已超出95%置信区间,为异常值;从主成分得分图能看出除了砷超标样品6、7、12、28、67、75及未超标样品32外,其余样品能根据砷含量超标和未超标分别聚集到一起,砷含量超标与未超标样品的分类正确率达到91.76%。结合砷元素测定结果(表2)可知,分类错误的砷超标样品12、28、75及未超标样品32的砷含量分别为0.605、0.59、0.54和0.453 mg/kg (DW)与砷超标与未超标的分类阈值0.5 mg/kg比较接近,因此难以准确分类;而分类错误的样品6、7和67,砷含量与分类阈值相差较大,其分类错误可能与样品本身有关。
3 结论
采用电感耦合等离子体原子发射光谱仪测定美味牛肝菌和绒柄牛肝菌中砷含量,结果显示所测牛肝菌样品的砷含量为0.033~8.301 mg/kg (DW),不同种类、不同产地牛肝菌对砷的富集量具有差异,其中采自普洱思茅区的绒柄牛肝菌较其他地区样品砷含量偏高;多数牛肝菌样品砷元素含量超过GB 2762—2012规定的食用菌中砷限量标准,长期或者过量食用有潜在风险。将牛肝菌红外光谱数据与砷元素含量进行拟合,用偏最小二乘判别分析法建立快速区分砷超标样品的检测方法,结果显示,偏最小二乘判别分析的主成分得分散点图能将砷超标样品和未超标样品区分开,其分类正确率达到91.76%。该方法操作简便,样品用量少,能为快速检测食用菌中砷含量是否超标提供新方法。
[1] WANG X M, ZHANG J, WU L H, et al. A mini-review of chemical composition and nutritional value of edible wild-grown mushroom from China[J]. Food Chemistry, 2014, 151: 279-285.
[2] WU G, FENG B, XU J, et al. Molecular phylogenetic analyses redefine seven major clades and reveal 22 new generic clades in the fungal family Boletaceae[J]. Fungal Diversity, 2014, 69(1): 93-115.
[3] 王茂胜, 连宾. 美味牛肝菌研究[J]. 贵州林业科技, 2003, 31(3): 34-38.
[4] 杜萍, 孙卉, 姜婧, 等. 云南野生牛肝菌中的有害物质[C]. 第九届全国食用菌学术研讨会摘要集, 2010.
[8] 杨军, 郑袁明, 陈同斌, 等. 北京市凉凤灌区土壤重金属的积累及其变化趋势[J]. 环境科学学报, 2005, 25(9): 1 175-1 181.
[9] WU Q, TAM N F Y, LEUNG J Y S, et al. Ecological risk and pollution history of heavy metals in Nansha mangrove, South China[J]. Ecotoxicology and Environmental Safety, 2014, 104: 143-151.
[10] SU C, JIANG L, ZHANG W. A review on heavy metal contamination in the soil worldwide: Situation, impact and remediation techniques[J]. Environmental Skeptics and Critics, 2014, 3(2): 24-38.
[12] MELGAR M J, ALONSO J, GARCIA M A. Total contents of arsenic and associated health risks in edible mushrooms, mushroom supplements and growth substrates from Galicia (NW Spain)[J]. Food and Chemical Toxicology, 2014, 73: 44-50.
[13] ZHANG J, LIU H, LI S J, et al. Arsenic in edible and medicinal mushrooms from Southwest China[J]. International Journal of Medicinal Mushrooms, 2015, 17(6): 601-605.
[14] LIU B, HUANG Q, CAI H, et al. Study of heavy metal concentrations in wild edible mushrooms in Yunnan Province, China[J]. Food Chemistry, 2015, 188: 294-300.
[15] 周友亚, 颜增光, 周光辉, 等. 制定场地土壤风险评价筛选值中关注污染物的预筛选方法[J]. 环境工程技术学报, 2011, 1(3): 264-269.
[16] YIN L L, SHI G Q, TIAN Q, et al. Determination of the metals by ICP‐MS in wild mushrooms from Yunnan, China[J]. Journal of Food Science, 2012, 77(8): T151-T155.
[17] LIU B, HUANG Q, CAI H, et al. Study of heavy metal concentrations in wild edible mushrooms in Yunnan province, China[J]. Food Chemistry, 2015, 188: 294-300.
[18] ZHANG J, LI T, YANG Y L, et al. Arsenic concentrations and associated health risks in laccaria mushrooms from Yunnan (SW China)[J]. Biological trace element research, 2015, 164(2): 261-266.
[19] VETTER J. Arsenic content of some edible mushroom species[J]. European Food Research and Technology, 2004, 219(1): 71-74.
[20] LARSEN E H, HANSEN M, GÖSSLER W. Speciation and health risk considerations of arsenic in the edible mushroomLaccariaamethystinacollected from contaminated and uncontaminated locations[J]. Applied Organometallic Chemistry, 1998, 12(4): 285-291.
[22] ALQADAMI A A, ABDALLA M A, ALOTHMAN Z A, et al. Application of solid phase extraction on multiwalled carbon nanotubes of some heavy metal ions to analysis of skin whitening cosmetics using ICP-AES[J]. International Journal of Environmental Research and Public Health, 2013, 10(1): 361-374.
[23] 徐云, 王一鸣, 吴静珠, 等. 用近红外光谱检测牛奶中的三聚氰胺[J]. 红外与毫米波学报, 2010, 29(1): 53-56.
[24] JAWAID S, TALPUR F N, AFIRIDI I H, et al. Quick determination of melamine in infant powder and liquid milk by Fourier Transform Infrared spectroscopy[J]. Analytical Methods, 2014, 6(14): 5 269-5 273.
[25] 邵学广, 宁宇, 刘凤霞, 等. 近红外光谱在无机微量成分分析中的应用[J]. 化学学报, 2012, 70(20): 2109-2114.
[26] MOROS J, VALLEJUELO S F O, GREDILLA A, et al. Use of reflectance infrared spectroscopy for monitoring the metal content of the estuarine sediments of the Nerbioi-Ibaizabal river (metropolitan bilbao, bay of biscay, basque country)[J]. Environmental Science & Technology, 2009, 43(24): 9 314-9 320.
[27] MOROS J, MARTNEZ-SNCHEZ M J, PÉREZ-SIRVENT C, et al. Testing of the region of murcia soils by near infrared diffuse reflectance spectroscopy and chemometrics[J]. Talanta, 2009, 78(2): 388-398.
[28] FONT R, DEL RIO M, VÉLEZ D, et al. Use of near-infrared spectroscopy for determining the total arsenic content in prostrate amaranth[J]. Science of the Total Environment, 2004, 327(1): 93-104.
[29] 朱向荣, 李高阳, 黄绿红, 等. 近红外光谱与化学计量学方法用于镉污染稻米的定性鉴别[J]. 分析化学, 2015, 43(4): 599-603.
[30] OUDGHIRI F, GARCA-MORALES J L, ALLALI N, et al. Investigation on possible contamination of port sediments by means of ATRFTIR spectroscopy and thermal analysis[J]. International Journal of Environmental Research, 2014, 8(4): 1 093-1 104.
Rapid determination of arsenic belete mushrooms by infrared spectroscopy
LI Jie-qing1, YANG Tian-wei1, WANG Yuan-zhong2,3, LIU Hong-gao1*, LI Tao4
1(College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China) 2(Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Kunming 650200, China) 3(unnan Technical Center for Quality of Chinese Materia Medica, Kunming 650200, China) 4(College of Resources and Environment, Yuxi Normal University, Yuxi 653100, China)
Fourier transform infrared spectroscopy combined with partial least squares discriminant analysis was used to establish a rapid method for determining whether arsenic content is over the standard limit in bolete mushrooms. The infrared spectral of 85BoletusedulisandBoletustomentipessamples were collected, and were optimized by smooth, second derivative and standard normal variables. The arsenic contents were determined by inductively coupled plasma emission spectrometer, and the food safety of bolete mushrooms was evaluated according to Chinese national food safety standards and limit contaminants in food (GB2762—2012). Infrared spectroscopy dates combined with arsenic contents of bolete samples were used to establish a classification method of detecting whether arsenic is over the standard limit. The results showed that: (1) The arsenic content in boletes were 0.033-8.301 mg/kg DW, and its differences in different samples were dramatic. (2) Arsenic content exceeded the standard limit of GB 2762—2012 (As≤0.5 mg/kg) in most samples; arsenic inB.tomentipescollected from Simao Puer severely over the standard, and has potential of safety risks. (3) Infrared Spectroscopy peak shape did not show obvious difference in samples with arsenic exceeded samples and not exceed samples. The optimized spectral data were analyzed by partial least squares discriminant analysis. The results showed principal components scores scatter plot can be used to distinguish the products of arsenic over or under the standard, and the classification accuracy was 91.76%. The study provides a new method for determining arsenic content in edible mushrooms and find out whether it exceeds the standard limit or not.
infrared spectroscopy; boletes; arsenic; health risk; discrimination
10.13995/j.cnki.11-1802/ts.201704035
硕士(刘鸿高教授为通讯作者,E-mail:honggaoliu@126.com)。
国家自然科学基金项目(21667031,31660591);云南省教育厅科学研究基金项目(2016ZZX106)
2016-05-17,改回日期:2016-09-07
