耐力项目运动员运动后冷水浴的作用机制与实践应用
2017-06-19李钊李庆曹春梅
李钊+李庆+曹春梅

摘 要:运动后冷水浴是当前世界竞技体育研究的热点问题,但耐力项目运动员运动后应用冷水浴的作用机制以及具体方法尚不清楚。通过对耐力项目运动员运动后应用冷水浴的相关研究文献进行梳理,在基础理论层面,从中枢神经系统、PGC-1α基因表达、心血管系统、自主神经系统、代谢产物清除、缓解肌纤维损伤与肌肉酸痛六个方面对其作用机制进行探讨;在实践应用层面认为,运动后每天进行持续时间5~15 min、温度10℃~15℃的冷水浴能够有效促进运动员的机能恢复,并对成绩产生增益效应。
关键词:耐力训练;冷水浴;作用机制;实践应用
中图分类号:G804.7 文献标识码:A文章编号:1006-2076(2017)03-0074-07
Abstract:Post-exercise cold water immersion is a hot topic of training for athletes in the world. But the mechanisms and concrete methods are not clear. The review sorted out the data for endurance athletes using cold water immersion and discussed at a theoretical level the functional mechanism from 6 aspects: central nervous system, PGC-1αgene expression, cardiovascular system, autonomic nervous system, muscle metabolite removal and attenuating muscle damage and soreness. As for practical application, it is held that 10-15℃cold water immersion for a duration of 5-15min everyday can promote physical function recovery and better performance.
Key words: endurance; cold water immersion; mechanisms; practical application
科学训练是一个运用科学的理论、技术和手段对运动训练进行指导的过程。在这个过程中,作为训练主体的运动员往往需要经过多年的艰苦训练才能达到个人职业生涯的最高水平。根据Neumann和Fiskerstrand等人的研究,世界优秀自行车、长跑、铁人三项、长距离滑雪运动员的年训练量已经达到了40 000 km、9 000 km、20 800 km、10 000 km,赛艇运动员(1970-2001年)的年训练量增加了20%[1]。由于大运动量训练所导致的肌肉微细结构损伤,高血热症以及能量的耗竭等被认为是对机体产生了剧烈的生理应激反应[2-3]。Mary L.OToole博士在《运动员过度训练》中指出,耐力运动员成功的秘诀在于大运动量训练,但这也是训练失败的原因之一[4]。因此在进行超负荷训练提高竞技运动能力的同时,如何通过科学的恢复手段尽量避免运动员产生过量训练或者过度训练,是摆在众多教练员和运动员面前一个亟需解决的问题。
在众多的训练恢复措施中,运动后冷水浴(Cold water immersion,CWI)被认为是耐力性项目运动员进行训练恢复的重要手段之一。多项研究也表明,此种恢复手段已经应用于不同水平运动员训练恢复中,以缓解高热环境所导致的疲劳以及减少运动训练所导致的肌纤维损伤[5-10]。但是目前对于运动后冷水浴在理论层面促进机体迅速恢复的影响机制尚不明确,同时在实践应用层面也多凭借个人经验,缺乏科学的理論指导。因此,本文主要从中枢神经系统、PGC-1α基因表达、心血管系统、自主神经系统、代谢产物清除、缓解肌纤维损伤与肌肉酸痛六个方面对其影响机制进行综述,以期为运动后冷水浴的研究进展提供理论支持,为加速耐力项目运动员训练后的机体恢复提供参考建议。
1 耐力运动导致的生理性疲劳因素
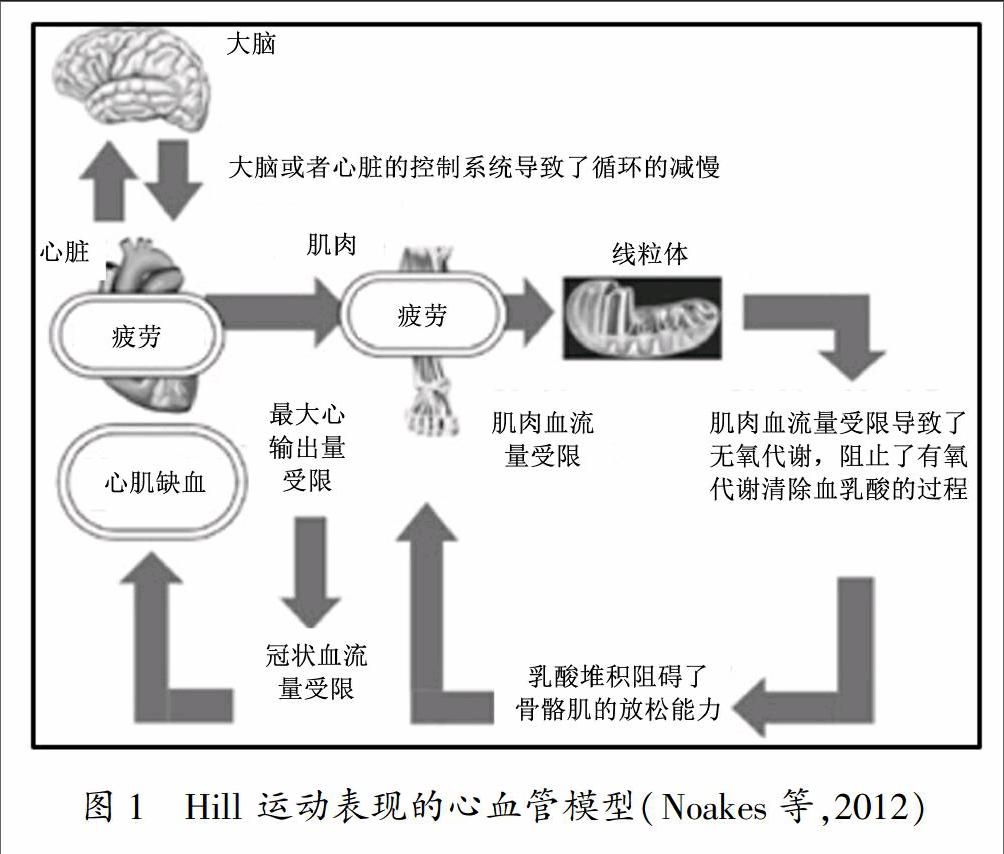
自从1880年意大利著名生理学家Mosso最先开始对疲劳进行研究至今已有130多年的历史。在此期间,不同学者从不同的角度对运动性疲劳进行了大量研究,并给出了不同的定义,直到1982年第五届国际运动生物化学会议才将运动性疲劳定义为:机体不能将它的机能保持在某一特定的水平和/或不能维持某一特定的运动强度[11]。尽管专家学者提出了不同类型的模型假说(能量耗竭、代谢产物堆积、离子代谢紊乱、保护性抑制等)用来解释运动疲劳,但是关于运动性疲劳的发生机制仍不十分清楚。相对于耐力训练产生的生理应激反应,世界著名的运动生理学家们(Bainbridge 1931,Hill 1927,Dill 1938,Bassett&Howley 1997)仍然采用由Hill等人于1924年提出的心血管模型对耐力训练所产生的疲劳进行解释[12]。该理论模型认为,人体在运动时由于心肌缺血造成心搏出量减少,进一步导致肌肉血流量受限,肌肉在无氧工作时产生了诸如乳酸等代谢产物,从而阻碍了骨骼肌的兴奋与收缩能力(如图1所示)。后来,Hill进一步完善该模型认为,必定在心脏或者大脑存在控制机制通过减少心脏的泵血能力(循环)以避免损伤[13]。我国学者田野研究认为,由于耐力训练的动作模式多为单调刺激,在体力尚未明显下降时,大脑细胞的工作能力以及整体工作能力已开始下降,并引起整个身体机能下降,当改变刺激形式时,脑细胞及整体工作能力均有所恢复[14]。综上所述可以认为,大脑-心脏-骨骼肌系统作为一个整体对耐力训练产生了应激性的生理反应,从而在耐力训练的过程中产生了疲劳。
2 冷水浴的作用机制
2.1 中枢神经系统
中枢神经系统疲劳是指由于随意动员与神经募集肌肉能力的降低而导致的力量下降[15]。在耐力训练的过程中,由于运动员内因性的持续产热超过了向外周环境散热的能力而导致核心体温与体表温度不断升高。已有的研究表明,与非高热运动员相比,高热运动员在耗氧量、肌肉血流量等方面不存在显著性的差异,但运动成绩显著降低[16]。这提示,高热可能导致了中枢神经系统的疲劳。这一研究假设同样得到了Nybo等人的证明。Nybo等人让14名自行车耐力运动员进行60%VO2max强度,实验组在40℃训练至力竭(50±3 min)和对照组在18℃训练未发生力竭(1 h)。研究结果表明,实验组与对照组在训练后重复性40 s MVC(每次持续2 s,间隔时间5 s)和表面肌电不存在显著性差异,然而持续性的MVC在30 s~120 s期间,实验组显著低于对照组;同时,肌电信号也表明实验组的神经冲动动员显著低于对照组,而实验组的总肌肉力量并没有受到高热的影响。为了进一步证明研究结论,Nybo等人进行了实验组与对照组未参与训练肌肉的肌力与肌电的比较,表明实验组的肌力与肌电显著低于对照组,由此证明了高热是导致中枢神经系统疲劳的主要因素[16]。
Pointon等人[17]2012年进行了冷水浴促进神经肌肉功能恢复的研究。该研究设计为,10名橄榄球运动员在32℃条件下进行2×30 min间歇训练,通过随机交叉,实验组接受2×9 min、9℃冷水浴,对照组接受被动恢复。训练前后测试了运动员随意和诱发的神经肌肉功能、肌肉酸痛感觉、代表肌损伤的血液指标。实验结果显示,与对照组相比,实验组通过降低核心温度、肌肉酸痛,相应增加了最大随意收缩和随意动员能力(P<0.05)。支持冷水浴通过降低身体核心温度增强中枢神经系统功能的另一项研究来自Minett等人[9]。该研究将9位受试者分为三组,分别为对照组、混合组、冷水浴组,分别在训练前后、干预后即刻及运动后1 h、24 h测试了运动员的随意收缩和随意动员能力,实验结果表明,与对照组和混合组相比,冷水浴组加速了干预后即刻(12.7±11.7%,mean ± SD),运动后1 h(16.3±10.5%)随意收缩力量的恢复,各自P<0.01;与对照组相比,冷水浴组在训练后24 h增加了随意收缩力量的16.1±20.5%,P<0.05;与对照组和混合组相比,通过光谱仪测定发现冷水浴组降低了大脑的氧化反应,P<0.01。综上所述,运动后冷水浴通过降低机体核心温度,加速了中枢神经系统疲劳的恢复,降低了氧化反应,从而提高了随意动员和神经募集肌肉的能力。
2.2 PGC-1α表达
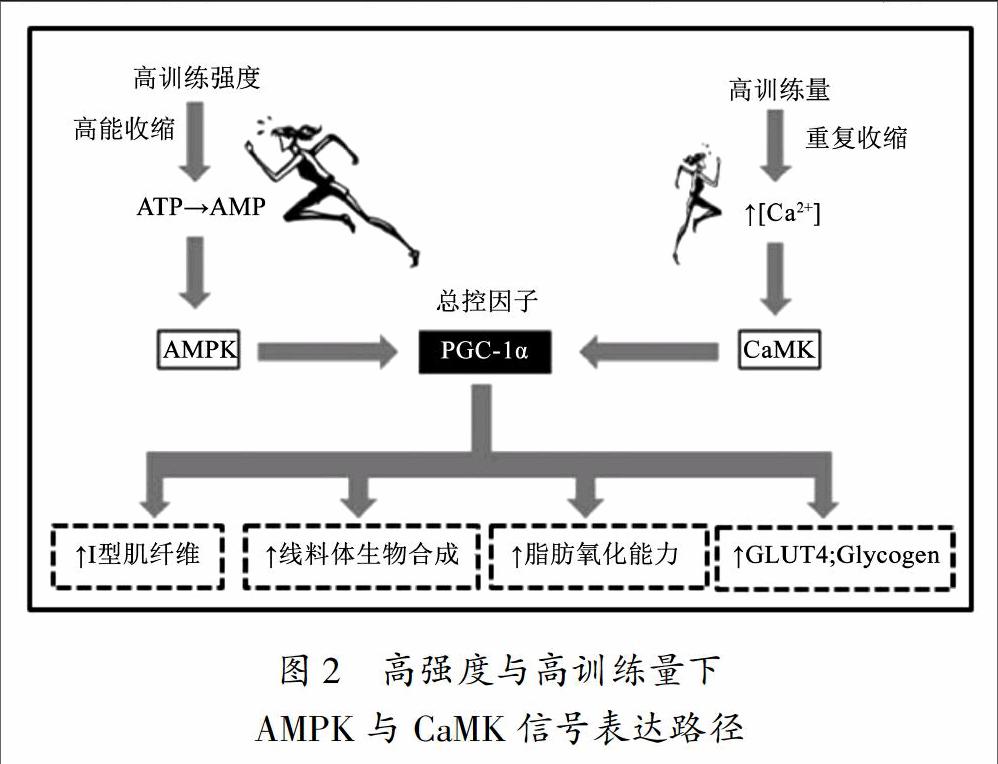
在竞技运动比赛中,众多项目的运动表现如赛艇、中长跑、自行车、网球、足球等既需要运动员长时间保持持续运动的能力,也需要运动员具备良好的冲刺能力。因此,在训练实践过程中,持续训练与高强度间歇训练是教练员最常采用的两种训练模式。Laursen[18]研究认为,高训练量会导致肌浆内的Ca2+浓度升高,进一步激活了线粒体合成信使钙调素依赖蛋白激酶(Calcium-calmodulin kinases,CaMK);高训练强度通过降低了肌肉ATP而生成更多的磷酸腺苷(Adenosine monophosphate,AMP),AMP激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)。两种训练模式虽然存在不同的生化路径表达,但两者最终存在共同的总控因子过氧化物酶体增殖活化受体γ辅助活化因子1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)。PGC-1α是过氧化物酶体增值活化受体γ辅助活化因子1的成员之一,同时也是参与能量代谢的转录辅助活化因子,通过PGC-1α可进一步提高I型肌纤维比例,促进线粒体生物合成,增强脂肪氧化能力以及葡萄糖运载能力(如图2所示)。
2015年Mohanmed[19]进行了经常性运动后冷水浴通过AMPK、p38MAPK促进线粒体合成的研究。研究设计要求8位男性业余体育爱好者进行3次/周、持续时间为4周的耐力训练,每次训练课结束后进行10℃、15 min的單侧腿冷水浴,对侧腿作为对照组,肌肉活检取自训练前和训练后48 h骨外侧肌,分析了取样的p38MAPK和AMPK、线粒体合成酶活性、呼吸链酶复合体I-V。研究结果为,重复性的冷水浴导致了AMPK、磷酸化AMPK、磷酸化乙酰辅酶A酸化酶、3-羟酰基-辅酶A脱氢酶、呼吸链酶复合体I和III显著高于对照组(P<0.05,此外,Cohens d>0.8被认为是大效果量),与对照组相比,实验组p38蛋白含量改变(d=1.02,P=0.064)、PGC-1α(d=0.99,P=0.079)过氧化物酶体增殖受体α(d=0.93,P=0.10),均显示存在大效果量。2014年Mohanmed等人[20]对运动后冷水浴增强PGC-1α的表达进行了研究。通过让9位受试者进行30 min的持续性耐力训练,结束后单侧腿进行10℃、15 min的冷水浴,对侧腿作为对照组未进行冷水浴,肌肉活检取自训练前、训练后即刻、冷水浴即刻以及训练后的3 h。研究结果表明,运动后3 h实验组的PGC-1α信使RNA表达显著高于对照组(P=0.014)。综上所述,耐力训练后冷水浴促进了AMPK、PGC-1α等有利于耐力基因的表达,从而更好地提高运动成绩。
2.3 心血管系统
按照Hill提出的心血管模型理论,耐力性疲劳主要导致了以下两个方面的变化:1)心脏不能向运动的肌肉提供足够含氧血量;2)心血管系统不能及时清除代谢产物[21]。Gonzalez-Alonso和Calbet的研究也支持了这一点,让自行车运动员进行最大有氧功率(356 W)至力竭,结果发现,体表温度与核心温度均高于正常水平,心输出量、平均动脉压均降低,进一步限制了肌肉血液流量、肌肉氧运输量以及最大摄氧量。Calbet也研究表明,越野滑雪运动员在最大耐力训练后,肌肉能力主要受限于心输出量的减少[22]。不难理解,在耐力训练过程中,机体持续性产热造成核心温度升高,促使血液重新分配,使更多的血液由运动的肌肉流向皮肤以便更好地散热,这又导致了流向心脏的血流量减少,心输出量降低。
耐力运动后冷水浴对于心血管系统影响的研究可以归结为以下两个方面:1)运动后冷水浴对于心率的影响;2)运动后冷水浴对于血液动力学的影响。在心率方面,Hayashi[23]首先進行了冷水浴对于心肺功能影响的机制。通过让7位男性受试者进行35℃、40 min功率自行车运动(65%VO2max),之后腿部进行35℃(对照组)与20℃(实验组)水浴5 min(实验1),之后重复之前的运动10min(实验2)。研究结果显示,在实验1后,实验组运动员的食道温度36.9℃±0.2℃显著低于对照组37.5℃±0.1℃,P<0.01;实验组体表温度33.9℃±0.2℃显著低于对照组35.2℃±0.2℃,P<0.01;实验组心率93.2℃±6.0次/min显著低于对照组102.7℃±4.9次/min,P<0.05。在实验2中,实验组运动员的食道温度、体表温度、心率显著低于对照组.研究结论认为运动后冷水浴可以显著降低心血管压力,促进疲劳的恢复。这一研究结论同样得到了Minett等人、Poinon等人、Vaile等人研究的证实[9,17,24]。在血液动力学方面,Vaile等人[25]进行了自行车运动员运动后冷水浴对肢体血流变影响的随机对照实验。让10位自行车耐力运动员完成两次训练课(间歇1周),每次训练课包括35 min×2的全力运动和60 min的恢复(冷水浴与积极恢复)。结果发现,积极恢复组的第二次全力运动成绩显著降低(-1.81%±1.05),冷水浴组无改变(0.1%±0.71);冷水浴组手臂的血流速度为3.64±1.47 mL/100 mL/min,积极恢复组为16.85±3.57 mL/100 mL/min,冷水浴组腿部血流速度为4.83±2.49 mL/100 mL/min,积极恢复组4.83±2.49 mL/100 mL/min,但在第二次全力运动的最后,冷水浴组的直肠温度为38.1℃±0.3℃,积极恢复组为38.8℃±0.2℃,冷水浴组的手臂血流速度为20.55±3.78 mL/100 mL/min,积极恢复组为23.83±5.32 mL/100 mL/min。研究结论认为,冷水浴主要降低了身体核心温度以及改变了血流速度,维持了第二组的运动成绩。与之相类似的研究也证明了Vaile的观点[26-27]。
2.4 自主神经系统提高
自主神经系统被认为是周围神经系统中运动神经的一部分,它存在两个主要的分支,即交感神经系统和副交感神经系统。交感神经系统也称为应急系统,在身体面临突然的压力或在身体活动时,会积极动员该系统,主要表现为心跳加快,外周血管舒张,骨骼肌供血量增加,促使肝脏释放更多的糖原入血以增加能量供应等;副交感神经系统的功能则主要是维持身体基本需求,包括消化、泌尿和各类腺体的分泌与节省能量[28]。
Buchheit等人进行了冷水浴对副交感神经系统影响的研究,该研究主要通过心率变异性(HRV)来反映该系统的变化[29]。HRV是通过测量连续正常QRS波群周期之间变化的变异系数来更精确地反映心率的变化,在临床上已经被用作无创伤性反映自主神经系统活动的指标[30]。Buchheit等人[29]通过让10位男性自行车耐力运动员进行两次次最大强度的耐力性运动(SE1、SE2),两组运动之间穿插20 min的恢复运动,随机分组,实验组进行14℃、5 min的冷水浴,对照组进行35℃、5 min温水浴。研究结果认为在SE2结束后的6 min中,实验组的连续性间隔30 s的R-R间隔期(rMSSD)显著高于对照组(如图3所示),研究结论认为运动后冷水浴有助于副交感神经系统机能的即刻恢复。与Buchheit等人得到相似研究结论的还有运动后的冷水浴通过增加中枢回心血量,进一步增加每搏输出量与心输出量,进而激活了血管压力感受器,抑制了交感神经活动,增强了副交感神经活动[31]。
2.5 代谢产物清除
持续训练法和间歇训练法是耐力训练最常用的两种训练方法。一般来讲,持续训练法主要用来发展运动员的有氧耐力,长时间间歇训练法主要发展运动员冲击乳酸的能力,而短时间间歇训练法则主要用来发展运动员耐受乳酸的能力(如表1所示)。Stepto等人[33]研究认为,高水平自行车运动员进行8次强度为86%VO2max,每次持续时间为5 min的骑行运动,肌乳酸从原来的6.2 mmol/kg干肌重显著增加为32.7 mmol/kg干肌重,血液pH值由7.09降为7.01。因此,在耐力训练过程中,运动表现的降低被认为是pH值的降低抑制了磷酸果糖激酶(PFK)的活性,从而降低了糖酵解过程,进一步降低了肌钙蛋白释放与回收钙离子的能力,同时刺激了痛觉感受器[34-35]。
Chris等人[21]研究认为,血液或肌细胞内的H+可以通过两条途径进行清除:增加血流的速度;增加骨骼肌的缓冲能力。运动后冷水浴可以促进血乳酸等代谢产物的清除同样得到了Stocks等人[36]研究的证实,该研究认为由于冷水浴导致静脉血压,肢体动脉以及皮肤血管收缩增大,使得血浆渗透梯度增大,从而促使了细胞间质的流体向着血管渗透,最终导致了代谢产物从外周运动的肌肉迅速循环到中枢循环系统。然而这[LL]一研究结论同样得到了其他研究的否定。Dunne等人[10]让9名男性耐力运动员进行了两次次最大强度跑步至疲劳(EX1、EX2),两次运动间歇时间为15 min,采用静坐及冷水浴(8℃和15℃)三种不同的间歇方式,实验结果表明,虽然采用冷水浴组的第二次运动成绩明显提高,但是三组在血乳酸、VO2max、跑步经济性方面不存在显著性差异。Halson等人[37]让11位男性自行车运动员完成两次40 min的测试,通过随机交叉分组,冷水浴组进行三次60 s、11.5℃,对照组进行被动恢复(24.2℃±1.8℃),研究结果认为,冷水浴组只改变了心率、体温,而在血乳酸、血液pH值、皮质醇、睾酮、肌酸激酶等生化指标上冷水浴组与对照组无显著性差异。Vaile等人[25]研究结果认为冷水浴组即刻血乳酸可达到4.5±1.2 mmol,显著高于对照组2.3±0.8 mmol(P<0.05)。综上所述,虽然各个研究的结论不尽相同,但可以认为,冷水浴促进了外周血液的回流,使得部分代谢产物得以快速清除,但冷水浴同时也限制了血液流向外周活动的肌肉,从而抑制了氧气以及营养物质的输送,从而导致部分代谢产物仍然滞留于活动的肌肉中。
2.6 缓解运动损伤与肌肉酸痛
运动导致的肌肉酸痛可以分为急性运动酸痛和延迟性肌肉酸痛。导致急性肌肉酸痛的主要原因是代谢产物的堆积(H+和乳酸等)和肌肉肿胀(血浆中的液体成分、肌肉组织);尽管还不能确定具体导致延迟性肌肉酸痛的原因,但是高张力牵拉所伴随的骨骼肌纤维微细结构损伤被认为是当今主流学说之一,同时也被写进我国运动生理学教材[11,38]。肌肉温度的提高同样可以导致肌肉组织的损伤,造成肌纤维坏死和连接组织分解,从而造成延迟性肌肉酸痛[38]。
当前对于运动后冷水浴缓解运动损伤和肌肉酸痛的机制主要包括以下方面:1)促进炎症的消除:在进行冷水浴的过程中,肌肉温度降低,进一步导致了细胞内代谢酶的活性降低,从而降低了由于缺氧导致的坏死组织以及炎症反应对于肌肉的损伤程度[27,39-40]。2)TRPM8的激活:瞬时受体电位通道M8(Transient receptor potential cation channel M8,TRPM8)是一种细胞膜去极化激活的电压门通道,也是一种重要的冷受体,冷刺激引起的TRPM8激活是一种从去极化电位生理负电位阶梯分明的电压敏感性的渐进性改变。通过适当降低患处温度,激发了TRPM8的活性,TRPM8介导的冷信号传递参与了阻断疼痛信息的传入,可以减少疼痛感[41-42]。3)减轻肌肉肿胀:运动后冷水浴通过促进肌肉毛细血管的收缩,从而减轻了水肿反应[43]。Poppendieck等人[44]采用Meta分析法进行了运动后冷水浴对肌肉损伤影响的研究,在纳入的21项研究中,其中有15项研究涉及了运动后冷水浴对肌肉酸痛的影响,8项研究认为冷水浴可以有效减轻肌肉酸痛(+2.1%,g=0.21),另外7项研究认为冷水浴对于肌肉酸痛效果不显著(+1.0%,g=0.11);其中5项研究认为运动后冷水浴可以降低肌酸激酶的含量。2项研究认为效果不显著,3项研究报道可以增加肌酸激酶的含量。该研究的结论表明,虽然足量的肌酸激酶可以被认为是肌肉运动损伤的重要指标,尽管其内在机制尚不明确,但研究者认为运动后冷水浴对于运动后肌肉损伤存在积极效果。
3 实践应用
3.1 冷水浴与运动的间隔时间
Halson[45]研究了運动后冷水浴对于下一次运动能力影响的持续时间,在间隔小于1小时的时间内,运动后冷水浴对于运动能力的迅速恢复具有显著性的效果,这尤其在热环境下的长距离项目表现更为突出,在短距离的项目中,由于缺少热身活动,冷水浴组的运动能力较对照组有所降低。然而根据Pointon、Tseng等人的研究,在间隔时间2~3小时的时间内,运动后冷水浴对于运动表现的负面影响可以忽略[17,46-48]。Poppendieck[44]同时研究认为,冷水浴在24~96小时后仍然对运动成绩起到了增益效应,且在96小时内连续每天冷水浴的效果要优于只进行单次的冷水浴效果。这提示,冷水浴的作用效果可以持续2~4天,这对于促进篮球、网球、足球等运动员在整个赛季保持或者恢复其运动能力具有一定的参考价值,同时对于保障长距离耐力项目运动员日常训练效果也具有一定的实践意义。
3.2 冷水浴部位
理论上讲,全身冷水浴的效果要优于部分肢体冷水浴。在降体温方面,McDermott等人[49]研究认为,小部分肢体(通常为运动肢体)进行冷水浴不会对身体的核心温度产生像全身冷水浴那样的效果,所以应该进行全身冷水浴以便更好地促进机体恢复。在静水压力方面,随着机体浸入水中深度的增加,水所施加给机体的压力会逐渐增大,Wilcock等人认为这种效果对运动恢复会产生更积极的作用[50]。静水压力的增加导致了皮肤间质压力的增大,从而导致间质更多的流体流向血管内,促进了代谢产物的清除和减少炎症反应的发生。
3.3 水温与持续时间
根据热传递的规律,在冷水浴的过程中,水温越低,体温降速越快,水温越高,体温降速越慢。尽管实验训练的强度、持续时间以及训练水平存在差异,但Poppendieck等人[44]对冷水浴与运动能力恢复进行了Meta分析(如图4),通过计算各研究的效果量,发现冷水浴的温度在12℃~15℃足够对训练后的恢复产生积极的效果,如果水浴温度低于12℃将不会产生额外的增益效应。Versey等人[51]对冷水浴的水温持续时间进行了综述,研究认为,冷水浴的最佳温度为10℃~15℃,持续时间范围为5~15 min,该研究结论与Poppendieck等人[44]的研究结论基本一致。由此可以认为,在实践应用过程中,可以根据运动员核心体温的高低程度,在水温为10℃~15℃,持续时间为5~15 min的范围内进行冷水浴,同时根据Clements、Proulx等人的研究,体温降速范围应为0.15℃~0.35℃/min,可以将此作为监控降温速率的参考范围[52-53]。
4 研究展望
运动后冷水浴促进耐力项目运动员竞技能力的恢复以及缓解运动疲劳已经被多数研究所证实,尽管在促进机体恢复效率方面的结果还不尽一致,这主要是实验设计方法的原因造成的,同时,受试对象的项目特征、年龄、性别、训练水平以及体表面积都会对实验结果造成一定的影响。另外,较少研究的对照组采用温水浴,由于多采用了被动恢复,因此不能较好体现冷水浴的作用机制。未来的冷水浴研究应集中在水浴温度10℃~15℃,持续时间为5~15 min。
参考文献:
[1]陈小平.竞技运动训练实践发展的理论思考[M].北京:北京体育大学出版社, 2008:150-151.
[2]Reilly T, Ekblom B. The use of recovery methods post-exercise[J]. Journal of sports sciences, 2005,23(6): 619-627.
[3]Barnett A. Using recovery modalities between training sessions in elite athletes[J]. Sports medicine, 2006, 36(9): 781-796.
[4]王然译.运动员过度训练[M].北京:北京体育大学出版社,2013.
[5]Peiffer J J, Abbiss C R, Watson G, et al. Effect of a 5-min cold-water immersion recovery on exercise performance in the heat[J]. British journal of sports medicine, 2010, 44(6): 461-465.
[6]Peiffer J J, Abbiss C R, Watson G, et al. Effect of cold-water immersion duration on body temperature and muscle function[J]. Journal of sports sciences, 2009, 27(10): 987-993.
[7]Vaile J, Halson S, Gill N, et al. Effect of hydrotherapy on the signs and symptoms of delayed onset muscle soreness[J]. European journal of applied physiology, 2008, 102(4): 447-455.
[8]Ingram J, Dawson B, Goodman C, et al. Effect of water immersion methods on post-exercise recovery from simulated team sport exercise[J]. Journal of Science and Medicine in Sport, 2009, 12(3): 417-421.
[9]Minett G M, Duffield R, Billaut F, et al. Cold‐water immersion decreases cerebral oxygenation but improves recovery after intermittent‐sprint exercise in the heat[J]. Scandinavian journal of medicine & science in sports, 2014, 24(4): 656-666.
[10]Dunne A, Crampton D, Egaa M. Effect of post-exercise hydrotherapy water temperature on subsequent exhaustive running performance in normothermic conditions[J]. Journal of Science and Medicine in Sport, 2013, 16(5): 466-471.
[11]王瑞元,蘇全生.运动生理学[M].北京:人民体育出版社,2012:363.
[12]Noakes T D. Physiological models to understand exercise fatigue and the adaptations that predict or enhance athletic performance[J]. Scandinavian journal of medicine & science in sports, 2000, 10(3): 123-145.
[13]Noakes T D O M S. Fatigue is a brain-derived emotion that regulates the exercise behavior to ensure the protection of whole body homeostasis[J]. Frontiers in physiology, 2012(3): 82.
[14]田野.运动生理学高级教程[M].北京:高等教育出版社,2003:454.
[15]Taylor J L, Todd G, Gandevia S C. Evidence for a supraspinal contribution to human muscle fatigue[J]. Clinical and Experimental Pharmacology and Physiology, 2006, 33(4): 400-405.
[16]Nybo L, Nielsen B. Hyperthermia and central fatigue during prolonged exercise in humans[J]. Journal of applied physiology, 2001, 91(3): 1055-1060.
[17]Pointon M, Duffield R, Cannon J, et al. Cold water immersion recovery following intermittent-sprint exercise in the heat[J]. European journal of applied physiology, 2012, 112(7): 2483-2494.
[18]Laursen P B. Training for intense exercise performance: high-intensity or high-volume training?[J]. Scandinavian journal of medicine & science in sports, 2010, 20(s2): 1-10.
[19]Ihsan M, Markworth J F, Watson G, et al. Regular postexercise cooling enhances mitochondrial biogenesis through AMPK and p38 MAPK in human skeletal muscle[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2015, 309(3): R286-R294.
[20]Ihsan M, Watson G, Choo H C, et al. Postexercise muscle cooling enhances gene expression of PGC-1[J]. Med Sci Sports Exerc, 2014(46): 1900-1907.
[21]Abbiss C R, Laursen P B. Models to explain fatigue during prolonged endurance cycling[J]. Sports Medicine, 2005, 35(10): 865-898.
[22]Calbet J A L, Jensen-Urstad M, Van Hall G, et al. Maximal muscular vascular conductances during whole body upright exercise in humans[J]. The Journal of physiology, 2004, 558(1): 319-331.
[23]Hayashi K, Honda Y, Ogawa T, et al. Effects of brief leg cooling after moderate exercise on cardiorespiratory responses to subsequent exercise in the heat[J]. European journal of applied physiology, 2004, 92(4-5): 414-420.
[24]Vaile J, Halson S, Gill N, et al. Effect of cold water immersion on repeat cycling performance and thermoregulation in the heat[J]. Journal of sports sciences, 2008, 26(5): 431-440.
[25]Vaile J, O'Hagan C, Stefanovic B, et al. Effect of cold water immersion on repeated cycling performance and limb blood flow[J]. British journal of sports medicine, 2010,45(10):825-9.
[26]Mawhinney C, Jones H, Joo C H, et al. Influence of cold-water immersion on limb and cutaneous blood flow after exercise[J]. Med Sci Sports Exerc, 2013, 45(12): 2277-85.
[27]Ihsan M, Watson G, Lipski M, et al. Influence of postexercise cooling on muscle oxygenation and blood volume changes[J]. Med Sci Sports Exerc, 2013, 45(5): 876-882.
[28]王瑞元,王軍译.运动生理学[M].北京:北京体育大学出版社,2011:94-95.
[29]Buchheit M, Peiffer J J, Abbiss C R, et al. Effect of cold water immersion on postexercise parasympathetic reactivation[J]. American Journal of Physiology-Heart and Circulatory Physiology, 2009, 296(2): 421-427.
[30]王留义, 吴淑伦.无创伤性心血管诊断技术[M].北京:中国医药科技出版社,1996.
[31]Ihsan M, Watson G, Abbiss C R. What are the Physiological Mechanisms for Post-Exercise Cold Water Immersion in the Recovery from Prolonged Endurance and Intermittent Exercise?[J]. Sports Medicine, 2016: 1-15.
[32]谢敏豪,严翊,冯炜权.耐力训练监控与营养[M].北京:北京体育大学出版社,2007.
[33]Stepto N K, Martin D T, Fallon K E, et al. Metabolic demands of intense aerobic interval training in competitive cyclists[J]. Medicine and Science in Sports and Exercise, 2001, 33(2): 303-310.
[34]Stackhouse S K, Reisman D S, Binder-Macleod S A. Challenging the role of pH in skeletal muscle fatigue[J]. Physical therapy, 2001, 81(12): 1897-1903.
[35]Hill C A, Thompson M W, Ruell P A, et al. Sarcoplasmic reticulum function and muscle contractile character following fatiguing exercise in humans[J]. The Journal of physiology, 2001, 531(3): 871-878.
[36]Stocks J M, Patterson M J, Hyde D E, et al. Effects of immersion water temperature on whole‐body fluid distribution in humans[J]. Actaphysiologicascandinavica, 2004, 182(1): 3-10.
[37]Halson S L, Quod M J, Martin D T, et al. Physiological responses to cold water immersion following cycling in the heat[J]. Int J Sports Physiol Perform, 2008, 3(3): 331-346.
[38]田野,主编.运动生理学高级教程[M].北京:高等教育出版社,2003:8,45.
[39]Merrick M A, Rankin J M, Andres F A, et al. A preliminary examination of cryotherapy and secondary injury in skeletal muscle[J]. Medicine and science in sports and exercise, 1999, 31(11): 1516-1521.
[40]Carvalho N, Puntel G, Correa P, et al. Protective effects of therapeutic cold and heat against the oxidative damage induced by a muscle strain injury in rats[J]. Journal of sports sciences, 2010, 28(9): 923-935.
[41]劉杰锋.TRPM8研究进展[J].国际病理科学与临床杂志,2010:30(3):269-72.
[42]Knowlton W M, Palkar R, Lippoldt E K, et al. A sensory-labeled line for cold: TRPM8-expressing sensory neurons define the cellular basis for cold, cold pain, and cooling-mediated analgesia[J]. The Journal of Neuroscience, 2013, 33(7): 2837-2848.
[43]Yanagisawa O, Kudo H, Takahashi N, et al. Magnetic resonance imaging evaluation of cooling on blood flow and oedema in skeletal muscles after exercise[J]. European journal of applied physiology, 2004, 91(5-6): 737-740.
[44]Poppendieck W, Faude O, Wegmann M, et al. Cooling and performance recovery of trained athletes: a meta-analytical review[J]. Int J Sports Physiol Perform, 2013, 8(3): 227-42.
[45]Halson S L. Does the time frame between exercise influence the effectiveness of hydrotherapy for recovery[J].Int J Sports Physiol Perform, 2011, 6(2): 147-159.
[46]Pointon M, Duffield R, Cannon J, et al. Cold application for neuromuscular recovery following intense lower-body exercise[J]. European journal of applied physiology, 2011, 111(12): 2977-2986.
[47]Tseng C Y, Lee J P, Tsai Y S, et al. Topical Cooling (Icing) Delays Recovery From Eccentric Exercise-Induced Muscle Damage[J]. The Journal of Strength & Conditioning Research, 2013, 27(5): 1354-1361.
[48]Pointon M, Duffield R. Cold water immersion recovery after simulated collision sport exercise[J]. Medicine and science in sports and exercise, 2012, 44(2): 206-216.
[49]McDermott B P, Casa D J, Ganio M S, et al. Acute whole-body cooling for exercise-induced hyperthermia: a systematic review[J]. Journal of athletic training, 2009, 44(1): 84-93.
[50]Wilcock I M, Cronin J B, Hing W A. Physiological response to water immersion[J]. Sports medicine, 2006, 36(9): 747-765.
[51]Versey N G, Halson S L, Dawson B T. Water immersion recovery for athletes: effect on exercise performance and practical recommendations[J]. Sports medicine, 2013, 43(11): 1101-1130.
[52]Clements J M, Casa D J, Knight J C, et al. Ice-water immersion and cold-water immersion provide similar cooling rates in runners with exercise-induced hyperthermia[J]. Journal of athletic training, 2002, 37(2): 146.
[53]Proulx C I, Ducharme M B, Kenny G P. Safe cooling limits from exercise-induced hyperthermia[J]. European journal of applied physiology, 2006, 96(4): 434-445.
