中荷64杨组织培养快繁技术研究
2017-06-19矫丽曼纪纯阳杨成超
矫丽曼,纪纯阳,杨成超
(辽宁省杨树研究所,辽宁盖州115213)
中荷64杨组织培养快繁技术研究
矫丽曼,纪纯阳,杨成超
(辽宁省杨树研究所,辽宁盖州115213)
以中荷64杨叶柄为外植体,通过对比试验确定中荷64杨组织快繁体系。结果表明:愈伤组织诱导与继代培养基为MS+6-BA 0.5 mg·L-1+2,4-D 0.5 mg·L-1+蔗糖20 g·L-1+琼脂5 g·L-1;不定芽分化与继代培养基为MS+6-BA 0.1 mg·L-1+NAA 0.02 mg·L-1+蔗糖30 g·L-1+琼脂5 g·L-1;生根培养基为1/2MS+IBA 0.2 mg·L-1+蔗糖20 g·L-1+琼脂5 g·L-1,将组培苗进行了移栽,成活率90%以上,为中荷64杨的推广和应用提供了保障。
中荷64杨;外植体;快繁
中荷64杨Populus×canadensis‘N3016’又名荷兰3016杨,是由荷兰森林及城市研究所选育出来的雌株,其母本为美洲黑杨,父本是欧洲黑杨。1982年由中国林业科学研究院林业研究所引进我国[1]。树干通直饱满,树形美观,速生性、抗寒性较强,在内蒙古、新疆部分地区生长良好,在辽宁中南部广泛栽培[2]。但其抗盐碱能力稍差,从而限制了该品种的推广应用。本文建立了中荷64杨组织培养快速繁殖体系,为该杨树品种的广泛推广、分子及抗性的研究提供了前期试验基础,为获得杨树优良新品种提供保障。
1 材料与方法
1.1 试验材料
中荷64杨枝条采自辽宁省杨树研究所锦州市金城苗圃。
1.2 试验方法
1.2.1 无菌材料的获得[3-4]
剪取1年生中荷64杨健壮枝条,长100 cm左右,放入装有水的坛子中,于室内进行水培,2~3 d换1次水,保持水的清洁。待芽开放展叶后,剪取1 cm幼嫩叶柄,用流水冲洗干净后,在超净工作台内用70%酒精浸泡30 s进行表面灭菌,期间轻轻摇晃三角瓶,无菌水冲洗3次,每次3 min,再用0.1%升汞灭菌5 min,期间轻轻摇晃三角瓶,最后用无菌水冲洗5次,每次3 min,沥干水分后获得无菌外植体。
1.2.2 愈伤组织的诱导与继代培养[5-6]
以MS为基本培养基,添加不同浓度的6-BA和2,4-D,蔗糖20 g·L-1、琼脂5 g·L-1,将无菌外植体分别接种于不同的培养基中诱导与继代培养。每个处理接种15个叶柄。
1.2.3 不定芽的分化与继代培养[7-9]
以MS为基本培养基,添加不同浓度的6-BA和NAA,添加蔗糖30 g·L-1,琼脂5 g·L-1,将愈伤组织分割成1 cm3的小块转入不同的不定芽分化培养基中分化与继代培养。每个处理接种18块愈伤组织。
1.2.4 不定芽的生根培养[10-11]
以1/2MS为基本培养基,加入不同浓度的IBA,添加蔗糖20 g·L-1,琼脂5 g·L-1,将长2 cm以上的不定芽从基部切下,接种于不同的培养基中生根培养。每个处理接种21个不定芽。
1.2.5 培养条件[12]
以上培养基pH值均为5.6。培养温度(25±1)℃,光照强度2 000 lx,每天光照13 h。
1.2.6 组培生根苗的容器移栽[13]
移栽前打开三角瓶上的封口膜,炼苗1~2 d。选择根系发达、苗高5 cm以上的组培苗,用温水小心洗去附着在组培苗根部的培养基,剪去较长的根系,移栽到营养杯中,基质为大田土、腐殖土、河沙按1∶1∶1比例混合,经高压灭菌后使用。
1.2.7 大田移栽
育苗地应选择疏松、排水透气性良好,易于灌溉的壤土或沙壤土为好,移栽前进行整地、做床,选择苗高15 cm以上的容器生根苗进行移栽。殖,体积膨大,呈扇面状。通过筛选确定最佳的诱导培养基为MS+6-BA 0.5 mg·L-1+2,4-D 0.5 mg·L-1,诱导48 h,诱导率100%,愈伤组织生长快,很大,呈嫩绿色(表1)。

图1 叶柄膨大
2 结果与分析
2.1 培养基的筛选
2.1.1 愈伤组织诱导与继代培养基的确定
接种2 d后,叶柄两端膨大(图1),叶柄逐渐肿胀伸长,6 d后叶柄表面形成淡黄色的愈伤组织(图2)。培养4周左右挑选黄绿色、松脆的愈伤组织转入该培养基中继代培养,转接后的愈伤组织不断增

图2 愈伤组织形成

表1 叶柄在不同培养基上的分化与继代情况
2.1.2 不定芽分化与继代培养基的确定
9 d后愈伤组织上分化出绿色的小芽点,15 d后分化出大量浓密的丛生芽(图3)。培养4周后,将分化出的不定芽转到该培养基中继代培养诱导其抽茎展叶。通过筛选确定最佳的增殖培养基为MS+ 6-BA0.1 mg·L-1+NAA0.02 mg·L-1,开始分化时间是11 d,平均分化芽15.8个,不定芽分化率100%,不定芽多且大,呈嫩绿色(表2)。
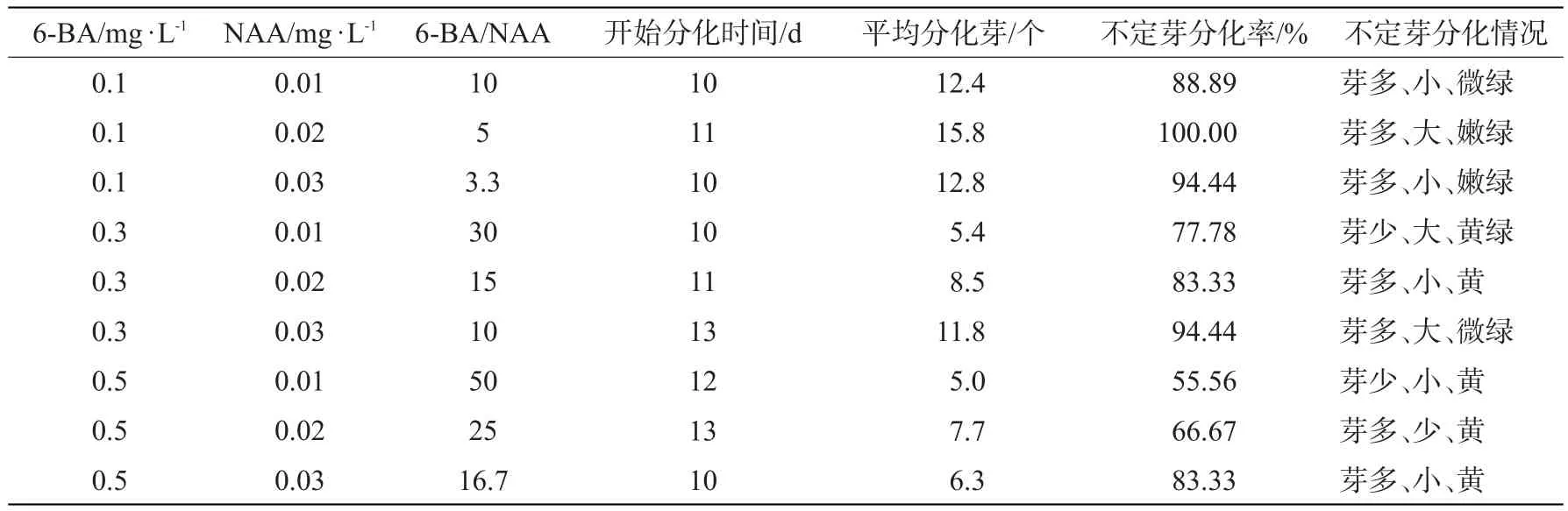
表2 不定芽在不同培养基上的分化与继代情况

图3 不定芽的分化培养

表3 不定芽在不同培养基上的生根情况
2.1.3 生根培养
6 d后,从无根苗基部长出粉红色毛状根(图4),向四周辐射生长,根长0.5~2.0 cm,根较粗壮,同时苗也逐渐长高长壮。通过筛选确定最佳生根培养基为1/2MS+IBA 0.2 mg·L-1,开始生根时间是8 d,生根的不定芽数21个,平均生根数13.5个,生根率100%,不定芽根多、粗且长、基部有很多愈伤组织(表3)。
2.2 容器移栽
移栽时为使苗根均匀分布于营养杯中,并与土壤紧密接触,将土装到距营养杯口1 cm为好,利于保水。用遮阳网遮光保湿,在保证空气相对湿度80%~95%的同时,还要保证土壤含水量70%左右,以免小苗根部腐烂死亡。遮阳时间应视季节和天气条件而定,短期遮阳后,小苗逐渐适应外界环境[13]。
2.3 大田移栽
移栽前1周灌足底水,保证小苗移栽时水分的供应,移栽时间为7、8月份,在阴天或傍晚进行移栽,选择苗高15 cm以上的容器生根苗移栽,去掉营养杯,带营养土栽植于圃地中,栽后立即浇水。
3 结论与讨论
植物组织培养中,生长素用来诱导细胞和根的分化,而细胞分裂素用来促进细胞分化和不定芽的分化,对根的分化具有抑制作用[14]。
通过比较分析确立了中荷64杨组织培养最佳配方,愈伤组织诱导与继代培养基:MS+6-BA 0.5 mg·L-1+2,4-D 0.5 mg·L-1+蔗糖20 g·L-1+琼脂5 g·L-1,pH值5.6。不定芽分化与继代培养基:MS+ 6-BA 0.1 mg·L-1+NAA 0.02 mg·L-1+蔗糖30 g·L-1+琼脂5 g·L-1,pH值5.6。生根培养基:1/2MS+ IBA0.2 mg·L-1+蔗糖20 g·L-1+琼脂5 g·L-1,pH值5.6。
不定芽的分化培养采用了6-BA和NAA来诱导,不定芽的再生频率较高,同时6-BA/NAA的比值对不定芽分化的影响也较大,当6-BA/NAA≤10时,会促进不定芽的分化;6-BA/NAA>10时,会抑制不定芽的分化。本研究选取的比值为5,有利于不定芽的分化,可以提高不定芽的分化率。生根培养基采用1/2MS培养基,培养基中无机盐减半会促进不定根的发育,同时IBA的浓度也会影响根细胞的分化,低浓度适宜根细胞的分化,较高浓度的IBA会对根的分化产生胁迫,阻碍根的生成。
容器移栽生根苗,选择的营养杯大小要适中,过小不利于根的伸展,过大杯内装土过多,含水量大,根易腐烂,同时大田土、腐殖土、河沙三者比例要适宜。栽培初期水分不宜过大,浇透水后,雾面喷洒即可。大田移栽时要选择通风良好的地块,如果地表土不松软,可以掺一些腐殖土。苗生长期要勤观察,发现病虫害要采取有效的措施及时防治。
[1]王胜东,杨志岩.辽宁杨树[M].北京:中国林业出版社,2006.
[2]陈章水.杨树栽培实用技术[M].北京:中国林业出版社,2005.
[3]赵鑫闻.甜杨叶片高频植株再生体系的建立[J].中国农学通报,2015,31(34):6-9.
[4]李开隆,靳春莲,李明德.香杨的组织培养和植株再生[J].植物生理学通讯,2009,45(3):281.
[5]郑进,康薇,洪华珠.中嘉8号杨的组织培养和植株再生[J].黄石理工学院学报,2007,23(5):19-23.
[6]冯连荣.盖杨叶片高频植株再生体系的建立[J].安徽农业科学,2016,44(1):209-211.
[7]赵鑫闻,彭儒胜,赵继梅.辽宁杨叶片高频植株再生体系的建立[J].中国农学通报,2015,31(10):13-16.
[8]孙宇飞,高秀华,赵彦修,等.欧美107杨组织培养再生系统的建立[J].山东师范大学学报(自然科学版),2004,19(2):85-87.
[9]张蕾,苏晓华,张冰玉,等.京2杨组培条件的优化与再生体系建立[J].林业科学研究,2007,20(6):787-793.
[10]陶延珍,李枫,李毅.箭杆杨组织培养再生体系的建立[J].西北农林科技大学学报(自然科学版),2008,36(3):203-207.
[11]张冰玉,苏晓华,郑书星.山新杨叶片高频植株再生体系建立及其遗传稳定性[J].北京林业大学学报,30(3):68-73.
[12]樊军锋,李玲,韩一凡,等.84K杨叶片外植体再生系统的建立[J].西北林学院学报,2002,17(2):33-36.
[13]李云.林果花菜组织培养快速育苗技术[M].北京:中国林业出版社,2001.
[14]刘青林,马祎,郑玉梅.花卉组织培养[M].北京:中国林业出版社,2003.
(责任编辑:张素清)
S722.37
A
1001-1714(2017)03-0030-04
2017-03-13
“十三五”国家重点研发计划(2016YFD060040104)。
矫丽曼(1981-),女,工程师,主要从事杨树转基因育种和森保等方面研究工作。E-mail:jiaoliman1025@163.com。
