蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅生长性能和非特异性免疫力的影响
2017-06-19张海涛高峰李云龙顾开朗
张海涛,高峰,李云龙,顾开朗
(徐州生物工程职业技术学院动物工程系,江苏徐州221006)
资源开发利用
蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅生长性能和非特异性免疫力的影响
张海涛,高峰*,李云龙,顾开朗
(徐州生物工程职业技术学院动物工程系,江苏徐州221006)
在含有蝇蛆粉的基础饲料中添加0%、0.025%、0.050%、0.100%、0.200%和0.400%的甲壳素酶,制成6种等氮等能的饲料(分别记为E1、E2、E3、E4、E5、E6组),饲养泥鳅50 d,通过比较各饲料组泥鳅的生长性能和形体指标,研究蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅生长性能和非特异性免疫力的影响。试验结果表明:饲料中添加0.025%~0.100%甲壳素酶可提高泥鳅的增重率(WGR)和特定生长率(SGR)(P<0.05),降低饲料系数(FCR)(P<0.05),其中0.100%组WGR和SGR最高,FCR最低。饲料中添加甲壳素酶对泥鳅的成活率(SR)、内脏指数(VSI)、肥满度(CF)和空壳率(DOR)无显著影响(P>0.05)。饲料中添加0.050%~0.100%甲壳素酶可显著提高泥鳅肝脏和血清中超氧化物歧化酶(SOD)活性(P<0.05);饲料中添加0.025%~0.100%甲壳素酶可显著降低泥鳅肝脏和血清中丙二醛(MDA)含量。综上所述,在本试验条件下,考虑生长性能、形态学指标和非特异性免疫指标,在含有蝇蛆粉的泥鳅饲料中甲壳素酶的适宜添加量为0.100%。
甲壳素酶;蝇蛆粉;泥鳅;生长;非特异性免疫力
泥鳅(Misgurnus anguillicaudatus),隶属鲤形目、鳅科、花鳅亚科、泥鳅属,俗称钢鳅、鳅鱼、真泥鳅等(刘蝉馨等,1987)。因为泥鳅肉质蛋白含量高、脂肪含量低、营养丰富、味道鲜美,深受广大消费者青睐(林启训等,2001;Amant等,1969)。近年来,由于环境污染、过度捕捞等原因,泥鳅野生资源呈下降趋势,为了满足市场的巨大需求,泥鳅人工养殖规模逐年扩大(罗艳萍等,2009)。但是泥鳅配合饲料的研究严重滞后,成为制约泥鳅养殖业健康快速可持续性发展的因素之一,急需加强对泥鳅配合饲料的研究力度(武迪,2016)。
鱼粉是一种广泛应用与水产饲料中的优质蛋白质源,但因其产量低、需求量大,鱼粉的价格一直维持在较高水平,加大了养殖企业的饲养成本,限制了水产养殖业的发展。因此,为了降低饲料成本,提高养殖企业的经济效益(周歧存等,2005),寻求一种优质、价格低廉和供应量大的动植物蛋白质源对鱼粉进行部分或全部替代,逐渐成为水产饲料的重要研究方向之一(张伯文等,2011;Nguyenthingoc等,2009)。
蝇蛆粉因其蛋白质含量高、营养全面、价格低廉,已有研究报告其可以部分替代饲料中的鱼粉(邓田方等,2012;郑伟等,2010;Ogunji等,2007)。李贤等(2012)发现,蝇蛆粉可以替代泥鳅饲料中鱼粉的25%~50%,但随着替代量的提高,泥鳅的生长性能逐渐下降,其认为是蝇蛆粉中含有较多的甲壳素,具有较高的抗营养作用,这与研究凡纳滨对虾(邓田方等,2012)、鲫鱼(朱家勇等,2013)、尼罗罗非鱼(Ogunji等,2007)的结果一致。
甲壳素酶为第三代饲料酶制剂,可以随机切断甲壳素中的β-1,4糖苷键,将其降解为水溶性的低聚糖(甲壳素聚糖),进而消除其抗营养作用(Muzzarelli等,1996)。目前,已有研究者将其应用于甲壳素含量较高的水产饲料中,以提高养殖动物对饲料的利用效率。朱家勇等(2013)利用具有甲壳素酶降解活性的酵母菌添加于含有蝇蛆粉的鲫鱼饲料中发现,甲壳素的抗营养作用降低,鲫鱼的生长性能和非特异性免疫能力提高。Zhang等(2012)在斜带石斑鱼的饲料中添加甲壳素酶和虾粉(富含甲壳素)后发现,斜带石斑鱼的生长性能和免疫能力得到显著提高。目前,甲壳素酶在泥鳅饲料中的应用研究还鲜见报道。
本试验通过在含有蝇蛆粉的泥鳅饲料中添加甲壳素酶,研究其对泥鳅生长性能和非特异性免疫能力的影响,分析并确定甲壳素酶在泥鳅饲料中的适宜添加量,旨在为配制优质价廉的泥鳅配合饲料提供基础资料和依据。
1 材料和方法
1.1 试验饲料甲壳素酶为饲料级粉状酶制剂,购自上海陆广生物科技有限公司,活性为20000 U/g。
试验用蝇蛆粉购于江苏长江饲料有限公司,粗蛋白质含量为53.00%;粗脂肪含量为:13.5%;水分含量为8.2%;粗灰分含量为10.80%;钙含量为1.00%;总磷含量为1.12%;能量为20.9 MJ/kg。蝇蛆粉粉碎研磨后过80目网筛,-20℃冰箱中保存备用。
试验采用单因素试验设计,在基础饲料的基础上,以0、0.025%、0.050%、0.100%、0.200%和0.400%的甲壳素酶替代等量的基础饲料,制成6种等氮等能试验饲料,分别用E1(对照组)、E2、E3、E4、E5和E6组表示。所有饲料原料均粉碎并过60目筛,再制成直径为2.00 mm的颗粒饲料,自然冷却后装入密封袋,置于阴凉干燥处保存备用。饲料中粗蛋白质、粗脂肪、粗灰分含量的测定参照AOAC(1995)的方法(张海涛等,2013)。饲料中总能采用氧弹量热仪(TRHW-6000C)进行测定。基础饲料组成及营养水平见表1。

表1 基础饲料组成及营养水平
1.2 试验用鱼与饲养管理试验用泥鳅幼鱼,从徐州市七里沟农贸市场购得。试验在徐州生物工程职业技术学院水产养殖实验室的水族箱(120 cm×60 cm×40 cm)中进行,开始饲喂鲤鱼开口料,2周后随机分为6组,每组3个重复,每个重复放养45尾鱼,初始体重约(2.32±0.01)g。试验开始停喂24 h后,于每天8∶00和17∶00各投喂1次,投喂量为泥鳅体重的3%左右,以泥鳅1 h内摄食完为宜,根据实际情况适当调整投喂量。试验用水为瀑气后的自来水,水深15 cm左右,水箱无土,每隔4 d换水一次,以保证水质清洁,加热棒加热控制水温在25~27℃。试验期为50 d。
1.3 样品采集与分析试验结束后停喂24 h,分别称量各组泥鳅的终末体重,统计泥鳅的尾数,计算平均终末体重、增重率、特定生长率、饲料系数、成活率、肥满度等指标,参照李爱杰(1996)和刘永坚(2002)的方法测定。取泥鳅血,经离心后,吸出血清待测;取血后再取出泥鳅的内脏,分离出肝脏,并准确称取内脏、肝脏重量,计算空壳率和内脏指数等指标。将肝脏和血清放人-80℃超低温冰箱中,待测超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量。
增重率/%=(终末体重-初始体重)/初体重× 100;
特定生长率/(%/d)=(ln终末体重-ln初始体重)/试验天数×100;
饲料系数=投饲总量/(终末体重+死亡体重-初始体重);
存活率/%=终末尾数/初始尾数×100;
空壳率/%=(体重-内脏重)/体重×100;
肥满度/(g/cm)=体重/体长3×100;
内脏指数/%=内脏重/体重×100。
肝脏和全肠道中SOD活性和MDA含量测定均采用南京建成生物有限公司生产的试剂盒,操作步骤按试剂盒中的说明书进行。
1.4 数据处理数据以“平均值±标准误”表示,采用SPSS 17.0 for Windows对所有数据进行单因子方差分析(ANOVA),若差异显著,则进行Tukey多重比较,显著水平为P<0.05。
2 试验结果与分析
2.1 蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅生长性能的影响由表2可知,各试验组终末体重随着甲壳素酶添加量的增加先上升后下降,其中E4组最高,为4.39 g,显著高于其他各组(P<0.05);E2和E3组差异不显著(P>0.05),但显著高于对照组、E5和E6组(P<0.05);对照组、E5和E6组差异不显著(P>0.05)。E4组泥鳅的WGR最高,为78.00%,随后依次是E3、E2、E6、E5、E1组,E1组最低,为40.33%;E4组显著高于E1、E2、E5、E6组(P<0.05),与E3组差异不显著(P>0.05);E1、E5和E6组之间无显著差异(P>0.05)。各组泥鳅SGR的顺序为E4>E3>E2>E6>E5>E1组,E4组显著高于其他各组(P<0.05);E2、E3和E4组与E1组差异显著(P<0.05),而E5、E6组与E1组差异不显著(P>0.05)。各组饲料FC在1.40~1.51,其中E4组最低,为1.40,显著高于E1、E2、E5、E6组(P<0.05),与E3组差异不显著(P>0.05);E2、E5、E6组与E1组无显著差异(P>0.05)。饲料中添加不同剂量的甲壳素酶对泥鳅的存活率无显著影响(P>0.05),但E4组泥鳅的SR最高,为95.56%。
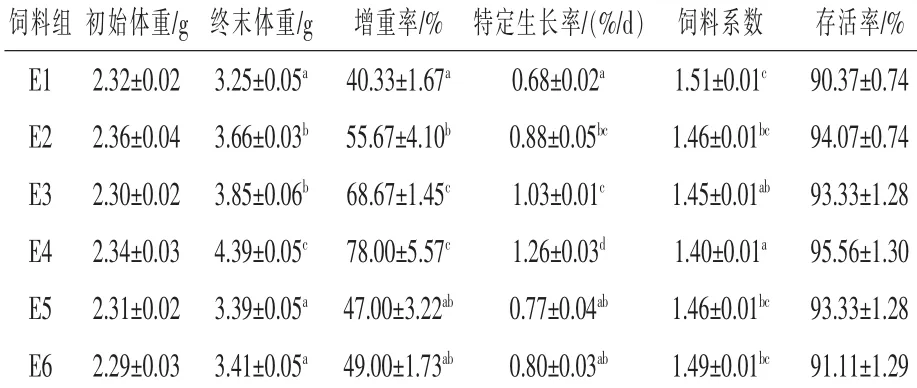
表2 蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅生长性能的影响
2.2 蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅形体指标的影响由表3可知,泥鳅的内脏指数、肥满度、空壳率各组之间无显著性差异(P>0.05),但随着饲料中甲壳素酶添加量的增加,内脏指数有先降低后上升的趋势,E4组最低,肥满度和空壳率有先上升后下降的趋势,E4组最高。

表3 蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅形体指标的影响%
2.3 蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅各组织中SOD活性和MDA含量的影响由表4可见,肝脏和血清中SOD活性均随着饲料中甲壳素酶添加量的增加先上升后降低,均在E4组最高,分别为153.96、113.63 U/mL,且均显著高于其他各组(P<0.05)。E2、E4和E5组泥鳅肝脏中SOD活性无显著差异(P>0.05),但显著高于E1组(P<0.05);E6和E1组之间无显著差异(P>0.05)。E3和E5组泥鳅血清中SOD活性差异不显著(P>0.05),但显著高于E1组(P<0.05);E2、E6和E1组之间无显著差异(P>0.05)。

表4 蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅各组织中SOD活性的影响U/mL
由表5可见,肝脏和血清中MDA含量均随着饲料中甲壳素酶添加量的增加先降低后上升,均在E4组最低,分别为10.67、10.90 nmol/mL。E2、E3和E4组肝脏MDA含量无显著差异(P>0.05),但显著低于E1和E6组(P<0.05);E5和E6组与E1组差异不显著(P>0.05)。E2、E3、E4和E5组泥鳅血清MDA含量无显著差异(P>0.05),但显著高于E1组(P<0.05);E1和E6组差异不显著(P>0.05)。

表5 蝇蛆粉替代鱼粉饲料中添加甲壳素酶对泥鳅各组织中MDA含量的影响nmol/mL
3 讨论
蝇蛆粉是一种生物蛋白饲料原料,蛋白质含量与鱼粉相差无几,同时含有多种生物活性物质,如抗菌肽、甲壳素等。由于不具有内源性甲壳素酶,动物很难降解蝇蛆粉中的甲壳素,某些情况下可能会对养殖动物的生长造成负面影响(Ogunji等,2008;Köprücü等,2005)。Chatzifotis等(2009)和Khempaka等(2011)在研究虾粉中甲壳素对鲷鱼和肉鸡生长性能的影响时,也有类似发现。
饲料中添加外源性甲壳素酶,能有效降低甲壳素对动物消化和吸收的负面影响,消除其抗营养作用。甲壳素聚糖为甲壳素酶降解甲壳素的产物,有研究表明,相较于水不溶性的甲壳素,其具有抗氧化作用,能激活动物的免疫机能,具有较强的生物学活性(Park等,2010;Ngo等,2009、2008)。
本研究中,在饲料中添加0.025%~0.100%的甲壳素酶能提高泥鳅的增重率和特定生长率,降低饲料系数。因此在含有蝇蛆粉的泥鳅饲料中添加甲壳素酶,能有效促进泥鳅的生长,提高饲料利用率,其中,以添加量为0.100%效果最显著。这与Zhang等(2012)在石斑鱼上的研究结果类似,该研究发现添加甲壳素酶到含有2%虾粉的斜带石斑鱼饲料中,能显著提高斜带石斑鱼的生长性能。本试验结果表明,当甲壳素酶添加量为0.200%和0.400%时,泥鳅的增重率、特定生长率和饲料系数与对照组无显著差异,原因可能是外源性酶过多的添加会抑制内源性酶的分泌,出现的酶活性饱和现象,进而影响泥鳅的生长性能。
本研究中,各添加甲壳素酶组的泥鳅内脏指数、肥满度和空壳率与对照组之间无统计学差异,这说明添加甲壳素酶对泥鳅的形体指标无不良影响。同时,本研究发现,随着饲料中甲壳素酶添加量的增加,内脏指数有先降低后上升的趋势,E4组最低,肥满度和空壳率有先上升后下降的趋势,E4组最高。原因可能与饲料中的脂类含量和氧化程度以及碳水化合物的含量有关,YE等(2011)、Lee等(2002)、Rueda-Jasso等(2004)发现水产动物的肝体比与饲料中脂肪和碳水化合物含量有关。曹俊明等(2012)在研究凡纳滨对虾时发现,蝇蛆粉高比例替代鱼粉会显著提高肝胰指数,这可能与蝇蛆粉脂质被氧化程度有关。
抗氧化系统在动物体免疫防御机制中起着重要作用,是一种防御过氧化反应伤害的主动防御系统(唐雪莲等,2012);SOD活性是衡量机体抗氧化能力和非特异性免疫能力的重要指标;MDA是脂质在自由基作用下发生过氧化反应的产物,通过测定其含量,能间接评价机体抗氧化的能力(Slater等,1979)。本试验中发现添加甲壳素酶对泥鳅的SOD活性有显著增强作用;MDA含量显著降低。说明在含有蝇蛆粉的饲料中添加甲壳素酶可在一定程度上有效增强泥鳅的抗氧化能力。数据分析表明,甲壳素酶添加量为0.100%效果最佳。这与斜带石斑鱼的研究结果相似。Zhang等(2012)研究发现,添加甲壳素酶到含有2%虾粉的斜带石斑鱼饲料中,能显著提高石斑鱼SOD的mRNA表达,其认为甲壳素酶能有效提高斜带石斑鱼的抗氧化能力和非特异性免疫机能。
4 结论
在本试验条件下,甲壳素酶添加于含有蝇蛆粉的饲料中,可降低蝇蛆中甲壳素对泥鳅的抗营养作用,提高泥鳅生长性能和对饲料的消化吸收率,增强其抗氧化力和非特异性免疫力,提高了蝇蛆粉在泥鳅饲料中的应用价值。基于本试验的研究结果和分析,考虑生长性能、形态学指标和非特异性免疫指标,在含有蝇蛆粉的泥鳅饲料中甲壳素酶的适宜添加量为0.100%。
[1]曹俊明,严晶,黄燕华,等.家蝇蛆粉替代鱼粉对凡纳滨对虾生长、抗氧化和免疫指标的影响[J].水产学报,2012,36(4):529~537.
[2]邓田方,吴玉刚,刘慧玲.蝇蛆粉替代鱼粉对凡纳滨对虾生长的影响[J].渔业现代化,2012,39(1):46~50.
[3]李贤,张世萍,杨帆,等.蝇蛆粉替代鱼粉对泥鳅生长及体成分的影响[J].湖北农业科学,2012,51(19):4321~4324.
[4]林启训,林静,庞杰.配合饲料对泥鳅鱼体营养成分的影响[J].福建农业大学学报,2001,30(2):231~235.
[5]刘蝉馨,秦克静.辽宁动物志:鱼类[M].辽宁:辽宁科学技术出版社,1987.55~55.
[6]唐雪莲,付京花,李志华,等.紫锥菊提取物对彭泽鲫生长和抗氧化反应的影响[J].饲料工业.
[7]武迪.泥鳅幼鱼维生素C需要量及复合添加剂的初步研究:[硕士学位论文][D].大连:大连海洋大学,2016.
[8]张伯文,孙龙生,姜亮,等.蚯蚓粉替代鱼粉对罗氏沼虾生长性能的影响[J].中国饲料,2011,15:38~40.
[9]张海涛,梁萌青,郑珂珂,等.饲料中维生素C对大菱鲆繁殖性能的影响[J].渔业科学进展,2013,34(2):73~81.
[10]郑伟,董志国,李晓英,等.投喂蝇蛆混养中国明对虾和三疣梭子蟹试验[J].水产科学,2010,29(6):344~347.
[11]周歧存,麦康森,刘永坚,等.动植物蛋白源替代鱼粉研究进展[J].水产学报,2005,29(3):404~410.
[12]朱家勇.家蝇幼虫粉作为饲料添加剂在鲫鱼养殖中的应用:[博士学位论文][D].广州:南方医科大学,2013.
[13]Amant S T JA,Hoover F G.Addition ofMisgurnusanguillicaudatus(Cantor)to the California fauna[J].California Fish and Game,1969,55(4):330~331.
[14]Chatzifotis S,Arias M V,Papadakis L E,et al.Evaluation of feed stimulants in diets for sea bream(Sparus aurata)[J].The Israeli journal of aquaculture-Bamidgeh,2009,61(4):315~321.
[15]Khempaka S,Chitsatchapong C,Molee W.Effect of chitin and protein constituents in shrimp head meal on growth performance,nutrient digestibility,intestinal microbial populations,volatile fatty acids,and ammonia production in broilers[J].The JournalofApplied Poultry Research,2011,20(1):1~11.
[16]KöprücüK,Özdemir Y.Apparent digestibility of selected feed ingredients for Nile tilapia(Oreochromis niloticus)[J].Aquaculture,2005,250(1-2):308~316.
[17]Lee S M,Jeon I G,Lee J Y.Effects of digestible protein and lipid levels in
practical diets on growth,protein utilization and body composition of juvenile rockfish(Sebates schlegeli)[J].Aquaculture,2002,211:227~239.
[18]Muzzarilli R A A,Terbojevich M,Casani A.Unspecific activities of lipases and amylases on chitosans[J].Chitin Enzymology,1996,2:69~81.
[19]Ngo D N,kim M M,Kim S K.Chitin oligosaccharides inhibit oxidative stress in live cells[J].Carbohydrate Polymers,2008,74(2):228~234.
[20]Ngo D N,Lee S H,Kim M M,et al.Production of chitin oligosaccharides with different molecular weights and their antioxidant effect in RAW 264.7 cell[J].Journal of Functional Foods,2009,1(2):188~198.
[21]Nguyenthingoc A,Tranthithanh H,Wille M,et al.Effect of fishmeal replacement with Artemia biomass as a protein source in practical diets for the giant freshwater prawn Macrobrachium rosenbergii[J].Aquaculture Research,2009,40(6):669~680.
[22]Ogunji J O,Nimptsch J,Wiegand C,et al.Evaluation of the influence of housefly maggot meal(magmeal)diets on catalase,glutathione S-transferase and glycogen concentration in the liver of Oreochromis niloticus fingerling[J]. Comparative Biochemistry&Physiology Part A:Molecular&Integrative Physiology,2007,147(4):942~947.
[23]Ogunji J,Sutter D,Rennert B,et al.Growth performance and body composition of carp(Cyprinus carpio)fed diets containing housefly maggot meal(magmeal)[C].Leibniz:Berichte des IGB,2007:140~148.
[24]Ogunji J,Toor RUAS,Schulz C,et al.Growth Performance,Nutrient U-tilization of Nile Tilapia Oreochromis niloticus Fed Housefly Maggot Meal(Magmeal)Diets[J].Turkish Journal of Fisheries&Aquatic Sciences,2008,8(1):141~147.
[25]Park B K,Kim M M.Applications of chitin and its derivatives in biological medicine[J].International journal of molecular sciences,2010,11(12):5152~5164.
[26]Rueda-Jassor,Coneceicao L E C,Dias J,et al.Effect of dietary non-protein energy levels on condition and oxidative status of Senegalese sole(Solea senegalensis)juveniles[J].Aquaculture,2004,23:417~433.
[27]Slater T F,Mickle P L.Oxygen free radicals and tissue damage[J].Excerpta Medica Am sterdam,1979,143.
[28]Ye J D,Liu X H,Wang Z J,et al.Effect of partial fish meal replacement by soybean meal on the growth performance and biochemical indices of juvenile Japanese founder Paralichthys olivaceus[J].Aquaculture International,2011,19:143~153.
[29]Zhang Y,Feng S,Chen J,et al.Stimulatory effects of chitinase on growth and immune defense of orange-spotted grouper(Epinephelus coioides)[J].Fish &Shellfish Immunology,2012,32(5):844~854.■
This experiment was conducted to investigate the effect of dietary chitinase addition in fish meal reduction diet on growth performance and non-specific immunity of loach(Misgurnus anguillicaudatus).Loach were fed with 6 isonitrogenous and isoenergetic experimental diets supplemented with 0%,0.025%,0.050%,0.100%,0.200%and 0.400% chitinase for 50 days,which were named groups E1,E2,E3,E4,E5 and E6,respectively.The results showed as follows:Supplementation of 0.025%to 0.100%chitinase could significantly enhance the weight gain rate(WGR)and the specific growth rate(SGR)(P<0.05),and significantly reduce the feed conversion ratio(FCR)(P<0.05).The highest WGR,SGR and lowest FCR of loach were both found in 0.100%group.No significant difference was observed between physical indexes among all groups(P>0.05).Supplementation of 0.050%to 0.100%chitimase could significantly enhance the activities of superoxide dismutase(SOD)in liver and serum of loach(P<0.05).Meanwhile,supplementation of 0.025%to 0.100% chitimase could significantly reduce malonaldehyde(MDA)contents in liver and serum of loach(P<0.05).So,considering the growth and non-specific immune indexes in the condition of this experiment,the optimal supplemental level of chitimase in fish meal reduction diet of loach is 0.100%.
chitinase;maggot meal;loach;growth;non-specific immunity
S963
A
1004-3314(2017)11-0039-05
10.15906/j.cnki.cn11-2975/s.20171109
徐州生物工程职业技术学院院级课题(2014B07)
*通讯作者
