QuEChERS-液相色谱-串联质谱法同时检测土壤和柑橘中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵的残留
2017-06-15李福琴石丽红孙财远张钰萍陈泠竹胡德禹
李福琴, 石丽红, 王 飞, 孙财远, 康 頔, 张钰萍, 陈泠竹, 胡德禹
(贵州大学精细化工研究开发中心, 教育部绿色农药与农业生物工程国家重点实验室, 贵州 贵阳 550025)
研究论文
QuEChERS-液相色谱-串联质谱法同时检测土壤和柑橘中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵的残留
李福琴, 石丽红, 王 飞, 孙财远, 康 頔, 张钰萍, 陈泠竹, 胡德禹*
(贵州大学精细化工研究开发中心, 教育部绿色农药与农业生物工程国家重点实验室, 贵州 贵阳 550025)
建立了QuEChERS-液相色谱-串联质谱法(LC-MS/MS)检测土壤和柑橘中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵的分析方法。样品经甲醇或乙腈提取,N-丙基乙二胺(PSA)净化后,用液相色谱分离,电喷雾正离子多反应监测(MRM)模式进行质谱测定,以基质匹配标准溶液进行外标法定量。吡唑醚菌酯、甲基硫菌灵和多菌灵的定量限(LOQ,S/N=10)分别为5.8~7.0 μg/kg、9.3~14.1 μg/kg和2.1~2.6 μg/kg。样品的加标回收率为75.48%~109.18%,相对标准偏差(RSD)为0.60%~5.11%(n=5)。该法快速简便,定量准确,用基质配制标准溶液能够有效、准确地校正LC-MS/MS测定吡唑醚菌酯、甲基硫菌灵和多菌灵残留的基质效应,满足土壤、橘皮、橘肉和柑橘全果实际样品的检测需求。
液相色谱-串联质谱;QuEChERS;吡唑醚菌酯;甲基硫菌灵;多菌灵;土壤;柑橘
吡唑醚菌酯(pyraclostrobin)是甲氧基丙烯酸酯类杀菌剂[1]。其抑菌机理[2]是阻止细胞色素间的电子传递而抑制线粒体的呼吸作用,使线粒体不能产生和提供细胞正常代谢所需能量,最终导致细胞死亡。
甲基硫菌灵(thiophanate-methyl),化学名称为1,2-二(3-甲氧羰基-2-硫脲基)苯,属于苯并咪唑类杀菌剂,经羟化、水解、代谢为多菌灵(carbendazim)[3]。其抑菌机理[4]是通过干扰细胞有丝分裂过程中纺锤体的形成,从而干扰细胞的分裂。GB 2763-2016规定甲基硫菌灵的残留定义为甲基硫菌灵和多菌灵的残留总和,以多菌灵计。
吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵作为高效、低毒的广谱性杀菌剂,对于果蔬生长期间的炭疽病、轮纹病、黑腐病以及贮藏期间的青霉病、绿霉病等有良好的防治作用[5,6],被广泛应用于农业生产中。然而,盲目或过量地使用这些农药而造成的环境污染、农药超标等问题引起了人们的广泛关注。欧盟规定吡唑醚菌酯、甲基硫菌灵和多菌灵在柑橘中的残留限量分别为2、6和0.2 mg/kg;日本规定吡唑醚菌酯、甲基硫菌灵和多菌灵的残留限量分别为2、3和3 mg/kg;国际食品法典委员会(CAC)规定吡唑醚菌酯和多菌灵的残留限量分别为2 mg/kg和1 mg/kg; GB 2763-2016中规定了柑橘中多菌灵的残留限量为5 mg/kg,但尚未规定吡唑醚菌酯和甲基硫菌灵在柑橘中的残留限量。因此,建立快速、灵敏的方法监测柑橘中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵的残留具有重要意义。
目前,吡唑醚菌酯的检测方法主要有气相色谱法(GC)[7,8]、液相色谱法(LC)[9,10]、气相色谱-质谱联用法(GC-MS)[11,12]、液相色谱-串联质谱法(LC-MS/MS)[13,14]。气相色谱法、液相色谱法的灵敏度较低,主要用于单一杀菌剂在简单作物上的残留分析;气相色谱-质谱法、液相色谱-串联质谱法选择性和灵敏度较高,主要应用于果蔬、谷物、茶叶、中药材、饮料、肉类等复杂基质的多残留分析。
甲基硫菌灵及代谢物多菌灵的检测方法主要有紫外分光光度法(UV)[15]、气相色谱法[16]、液相色谱法[17-20]、液相色谱-串联质谱法[21-25]等。紫外分光光度法易受干扰,准确度较低;气相色谱法不宜直接分析苯并咪唑类等热不稳定化合物,往往需要衍生化。
已报道的吡唑醚菌酯、甲基硫菌灵和多菌灵的前处理方法主要有固相微萃取法(SPME)[8]、凝胶渗透法(GPC)[10,11]、固相萃取法[12,14,19-21]、微孔膜液液萃取法[17]、QuEChERS技术[23-25]等。Munitz等[8]采用固相微萃取法、吴迪等[10]采用凝胶渗透法提高了样品的净化效率,但复杂繁琐的前处理步骤不能满足大批量快速检测的需求;固相萃取法溶剂消耗量大、费时费力且易对环境造成污染;Sandahl等[17]采用微孔膜液液萃取技术实现了对目标化合物的选择性富集,但有机溶剂消耗量大;李鹏等[23]用QuEChERS方法对样品进行净化,过程繁琐(二次提取)、耗时长(60 min);王连珠等[24]采用QuEChERS方法提取51种农药,其中甲基硫菌灵的回收率低于50%;张志勇等[25]采用改进的QuEChERS技术作为黄瓜样品的前处理方法,过程复杂且溶剂使用量大(40 mL)。
本研究采用改进的QuEChERS技术与LC-MS/MS结合,建立了一种快速、灵敏地检测土壤、橘皮、橘肉和柑橘全果中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵残留的分析方法。该方法简便、快速、灵敏,可满足农药残留的分析要求。
1 实验部分
1.1 仪器与试剂
LC-20 ADXR液相色谱仪(日本Shimadzu公司); 4000 Q-TRAP三重四极杆质谱仪(美国Applied Biosystems公司); QL-901涡旋混合器(江苏海门市麒麟医用仪器厂); TGL-20B高速离心机(上海安亭科学仪器厂); RE-2000A旋转蒸发仪(上海亚荣生化仪器厂); ALC-210.4电子天平(德国艾科勒公司)。
甲醇、乙腈为质谱纯(美国Tedia公司);N-丙基乙二胺(PSA, 40~60 μm, 博纳艾杰尔公司);吡唑醚菌酯标准品(纯度99.0%)、甲基硫菌灵标准品(纯度97.0%)(德国Dr. Ehrenstorfer公司);多菌灵标准品(纯度99.2%)(国家标准物质信息中心); 40%(质量分数)吡唑醚菌酯-甲基硫菌灵悬浮剂(有效成分为5%(质量分数)吡唑醚菌酯和35%(质量分数)甲基硫菌灵, 推荐的施药剂量为有效成分333.3~500 mg/kg,江苏龙灯化工有限公司);屈臣氏蒸馏水(香港Watson有限公司);无水硫酸镁、氯化钠为分析纯(成都金山化学试剂有限公司)。
1.2 残留试验
田间试验于2015、2016年在贵州省都匀市惠水县、广西壮族自治区崇左市扶绥县和湖南省长沙市芙蓉镇3地实施。试验区按《农药登记残留田间试验标准操作规程》的要求设置,每个试验区随机抽取2棵果树,重复3次。以40%(质量分数)吡唑醚菌酯-甲基硫菌灵悬浮剂的高剂量(500 mg/kg)和1.5倍高剂量(750 mg/kg)各喷雾施药2次和3次,施药间隔期为10 d。在相同条件下另设空白对照区,空白对照区不施药。距最后1次施药的第14、21、28 d采集土壤和柑橘样品,测定土壤和柑橘中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵的残留。
1.3 样品的制备
土壤样品按SOP FT-04-01规定制备,柑橘全果、果皮、果肉样品按SOP FT-03-22规定制备。
将土壤样品碾碎后过1 mm(16目)筛,收集于搪瓷盘中混匀,用四分法取200~300 g样品两份;将橘皮切成2 cm的小块,匀浆后混匀;用匀浆机将橘肉、柑橘全果匀浆、混匀。取150 g处理好的样品两份。
将上述样品分别装入封口样品容器中,贴好标签,于-20 ℃冷冻保存。
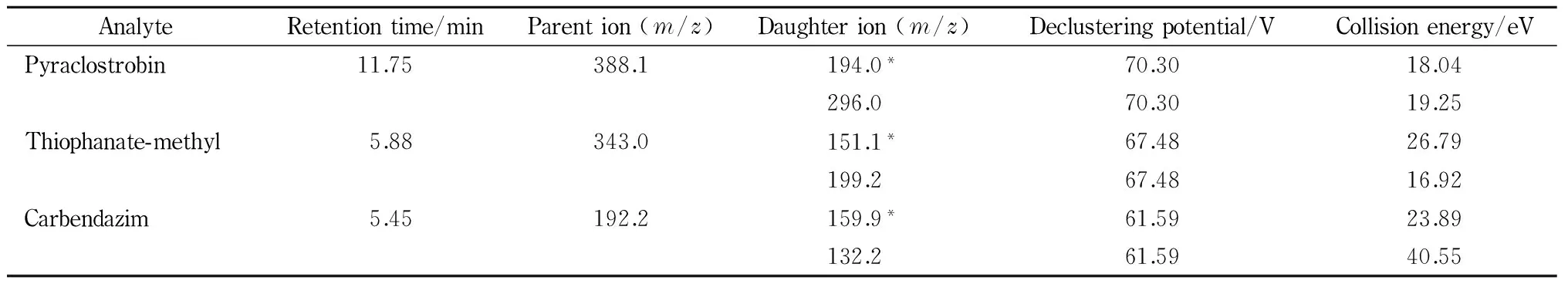
表 1 MRM模式下吡唑醚菌酯、甲基硫菌灵和多菌灵的保留时间、监测离子、去簇电压和碰撞能量
* Quantitative ion.
1.4 样品前处理
土壤:称取5.0 g(精确至0.01 g)样品于50 mL聚四氟乙烯离心管中,加入20 mL甲醇,涡旋提取3 min,超声10 min,加入5 g无水硫酸镁,涡旋1 min,以6 000 r/min离心5 min。取1 mL上清液转移至装有50 mg PSA的离心管中,涡旋1 min,过0.22 μm滤膜,待LC-MS/MS检测。
橘皮、橘肉、柑橘全果:称取5.0 g(精确至0.01 g)样品于50 mL聚四氟乙烯离心管中,加入20 mL乙腈,涡旋提取5 min,超声15 min,加入5 g氯化钠,涡旋1 min,以6 000 r/min离心5 min。取1 mL上清液转移至装有50 mg PSA的离心管中,涡旋1 min,过0.22 μm滤膜,待LC-MS/MS检测。
1.5 标准溶液的配制
分别准确称取10 mg吡唑醚菌酯、甲基硫菌灵和多菌灵标准品,用甲醇溶解并定容至100 mL,分别配制质量浓度为100 mg/L的单标准储备液,密封后于4 ℃避光保存,备用。
分别取适量吡唑醚菌酯、甲基硫菌灵和多菌灵的单标准储备液,用甲醇逐级稀释,配制吡唑醚菌酯质量浓度为5~1 000 μg/L、甲基硫菌灵质量浓度为12.5~2 500 μg/L、多菌灵质量浓度为1.25~250 μg/L的系列混合标准溶液,密封后于4 ℃避光保存,备用。
取空白样品,按1.4节方法前处理后,取1 mL上清液浓缩至干,用系列混合标准溶液复溶并定容至1 mL,分别配制土壤、橘皮、橘肉和柑橘全果中质量浓度对应的系列基质匹配标准溶液。
1.6 分析条件
色谱柱:Agilent Eclipse XDB-C18色谱柱(150 mm×4.6 mm, 5 μm);柱温40 ℃;流动相:(A)甲醇和(B)水;梯度洗脱程序:0~1.0 min,50%B;1.0~1.1 min, 50%B~30%B;1.1~6.0 min,30%B;6.0~6.1 min,30%B~15%B;6.1~12.0 min,15%B;12.0~12.1 min,15%B~50%B;12.1~15.0 min,50%B;流速:0.5 mL/min;进样量:2.0 μL。
离子源:电喷雾离子(ESI)源;扫描方式:正离子扫描;离子源温度:550 ℃;离子喷雾电压:5 500 V;辅助气压力1(N2): 344.8 kPa;辅助气压力2(N2): 344.8 kPa;气帘气压力:206.9 kPa。采用多反应监测(MRM)模式采集数据,以保留时间和离子对信息进行定性分析,以母离子和响应值最高的子离子进行定量分析。吡唑醚菌酯、甲基硫菌灵和多菌灵的保留时间、监测离子、去簇电压和碰撞能量见表1。
2 结果与讨论
2.1 色谱和质谱条件的优化
分别考察了以不同比例的甲醇-水、乙腈-水和甲醇-0.1%(v/v)甲酸水溶液作为流动相进行梯度洗脱时目标物的分离效果。以乙腈-水作为流动相体系时,多菌灵有拖尾现象且峰宽过大;以甲醇-0.1%(v/v)甲酸水溶液作为流动相体系时,吡唑醚菌酯峰形变形、分叉;以甲醇-水作为流动相体系时,吡唑醚菌酯、甲基硫菌灵和多菌灵均有较好的峰形且分离效果较好,故选为实验所用。
采用流动注射单标准储备液的形式分别对吡唑醚菌酯、甲基硫菌灵和多菌灵的质谱参数进行优化。选择ESI+电离模式,对离子喷雾电压、离子源温度、气帘气压力及碰撞能量等条件进行优化。通过选择Full scan扫描得到分子离子峰,并优化得到去簇电压,再在Product Ion模式下优化碰撞能量,并得到定量和定性离子,然后用优化得到的质谱条件进行MRM测定。
2.2 提取溶剂的选择
根据现有的文献方法,结合吡唑醚菌酯、甲基硫菌灵和多菌灵的性质,考察了甲醇、乙腈、丙酮、乙酸乙酯、二氯甲烷5种提取溶剂对吡唑醚菌酯、甲基硫菌灵和多菌灵在土壤、橘皮、橘肉、柑橘全果中回收率的影响(见图1)。结果表明,对于土壤样品,采用丙酮、乙酸乙酯、二氯甲烷提取时,吡唑醚菌酯、甲基硫菌灵和多菌灵的回收率均不能同时达到70%以上;采用乙腈提取时,目标物的回收率为70%~85%;采用甲醇提取时,目标物的回收率为90%~100%,故选择甲醇作为提取溶剂。对于柑橘果皮、果肉、全果样品,采用甲醇、丙酮、乙酸乙酯、二氯甲烷提取时,目标物的回收率均不能同时达到70%以上;采用乙腈提取时,目标物的回收率为80%~100%,故选择乙腈作为提取溶剂。
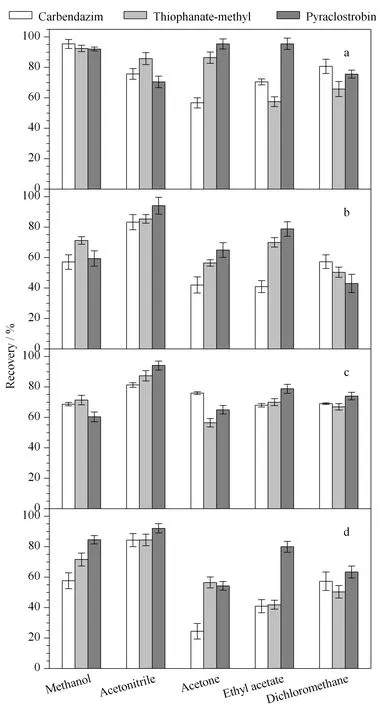
图 1 不同提取剂对吡唑醚菌酯(0.2 mg/kg)、甲基硫菌灵(0.5 mg/kg)和多菌灵(0.05 mg/kg)回收率的影响(n=3)Fig. 1 Effects of the different extraction solvents on the recoveries of pyraclostrobin (0.2 mg/kg), thiophanate-methyl (0.5 mg/kg), carbendazim (0.05 mg/kg) (n=3) Matrix: a. soil; b. citrus peel; c. citrus pulp; d. citrus.
2.3 吸附剂的选择
在提取柑橘样品时,会有较多的有机酸、色素和糖类化合物与目标化合物共流出,如果不进一步净化,会干扰目标化合物的准确定量。目前,采用QuEChERS技术时常用的吸附剂主要有C18、石墨化炭黑(GCB)和PSA。C18主要用于去除脂类等疏水性杂质;GCB主要用于去除色素类物质;PSA是一种弱阴离子交换剂,主要用于去除脂肪酸等物质。本研究分别考察了10、30和50 mg的C18、GCB和PSA对目标物质回收率的影响。结果表明,经不同质量的C18或GCB净化后,目标物质的回收率均较低,无法满足分析要求;而经10、30和50 mg的PSA净化后,目标物质的回收率分别为82.29%~95.24%、82.14%~96.71%和81.53%~95.85%,且PSA的用量越多,样品净化后的颜色越浅,故本研究选用50 mg的PSA作为吸附剂。
2.4 方法学评价
2.4.1 线性范围、检出限和定量限
本试验对不同浓度的基质匹配标准溶液进行分析,以目标物质的峰面积为纵坐标(y)、对应的质量浓度为横坐标(x, μg/L)绘制标准曲线。结果表明,吡唑醚菌酯在5~1 000 μg/L、甲基硫菌灵在12.5~2 500 μg/L、多菌灵在1.25~250 μg/L范围内线性关系良好,相关系数(r2)均大于0.99(见表2)。
以3倍和10倍信噪比(S/N)确定方法的检出限(LOD)和定量限(LOQ)。吡唑醚菌酯、甲基硫菌灵和多菌灵的检出限分别为1.7~2.1 μg/kg、2.8~4.2 μg/kg和0.6~0.8 μg/kg,定量限分别为5.8~7.0 μg/kg、9.3~14.1 μg/kg和2.1~2.6 μg/kg。方法的检出限和定量限远低于当前各国现行的残留限量标准。
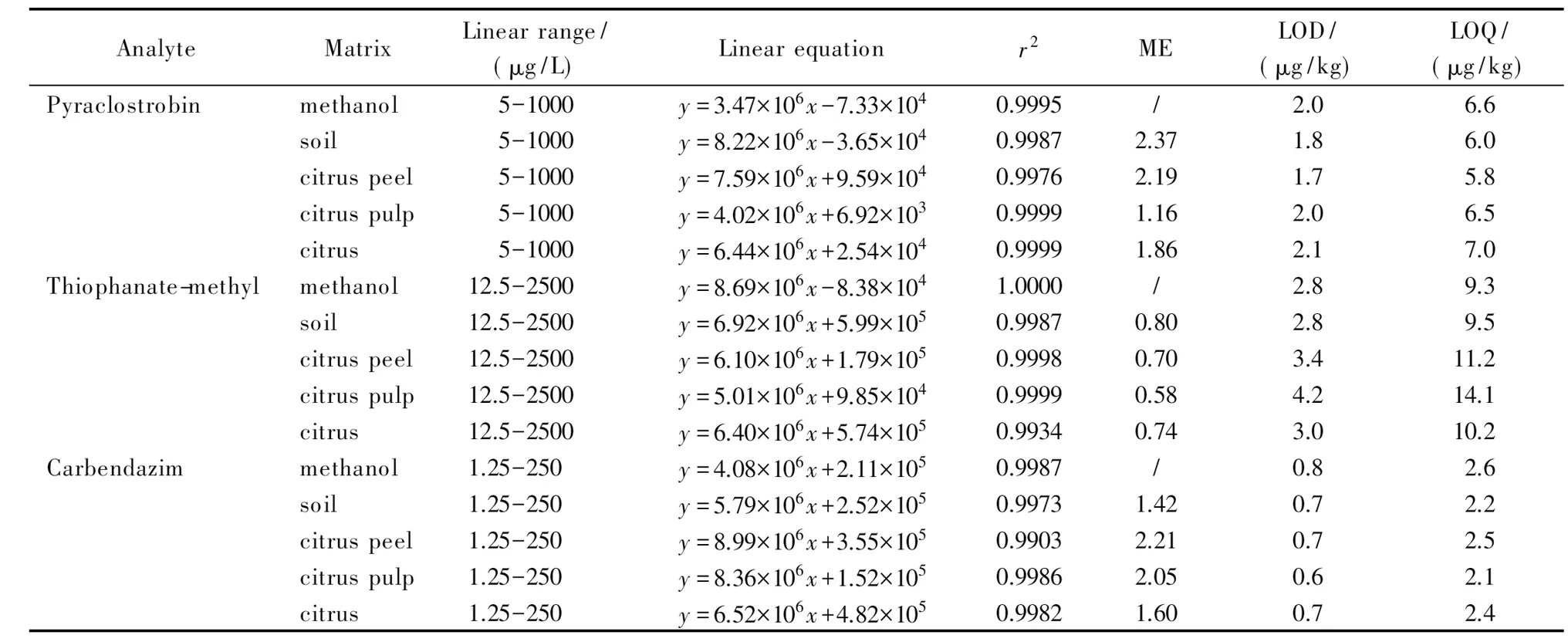
表 2 不同基质中吡唑醚菌酯、甲基硫菌灵和多菌灵的线性范围、线性方程、相关系数、基质效应(ME)、检出限和定量限
y: peak area;x: mass concentration, μg/L; /: not exist.
2.4.2 基质效应的考察
基质效应是指样品中一种或几种非待测组分对待测物含量测定准确度的影响。为提高方法的准确度,需要对不同基质产生的基质效应做出评价[26]。对1.5节配制的基质匹配标准溶液和混合标准溶液进行分析,绘制标准曲线,,以二者的斜率比来判定基质效应的强弱[27-29]:比值大于1时,表现为基质增强效应;比值小于1时,表现为基质抑制效应。结果表明,吡唑醚菌酯在不同基质中的斜率比大于1,说明存在基质增强效应;甲基硫菌灵在不同基质中的斜率比均小于1,说明存在明显的基质抑制效应;多菌灵在不同基质中的斜率比大于1,说明存在基质增强效应(见表2)。不同基质中吡唑醚菌酯(0.2 mg/kg)、甲基硫菌灵(0.5 mg/kg)和多菌灵(0.05 mg/kg)的MRM色谱图见图2。
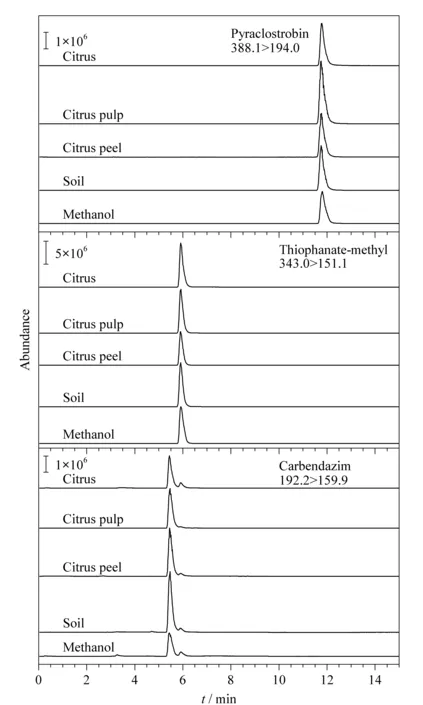
图 2 不同基质中吡唑醚菌酯(0.2 mg/kg)、甲基硫菌灵(0.5 mg/kg)和多菌灵(0.05 mg/kg)的色谱图 Fig. 2 Chromatograms of pyraclostrobin (0.2 mg/kg),thiophanate-methyl (0.5 mg/kg) and carbendazim (0.05 mg/kg) in different matrices
2.4.3 回收率与精密度
称取不同基质的空白样品,加入不同浓度水平的混合标准溶液,混匀后静置2 h,制得吡唑醚菌酯含量为0.02、0.2、4 mg/kg、甲基硫菌灵含量为0.05、0.5、10 mg/kg、多菌灵含量为0.005、0.05、1 mg/kg的加标样品。按1.4节的描述进行前处理,进行加标回收率试验,每个加标水平重复5次,结果见表3。土壤、橘皮、橘肉和柑橘全果中吡唑醚菌酯、甲基硫菌灵和多菌灵的加标回收率分别为75.48%~101.73%、77.92%~109.18%和83.31%~102.44%, RSD分别为0.60%~4.97%、0.66%~3.20%和1.09%~5.11%(n=5)。实验数据表明,建立的方法具有较高的准确度和精密度,满足在土壤、橘皮、橘肉和柑橘全果基质中吡唑醚菌酯、甲基硫菌灵和多菌灵的残留检测要求。
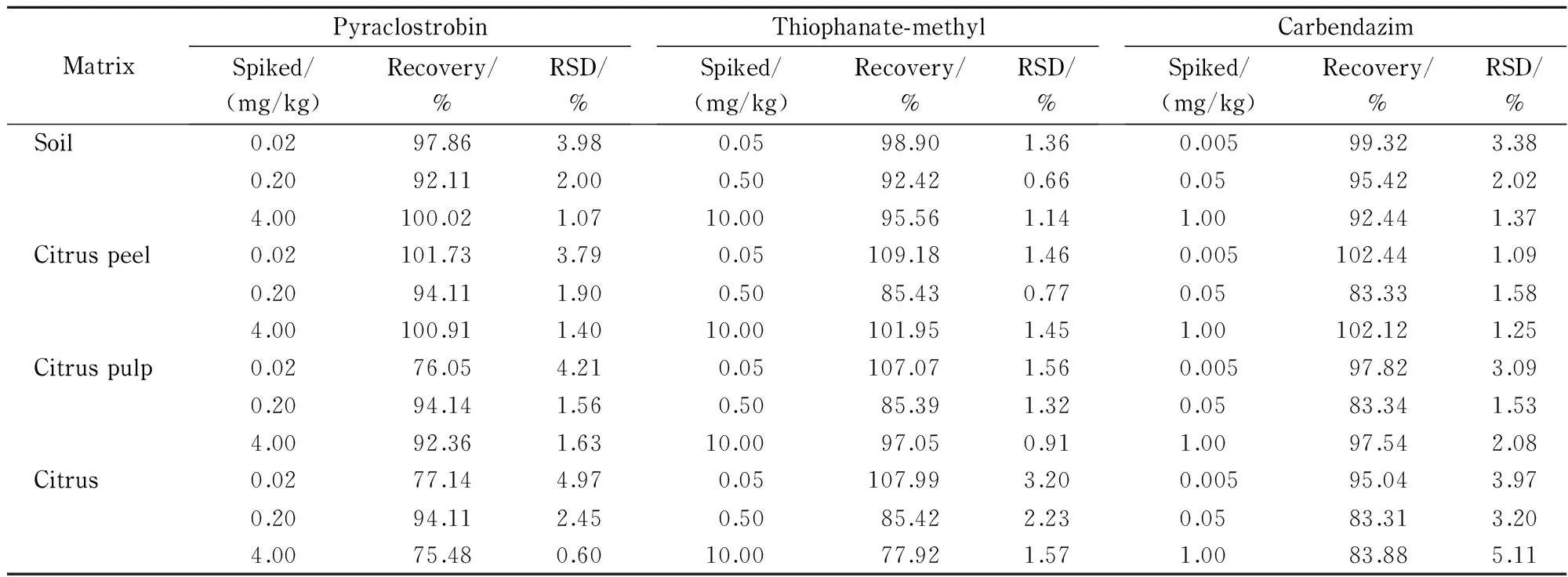
表 3 吡唑醚菌酯、甲基硫菌灵和多菌灵在不同基质中的加标回收率及相对标准偏差(n=5)
2.5 实际样品检测
将建立的方法应用于田间试验样品。检测出吡唑醚菌酯在所有土壤、橘皮、橘肉、柑橘全果样品中的最终残留分别小于1.78、0.98、0.09和0.26 mg/kg;甲基硫菌灵的残留分别小于0.32、0.98、0.41和0.87 mg/kg;多菌灵的残留分别小于1.23、0.61、0.18和0.52 mg/kg。橘肉中吡唑醚菌酯、甲基硫菌灵和多菌灵最终残留量均低于各国规定的残留限量值。
3 结论
本研究建立了QuEChERS-液相色谱-串联质谱同时检测土壤和柑橘中吡唑醚菌酯、甲基硫菌灵和多菌灵残留的分析方法。该方法操作简单,提取时间短,溶剂用量少,线性范围宽,灵敏度高,为柑橘中农药残留检测提供了技术支持。
[1] Zhang Y B. World Pasticides, 2007, 29(3): 47
张亦冰. 世界农药, 2007, 29(3): 47
[2] Yao Y, Chen J X, Li T, et al. Fine Chemical Intermediates, 2013, 43(3): 65
姚瑛, 陈九星, 李涛, 等. 精细化工中间体, 2013, 43(3): 65
[3] Ding Y, Wu R H, Guo X Y, et al. Agrochemicals, 2013, 52(12): 896
丁悦, 吴若函, 郭晓瑜, 等. 农药, 2013, 52(12): 896
[4] Yin X H, Li R Y, Wang M, et al. Agrochemicals, 2014, 53(3): 191
尹显慧, 李荣玉, 王梅, 等. 农药, 2014, 53(3): 191
[5] Pu Z X, Huang Z D, Hu X R, et al. Acta Agricultural Zhejiangensis, 2014, 26(1): 122
蒲占湑, 黄振东, 胡秀荣, 等. 浙江农业学报, 2014, 26(1): 122
[6] Ma H J, Cao Q L, Ma Y F, et al. Agrochemicals, 2013, 52(6): 408
马海军, 曹庆亮, 马亚芳, 等. 农药, 2013, 52(6): 408
[7] Wu J S, Feng J W, Ren Y X, et al. Agrochemicals, 2011, 50(10): 754
吴洁珊, 冯家望, 任永霞, 等. 农药, 2011, 50(10): 754
[8] Munitz M S, Resnik S L, Montti M I T, et al. Agr Sci, 2014, 5(11): 964
[9] Li R J, Yu J L, Song G C. Pesticide Science and Administration, 2010, 31(6): 33
李瑞娟, 于建垒, 宋国春. 农药科学与管理, 2010, 31(6): 33
[10] Wu D, Xin J, Pan H J, et al. Chinese Journal of Pesticide Science, 2012, 14(6): 681
吴迪, 莘婧, 潘洪吉, 等. 农药学学报, 2012, 14(6): 681
[11] Bo H B, Wang J H, Guo C H, et al. Chinese Journal of Analytical Chemistry, 2008, 36(11): 1471
薄海波, 王金花, 郭春海, 等. 分析化学, 2008, 36(11): 1471
[12] Lagunas-Allué L, Sanz-Asensio J, Martínez-Soria M T. J Chromatogr A, 2012, 1270(24): 62
[13] Zhang F Z, Wang L, Zhou L, et al. Ecotox Environ Safe, 2012, 78(4): 116
[14] Liu J, Zhang X, Shen J, et al. Hubei Agricultural Sciences, 2014, 53(19): 4698
刘军, 张仙, 沈菁, 等. 湖北农业科学, 2014, 53(19): 4698
[15] GB/T 5009. 188-2003
[16] SN 0162-92
[17] Sandahl M, Mathiasson L, Jonsson J A. J Chromatogr A, 2000, 893(1): 123
[18] Gu X Y, Qiu M Z, Liu Y Z. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2010, 46(7): 797
辜雪英, 仇满珍, 刘云珠. 理化检验-化学分册, 2010, 46(7): 797
[19] Shi J L, Song C M, Kong G H, et al. Chinese Journal of Analysis Laboratory, 2012, 31(12): 82
师君丽, 宋春满, 孔光辉, 等. 分析试验室, 2012, 31(12): 82
[20] Zhang N J, Wu X Z, Jiang X. Modern Food Science and Technology, 2013, 29(4): 907
张念洁, 吴信子, 姜旭. 现代食品科技, 2013, 29(4): 907[21] Liu X S, Zheng L, Huang W W, et al. Journal of Instrumental Analysis, 2013, 32(1): 84
刘晓松, 郑玲, 黄文雯, 等. 分析测试学报, 2013, 32(1): 84
[22] Liu N, Dong F S, Liu X G, et al. Food Control, 2014, 43(43): 115
[23] Li P, Liu K L, Yang X, et al. Journal of Food Safety and Quality, 2013, 4(1): 89
李鹏, 刘凯丽, 杨欣, 等. 食品安全质量检测学报, 2013, 4(1): 89
[24] Wang L Z, Zhou Y, Huang X Y, et al. Chinese Journal of Chromatography, 2013, 31(12): 1167
王连珠, 周昱, 黄小燕, 等. 色谱, 2013, 31(12): 1167
[25] Zhang Z Y, Gong Y, Shan W L, et al. Chinese Journal of Chromatography, 2012, 30(1): 91
张志勇, 龚勇, 单炜力, 等. 色谱, 2012, 30(1): 91
[26] Chen J J, Zhang J, Wu S Z, et al. Chinese Journal of Chromatography, 2016, 34(10): 1005
陈姣姣, 张静, 吴思卓, 等. 色谱, 2016, 34(10): 1005
[27] Zheng X P, Ding L P, Chen Z T, et al. Chinese Journal of Chromatography, 2015, 33(6): 652
郑香平, 丁立平, 陈志涛, 等. 色谱, 2015, 33(6): 652
[28] Chen X X, Xu J, Liu X G, et al. J Sep Sci, 2014, 37(13): 1640
[29] Ding L P, Cai C P, Wang D H. Chinese Journal of Chromatography, 2014, 32(8): 849
丁立平, 蔡春平, 王丹红. 色谱, 2014, 32(8): 849
Guizhou University Graduate Student Innovation Fund (No. 2016077).
Simultaneous determination of pyraclostrobin and thiophanate-methyl and its metabolite carbendazim residues in soil and citrus by QuEChERS-liquid chromatography-tandem mass spectrometry
LI Fuqin, SHI Lihong, WANG Fei, SUN Caiyuan, KANG Di,ZHANG Yuping, CHEN Lingzhu, HU Deyu*
(ResearchandDevelopmentCenterforFineChemicals,StateKeyLaboratoryofGreenPesticideandAgriculturalBioengineering,MinistryofEducation,GuizhouUniversity,Guiyang550025,China)
A QuEChERS-liquid chromatography-tandem mass spectrometry (LC-MS/MS) method was developed for the determination of pyraclostrobin, thiophanate-methyl and its metabolite carbendazim in soil and citrus. The samples were extracted with methanol or acetonitrile, purified by primary secondary amine (PSA), then separated by LC, detected in multiple reaction monitoring (MRM) mass spectrometry mode via positive electrospray ionization. The analytes were quantified by matrix-matched standard solutions with external standard method. The limits of quantification (LOQs) of pyraclostrobin, thiophanate-methyl and carbendazim in different matrices were 5.8-7.0 μg/kg, 9.3-14.1 μg/kg and 2.1-2.6 μg/kg, respectively. For all the samples, the spiked recoveries ranged from 75.48% to 109.18%, and the relative standard deviations (RSDs) were 0.60%-5.11% (n=5). The method is quick, easy, effective, sensitive and accurate. The matrix-matched calibration solutions can efficiently compensate matrix effects of the pyraclostrobin, thiophanate-methyl and carbendazim in LC-MS/MS analysis. The established method can be applied to the residue analysis of the real samples of soil, citrus peel, citrus pulp and citrus fruits.
liquid chromatography-tandem mass spectrometry (LC-MS/MS); QuEChERS; pyraclostrobin; thiophanate-methyl; carbendazim; soil; citrus
10.3724/SP.J.1123.2017.01031
2017-01-22
贵州大学研究生创新基金项目(2016077).
O658
A
1000-8713(2017)06-0620-07
* 通讯联系人.Tel:(0851)88292170,E-mail:dyhu@gzu.edu.cn.
