超高效液相色谱-大气压化学电离-三重四极杆质谱联用法快速测定食品中苯并[a]芘
2017-06-15张晓艺张秀尧蔡欣欣李瑞芬
张晓艺, 张秀尧, 蔡欣欣, 李瑞芬
(温州市疾病预防控制中心, 浙江 温州 325001)
研究论文
超高效液相色谱-大气压化学电离-三重四极杆质谱联用法快速测定食品中苯并[a]芘
张晓艺, 张秀尧*, 蔡欣欣, 李瑞芬
(温州市疾病预防控制中心, 浙江 温州 325001)
建立了快速检测食品中苯并[a]芘的超高效液相色谱-三重四极杆质谱联用(UPLC-MS/MS)分析方法。样品用正己烷提取后,经分子印迹固相萃取柱净化,以甲醇和水作为流动相进行梯度洗脱,在XBridge BEH C18柱上实现分离,大气压化学电离(APCI)-三重四极杆质谱正离子MRM方式检测,以苯并[a]芘-d12作为内标的稳定同位素稀释法定量。方法的线性范围为0.07~50 μg/kg,定量限为0.07 μg/kg。平均加标回收率为86%~104%,相对标准偏差为2.3%~14%。该方法灵敏、准确,适用于食品中苯并[a]芘的测定,已应用于实际样品的检查。
超高效液相色谱-串联质谱;大气压化学电离;分子印迹固相萃取;苯并[a]芘;食品
苯并[a]芘(benzo[a]pyrene, BaP)又称3,4-苯并芘,是一种5环的稠环芳烃,具有致癌、致畸、致突变性毒性。苯并[a]芘主要存在于生活与工业生产过程中的燃烧能源,比如煤、石油以及天然气等不完全燃烧过程中所生成的废气中,这些废气通过水、大气和土壤进入到粮食、蔬菜、水果、水产品以及肉制品等食品中;同时食品在煎炸和熏烤等加工过程中也会发生热裂解形成大量稠环芳烃,其中苯并[a]芘的含量比较高,特别是在烘烤和烟熏过程中发生的糊焦现象时,苯并[a]芘的生成量将会比普通食品高20倍以上[1-4]。我国国标GB 2762-2012《食品安全国家标准 食品中污染物限量》规定谷物及其制品(稻谷、糙米、大米、小麦、小麦粉、玉米、玉米面(渣、片))、肉及肉制品(熏、烧、烤肉类)和水产动物及其制品(熏、烤水产品)中苯并[a]芘的不得超过5.0 μg/kg,油脂及其制品不得超过10 μg/kg。欧盟推荐食用油中苯并[a]芘的限量值为2 μg/kg (Regulation 208/2005, EC)。
目前,食品中苯并[a]芘的分析方法主要有高效液相色谱-荧光检测法[5,6]、气相色谱-质谱联用法[7,8]和液相色谱-串联质谱联用法等[9,10]。高效液相色谱-荧光检测法灵敏、重现性好,是较常用的方法[5,6],但与液相色谱-质谱联用法相比定性能力不强、灵敏度不高;气相色谱-质谱联用法灵敏度不高,需对样品进行多倍浓缩,样品前处理常会耗费较多的有机溶剂,检测周期长[8]。刘玉兰等[9]采用液相色谱-光化学电离-质谱联用法测定食用油脂中的苯并[a]芘,样品稀释后直接进样,方法检出限为1 μg/kg。虽然简化了样品前处理过程,但容易造成基线漂移,对色谱柱损害较大,整个系统易污染,且光化学电离源非仪器标配部件,通用性差,同时还需1台溶剂输送泵在柱后加入掺杂剂(dopant)甲苯,装置复杂。王浩等[10]采用液相色谱-光化学电离-质谱联用法测定植物油中的苯并[a]芘和4种黄曲霉毒素,样品经凝胶渗透色谱净化,在去除大分子杂质方面效果较好,但有机溶剂消耗量大、耗时,还存在一定的基质抑制效应,需用基质标准外标法定量。蓝长波[11]采用液相色谱-电喷雾电离-质谱联用法,但苯并[a]芘在电喷雾源中难以离子化,灵敏度极低。
分子印迹固相萃取技术是以分子印迹材料作为固相萃取填料制成分子印迹固相小柱,可选择性吸附液体样品中的目标化合物,使其与样品的基体等干扰成分分离,最终达到净化和富集的目的;分子印迹固相萃取技术具有良好的特异性,可以提高分析的准确度、精密度和灵敏度,已成为近年来样品前处理领域的一个研究热点[12]。本研究采用分子印迹固相萃取法进行样品前处理,消除了基质效应,方法选择性好,使用仪器标配的大气压化学电离源,通过对色谱和质谱条件的优化,实现了超高效液相色谱-串联质谱法的高灵敏检测,以稳定同位素稀释法定量,建立了食品中苯并[a]芘的检测方法,检出限优于新国标GB 5009.27-2016《食品安全国家标准 食品中苯并[a]芘的测定》10倍,方法简便、快速、灵敏、准确。
1 实验部分
1.1 仪器与试剂
超高效液相色谱仪由ACQUITY UPLC BSM二元溶剂管理系统、ACQUITY UPLC FTN样品管理系统和ACQUITY UPLC CM-A色谱柱管理系统组成,由Empower 3工作站控制(美国Waters公司); QTRAP 6500三重四极杆/复合线性离子阱串联质谱仪(美国AB SCIEX公司),由Analyst 1.6.2软件控制;2510超声波清洗机(美国Branson公司); Multi Reax数显型多管旋涡混合器(德国Heidolph公司); 3-30K高速冷冻离心机(德国Sigma公司); N-EVAP氮吹仪(24孔,美国Organomation公司); Gradient A10 Milli-Q超纯水器(法国Millipore公司)。
甲醇、正己烷、二氯甲烷和乙腈为HPLC级(德国Merck公司);分子印迹柱固相萃取柱(500 mg/6 mL,上海安谱实验科技股份有限公司);苯并[a]芘标准物质(20 μg/mL,农业部环境保护科研监测所)、苯并[a]芘-d12标准物质(200 μg/mL,北京曼哈格生物科技有限公司),临用时稀释至所需浓度,避光保存。
1份花生油、2份玉米油、1份大豆油、1份茶油、2份烤鸡翅、1份烤鸡腿、1份烤猪肉、2份烤虾、1份烤鱿鱼丝和3份大米均购自当地商场。
1.2 实验条件
1.2.1 色谱分离条件
分析柱为XBridge BEH C18(75 mm×3.0 mm, 2.5 μm),配套保护柱VanGuard BEH C18(5 mm×2.1 mm, 1.7 μm);流动相A为甲醇,B为水。梯度洗脱程序:0~3.00 min, 68%A~98%A; 3.00~4.50 min, 98%A; 4.50~4.60 min, 98%A~68%A; 4.60~6.00 min, 68%A。流速:1.000 mL/min;柱温:55 ℃;进样体积:5 μL;乙腈作为清洗溶剂(wash solvent), 50%(v/v)甲醇作为消除溶剂(purge solvent)。
1.2.2 质谱条件
大气压化学电离离子源,正离子扫描方式多离子反应监测(MRM)。离子化电压(IS): 5 500 V,离子源温度(TEM): 600 ℃,放电电流(NC): 3 μA,气帘气(CUR): 277 kPa,喷雾气(GS1): 345 kPa,碰撞气(CAD): medium。苯并[a]芘定量离子对为m/z253.2>224.1,定性离子对为m/z253.2>226.1,去簇电压(DP)均为120 V,碰撞能量(CE)分别为95和69 eV;苯并[a]芘-d12离子对为m/z263.2>232.1, DP为120 V, CE为95 eV;峰驻留时间均为80 ms。
1.3 样品前处理
样品前处理在避光条件下进行。
1.3.1 提取
油脂及其制品:准确称取0.500 g试样,加入25 μL 100 μg/L苯并[a]芘-d12内标溶液,混匀,再加入5 mL正己烷,旋涡混合溶解,待净化。
其他食品:取可食部分,均质。准确称取1.00 g,加入50 μL 100 μg/L苯并[a]芘-d12内标溶液,混匀,再加入5.0 mL正己烷,旋涡混合0.5 min, 40 ℃下超声提取10 min, 10 000 r/min下离心5 min,移取上清液。残渣中再加入5.0 mL正己烷重复提取一次。合并提取液,待净化。
1.3.2 净化
分子印迹柱固相萃取柱依次用5.0 mL二氯甲烷和5.0 mL正己烷活化,上样,分别各用5.0 mL正己烷淋洗柱子2次,抽干,用5.0 mL二氯甲烷洗脱,洗脱液在40 ℃下氮气吹干,油脂及其制品的残渣中加入0.25 mL乙腈,其他类型食品的残渣中加入0.50 mL乙腈,涡旋复溶0.5 min,过0.22 μm滤膜,待测。
2 结果与讨论
2.1 样品前处理方法的优化
苯并[a]芘属非极性化合物,易溶于苯、正己烷等非极性有机溶剂。目前,国内外广泛采用正己烷作为苯并[a]芘的提取溶剂,我们也选择正己烷作为提取剂。
食品中苯并[a]芘的样品预处理方法主要有固相萃取法[13-16]、QuEChERS法[6]、基质分散固相萃取法[17]和凝胶色谱法[8-10,18]等。固相萃取法主要采用弗罗里硅土柱、氧化铝柱等。国内已有商品化的苯并[a]芘专用固相萃取柱,这些专用柱分为两类。一类是按照GB/T 22509-2008 《动植物油脂 苯并[a]芘的测定 反相高效液相色谱法》中规定的,将适当活度的22 g氧化铝制成固相萃取柱(22 g/60 mL);另一类是苯并[a]芘分子印迹固相萃取柱(500 mg/6 mL)。这两类柱都能起到较好的净化效果,但第一类固相萃取柱消耗的溶剂较多,第二类固相萃取柱特异性更强,溶剂消耗少。戴廷灿等[6]采用QuEChERS法提取,自制乙二胺-N-丙基硅胶(PSA)+中性氧化铝小柱净化,测定蔬菜中的苯并[a]芘,在操作便利和净化效果上并无明显优势。基质分散固相萃取法需要手工装柱,烦琐、耗时,使用C18填料作为吸附分散剂,特异性不强,净化效果不明显[17]。离线的凝胶色谱法可以去除大分子杂质,但耗溶剂、耗时;在线的凝胶色谱法多与气相色谱-质谱联用仪联用,需专门的仪器设备。所以我们最终选择苯并[a]芘分子印迹固相萃取法作为样品净化方法,10 mL 0.1 μg/L苯并[a]芘的正己烷标准溶液上样,用10 mL正己烷分2次淋洗,再用5.0 mL二氯甲烷洗脱,苯并[a]芘的绝对回收率≥95%。选择玉米油、大米、烤鸡腿分别作为油脂及其制品、谷物及其制品、肉及肉制品及水产动物及其制品的代表样品,经本法处理后,以苯并[a]芘-d12配制基质标准与溶剂标准比较进行基质效应(matrix effect, ME)评估。结果表明以上3种样品的ME均在90%~100%范围内,基质效应不明显[19]。为了克服样品前处理和仪器检测过程中可能存在的误差,本法采用苯并[a]芘-d12稳定同位素作为内标进行定量。
2.2 质谱条件的优化
由于苯并[a]芘极性小,在电喷雾离子(ESI)源中不能电离,可在大气压化学电离源中以正离子的方式电离。利用注射泵以7 μL/min的流速分别将2.0 μg/mL的苯并[a]芘和苯并[a]芘-d12标准溶液通过三通汇合流动相(90%(v/v)甲醇水溶液,流速为0.700 mL/min)注入离子源中,在大气压化学电离正离子检测方式下对质谱测定条件进行优化。Q1扫描时可见[M+H]+峰,对准分子离子峰进行子离子扫描,得到碎片离子信息,然后再对离子源温度、电晕针放电电流、去簇电压、碰撞能量等参数进行优化,使得分子离子对信号达到最佳。遵循国际惯例,确证分析需要4个识别点,故选择两对分子离子对,同时设定合适的峰驻留时间确保色谱峰的采样点数为15~20点,从而得到较好的定量重复性。优化后的测定条件见1.2.2节。
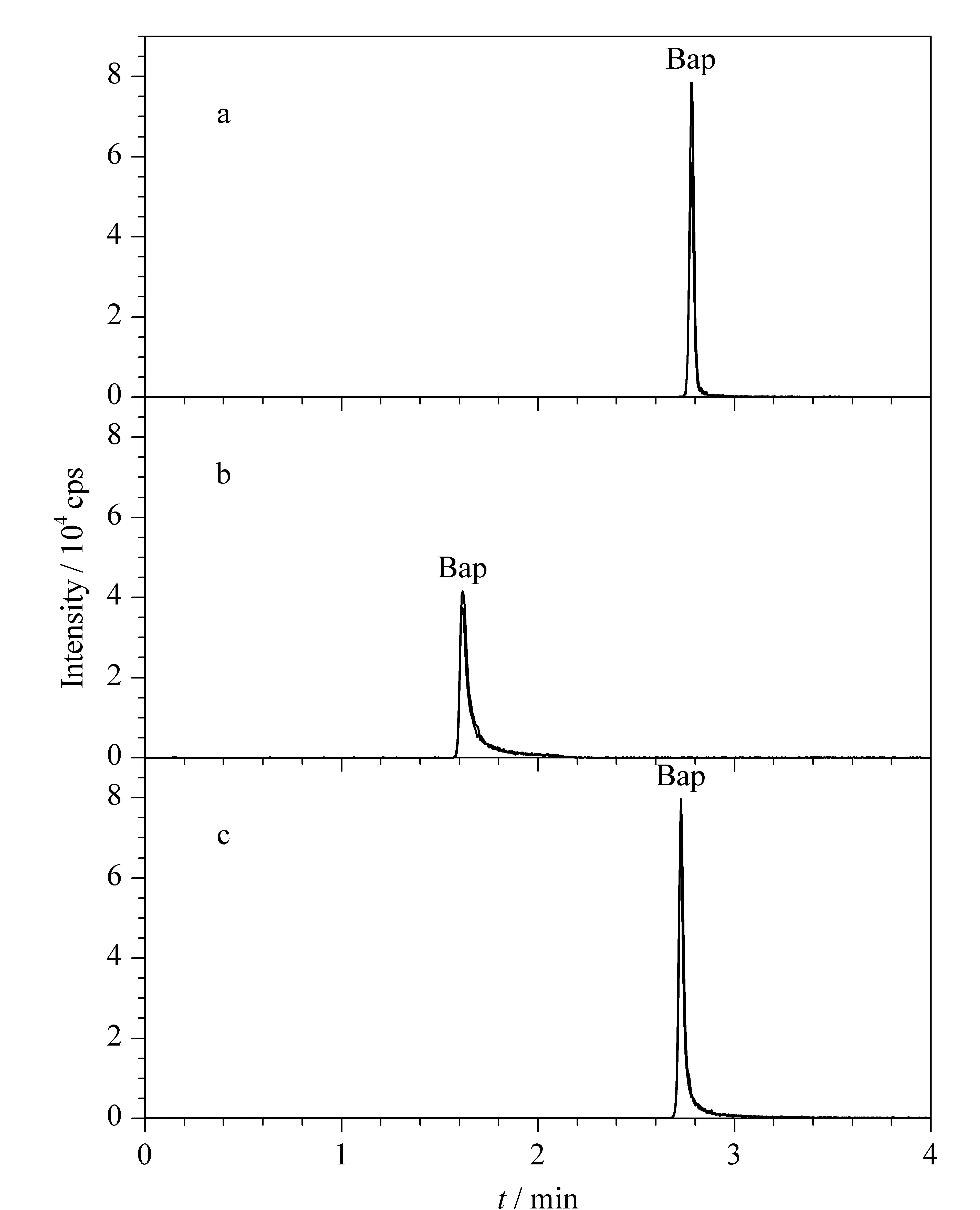
图 1 3种色谱柱对苯并[a]芘分离的比较Fig. 1 Comparison of three chromatographic columns on the separation of benzo[a]pyrene (BaP) a. Acquity UPLC BEH C18 (50 mm×2.1 mm, 1.7 μm); b. Acquity UPLC BEH C8 (50 mm×2.1 mm, 1.7 μm); c. Acquity UPLC BEH Shield RP (50 mm×2.1 mm, 1.7 μm).
2.3 超高效液相色谱条件的优化
由于采用大气压化学电离法,流动相的流速要≥0.6 mL/min,考虑到柱压的限制,选择50 mm长的超高效液相色谱柱。试验了50 mm×2.1 mm规格的BEH C18(1.7 μm)、Shield RP(1.7 μm)和BEH C8(1.7 μm)超高效液相色谱柱,结果见图1。苯并[a]芘在BEH C18柱上的色谱峰形和响应值最佳,而在其他色谱柱上严重拖尾,响应值低。实际样品处理液以乙腈为溶剂,进样5 μL, 50 mm×2.1 mm的BEH C18色谱柱会有溶剂效应,导致色谱峰展宽,使苯并[a]芘不能与杂质干扰峰达到基线分离。最终选用75 mm×3.0 mm的BEH C18(2.5 μm)作为分析色谱柱,由于其柱容量较大,不会出现进样溶剂效应。
比较甲醇-水、乙腈-水作为流动相的效果,并加入低浓度的甲酸和乙酸铵缓冲盐等进行优化。结果显示苯并[a]芘在甲醇-水系统中的离子化效果最好,同时又对流动相梯度洗脱程序和柱温等条件进行优化,最终苯并[a]芘的色谱保留时间适当,最高柱压约为55.2 MPa (8 000 psi),适合在超高效液相色谱仪上运行,色谱峰形好,能与杂质峰达到基线分离(见图2)。优化的色谱条件见1.2.1节。
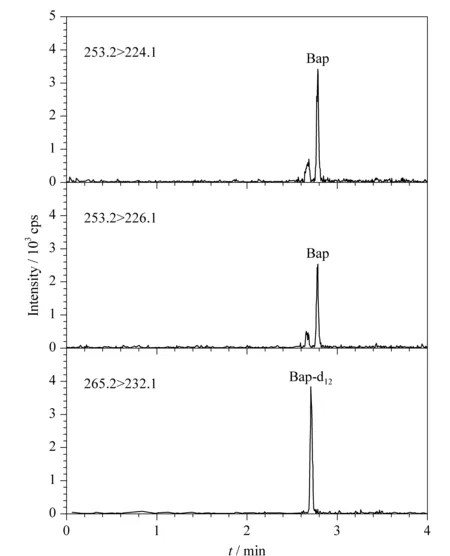
图 2 玉米油样品中苯并[a]芘的UPLC-MS/MS MRM色谱图(0.98 μg/kg)Fig. 2 UPLC-MS/MS MRM chromatograms of benzo[a]pyrene in a corn oil sample (0.98 μg/kg)
2.4 方法的线性范围、检出限和定量限
将苯并[a]芘标准品溶液分别用乙腈稀释成0.1、0.5、1.0、5.0、20、100 μg/L(各含有5.0 μg/L苯并[a]芘-d12)的系列标准溶液进行测定,采用MultiQuant定量软件进行数据处理,以定量离子对与内标物的峰面积比值(y)对系列标准溶液质量浓度(x, μg/L)进行回归(权重取1/x),苯并[a]芘在0.1~100 μg/L范围内的回归方程为y=0.203 2x+0.000 613,相关系数优于0.999,呈线性关系。
在空白样本中加入低浓度的苯并[a]芘,按本法测定;倘若无法找到空白样品,可加入低浓度的同位素内标苯并[a]芘-d12。以两对分子离子对的信噪比均≥3时对应的样品浓度作为检出限(LOD),以信噪比≥10时的样品浓度作为定量限(LOQ),测得检出限为0.02 μg/kg,定量限为0.07 μg/kg,测定上限为50 μg/kg。本法测定范围涵盖了大部分样品中的苯并[a]芘浓度水平,超过测定上限的样品应稀释后再行测定。
2.5 样品的加标回收和精密度试验
分别取玉米油、烤鸡腿和大米样品进行加标回收和精密度试验。样品中添加不同水平的标准溶液,混匀,放置过夜,使待测成分与样品基体成分相互作用达到平衡,再按样品前处理方法进行操作,其回收率和精密度结果见表1。加标回收率在86%~104%之间,相对标准偏差在2.3%~14%之间,符合痕量分析的要求。
2.6 实际样品的分析
检测了5份植物油、4份烤肉类、2份烤虾、1份烤鱿鱼丝和3份大米共15份市售样品,均检出了苯并[a]芘。5份植物油中苯并[a]芘的含量在0.27~1.65 μg/kg之间,3份大米为0.031~0.10 μg/kg,其余均在0.082~0.97 μg/kg范围内,均符合国标限量要求。
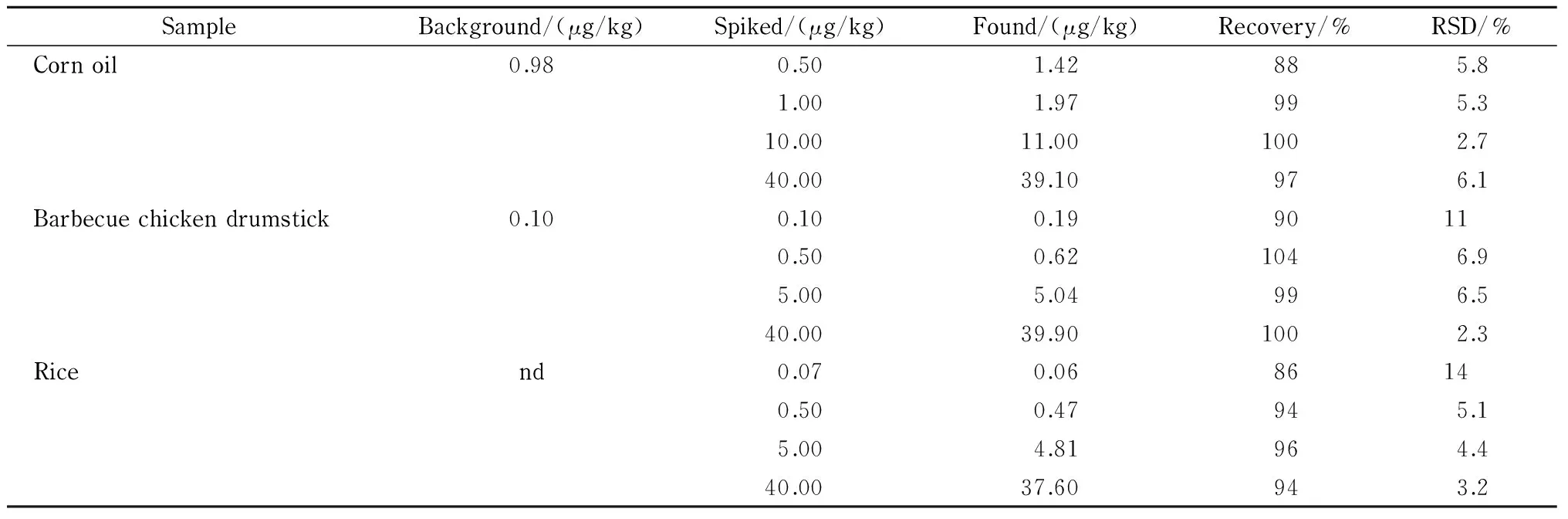
表 1 食品中苯并[a]芘在不同添加水平下的回收率(n=6)
nd: not detected.
3 结论
本文建立了检测食品中苯并[a]芘的超高液相色谱-三重四极杆质谱联用方法。通过对分子印迹固相萃取法的样品净化效果和基质效应的评估,证明了样品净化方法的有效性。通过对色谱分离和质谱检测等条件的优化,得到了较高的检测灵敏度。方法学验证结果表明本方法灵敏度高、选择性好、定量准确和精密度好;应用于实际样品的检测取得满意结果,适用于食品中苯并[a]芘的检测。
[1] Zhang T B, Wan H F, Yang G Y, et al. Acta Scientiae Circumstantiae, 2008, 28(11): 2375
张天彬, 万洪富, 杨国义, 等. 环境科学学报, 2008, 28(11): 2375
[2] Gong Z, Wang D H, Zhao D Z, et al. Chemistry, 2015, 78(9): 786
宫哲, 王德慧, 赵德智, 等. 化学通报, 2015, 78(9): 786
[3] Wu D. Science and Technology of Food Industry, 2008, 29(5): 309
吴丹. 食品工业科技, 2008, 29(5): 309
[4] Shi Q Q, Xi J, Lu Q Y. Science and Technology of Food Industry, 2014, 35(5): 12
史巧巧, 席俊, 陆启玉. 食品工业科技, 2014, 35(5): 12
[5] Zheng X P, Ding L P, Chen Z T, et al. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2015, 51(10): 1437
郑香平, 丁立平, 陈志涛, 等. 理化检验-化学分册, 2015, 51(10): 1437
[6] Dai T C, Li W H, Liao Q G, et al. Journal of Instrumental Analysis, 2011, 30(5): 570
戴廷灿, 李伟红, 廖且根, 等. 分析测试学报, 2011, 30(5): 570
[7] Xu X M, Cai Z X, Ren Y P, et al. Chinese Journal of Health
Laboratory Technology, 2012, 22(7): 1479
徐小民, 蔡增轩, 任一平, 等. 中国卫生检验杂志, 2012, 22(7): 1479
[8] Wang J H, Guo C, Pang G F, et al. Journal of Instrumental Analysis, 2009, 28(3): 267
王建华, 郭翠, 庞国芳, 等. 分析测试学报, 2009, 28(3): 267
[9] Liu Y L, Zhang X T, Zhao H H. Farm Machinery, 2012, 38(20): 45
刘玉兰, 张小涛, 赵欢欢. 农业机械, 2012, 38(20): 45
[10] Wang H, Yang H M, Guo Q L, et al. Journal of Instrumental Analysis, 2014, 33(8): 911
王浩, 杨红梅, 郭启雷, 等. 分析测试学报, 2014, 33(8): 911
[11] Lan C B. Science and Technology of Cereals, Oils and Foods, 2014, 22(4): 54
蓝长波. 粮油食品科技, 2014, 22(4): 54
[12] Ma R T, Shi Y P. Chinese Journal of Chromatography, 2016, 34(3): 223
马润恬, 师彦平. 色谱, 2016, 34(3): 223
[13] Huang L Y, Li X Z, Qin Z F. Chinese Journal of Analysis Laboratory, 2009, 28(12): 63
黄鸾玉, 黎小正, 秦振发. 分析试验室, 2009, 28(12): 63
[14] Liu Q, Wu X X, Jia Z X, et al. Meat Research, 2015, 29(3): 20
刘谦, 吴新欣, 贾志欣, 等. 肉类研究, 2015, 29(3): 20
[15] Hu J W, Li T B, Wang C L, et al. Chemical Analysis and Meterage, 2014, 23(3): 25
胡加文, 李天宝, 王春利, 等. 化学分析计量, 2014, 23(3): 25
[16] Zhao W J, Chen X B, Fang L, et al. J Agric Food Chem, 2013, 61(8): 1804
[17] Liu H C, Li Q W, Liu J F. Chinese Journal of Chromatography, 2006, 24(4): 415
刘宏程, 黎其万, 刘家富. 色谱, 2006, 24(4): 415
[18] Kang M Q, Cao H W, Tian F J, et al. Cereals & Oils, 2016, 29(8): 67
康明芹, 曹海微, 田芳洁, 等. 粮食与油脂, 2016, 29(8): 67
[19] Matuszewski B K, Constanzer M L, Chavez-Eng C M. Anal Chem, 2003, 75 (13): 3019
Rapid determination of benzo[a]pyrene in foods by ultra performance liquid chromatography-triple quadrupole mass spectrometry with atmospheric pressure chemical ionization
ZHANG Xiaoyi, ZHANG Xiuyao*, CAI Xinxin, LI Ruifen
(WenzhouMunicipalCenterforDiseaseControlandPrevention,Wenzhou325001,China)
A method for the determination of benzo[a]pyrene in foods was developed by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) based on isotope dilution and molecularly imprinted solid-phase extraction (MIP-SPE). The target analyte in samples was extracted withn-hexane after spiked with benzo[a]pyrene-d12, and purified using MIP-SPE to eliminate most of the coextracts. The separation of benzo[a]pyrene was carried out on an XBridge BEH C18column with gradient elution of methanol and water. An atmospheric pressure chemical ionization (APCI) interface was used as the ion source and the analysis was performed in the multiple reaction monitoring (MRM) mode. Benzo[a]pyrene levels in the range of 0.07-50 μg/kg were measured accurately by this method, and the limit of quantification (LOQ) was 0.07 μg/kg. The average recoveries were between 86% and 104% with the relative standard deviations within 2.3%-14%. The method was sensitive and accurate, and it has been successfully applied to the measurement of benzo[a]pyrene in food samples.
ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); atmospheric pressure chemical ionization (APCI); molecularly imprinted solid-phase extraction (MIP-SPE); benzo[a]pyrene; food
10.3724/SP.J.1123.2017.02021
2017-02-20
O658
A
1000-8713(2017)06-0608-05
* 通讯联系人.Tel:(0577)56966951,E-mail:xyzwz123@126.com.
